Farmakologická skupina
Pegylovaný lipozomální doxorubicin (PLD) patří mezi cytostatika ze skupiny antracyklinů; ATC kód L01DB [3].
Chemické a fyzikální vlastnosti
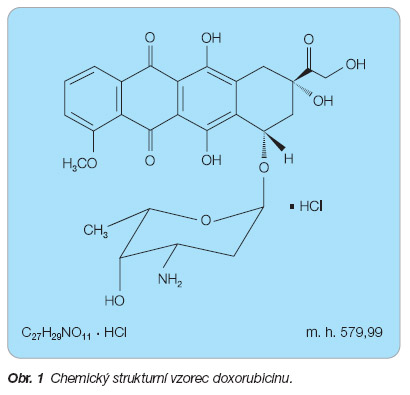
Pegylovaný lipozomální doxorubicin je doxorubicin hydrochlorid enkapsulovaný v lipozomech stabilizovaných vrstvou polyethylenglykolu. Doxorubicin je chemicky (8S,10S)-10-[(3-amino-2,3,6-trideoxy- a -L-lyxo-hexopyranosyl)oxy]-8-glykolyl-7,8,9,10-tetrahydro-6,8,11-trihydroxy-1-methoxy-5,12-naftacendion. Je přítomen ve formě hydrochloridu ( obr. 1 ) [4].
Sumární vzorec: C 27 H 29 NO 11 . HCl
Molekulová hmotnost: 579,99
Mechanismus účinku, farmakodynamika
Pegylovaný lipozomální doxorubicin, lipozomová léková forma, je doxorubicin hydrochlorid enkapsulovaný v lipozomech
s povrchově vázaným methoxypolyethy len- glykolem (MPEG). Aktivním cytostatikem lipozomální formy je doxorubicin. Doxorubicin narušuje DNA interkalací antracyklinové části, chelací kovových ion tů nebo generováním volných radikálů. Mole kula cytostatika se zasune mezi dvojspirálu DNA, kde se váže vodíkovými můstky . Výsled kem je inhibice replikace a tran skripce. Doxo rubicin působí též inhibici topoizomerázy II, která je kritickou strukturou pro funkci DNA. Topoizomeráza II se váže na oba řetězce dvojspirály, působí jejich přerušení a vzápětí opětné spojení. Při blokádě jejich funkce nedojde k opět nému spojení rozštěpených řetězců a zlo my mají pro buňku letální účinek. Cytotoxická účinnost je považo vá na za nezávislou na fázi buněčného cyk lu, ačkoliv maximum cytotoxického efektu je v S fázi. Nádorové buňky exponované doxorubicinu v G1 fázi mohou přejít do S fáze, ale pak jsou zablokovány a zanikají v G2 fázi.
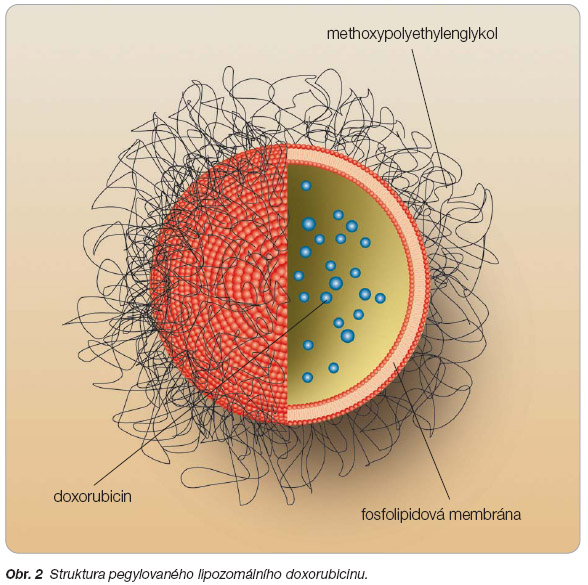
Enkapsulace doxorubicinu v lipozomech ovlivňuje farmakokinetické vlastnosti cytostatika. Lipozomy jsou váčky s fosfolipidovou membránou, které umožňují delší setrvání v cirkulaci, větší stabilitu a měly by
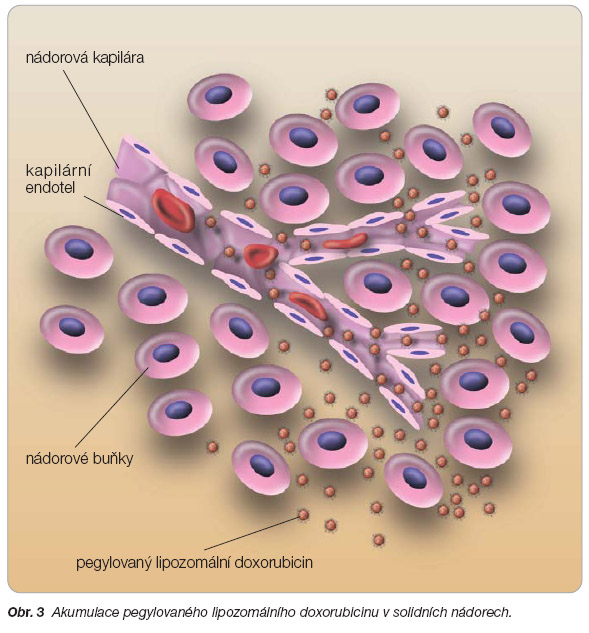
umožňovat větší dostupnost pro nádoro vou tkáň. Lipozomy jsou užívány jako vehi kula pro transport makromolekul. Lipozomy mají vnější lipidovou membránu a vnitřní vodní prostor. Do vnitřního prostoru je vložen doxorubicin. Pegylované lipozomy mají pokryty fosfolipidový povrch methoxypo lyethylenglykolem (MPEG), viz obr. 2 . Ten to proces je označován jako pegylace. Polyethylenglykolový potah chrání lipozomy před degradací během cirkulace v krevním řečišti. Zabraňuje vazbě na sérové opsoniny a snižuje rozpoznání a pohlcení lipozomů v mononukleárním fagocytárním systému. Enkapsulované formy antracyklinů přinášejí zlepšení tkáňové distribuce a zlepšení farmakokinetiky. Biologický polo čas (t 1/2 ) eliminace pegylovaného doxoru bi cinu je více než 55 hodin (pro srovnání – t 1/2 nepegylovaného lipozomálního doxo rubicinu je 2 až 3 hodiny a t 1/2 konvenční ho doxorubicinu je kolem 10 minut). Průměr enkapsulované pegylované formace doxorubicinu je přibližně 85 nm. Takto malý roz měr umožňuje lipozomům prosakovat skr ze cévy zásobující nádor a více se tak hro madit v nádoru. Předpokládáná preferenční akumulace v oblastech s narušeným cév ním zásobením, které je více prostupné pro prolongované uvolňování cytostatika do oblasti nádoru, je znázorněna na obr. 3 . Prodloužená cirkulační doba při podání doxorubicinu v lipozomální formě byla demonstrována u zvířat a lidí [5].
Uzavření doxorubicinu do lipozomů je též cestou ke snížení kardiotoxicity. Lipozomy mají tendenci ke kumulaci v místech
inflamace a ve vaskularizované tkáni nádo ru s fenestrovaným endotelem, kdežto v parenchymatózních orgánech s normál ní neporušenou a těsnou endoteliální bariérou je jejich koncentrace nižší. To vysvětluje omezenou kardiotoxicitu této lékové for my [6].
Myelotoxicita je však stejná, protože lipozomy jsou vychytávány v retikuloendoteliálním systému.
Rezistence k doxorubicinu může vznikat různými mechanismy. Jedním z nejdůležitějších mechanismů je vícečetná léková rezistence (MDR), která je zprostředkována zvýšenou expresí P170-glykoproteinu. MDR je u lipozomálních doxorubicinů méně častá [6–12].
Farmakokinetické vlastnosti
Farmakokinetika konvenčního a lipozomálního doxorubicinu je zcela odlišná. Stej ně tak je odlišná farmakokinetika pegylovaného doxorubicinu s extrémně prodlouženou dobou setrvání v cirkulaci a nepegylovaného doxorubicinu. Plazmatické farmakokinetické parametry PLD se u člověka významně liší od parametrů uváděných v literatuře pro standardní přípravky doxorubicin hydrochloridu. Při nižších dávkách (10–20 mg/m2) je farmakokinetika PLD lineární. Přes dávkové rozmezí 10–60 mg/m2 má PLD nelineární farmakokinetiku. Standardní doxorubin hydrochlorid se vyznačuje rozsáhlou tkáňovou distribucí (distribuční objem je 700–1100 l/m2) a velkou rychlostí eliminační clearance (24–73 l/ hod/m2). Naopak z farmakokinetického profilu PLD se ukazuje, že PLD je omezen převážně na objem vaskulární tekutiny a že clearance doxorubicinu z krve závisí především na jeho lipozomovém nosiči. Doxorubicin se stává dostupným teprve po extravazaci lipozomů a po jejich vstupu do tkáňového kompartmentu.
Při stejně vysokých dávkách jsou plazmatické koncentrace a hodnoty AUC, které reprezentují převážně pegylovaný lipozomální doxorubicin hydrochlorid (obsahuje
90–95 % naměřeného doxorubicinu),
významně vyšší než ty získané při podání
standardních přípravků doxorubicin hyd rochloridu [3, 13].
Jak již bylo uvedeno, enkapsulované formy antracyklinů přinášejí zlepšení tkáňové distribuce a zlepšení farmakokinetiky (biologický poločas eliminace PLD je více než 55 hodin). Pegylovaný lipozomální doxorubicin je jediným lipozomálním antracyklinem s výrazně nízkou absorpcí v mononukleárním fagocytárním systému; příčinou je přítomnost polyethylenglykolové vrstvy, která obklopuje lipozomy obsahující doxorubicin. Doxorubicin je elimi nován především játry. Snížení dávky lipozomálního doxorubicinu se ukazuje jako vhodné u pacientů s narušenou funkcí jater. Přibližně 5 % doxorubicinu nebo doxorubicinolu je vylučováno do moči; u pacien tek s poruchami ledvin nebyla farmakoki netika speciálně studována. Základní farmakokinetické parametry PLD jsou shr nuty v tab. 1 .
Přibližně 90 % doxorubicinu zůstává během cirkulace v enkapsulované formě. V nádoru dochází k uvolnění zapouzdřeného doxorubicinu. Ačkoliv exaktní mechanismus uvolňování cytostatika z lipozomů není přesně objasněn, jsou pravděpodobné procesy, jako je endocytóza a degradace lysozomů s uvolněním jejich obsahu, výměna lipidů mezi lipozomy a buněčnou
membránou vedoucí k přesunu obsahu
lipozomů do buněk a fúze lipozomů s buněčnou membránou. Lipozomy se též mohou připojit k buněčnému povrchu, což umožňuje, aby obsah lipozomů pronikl skrze buněčnou membránu do cytoplazmy. Koncentrace PLD v lézích Kaposiho sarkomu může být až 22krát vyšší než v normální kůži.
Klinické zkušenosti
V iniciálních studiích fáze I byly zaznamenány léčebné odpovědi u refrakterních renálních karcinomů, karcinomů prsu, prostaty, plic a ORL oblasti. Ve studiích fáze I/II byl PLD v dávce 25–35 mg/m2 každé 3 týdny kombinován s cyklofosfamidem, paklitaxelem, docetaxelem, vinorelbinem, gemcitabinem a trastuzumabem.
Celkem v osmi studiích fáze II byla hod nocena bezpečnost a účinnost PLD v monoterapii metastazujícího karcinomu prsu [14].
Karcinom prsu
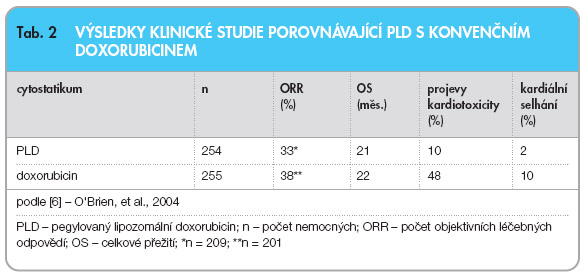
V klinické studii fáze III [6] byla srovnávána účinnost a bezpečnost PLD oproti konvenčnímu doxorubicinu v léčbě první linie metastazujícího karcinomu prsu. Celkem 509 ženám byla podávána 1hodinová infuze PLD, 50 mg/m2 každé 4 týdny, nebo konvenční doxorubicin, 60 mg/m2
každé 3 týdny. Výsledky jsou shrnuty
v
tab. 2
.
Z nežádoucích účinků byl u konvenčního doxorubicinu zaznamenán vyšší výskyt alopecie (66 % vs. 20 % u PLD), nevolnosti (53 % vs. 37 %), zvracení (31 % vs. 19 %) a neutropenie (10 % vs. 4 %). Palmoplantární erytrodysestezie (hand-foot syndrom,
HF syndrom, 48 % vs. 2 %), stomatitida (22 % vs. 15 %) a mukozitida (23 % vs. 13 %) byla častější při aplikaci PLD než při podávání konvenčního doxorubicinu. Výskyt HF syndromu byl relativně četný, ale jen u 7 % nemocných byl důvodem k pře rušení léčby.
Do další klinické studie fáze III bylo zařazeno celkem 301 nemocných s metastazujícím karcinomem prsu po selhání léčby na bázi taxanů [15]. Byl porovnáván PLD v dávce 50 mg/m2 podávané každé 4 týdny buď s vinorelbinem (30 mg/m2 1krát týdně), nebo s kombinací mitomycinu C (MMC) a vinblastinu (MMC 10 mg/m2 den 1 a 28, vinblastin 5 mg/m2 den 1, 14, 28 a 42 každých 6–8 týdnů). V této studii nebyly zaznamenány rozdíly v účinnosti. Medián doby bez progrese (PFS) předsta voval pro PLD 2,86 měsíce oproti 2,53 měsíce ve srovnávací skupině; medián celkové doby přežití byl delší při PLD 11,0 vs. 9,0 měsíců, ale rozdíly nebyly statisticky signifikantní. V rameni s léčbou PLD bylo zaznamenáno 9 % objektivních léčebných odpovědí oproti 11 % u srovnávací skupiny .
V další klinické studii fáze III byl ověřován význam udržovací terapie následně po ukončení standardní chemoterapie metastazujícího karcinomu prsu [16].
PLD u starších nemocných s karcinomem prsu
Klinická studie fáze II, ve které byla podávána kombinace PLD s alternujícím podáním i.v. a p.o. vinorelbinu, byla zorganizována s cílem nalézt režim akceptovatelné toxicity bez překrývání se nežádoucích účinků, který je vhodný pro vyšší věkovou skupinu nemocných. Do této klinické studie bylo možné zařadit ženy s metastazujícím karcinomem prsu ve věku ≥ 65 let. Podání předchozí adjuvantní chemoterapie včetně antracyklinů bylo možné, pokud bylo ukončeno v odstupu nejméně 12 měsíců.
Celkem bylo do studie zařazeno 34 nemocných s mediánem věku 71 let (rozmezí 65–82). Kombinovaný režim obsahoval PLD 40 mg/m2 plus vinorelbin 25 mg/m2 i.v. podané v den 1, patnáctý den každého cyklu byl podáván vinorelbin 60 mg/m2 p.o. Všichni nemocní byli hodnoceni z hlediska bezpečnosti a účinnosti.
Celkově byla zaznamenána léčebná odpověď u 50 % nemocných (95% CI 36–66), z toho byly 3 kompletní léčebné odpovědi (CR) a 14 parciálních objektivních odpovědí (PR). Medián celkové doby přežití byl 13 měsíců a medián času do progrese 8 měsíců. Nejčastějším nežádoucím účinkem byla neutropenie (stupeň 3 u 15 % a stupeň 4 u 11 % nemocných).
Febrilní neutropenie se objevila u 3 nemoc ných a nevyžadovala redukci dávky. Z ostatních nežádoucích účinků byla zazna menána anémie, nauzea, zvracení, stomatitida, jen výjimečně vyššího stupně. Palmoplantární erytrodys estezie se objevila u 6 nemocných, ale pou ze v jediném případě dosáhla stupně 3 [17].
Cílem retrospektivní analýzy dvou klinických studií organizovaných EORTC ( European Organization for the Research and Treatment of Cancer ) bylo vyhodnotit bezpečnost a účinnost PLD u vyšší věkové skupiny žen (od 70 let věku výše) s metastazujícím karcinomem prsu. Při porovnání dvou dávkových schémat 60 mg/m2 každých 6 týdnů nebo 50 mg/m2 každé 4 týdny (u 136 nemocných ve 2 klinických studiích) nebyly nalezeny rozdíly v účinnosti, ale byl pozorován vyšší výskyt hematologické toxicity, anorexie, astenie a stomatitidy při 6týdenním schématu podávání. PLD 50 mg/m2 každé 4 týdny je doporučitelným dávkovacím schématem monoterapie metastazujícího onemocnění u vyšší věkové skupiny [1 8 , 19].
PLD plus trastuzumab
V preklinických modelech byla prokázána synergie kombinace PLD s trastuzumabem [2 0 , 21].
Pro zvýšený výskyt kardiotoxicity kombinace konvenčního doxorubicinu s trastuzumabem je nemožné použít tuto jinak velmi účinnou kombinaci v klinické praxi. Kombinace trastuzumabu s lipozomálními antracykliny je proto v současnosti předmětem hodnocení v klinických studiích. První studie prokázaly z hlediska kardiotoxicity větší bezpečnost podání ve srovnání s konvenčním doxorubicinem [21–23].
V multicentrické studii fáze II byla srovnávána bezpečnost a účinnost PLD v kombinaci s trastuzumabem u HER-2 dependentních nemocných s metastazujícím onemocněním. Primárním cílem bylo vyhodnotit riziko kardiotoxicity při léčbě touto kombinací [23].
Ženy s HER-2 dependentním metastazujícím karcinomem prsu s měřitelným onemocněním při vstupní hodnotě LVEF ≥ 55 % byly léčeny PLD v dávce 50 mg/m2 každé 4 týdny v 6 cyklech při současné týdenní aplikaci trastuzumabu (4 mg/kg nasycovací dávka a dále udržovací dávka 2 mg/kg týdně). Kardiotoxicita byla definována jako symptomatické městnané srdeční selhávání s ≥ 10% poklesem LVEF pod dolní limit, dále jako ≥ 15% pokles LVEF bez klinické symptomatologie nebo méně než 10% pokles LVEF, pokud překročil 45% hranici.
Celkem bylo do klinické studie zařazeno 30 žen a 13 z nich bylo předléčeno antracykliny. Medián podaných cyklů PLD byl 5,5. Průměr bazálních hodnot LVEF byl 62,8 %; 59,5 % po ukončení 4. cyklu a 58,3 % po ukončení 6. cyklu. U 3 nemocných (10 %) se rozvinuly protokolem definované projevy kardiotoxicity bez klinické symptomatologie. Bylo zaznamenáno 52 % objektivních léčebných odpovědí a ve 38 % došlo ke stabilizaci nemoci.
Při mediánu doby sledování 13,9 měsíce byl medián doby bez progrese 12,0 měsíců. Nejčetnějším nežádoucím účinkem stupně 3 byla palmoplantární erytrodysestezie (30 %) a neutropenie stupně 3/4 (27 %).
V další studii byla použita kombinace PLD, docetaxelu a trastuzumabu bez výrazného nárůstu kardiotoxicity [24].
Gynekologické nádory – karcinomy vaječníků
Pegylovaný lipozomální doxorubicin je účinné cytostatikum pro léčbu nemocných
s epiteliálním karcinomem vaječníků refrak terním k platině a taxanům. Klinická účinnost lipozomálního doxorubicinu byla hodnocena v klinických studiích fáze II a srovnání bylo provedeno též ve studiích fáze III. Ve studiích fáze II byl používán režim PLD 50 mg/m2 každé 3 nebo 4 týdny. Účinnost lipozomálního doxorubicinu u onemocnění refrakterního k platině a taxanům byla hodnocena ve studiích fáze II. Do první klinické studie fáze II bylo zařazeno 89 nemocných s platina-refrakterním onemocněním (82 pacientů bylo též rezistentních k léčbě paklitaxelem). Při dávkování PLD 50 mg/m2 každé 4 týdny bylo zaznamenáno 17 % objektivních léčebných odpovědí (1 CR a 14 PR) [25]. V další méně početné klinické studii byla zaznamená na ORR u devíti z 35 žen (26 %) při dáv ko vání 50 mg/m2 každé 3 týdny [26]. U nemocných s progresí v průběhu léčby první linie nebyla zaznamenána objektivní odpověď.
Ve studiích fáze III byla srovnávána
monoterapie pegylovaným lipozomálním doxorubicinem s topotekanem nebo s paklitaxelem. V klinické studii fáze III, do které bylo zařazeno celkem 481 nemocných s relapsem po jedné linii chemoterapie na bázi platiny, byl srovnáván PLD (50 mg/m2 během 1 hodiny každé 4 týdny) s topotekanem (1,5 mg/m2 denně po dobu 5 dní,
každé 3 týdny). Medián přežití byl v rame ni s PLD 63,6 týdne, v rameni s topoteka nem 57 týdnů (p = 0,038). Ve skupině pacien tů citlivých k chemoterapii na bázi platiny (n = 219) bylo v rameni s PLD zaznamenáno 30% snížení rizika úmrtí (medián přežití 107,9 vs. 70,1 týdne, p = 0,017). U pacientů rezistentních k podání platiny byl medián přežití v obou ramenech srovnatelný [27, 28]. Profil myelotoxicity vyzněl ve prospěch PLD (neutropenie stupně 3 nebo 4: 12 % vs. 71 %; trombocytope nie stupně 3 nebo 4: 1 % vs. 35 %).
V klinické studii fáze III srovnávající pegylovaný lipozomální doxorubicin s paklitaxelem v léčbě nemocných nepředléčených taxany nebyly zaznamenány rozdíly [29]. Gemcitabin byl přímo srovnáván s PLD u pacientů s onemocněním rezistentním k léčbě platinou. V randomizované studii fáze III, do které bylo zařazeno 153 nemocných, byla porovnávána monoterapie gemcitabinem (1000 mg/m2 v 30minutové infuzi den 1, 8 a 15, s opakováním 29. den) s monoterapií PLD (40 mg/m2 každé 4 týdny; obvyklé dávkování je 50 mg/m2) ve druhé linii léčby. Kritériem pro zařazení byl relaps během 12 měsíců od iniciální léčby na bázi platinového derivátu (rozdíl od standardní definice s relapsem do 6 měsíců). Nebyly nalezeny statisticky signifikantní rozdíly v počtu objektivních regresí, v délce doby do progrese a v celkové době přeži tí. Výsledky podporují použití PLD i gem citabinu u pacientů s onemocněním rezistentním k léčbě platinou [30].
Lipozomální doxorubicin tak představuje volbu pro chemoterapii druhé linie zejména u žen s preexistujícím neuromuskulárním onemocněním nebo u žen, které se chtějí vyhnout riziku alopecie.
Nejzávažnějším nežádoucím účinkem léčby PLD byla palmoplantární erytrodys estezie (hand-foot syndrom), která se objevila u 20 % nemocných při dávce 50 mg/m2 každé tři týdny. Léčba s nižší dávkou (35–40 mg/m2 každé 4 týdny) může být spojena se stejným protinádo rovým účinkem při příznivějším profilu kož ní toxicity.
PLD v kombinované chemoterapii
V klinické studii organizované americkou onkologickou skupinou SWOG (Southwest Oncology Group) bylo prokázáno prodloužení přežití při kombinované chemoterapii (PLD plus karboplatina) ve srovnání s monoterapií karboplatinou. Bylo dosaženo vyššího počtu objektivních léčebných odpovědí (67 % vs. 32 %), mediánu PFS (12 vs. 8 měsíců) a mediánu celkové doby přežití (26 vs. 18 měsíců). Výsledky je třeba interpretovat s velkou opatrností, protože do klinické studie bylo zařazeno pouze 61 z plánovaného počtu 900 žen [31].
Kombinovaný režim karboplatina plus
PLD vs. karboplatina plus paklitaxel v léč bě 1. linie je sledován ve studii fáze III u paci entek s pokročilým ovariálním karcinomem. PLD je podáván v dávce 30 mg/m2 každé 3 týdny, paklitaxel v dávce 175 mg/m2 každé 3 týdny. V době první interim analýzy ramene s léčbou PLD (n = 50) byla zjiště na kompletní odpověď u 14 (28 %) paci entek a částečná odpověď u 20 (40 %) pacientek. Zhodnocení efektu kombinované léčby v obou ramenech studie bude možné až po ukončení studie [32].
Mnohočetný myelom
Další významnou indikací PLD je mnohočetný myelom v kombinaci s bortezomibem. Jedná se o záchranný režim, kdy je bortezomib podáván v dávce 1,3 mg/m2 i.v. bolus den 1, 4, 8 a 11 každé 3 týdny a PLD v dávce 30 mg/m2 i.v. den 4 po aplikaci bortezomibu. Cyklus je opakován po 14 dnech do progrese; maximálně 8 cyklů [33].
Indukční režim DVd zahrnuje kromě PLD
vinkristin a dexamethason. PLD je podá ván v dávce 40 mg/m2 i.v. den 1, vinkris tin v dávce 1,4 mg/m2 (maximum 2 mg) i.v. den 1 a dexamethason v dávce 40 mg p.o. nebo i.v. den 1–4. Cyklus je opakován každých 28 dní [34, 35].
Ve studii fáze III byla srovnávána bezpečnost a účinnost kombinace PLD + bortezomib vs. monoterapie bortezomibem u 646 pacientů s relabovaným nebo refrakterním mnohočetným myelomem. Bortezomib byl podáván v obou ramenech v dávce 1,3 mg/m2 i.v. den 1, 4, 8 a 11 každé 3 týdny a PLD v dávce 30 mg/m2 i.v. den 4 po aplikaci bortezomibu. Medián času do progrese byl 9,3 měsíce (kombinovaná léčba) vs. 6,5 měsíce (monoterapie bortezomibem). Po 15 měsících přežívalo 76 % (kombinovaná léčba), resp. 65 % pacientů (monoterapie). Signifikantní prodloužení času do progrese v rameni s kombinovanou léčbou nebylo ovlivněno předchozím podáním imunomodulačních léčiv (thalidomid/lenalidomid). Rozdíl v počtu kompletních a parciálních remisí nebyl sta tisticky signifikantní (41 % bortezomib, 44 % PLD + bortezomib). V rameni s kombinovanou léčbou byl zaznamenán vyšší výskyt toxicity stupně 3/4 (80 % vs. 64 %), zejména neutropenie, trombocytopenie, astenie, únava, průjem a HF syndrom. Výsledky studie prokazují superiori tu kombinace PLD + bortezomib oproti monoterapii bortezomibem [36, 37].
Zařazení do současné palety léčiv
Lipozomální antracykliny byly vyvinuty s cílem zlepšit terapeutický index ve srov nání s konvenčními antracykliny. Zname ná to, že při zachování protinádorové účinnosti mají příznivější profil nežádoucích účinků. V lipozomech enkapsulované ant racykliny mají odlišnou tkáňovou distribu ci a farmakokinetiku, a tím vylepšený terapeutický index.
Pegylovaný lipozomální doxorubicin je cytostatikem se stejným mechanismem účinku jako doxorubicin s příznivějším profilem kardiotoxicity. (Pozn. Při stanovení dávky nelze použít převod dávky v mg v poměru 1 : 1.
)
Indikace
Hlavní indikace podle diagnóz jsou shrnuty v
tab. 3
.
Terapeutické indikace podle SPC:
– �jako monoterapie u pacientů s metastazujícím karcinomem prsu, u kterých je zvýšené kardiální riziko;
– �k léčbě pokročilého ovariálního karcinomu u žen, u kterých chemoterapie přípravky na bázi platiny selhala jako léčba první volby;
– �v kombinaci s bortezomibem k léčbě progredujícího mnohočetného myelomu u pacientů, kteří byli dříve už alespoň jednou léčeni a kteří již podstoupili transplantaci kostní dřeně nebo pro ni nejsou vhodní;
– �pro léčbu Kaposiho sarkomu (KS) sdruženého s AIDS u pacientů s nízkým počtem CD4 (< 200 CD4 lymfocytů/mm3) a s rozsáhlým mukokutánním nebo viscerálním postižením. PLD lze užít jako systémovou chemoterapii první volby, nebo jako chemoterapii druhé volby u pacientů s KS sdruženým s AIDS při progresi onemocnění navzdory kombinované systémové terapii tvořené minimálně dvěma z následujících přípravků: vinkaalkaloidy, bleomycin a standardní doxorubicin (nebo jiné antracyklinové antibiotikum), a také u pacientů, kteří tuto terapii netolerují.
Jako perspektivní indikace se jeví
podá vání u starší skupiny nemocných a u nemocných s vysokým rizikem kardiotoxicity, kde by PLD mohl nahradit konvenční antracykliny prakticky ve všech účinných režimech. Perspektivní se ukazuje kombinace PLD s trastuzumabem. Pro výrazný nárůst kardiotoxicity není klinicky použitelná kombinace konvenčního doxorubicinu s trastuzumabem. Jako perspektivní se jeví též adjuvantní podání zejména u HER-2 dependentních karcinomů prsu stejně jako použití v neoadjuvantní (indukční) léčbě.
Kontraindikace
Hypersenzitivita na doxorubicin nebo na jiné antracykliny nebo na jakékoliv lékové komponenty.
Nežádoucí účinky
Mezi nejčastěji se vyskytující nežádoucí účinky (> 20 %) patří astenie, únavnost, horečka, anorexie, nevolnost, zvracení, stomatitida, průjem, obstipace, palmoplantární erytrodysestezie (HF syndrom), rash, neutropenie, trombocytopenie a anémie [3, 4, 8, 38].
Pro klinickou praxi jsou nejdůležitější tyto nežádoucí účinky:
– �myelotoxicita – mnohem častěji limituje dávku PLD leukopenie než trombocytopenie a anémie (začátek poklesu 7. den; maximální pokles: 10.–14. den; zotavení: 21.–28. den);
– �nauzea a zvracení – většinou mírné intenzity objevující se u 20 % nemocných;
– �mukozitida a průjem – poměrně častý nežádoucí účinek, který nelimituje dávku PLD;
– �kardiotoxicita – akutní forma se může objevit během prvních 2–3 dní jako arytmie a/nebo jiné poruchy, které jsou většinou tranzitorní a většinou asymptomatické, nejsou závislé na dávce. Chronické změny závisí na kumulativní dávce, kardiální funkce musí být proto důsledně monitorovány v průběhu léčby (echokardiografie, MUGA scan);
– �nejčastějším projevem kožní toxicity je palmoplantární erytrodysestezie (HF syndrom), která se projevuje začervenáním,
otokem, bolestivostí a deskvamací. Obvyk le je mírné intenzity a objevuje se zpravidla za 5–6 týdnů po zahájení léčby. V rámci prevence HF syndromu by se měl nemocný vyvarovat prolongované expozice končetin horké vodě a vyhnout se dlouhodobějšímu tlaku na ruce a nohy, nevhodné jsou příliš těsné ponožky a boty. Vhodné jsou hydratační krémy, a pokud je třeba, doporučují se analgetika jako paracetamol. Pro prevenci bývá doporučován vitamin B6 (pyridoxin). Při intenzivních projevech je nutná modifikace dávky;
– �hyperpigmentace nehtů, kožní rash nebo urtika. Může se objevit též tzv. recall kožní reakce v místech předchozího ozařování;
– �alopecie je poměrně častá, reverzibilní;
– �u 5–10 % nemocných se může objevit infuzní reakce (se symptomy včetně astmatu , zrudnutí, kopřivkové vyrážky, bolest i na hrudi, zvýšené teploty, hypertenze, tachykardie, svědění, pocení, zkrácené ho dechu, otoku obličeje, zimnice, boles ti v zádech, napětí na hrudi nebo hypo tenze), nejčastěji při první aplikaci;
– �červenooranžové zbarvení moče se objevuje obvykle během 1–2 dnů po aplikaci [4, 39].
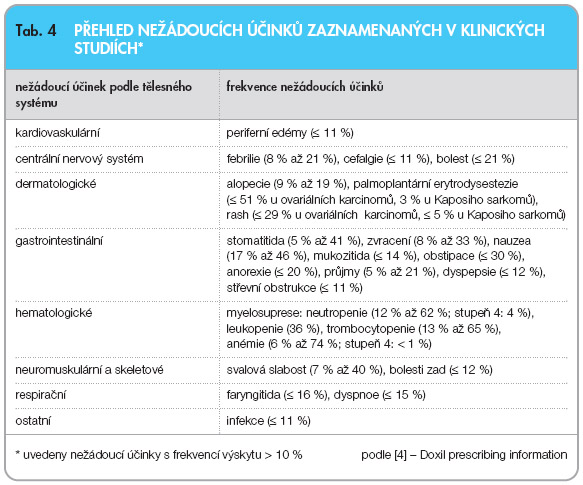
Přehled nežádoucích účinků zaznamenaných v klinických studiích s výskytem > 10 % je uveden v
tab. 4
[4].
Lékové interakce
Doposud nebyly provedeny studie,
které by podrobně studovaly interakce pegylovaného lipozomálního doxorubicinu s ostatními léčivy. Opatrnosti je třeba při současném užití látek, u nichž jsou známy interakce se standardním doxorubicin hydrochloridem. U pacientů se solidním nádorem, kteří byli léčeni konkomitantně
cyklofosfamidem nebo taxany, nebyly
pozorovány žádné nové nežádoucí účinky. PLD může stejně jako ostatní přípravky obsahující doxorubicin hydrochlorid potencovat toxické účinky ostatních protinádorových léčiv. Opatrnost je nutná zejména u pacientů, kterým jsou současně podávána myelotoxická léčiva [3].
Těhotenství a kojení
PLD by neměl být během těhotenství podáván, pokud to není nezbytně nutné. Není známo, zda je PLD vylučován do mateřského mléka. Nelipozomální formy antracyklinů jsou vylučovány do mateř ského mléka. Z tohoto důvodu a pro potenciální možnosti závažných nežádoucích reakcí u kojených dětí musí matky přerušit kojení před zahájením léčby tímto přípravkem.
Schopnost řídit motorová vozidla a obsluhovat stroje
PLD nemá žádný vliv nebo má zanedbatelný vliv na schopnost řídit motorová vozidla a obsluhovat stroje. V některých dosud provedených klinických studiích se při podávání ojediněle (< 5 %) vyskytly závratě a somnolence. Pacienti, u nichž se tyto projevy vyskytnou, se musí vyvarovat řízení motorových vozidel a obsluhy strojů [3].
Dávkování
Při stanovení dávky lipozomálního doxorubicinu nesmí být použit převod dávky z konvenčního doxorubicinu (doxorubicin hydrochlorid) na bázi 1 mg = 1 mg. Při první infuzi je doporučená rychlost infuze 1 mg/min. Pokud se nevyskytne během infuze nežádoucí reakce, je doporučena při každé aplikaci infuze v délce 1 hodiny.
Dávkové schéma podle platného SPC [3]:
Karcinom prsu/ovariální karcinom: PLD je podáván intravenózně v dávce 50 mg/m2 jednou za 4 týdny do progrese onemocnění nebo do projevů intolerance.
Mnohočetný myelom: PLD se podává v dávce 30 mg/m2 4. den 3týdenního léčebného režimu bortezomibu ve formě 1 hodinu trvající infuze podané bezprostředně po infuzi s bortezomibem. Léčebný režim bortezomibu se skládá z dávek 1,3 mg/m2 podávaných 1., 4., 8. a 11. den každé tři týdny. Podávání dávky by se mělo opakovat tak dlouho, dokud bude pacient uspokojivě reagovat a snášet léčbu; 4. den léčebného režimu obou léčivých přípravků lze posunout až o 48 hodin, je-li to z lékařského hlediska zapotřebí. Mezi podáním jednotlivých dávek bortezomibu by mělo uplynout alespoň 72 hodin.
KS sdružený s AIDS: PLD se podává nitrožilně v dávce 20 mg/m2 každé dva až tři týdny. Je třeba se vyvarovat intervalů kratších než 10 dnů, neboť při nich nelze vyloučit kumulaci léku a zvýšenou toxicitu.
Modifikace dávky (Pozn. na základě analýzy studie u pacientek s karcinomem vaječník ů ):
Modifikace dávky při poruše jaterních funkcí:
– �2–3násobně vyšší hodnoty ALT/AST než laboratorní norma: podat 75 % dávky;
– � více než 3násobně vyšší hodnoty ALT/AST oproti laboratorní normě nebo hladina bilirubinu 1,2–3 mg/dl (20–51 m mol/l): podat 50 % dávky;
– �hladina bilirubinu 3,1–5 mg/dl (51–85
m
mol/l): podat 25 % dávky;
– �hladina bilirubinu > 5 mg/dl (85
m
mol/l): nepodávat.
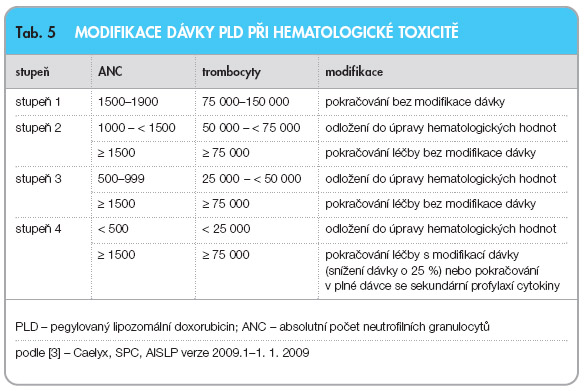
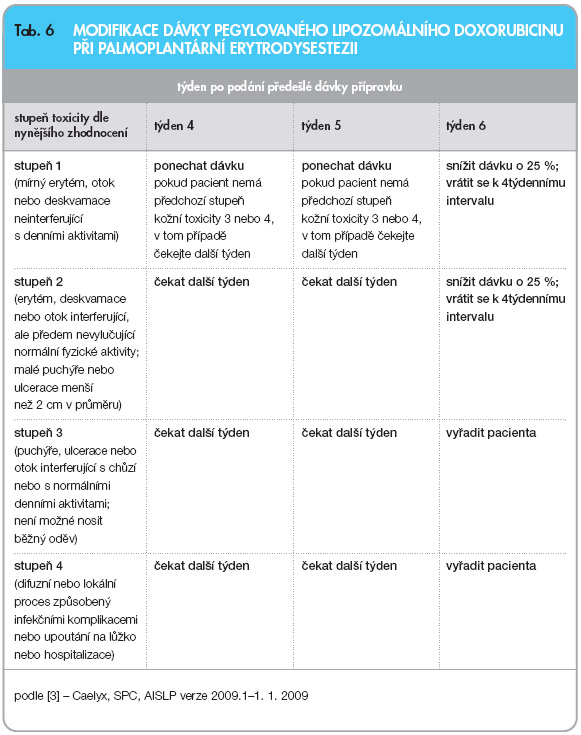
Modifikace dávky při hematologické
toxicitě a při projevech palmoplantární eryt rodysestezie je uvedena v tab. 5 a 6 [3].
Úprava dávkování při kombinaci s bortezomibem v léčbě mnohočetného myelomu viz specializovaná doporučení.
Balení
Pegylovaný lipozomální doxorubicin
je v Evropské unii dodáván na trh pod
obchodním názvem Caelyx ( tab. 7 ), ve Spo jených státech amerických pod názvem Doxil. Přípravek je třeba uchovávat v chladničce (2–8 °C) a chránit před mrazem. Pří pravek Caelyx je od 1. 1. 2009 hrazen z prostředků veřejného zdravotního pojištění v indikaci ovariální karcinom a v kombinaci s bortezomibem v indikaci mnohočetný myelom.