Prasugrel
Nově registrovaný ireverzibilní blokátor ADP receptorů prasugrel je významnou inovací na poli antitrombotik. Oproti dosud užívanému klopidogrelu má spolehlivější protidestičkový účinek při minimálním výskytu rezistence a rychlejší nástup účinku.
Na základě výsledků studie TRITON-TIMI 38, provedené u nemocných s akutními koronárními syndromy typu STEMI i NSTEMI s předpokládanou indikací ke koronární angioplastice, byl doložen významný pokles výskytu aterotrombotických příhod. Ve srovnání s kombinací klopidogrel–kyselina acetylsalicylová (ASA) vedla kombinace prasugrel–ASA k poklesu primárního ukazatele účinku (kardiovaskulární mortalita, infarkt myokardu či iktus) o relativních 19 %, resp. absolutních 2,2 %. Největší efekt byl patrný v podskupině diabetiků, kdy stejný ukazatel poklesl o 30 %, resp. 4,8 %. Výraznější inhibice primární hemostázy je provázena též vyšším rizikem krvácení, v uvedené studii se větší krvácení (vyžadující intervenci) objevilo v prasugrelové větvi o relativních 32 %, resp. o absolutních 0,6 % častěji než ve větvi klopidogrelové.
Na základě příznivých výsledků byla schválena indikace prasugrelu pro léčbu nemocných s akutními koronárními syndromy typu STEMI i NSTEMI s předpokládanou indikací ke koronární angioplastice.
Farmakologická skupina
Prasugrel je antitrombotikum, protidestičkový lék ze skupiny selektivních a ireverzibilních inhibitorů trombocytárních receptorů pro adenosindifosfát (ADP) typu P2Y12. Vzhledem k nutné bioaktivaci je skupina označována jako nepřímé inhibitory ADP receptorů. Po chemické stránce je skupina ireverzibilních blokátorů řazena mezi thienopyridiny.
Chemické vlastnosti
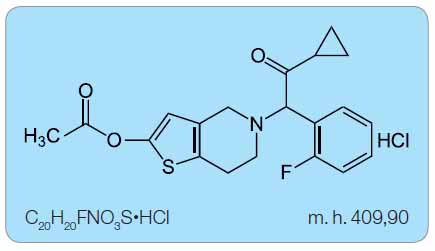 Prasugrel (prasugrel hydrochlorid) je derivátem thienopyridinu, jeho vzorec je možno chemicky popsat jako 5-[(1RS)-2-cyclopropyl-1-(2-fluorophenyl)-2-oxoethyl]-4,5,6,7-tetrahydrothieno[3,2-c]pyridin-2-yl acetát hydrochlorid (obr. 1).
Prasugrel (prasugrel hydrochlorid) je derivátem thienopyridinu, jeho vzorec je možno chemicky popsat jako 5-[(1RS)-2-cyclopropyl-1-(2-fluorophenyl)-2-oxoethyl]-4,5,6,7-tetrahydrothieno[3,2-c]pyridin-2-yl acetát hydrochlorid (obr. 1).
Sumární vzorec: C20H20FNO3S•HCl
Molekulová hmotnost: 409,90
Mechanismus účinku a farmakodynamické vlastnosti
Prasugrel je ireverzibilní blokátor destičkových receptorů P2Y12. Tyto receptory aktivované adenosindifosfátem (ADP) vedou ke stimulaci řady trombocytárních funkcí – k aktivaci, degranulaci (s významným chemotaktickým působením) a změnou konformace integrilinových receptorů IIb/IIIa též k agregaci. Inhibice těchto receptorů má významný dopad na snížení aktivity primární hemostázy. Ireverzibilní blokáda vede k dlouhodobému účinku, který trvá po zbytek doby cirkulace trombocytu v krvi.
Význam receptorů P2Y12 v primární hemostáze
Primární hemostázu můžeme inhibovat na více úrovních – ve fázi adheze, aktivace, degranulace či vlastní agregace. Pro jednotlivé fáze primární hemostázy jsou významné různé membránové receptory. Jedněmi z nejvýznamnějších jsou receptory pro ADP typu P2Y. Fyziologicky se receptory P2Y účastní řady reparačních a defenzivních pochodů, zejména však hemostázy. Na úrovni trombocytu hrají úlohu dva podtypy – receptory P2Y1 a P2Y12. Úlohou receptorů P2Y1 je mobilizace kalcia ze sarkoplazmatického retikula a jeho influx do sarkoplazmy, výsledkem je změna tvaru a krátkodobá aktivace trombocytu.
Aktivace receptoru P2Y12 indukuje degranulaci trombocytu (uvolnění řady vazokonstrikčních, chemotakticky a mitogenně působících cytokinů) a aktivaci glykoproteinových receptorů IIb/IIIa (změnou jejich izomerického uspořádání), která umožní vlastní agregaci trombocytů a vytvoření destičkového trombu. Stimulace receptoru P2Y12 tak vede k tvorbě primární hemostatické zátky a díky uvolnění řady růstových faktorů též ke stimulaci reparace vlastní léze překryté primárním trombem. Ligandem receptorů P2Y12 je ADP, jeden z klíčových působků uvolňujících se při degranulaci destičky. Vedle vlastní stimulace receptoru s aktivací trombocytu působí ADP též chemotakticky – přitahuje další trombocyty do místa vývoje destičkového trombu.
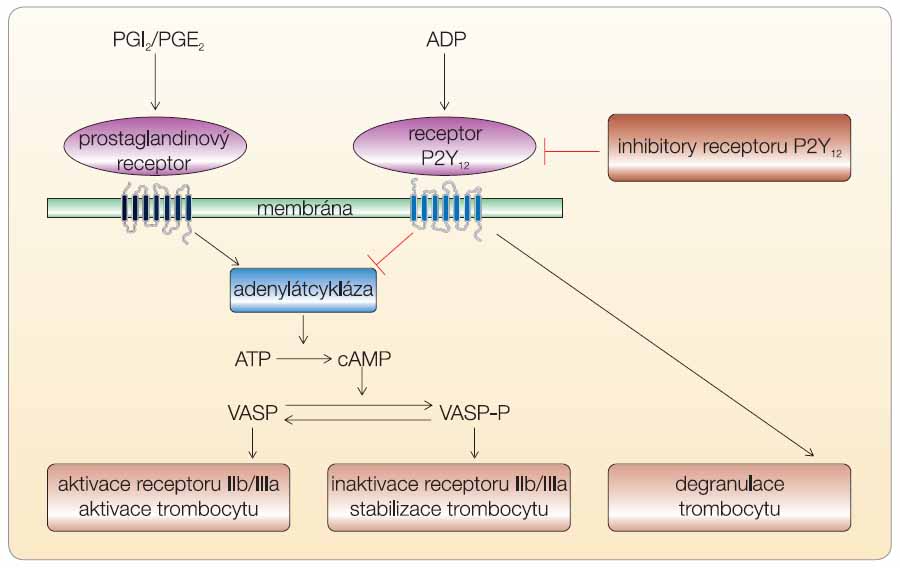 Na molekulární úrovni je funkce receptoru P2Y12, sdruženého s G-inhibičním proteinem, velmi zajímavá. Jeho aktivita je opačná než efekt obdobného receptoru prostanoidového, který je aktivován prostaglandinem E1 a prostacyklinem (obr. 2). Oba receptory působí na specifický protein VASP (vasodilator-stimulated phosphoprotein). Zatímco prostanoidy stimulují jeho fosforylaci (VASP-P), ADP fosforylaci inhibuje [1]. Fosforylovaný VASP trombocyt stabilizuje, naopak defosforylovaný stimuluje sekreci a agregaci trombocytů. Pomocí poměru VASP a VASP-P pak můžeme v praxi detekovat a určit stupeň aktivace destiček, respektive efekt blokády receptoru P2Y12.
Na molekulární úrovni je funkce receptoru P2Y12, sdruženého s G-inhibičním proteinem, velmi zajímavá. Jeho aktivita je opačná než efekt obdobného receptoru prostanoidového, který je aktivován prostaglandinem E1 a prostacyklinem (obr. 2). Oba receptory působí na specifický protein VASP (vasodilator-stimulated phosphoprotein). Zatímco prostanoidy stimulují jeho fosforylaci (VASP-P), ADP fosforylaci inhibuje [1]. Fosforylovaný VASP trombocyt stabilizuje, naopak defosforylovaný stimuluje sekreci a agregaci trombocytů. Pomocí poměru VASP a VASP-P pak můžeme v praxi detekovat a určit stupeň aktivace destiček, respektive efekt blokády receptoru P2Y12.
Blokáda receptorů P2Y12 pro ADP je výhodná. Tlumíme nejen vlastní aktivaci trombocytu a chemotaktické působení na ostatní trombocyty, tj. jejich nabírání do tvořícího se primárního trombu stimulované ADP, ale zabráněním přechodu receptorů IIb/IIIa do aktivního stavu inhibujeme i vzájemnou vazbu destiček.
Inhibice receptorů P2Y12
Inhibice vlastních receptorů může být reverzibilní, trvající jen po dobu vazby léčiva na receptor, nebo ireverzibilní, která kompromituje receptor trvale. Prasugrel, stejně jako klopidogrel a tiklopidin, inhibuje ADP receptor P2Y12 nevratně. Díky skutečnosti, že trombocyt je bezjaderný element, který není vybaven DNA umožňující resyntézu dalšího receptoru, je inhibice destičkových funkcí dlouhodobá. Trombocyt vystavený působení ireverzibilního blokátoru receptoru P2Y12 je po dobu další cirkulace v plazmě dysfunkční a primární hemostáza daná aktivací ADP je inhibována.
Primární hemostáza je však stimulována též jinými působky – zejména tromboxanem A2 (TXA2). Proto je výhodná kombinace blokátorů receptorů ADP s inhibitory tromboxanové cesty aktivace destiček. V praxi s výhodou užíváme v této indikaci ASA, která indukuje ireverzibilní blokádu cyklooxygenázy-1 (COX-1), klíčového enzymu syntézy TXA2. Právě díky ireverzibilní inhibici je kombinace obou postupů výhodná, účinek na trombocyt stejně dlouhý a proti reverzibilní inhibici není tolik závislý na přesné spolupráci nemocného.
Vedle ireverzibilních blokátorů ADP receptorů podtypu P2Y12 je dostupný též inhibitor reverzibilní – tikagrelor, analog adenosin trifosfátu. Rozdílem ireverzibilních inhibitorů oproti reverzibilním je délka působení – efekt prasugrelu odeznívá za více než týden a plný účinek trvá nejméně 48 hodin. K zajištění uspokojivé stability a dostupnosti při perorálním podání jsou ireverzibilní inhibitory aplikovány jako proléčiva a jejich vlastní farmakodynamický efekt je zajištěn až aktivním metabolitem. Z těchto důvodů je skupina označována jako inhibitory nepřímé (tj. fungující až po bioaktivaci). Aktivace prasugrelu je (na rozdíl od aktivace obou starších ireverzibilních blokátorů klopidogrelu a tiklopidinu) rychlejší a významně jednodušší. Proto i léčba prasugrelem je významně spolehlivější a má zásadně rychlejší nástup účinku.
Důvodem rozdílu je skutečnost, že jak u klopidogrelu, tak u tiklopidinu je bioaktivace proléčiva komplikovaná. Podobně do hry vstupuje i variabilní dostupnost. Výsledkem je velká inter- i intraindividuální variabilita účinku předchozích generací thienopyridinových inhibitorů. Na inter-individuální variabilitě se podílí zejména nestandardní biologická dostupnost na podkladě polymorfní aktivity glykoproteinu P (efluxní pumpa kontrolující eliminaci substrátu) a variabilní bioaktivace při polymorfismu izoenzymů CYP. Intraindividuální variabilita účinku je dána lékovými interakcemi na úrovni glykoproteinu P (P-gp) i oxidáz CYP. Výsledkem je nedostatečný protidestičkový efekt při standardním dávkování, který se objevuje při léčbě klopidogrelem asi u 30 % indoevropské populace. Jinak řečeno, část populace je k léčbě klopidogrelem semirezistentní či rezistentní.
Prasugrel je sice také proléčivo, nicméně jeho bioaktivace je jednoduchá a nejsou zapojeny oxidázy CYP s významným polymorfismem účinku a bioaktivace má minimální variabilitu. Rovněž biologická dostupnost prasugrelu je významně méně závislá na aktivitě P-gp působícího na úrovni enterocytu, hepatocytu a renálního tubulu. Díky slabé afinitě k tomuto transportéru je dosažitelnost prasugrelu i při plné aktivitě P-gp vysoká a ovlivnění aktivity pumpy se na výsledné dosažitelnosti mnoho neprojeví. Díky těmto příznivějším farmakokinetickým vlastnostem prasugrelu je docíleno rychlejšího a spolehlivějšího účinku při podávání standardní dávky v celé populaci.
Právě standardní účinek s malou variabilitou je u antitrombotik – při jejich úzkém terapeutickém okně – velmi důležitý. K docílení klinicky významné blokády destičkové hemostázy a k poklesu rizika vzniku trombotických příhod je potřeba snížit reaktivitu nejméně 60 % cirkulujících trombocytů, optimálně však 70–80 % [2]. Méně intenzivní inhibice vede k nedostatečnému antitrombotickému efektu, naopak inhibice funkce všech trombocytů je zatížena vysokým rizikem krvácení. Stanovení procenta aktivovaných trombocytů při léčbě má prognostický význam. Vysoká reaktivita při léčbě (high on-treatment platelet reactivity), stanovená například agregometricky či vyšetřením poměru VASP/VASP-P, svědčí pro nedostatečnou inhibici při nedostatečné koncentraci aktivního metabolitu. Příčinou může být suboptimální dávka, nízká bioaktivace proléčiva, pomalý nástup, eventuálně rychlé odeznění účinku.
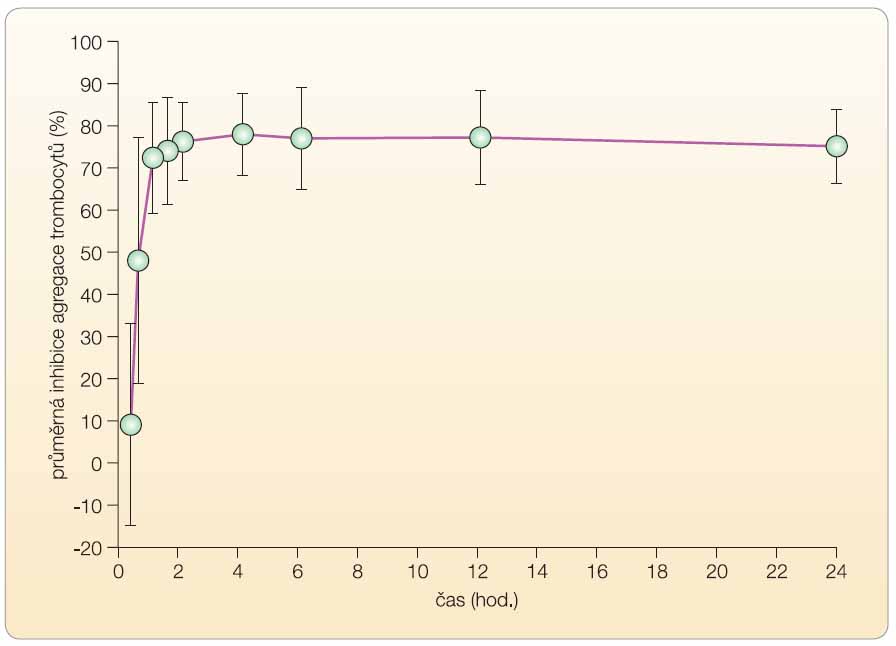 Při standardní nasycovací dávce 60 mg prasugrelu je za hodinu po podání inhibováno nejméně 70 % trombocytů u více než 60 % nemocných a za 2 hodiny po podání nejméně 80 % trombocytů (opět po 20 µM ADP) u více než 90 % nemocných (graf 1). Je možno konstatovat spolehlivý a rychlý účinek prasugrelu do 1–2 hodin po podání. V ustáleném stavu, tj. za 3–5 dnů, při podávání udržovací dávky 10 mg denně přetrvávala u více než 90 % nemocných významná inhibice destičkových funkcí nejméně 70 % trombocytů [3]. Také při léčbě udržovací dávkou je dokumentován spolehlivý účinek, tj. dostatečná inhibice agregace u téměř všech nemocných. Plné obnovy agregace je dosaženo do 5–9 dnů v závislosti na rychlosti produkce nových trombocytů.
Při standardní nasycovací dávce 60 mg prasugrelu je za hodinu po podání inhibováno nejméně 70 % trombocytů u více než 60 % nemocných a za 2 hodiny po podání nejméně 80 % trombocytů (opět po 20 µM ADP) u více než 90 % nemocných (graf 1). Je možno konstatovat spolehlivý a rychlý účinek prasugrelu do 1–2 hodin po podání. V ustáleném stavu, tj. za 3–5 dnů, při podávání udržovací dávky 10 mg denně přetrvávala u více než 90 % nemocných významná inhibice destičkových funkcí nejméně 70 % trombocytů [3]. Také při léčbě udržovací dávkou je dokumentován spolehlivý účinek, tj. dostatečná inhibice agregace u téměř všech nemocných. Plné obnovy agregace je dosaženo do 5–9 dnů v závislosti na rychlosti produkce nových trombocytů.
Při léčbě ireverzibilními inhibitory trombocytárních ADP receptorů je důležitá otázka obnovy destičkových funkcí. Při testování destičkových funkcí různými metodami (VerifyNow, Multiplate a LTA – light transmission aggregometry) byl získán konzistentní výsledek. V randomizované studii došlo k obnově primární hemostázy po podání nasycovací dávky 60 mg prasugrelu jednorázově za 7–9 dnů [4]. Pro srovnání – po nasycovací dávce klopidogrelu došlo k úpravě za 3–7 dnů. Efekt prasugrelu tak trvá déle, příčinou je pravděpodobně intenzivnější inhibice ADP receptoru.
![Graf 2 Inhibice agregace trombocytů při různých dávkách prasugrelu. Poloviční udržovací dávka prasugrelu (5 mg) vede ke stejné inhibici agregace jako standardní udržovací dávka klopidogrelu (75 mg). Zvýšení iniciální i udržovací dávky prasugrelu vede k mírnému nárůstu efektu; podle [5] – Jernberg, et al., 2006. ID – iniciální dávka, UD – udržovací dávka](https://www.remedia.cz/photo-a-28863---.jpg) Při srovnání různých dávek prasugrelu (jak iniciálních, tak udržovacích) se standardní dávkou klopidogrelu (graf 2) byl ve studii založené na turbidimetrickém stanovení agregace trombocytů prokázán větší účinek i polovičních dávek prasugrelu proti standardním dávkám klopidogrelu. Zvýšení udržovací dávky prasugrelu mělo jen nevelký přídatný účinek [5].
Při srovnání různých dávek prasugrelu (jak iniciálních, tak udržovacích) se standardní dávkou klopidogrelu (graf 2) byl ve studii založené na turbidimetrickém stanovení agregace trombocytů prokázán větší účinek i polovičních dávek prasugrelu proti standardním dávkám klopidogrelu. Zvýšení udržovací dávky prasugrelu mělo jen nevelký přídatný účinek [5].
Farmakokinetické vlastnosti
Prasugrel je proléčivo, které se velmi rychle vstřebává – po perorální aplikaci nalačno je maximální koncentrace dosaženo za 30 minut (s rozmezím 20–60 minut). Biologická dostupnost prasugrelu (mateřské látky) je kolem 80 %. Na rozdíl od klopidogrelu ovlivňuje aktivita eliminační pumpy glykoproteinu P (P-gp) dostupnost prasugrelu jen velmi málo. Současné podání prasugrelu s potravou pouze zpomalí resorpci – doba do nástupu účinku se prodlouží na dvoj- až trojnásobek – dostupnost a celková expozice se nezmění [6]. Pokles maximální koncentrace mateřské látky o 40–50 % není pokládán za významný, není nutno aplikovat prasugrel nalačno.
Rovněž biokonverze na aktivní metabolit, látku s kódovým označením R-138727, je velmi rychlá, vrcholová koncentrace aktivního metabolitu těsně kopíruje koncentraci mateřské látky a čas do jejího dosažení se po perorálním podání prasugrelu nalačno pohybuje kolem 30 minut. U dospělých se plazmatický poločas pohybuje mezi 7–8 hodinami s rozmezím 2–15 hodin. Tato variabilita však nehraje významnou úlohu, díky ireverzibilní inhibici ADP receptorů P2Y12 není farmakodynamický účinek tolik závislý na přetrvávání plazmatické koncentrace, ale je více ovlivněn koncentrací vrcholovou, která má variabilitu menší. Expozice aktivnímu metabolitu je v rozmezí 5–60 mg mateřské látky téměř lineární. Mírný nárůst koncentrace nad lineární vztah (při aplikaci vyšších dávek) je klinicky nevýznamný. Při podávání udržovací dávky 10 mg prasugrelu denně nedochází k akumulaci mateřské látky [6].
 Vlastní bioaktivace probíhá v prvé fázi v enterocytu hydrolýzou na thiolakton, poté na úrovni hepatocytu je konverze dokončena v jednom metabolickém kroku oxidázami CYP, konkrétně CYP3A a CYP2B6 či v menší míře CYP2C9 nebo CYP2C19. Díky velké kapacitě esteráz i vzájemné zastupitelnosti zúčastněných izoenzymů CYP je výsledná aktivace málo ovlivněna vlivy farmakogenetickými i lékovými interakcemi. V tomto bodě se zásadně liší nekomplikovaná bioaktivace i resorpce prasugrelu od problematické farmakokinetiky klopidogrelu či tiklopidinu.
Vlastní bioaktivace probíhá v prvé fázi v enterocytu hydrolýzou na thiolakton, poté na úrovni hepatocytu je konverze dokončena v jednom metabolickém kroku oxidázami CYP, konkrétně CYP3A a CYP2B6 či v menší míře CYP2C9 nebo CYP2C19. Díky velké kapacitě esteráz i vzájemné zastupitelnosti zúčastněných izoenzymů CYP je výsledná aktivace málo ovlivněna vlivy farmakogenetickými i lékovými interakcemi. V tomto bodě se zásadně liší nekomplikovaná bioaktivace i resorpce prasugrelu od problematické farmakokinetiky klopidogrelu či tiklopidinu.
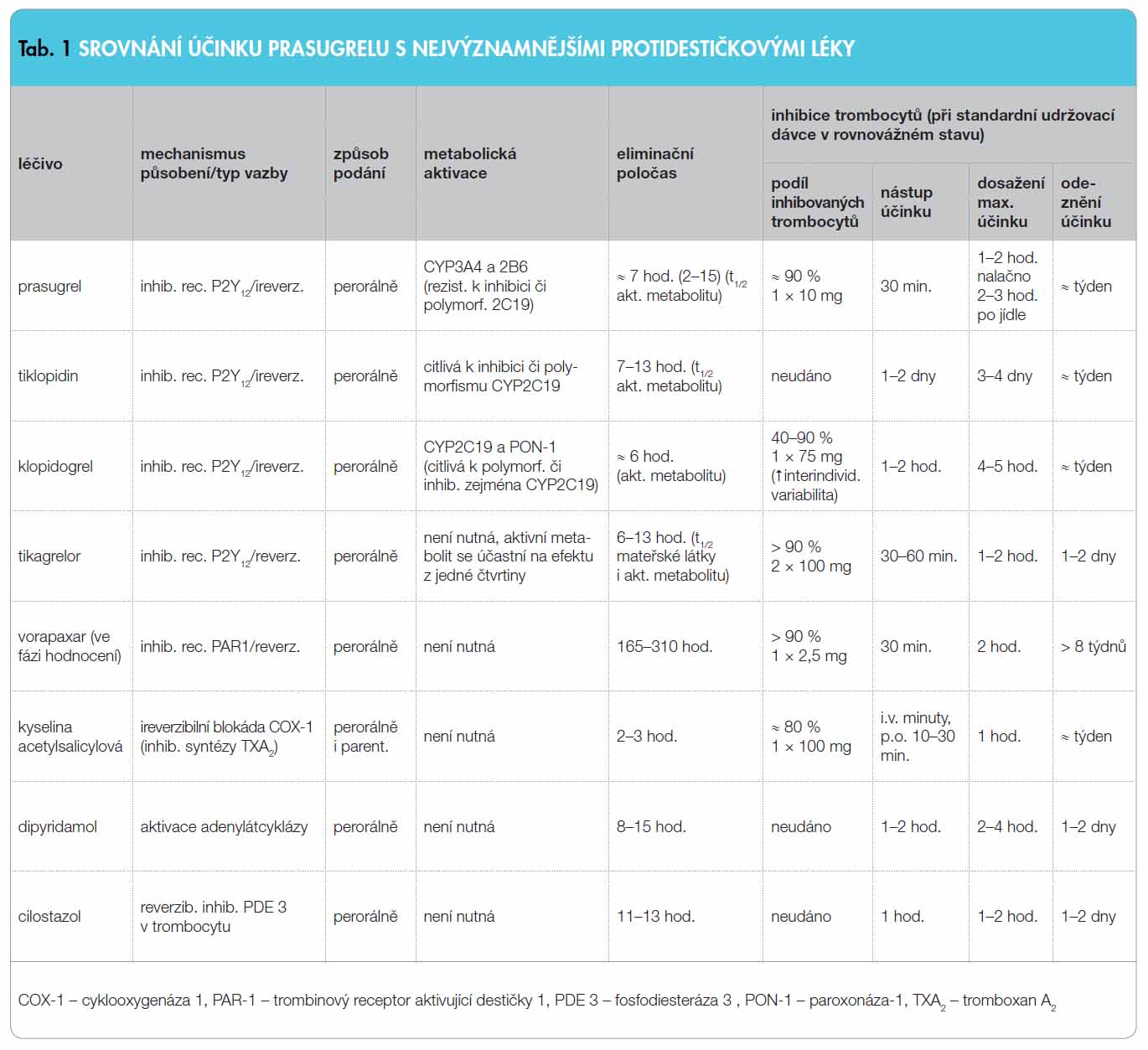
V oběhu je aktivní metabolit vázán z 98 % na albumin. Před vlastní eliminací je aktivní metabolit v játrech inaktivován konjugací s cysteinem či S-metylací. Vyloučení je ze dvou třetin závislé na ledvinách, zbytek odchází jaterní cestou do stolice [6]. Srovnání farmakokinetiky prasugrelu s ostatními protidestičkovými léky uvádí tab. 1.
Při sledování farmakokinetiky prasugrelu a jeho aktivního metabolitu v různých subpopulacích byly zjištěny relativně malé rozdíly. U osob starších 75 let byl pozorován mírný vzestup expozice (do 20 %), proto je u seniorů riziko krvácení vyšší a k zajištění příznivého poměru přínos/riziko je léčba indikována jen u výrazně rizikových podskupin, tj. u seniorů po infarktu myokardu (IM) nebo s diabetem. Podobně byla doložena větší expozice aktivnímu metabolitu (asi o třetinu) u osob s nižší hmotností, tj. s váhou pod 60 kg. Při volbě optimální dávky proto zvažujeme riziko krvácení a případně snížíme udržovací dávku prasugrelu na polovinu, tj. na 5 mg denně [6].
V ostatních podskupinách – podle pohlaví, kuřáckého návyku, typu polymorfismu izoenzymů CYP či podle etnických skupin – nebyl pozorován významný rozdíl ve farmakokinetice. Také renální selhání středního stupně (s clearance kreatininu . 0,5 ml/s) nebo mírné až středně závažné postižení jater neovlivnilo expozici prasugrelu ani jeho aktivnímu metabolitu. Farmakokinetika prasugrelu u nemocných s pokročilejším renálním selháním či s těžkou jaterní lézí studována nebyla [6].
Klinické zkušenosti s prasugrelem
V prvých fázích klinického hodnocení byla stanovena optimální léčebná dávka. Maximální poměr efekt vs. riziko byl pozorován při nasycovací dávce 60 mg prasugrelu a udržovací dávce 10 mg denně, resp. u vybraných podskupin 5 mg denně. V těchto dávkách byl v testech sledujících inhibici agregace trombocytů in vitro doložen rychlejší a spolehlivější účinek proti klopidogrelu ve standardních dávkách i v dávkách dvojnásobných [7]. Obdobně ve studii PRINCIPLE-TIMI 44 byla zjištěna (opět agregačními testy in vitro) výraznější inhibice destičkových funkcí u nemocných po PCI (percutaneous coronary intervention) [8]. Konečně ve studii JUMBO-TIMI 26 byla doložena srovnatelná bezpečnost testovaných dávek prasugrelu a klopidogrelu, výskyt většího krvácení ani celkového krvácení se u obou léků významně nelišil [9].
Pro zhodnocení přínosu léku jsou rozhodující studie 3. fáze klinického hodnocení. Efekt prasugrelu byl hodnocen ve dvou studiích 3. fáze, ve studii TRITON-TIMI 38 a TRILOGY-ACS. Výsledky první studie máme k dispozici, druhá (u nemocných s konzervativně léčenými příhodami typu NSTEMI – nestabilní angina pectoris či IM bez elevace úseku ST) stále probíhá, zveřejnění výsledku se očekává v srpnu 2012 na kongresu ESC (European Society of Cardiology).
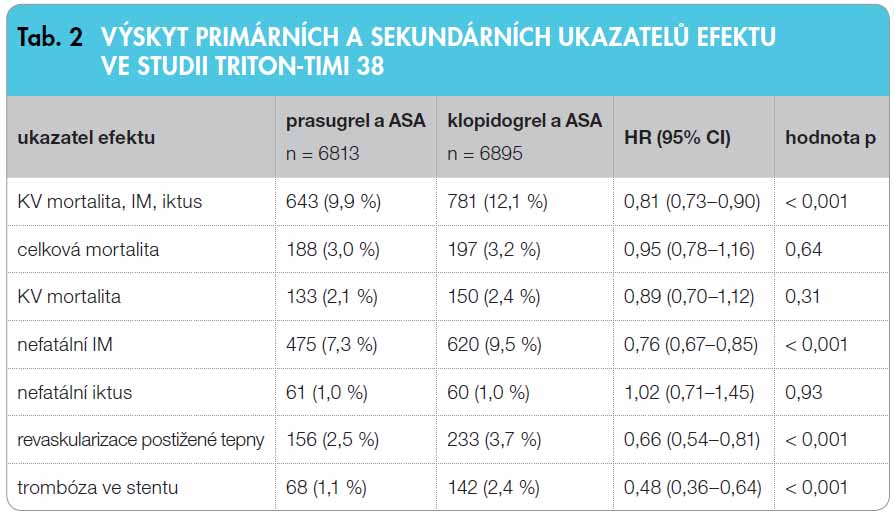 Ve studii TRITON-TIMI 38 byl prasugrel ve dvojitě zaslepeném sledování porovnáván s klopidogrelem [10]. Studie prověřovala efekt v indikaci prevence kardiovaskulárních příhod u nemocných léčených v rámci sekundární prevence a indikovaných ke koronární intervenci PCI (percutaneous coronary intervention). Téměř 14 tisíc nemocných s recentní příhodou – tři čtvrtiny typu NSTEMI (nestabilní angina pectoris či IM bez elevace úseku ST a čtvrtina typu STEMI (IM s elevací úseku ST) – bylo randomizováno do dvou větví. V jedné byli pacienti léčeni iniciální dávkou 60 mg a udržovací dávkou 10 mg prasugrelu, v paralelní větvi 300 mg, resp. 75 mg klopidogrelu. Studie trvala po dobu 6–15 měsíců s mediánem 14,5 měsíce. V obou větvích byli nemocní léčeni po dobu studie 75–162 mg ASA.
Ve studii TRITON-TIMI 38 byl prasugrel ve dvojitě zaslepeném sledování porovnáván s klopidogrelem [10]. Studie prověřovala efekt v indikaci prevence kardiovaskulárních příhod u nemocných léčených v rámci sekundární prevence a indikovaných ke koronární intervenci PCI (percutaneous coronary intervention). Téměř 14 tisíc nemocných s recentní příhodou – tři čtvrtiny typu NSTEMI (nestabilní angina pectoris či IM bez elevace úseku ST a čtvrtina typu STEMI (IM s elevací úseku ST) – bylo randomizováno do dvou větví. V jedné byli pacienti léčeni iniciální dávkou 60 mg a udržovací dávkou 10 mg prasugrelu, v paralelní větvi 300 mg, resp. 75 mg klopidogrelu. Studie trvala po dobu 6–15 měsíců s mediánem 14,5 měsíce. V obou větvích byli nemocní léčeni po dobu studie 75–162 mg ASA.
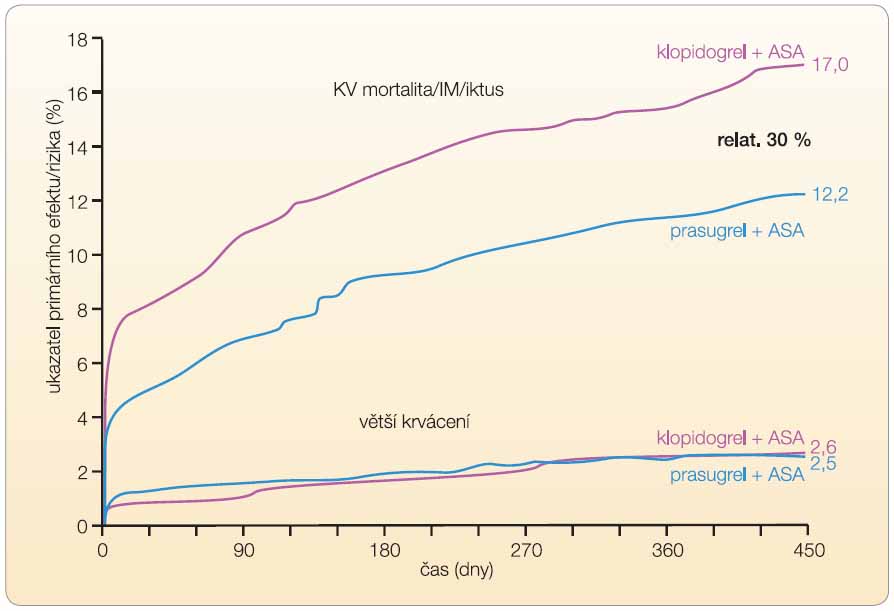
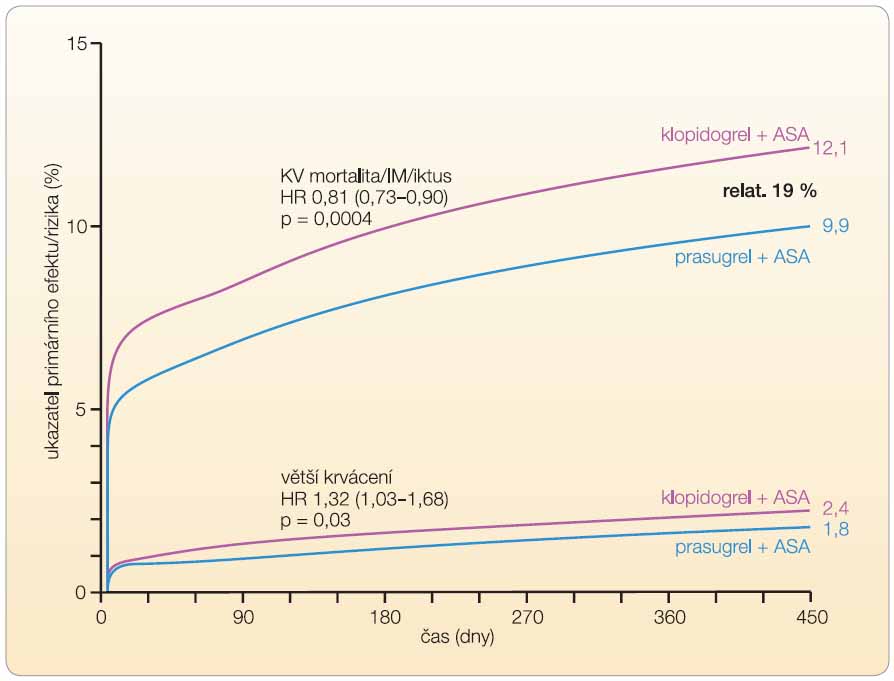 Primární ukazatel účinku (kardiovaskulární mortalita, nefatální IM či iktus) se objevil téměř o pětinu méně často při léčbě kombinací prasugrelu s ASA ve srovnání s kombinací klopidogrelu s ASA (HR 0,81; 95% CI: 0,73–0,90; p < 0,001), graf 3. Významný pokles incidence nastal zejména díky snížení výskytu IM o 24 % (HR 0,76; 95% CI: 0,67–0,85; p < 0,001). Pokles kardiovaskulární mortality o 11 % nedosáhl statistické významnosti, incidence mozkových příhod ovlivněna nebyla. Souhrnně výsledky sekundárních ukazatelů efektu prezentuje tab. 2. Za povšimnutí stojí zejména méně než poloviční výskyt trombóz v místě intervenované tepny při implantaci stentu. Rozdíl v účinku podle typu implantovaného stentu pozorován nebyl.
Primární ukazatel účinku (kardiovaskulární mortalita, nefatální IM či iktus) se objevil téměř o pětinu méně často při léčbě kombinací prasugrelu s ASA ve srovnání s kombinací klopidogrelu s ASA (HR 0,81; 95% CI: 0,73–0,90; p < 0,001), graf 3. Významný pokles incidence nastal zejména díky snížení výskytu IM o 24 % (HR 0,76; 95% CI: 0,67–0,85; p < 0,001). Pokles kardiovaskulární mortality o 11 % nedosáhl statistické významnosti, incidence mozkových příhod ovlivněna nebyla. Souhrnně výsledky sekundárních ukazatelů efektu prezentuje tab. 2. Za povšimnutí stojí zejména méně než poloviční výskyt trombóz v místě intervenované tepny při implantaci stentu. Rozdíl v účinku podle typu implantovaného stentu pozorován nebyl.
Z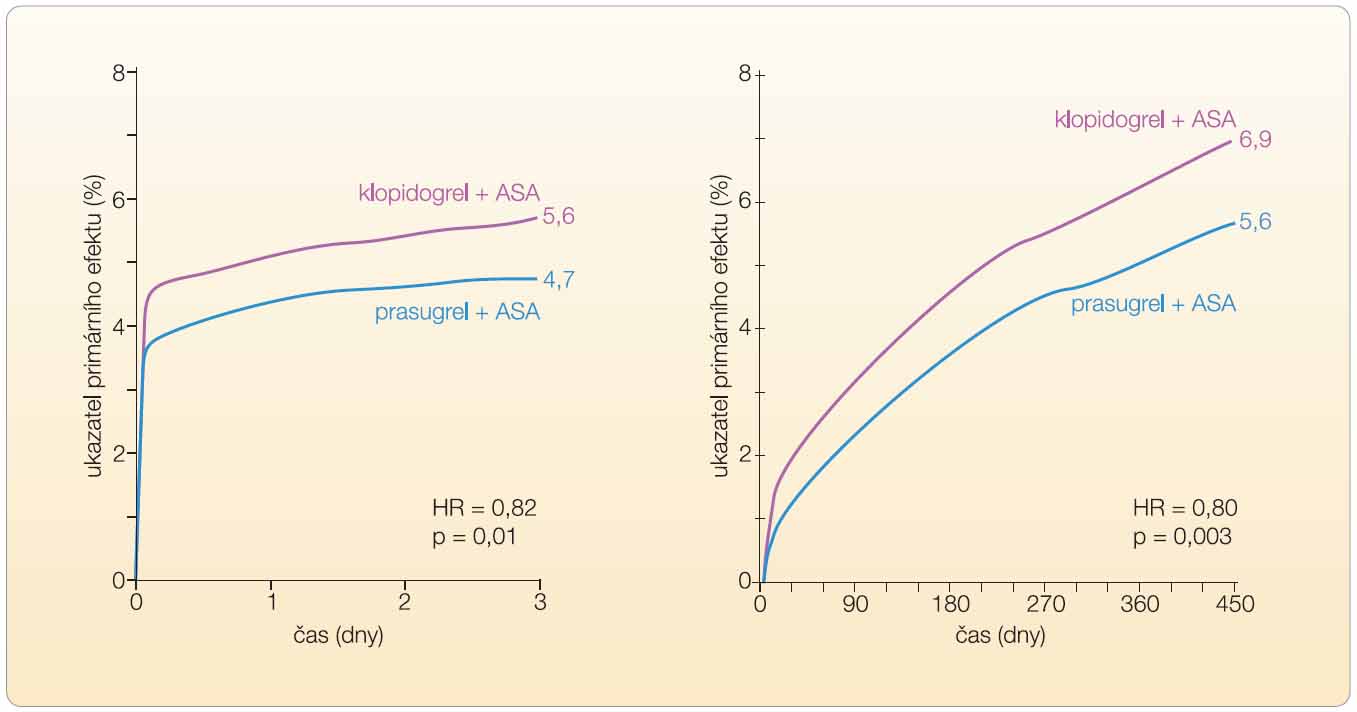 ajímavý je vztah mezi délkou léčby a dosaženým rozdílem v efektu. Z křivek reflektujících výskyt příhod ve vztahu k času je zřejmé, že rozhodující byly prvé dny léčby, resp. dokonce prvé hodiny (graf 4).
ajímavý je vztah mezi délkou léčby a dosaženým rozdílem v efektu. Z křivek reflektujících výskyt příhod ve vztahu k času je zřejmé, že rozhodující byly prvé dny léčby, resp. dokonce prvé hodiny (graf 4).
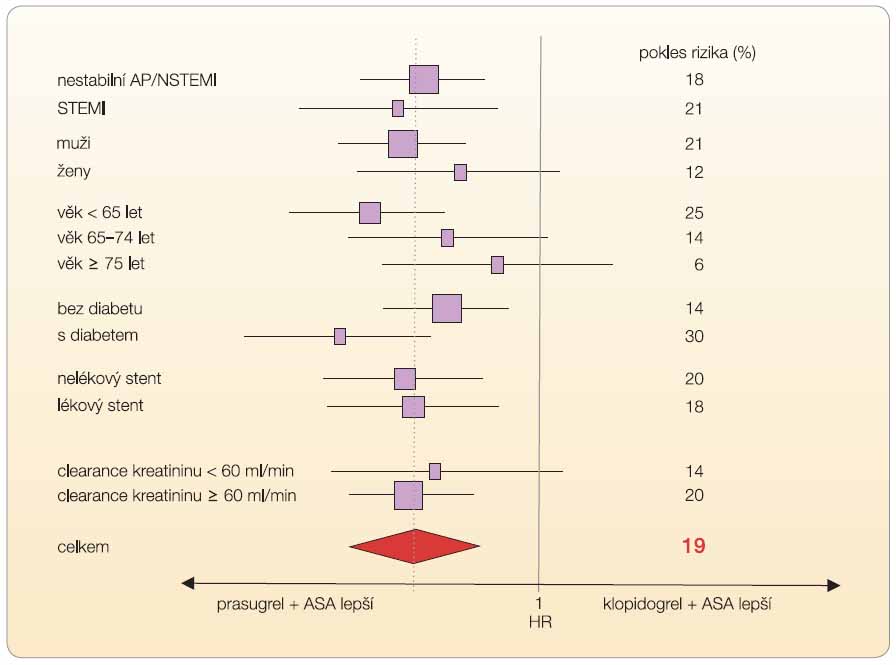
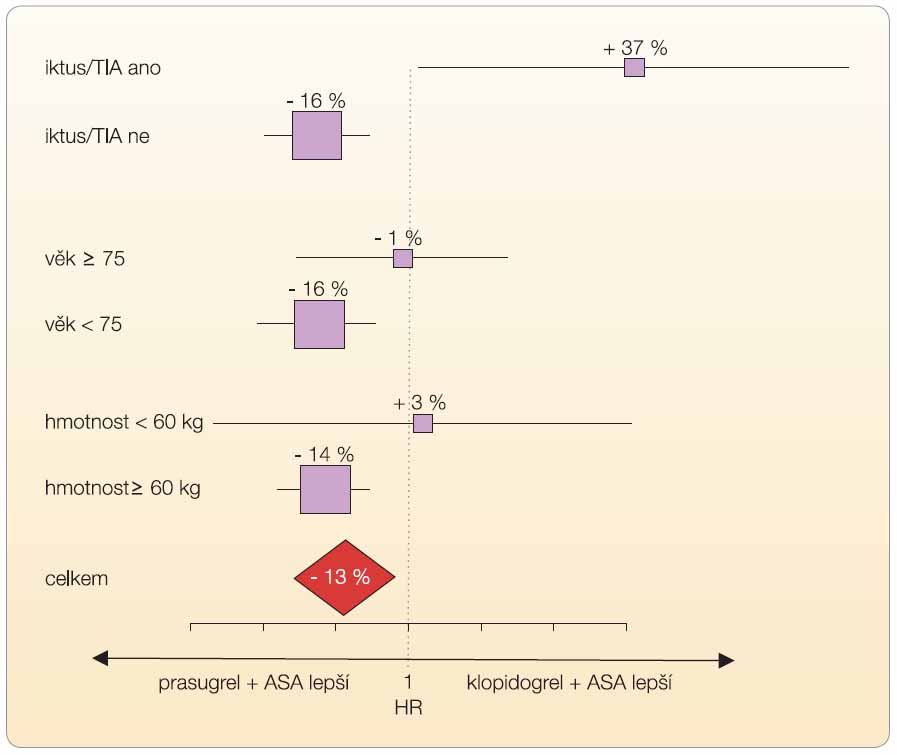
Analyzujeme-li efekt v jednotlivých podskupinách, pak mezi skupinami nebyl statisticky významný rozdíl (graf 5). Nicméně je zřetelný trend k většímu efektu prasugrelu u diabetiků a naopak jeho pokles s věkem.
 Vedle účinnosti je základním ukazatelem též bezpečnost. Hlavním a rozhodujícím je výskyt krvácení. Ve srovnání s klopidogrelem byl u všech sledovaných typů krvácení pozorován nárůst. V primárním ukazateli bezpečnosti – v incidenci většího krvácení podle definice TIMI (jakékoli intrakraniální krvácení, krvácení vyžadující intervenci a s poklesem hladiny hemoglobinu alespoň o 50 g/l), které se neobjevilo v souvislosti s revaskularizační operací (coronary artery bypass graft surgery, CABG) – byl pozorován významný nárůst (o 32 %). Obdobně se zvýšil výskyt krvácení menších (o 31 %) a krvácení minimálních (o 47 %). Fatálních krvácení přibylo čtyřnásobně, číselné údaje o těchto změnách však nemají dostatečnou vypovídací hodnotu. Přehled bezpečnostních parametrů přináší tab. 3.
Vedle účinnosti je základním ukazatelem též bezpečnost. Hlavním a rozhodujícím je výskyt krvácení. Ve srovnání s klopidogrelem byl u všech sledovaných typů krvácení pozorován nárůst. V primárním ukazateli bezpečnosti – v incidenci většího krvácení podle definice TIMI (jakékoli intrakraniální krvácení, krvácení vyžadující intervenci a s poklesem hladiny hemoglobinu alespoň o 50 g/l), které se neobjevilo v souvislosti s revaskularizační operací (coronary artery bypass graft surgery, CABG) – byl pozorován významný nárůst (o 32 %). Obdobně se zvýšil výskyt krvácení menších (o 31 %) a krvácení minimálních (o 47 %). Fatálních krvácení přibylo čtyřnásobně, číselné údaje o těchto změnách však nemají dostatečnou vypovídací hodnotu. Přehled bezpečnostních parametrů přináší tab. 3.
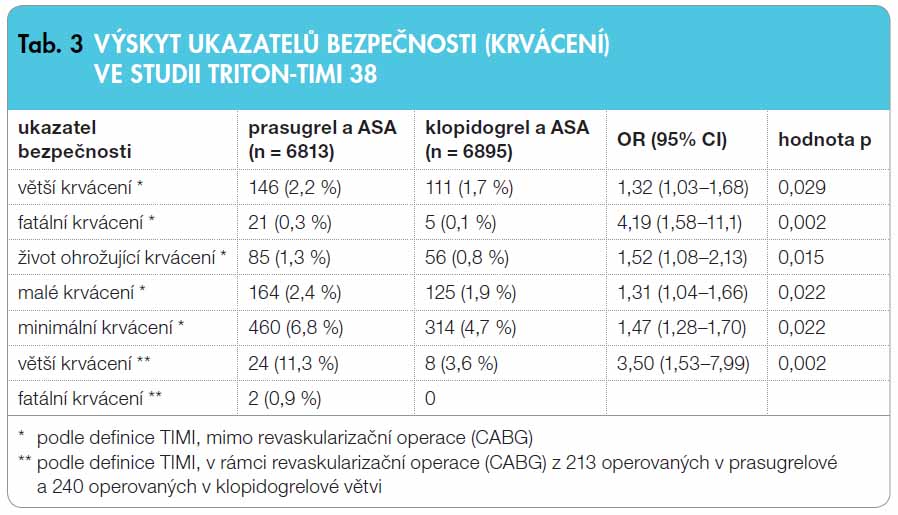 Nárůst krvácení řádově o třetinu je logický, reflektuje větší počet nemocných, kteří odpověděli na léčbu prasugrelem a neodpovídali na podání klopidogrelu. Jinak řečeno, zvýšil-li se počet nemocných s účinnou protidestičkovou léčbou o 20–30 %, zvýšil se o třetinu i výskyt krvácení.
Nárůst krvácení řádově o třetinu je logický, reflektuje větší počet nemocných, kteří odpověděli na léčbu prasugrelem a neodpovídali na podání klopidogrelu. Jinak řečeno, zvýšil-li se počet nemocných s účinnou protidestičkovou léčbou o 20–30 %, zvýšil se o třetinu i výskyt krvácení.
Pro zhodnocení skutečného přínosu léku je potřeba porovnat čistý efekt, tzv. net clinical benefit – tj. zhodnotit přínos (snížení celkové mortality, IM, iktu) ve vztahu k riziku (výskytu většího krvácení). Čistý přínos kombinace prasugrelu s ASA proti kombinaci klopidogrel s ASA v celé skupině, tj. pokles o 13 % (HR 0,87; 95% CI: 0,79–0,95; p = 0,004), byl stále klinicky i statisticky významný [11–13]. Efekt v predefinovaných podskupinách byl největší u diabetiků, doložen pokles o 26 % (HR 0,74; 95% CI: 0,62–0,89; p = 0,01).
Podíváme-li se podrobněji na podskupinu pacientů s diabetem mellitem, je při analýze mortalitně/morbiditní křivky patrný významný rozdíl mezi diabetiky, křivka reflektující výskyt závažného krvácení však nestoupá (graf 6). Je také zřetelné, že i u diabetiků se většina rozdílu v poklesu výskytu cévních příhod, stejně jako většina krvácivých příhod, objevila v prvých dnech léčby.
 Shrneme-li, pak u nemocných s akutními koronárními příhodami typu nestabilní anginy pectoris nebo IM bez elevací či s elevacemi úseku ST, kteří jsou indikováni k PCI, vede léčba kombinací prasugrelu s ASA k intenzivnějšímu snížení výskytu koronárních příhod: výskyt IM klesá o čtvrtinu, kombinovaný ukazatel (kardiovaskulární mortalita, IM a iktus) o pětinu ve srovnání s kombinací klopidogrelu s ASA. Daní za větší účinnost je asi o třetinu vyšší výskyt krvácení – jak větších, tak menších příhod. Největší účinek byl pozorován u diabetiků. Zatímco ve skupině všech nemocných bylo třeba léčit 46 nemocných k zabránění jedné příhody (NNT), u diabetiků bylo zamezeno jedné příhodě na každých 21 léčených.
Shrneme-li, pak u nemocných s akutními koronárními příhodami typu nestabilní anginy pectoris nebo IM bez elevací či s elevacemi úseku ST, kteří jsou indikováni k PCI, vede léčba kombinací prasugrelu s ASA k intenzivnějšímu snížení výskytu koronárních příhod: výskyt IM klesá o čtvrtinu, kombinovaný ukazatel (kardiovaskulární mortalita, IM a iktus) o pětinu ve srovnání s kombinací klopidogrelu s ASA. Daní za větší účinnost je asi o třetinu vyšší výskyt krvácení – jak větších, tak menších příhod. Největší účinek byl pozorován u diabetiků. Zatímco ve skupině všech nemocných bylo třeba léčit 46 nemocných k zabránění jedné příhody (NNT), u diabetiků bylo zamezeno jedné příhodě na každých 21 léčených.
Vedle klíčové studie TRITON-TIMI 38 probíhá ještě několik velkých studií v různých indikacích. Studie TRILOGY ACS sleduje účinek prasugrelu v kombinaci s ASA proti klopidogrelu v kombinaci s ASA u nemocných s akutními koronárními příhodami (typu NSTEMI), kteří jsou, na rozdíl od pacientů zařazených do studie TRITON-TIMI 38, indikováni ke konzervativnímu léčebnému postupu [14].
Podobně je realizována studie v indikaci profylaxe trombotických komplikací u nemocných po implantaci stentu. Například studie TAXUS Liberte Post-Approval Study sleduje efekt prasugrelu po implantaci lékových stentů s paklitaxelem [15]. Podobně je sledován efekt prasugrelu po implantaci lékových i nelékových stentů ve studii BASKET-PROVE II [16]. Výsledky se očekávají nejdříve v roce 2013.
Nežádoucí účinky
Inhibujeme-li hemostázu, je nutno počítat s rizikem krvácení. V klinických studiích se výskyt velkého krvácení (jakékoli krvácení intrakraniální či krvácení s intervencí a s poklesem koncentrace hemoglobinu nejméně o 50 g/l) při duální protidestičkové léčbě prasugrelem s ASA objevil asi u 2 % léčených ročně, stejná incidence byla pozorována v případě malého krvácení (s poklesem koncentrace hemoglobinu nejméně o 30 g/l, avšak o méně než 50 g/l). V reálném životě – při méně striktních podmínkách indikace a zpravidla též při méně častém sledování – je výskyt obdobný, resp. jen o málo vyšší. Ve studii provedené u tří set konsekutivních nemocných s implantací stentu (převážně z indikace IM) se vyskytlo „velké“ krvácení téměř ve 3 %, „malé“ v 5 % a „minimální“ krvácení (nejčastěji epistaxe) v 15 % [17].
 Riziko krvácení je výrazně vyšší u nemocných s anamnézou recentního krvácení či s anamnézou ischemické mozkové příhody. V těchto případech riziko převažuje nad přínosem a léčba je kontraindikována. Také u seniorů od 75 let věku hrozí vysoké riziko zejména fatálního a intracerebrálního krvácení a léčbu indikujeme pouze při vysokém riziku trombózy, tj. zejména při přítomnosti diabetu či anamnéze IM. Za těchto podmínek může riziko krvácení převážit vlastní léčebný přínos (graf 7).
Riziko krvácení je výrazně vyšší u nemocných s anamnézou recentního krvácení či s anamnézou ischemické mozkové příhody. V těchto případech riziko převažuje nad přínosem a léčba je kontraindikována. Také u seniorů od 75 let věku hrozí vysoké riziko zejména fatálního a intracerebrálního krvácení a léčbu indikujeme pouze při vysokém riziku trombózy, tj. zejména při přítomnosti diabetu či anamnéze IM. Za těchto podmínek může riziko krvácení převážit vlastní léčebný přínos (graf 7).
Vznik krvácení významně ovlivňuje též užívání léků snižujících odolnost sliznice trávicího traktu. Sem patří zejména nesteroidní antirevmatika, glukokortikoidy, riziko zvyšují i léky s antitrombotickým účinkem – zejména antikoagulancia. Vyšší expozice prasugrelu – zejména při nízké tělesné hmotnosti (< 60 kg) – může rovněž zvýšit pravděpodobnost hemoragie. Podobně riziko intrakraniálního krvácení výrazně zvyšuje nedostatečně kontrolovaná hypertenze.
Jaké bude reálné riziko krvácení v klinické praxi? Při respektování doporučení uvedených v SPC vyřadíme z léčby pacienty kontraindikované, tj. s anamnézou cévní mozkové příhody (tranzitorní ischemie či iktu), nebo nedoporučené k léčbě – nemocné ve věku nad 75 let či s hmotností menší než 60 kg. Vyřazením těchto nemocných (asi 20 %) docílíme výrazného zvýšení bezpečnosti (hodnoceno výskytem závažného krvácení) a současně naroste účinnost (poklesne výskyt závažných KV příhod). Na základě podskupinové analýzy dat studie TRITON-TIMI 38 se relativní nárůst většího krvácení sníží pod 2 % a rozdíl výskytu krvácení mezi prasugrelem a klopidogrelem pod 0,5 % (1,9 % vs. 1,5 %; HR 1,24; 0,91–1,69, p = 0,17). Efekt léčby (výskyt kardiovaskulárního úmrtí, IM či iktu) se ve srovnání s klopidogrelem zvýrazní na relativních 26 %, resp. absolutních 2,7 % (8,3 % vs. 11,0 %; HR 0,74; 0,66–0,84, p < 0,0001). Jinak řečeno, při správné indikaci předejdeme jedné závažné kardiovaskulární příhodě na každých 40–50 léčených nemocných [18].
V případě méně závažného krvácení, zejména objeví-li se v akutním a subakutním období koronární příhody, se snažíme stav zvládnout bez vysazení prasugrelu. Ukončení léčby je totiž spojeno s vyšším rizikem trombotické komplikace.
Z ostatních nežádoucích účinků je nutno zmínit nevelké riziko vzniku závažné trombocytopenie (0,06 %), výrazně nižší je riziko trombotické trombocytopenické purpury. Dále se jako následek krvácení může vyskytnout anémie (2,2 %).
Relativně vzácná je incidence alergických reakcí (0,35 %), abnormálních hodnot jaterních testů (0,22 %) či angioedému (0,06 %). Zcela identický výskyt těchto příznaků byl pozorován také při léčbě klopidogrelem.
Předčasné ukončení léčby
V případě výskytu nežádoucího účinku při léčbě prasugrelem, zejména při krvácení nebo při potřebě chirurgického zákroku, je potřeba přerušit či ukončit léčbu. Vzhledem k tomu, že přerušení léčby opět zvýší riziko aterotrombotické příhody, vždy zvažujeme přínos a riziko takového kroku. Vyšší riziko trombózy provází zejména časné období po implantaci stentu do koronárního povodí.
Vzájemné srovnání inhibitorů ADP receptoru P2Y12
Nejvýznamnějším rozdílem uvnitř skupiny ireverzibilních inhibitorů je bezpečnost (při srovnání prasugrelu s tiklopidinem) či spolehlivost účinku a rychlost nástupu efektu (při srovnání prasugrelu s klopidogrelem i s tiklopidinem).
Hlavní slabinou léčby tiklopidinem je riziko indukce neutropenie a absence dokladů o účinnosti v indikaci léčby akutních koronárních příhod. Nedostatkem klopidogrelu je, jak bylo uvedeno, nestandardní biologická dostupnost a problematická bioaktivace. Výsledkem je pomalejší nástup účinku a nedostatečný efekt až u 30 % indoevropské populace. Klinickým korelátem je větší dopad léčby kombinací prasugrelu s ASA na pokles výskytu trombotických koronárních příhod. Tento rozdíl byl důkladně probrán v rámci výsledků studie TRITON-TIMI 38.
Při srovnání reverzibilních a ireverzibilních blokátorů ADP receptoru je rozhodujícím rozdílem délka inhibice destičkových funkcí. V případě prasugrelu a tikagreloru je nástup účinku u obou léků velmi rychlý (30–60 minut), při doporučených dávkách je docíleno srovnatelné a účinné inhibice trombocytů jak ve smyslu velmi nízké interindividuální variability, tak ve smyslu malého podílu stále aktivních trombocytů při léčbě. Rovněž riziko lékových interakcí a závislost efektu na farmakogenetické výbavě léčeného je u obou léků minimální. Jediným zásadním rozdílem je délka působení – ta trvá při reverzibilní inhibici ADP receptoru tikagrelorem kolem 24 hodin, při ireverzibilní blokádě prasugrelem asi týden. Reverzibilita blokády receptoru může být výhodou v případě, kdy potřebujeme ukončit inhibici primární hemostázy, např. při akutní indikaci chirurgického zákroku, zejména revaskularizace myokardu aortokoronárním bypassem. Na druhé straně efekt závisí na dokonalé spolupráci nemocného, vynechání více než jedné dávky vede k obnovení aktivity trombocytů a k riziku trombotické komplikace.
Při vzájemném porovnání dvou favoritů (prasugrelu s tikagrelorem) v klinickém účinku nemáme sice srovnání „head-to-head“, ale nepřímé porovnání vůči klopidogrelu neprokazuje rozdíl v celkové mortalitě, výskytu nefatálního IM či nefatálního iktu [19]. Rozdíl byl pozorován pouze v nižším výskytu trombotických příhod v místě implantovaného stentu (ve prospěch prasugrelu) a celkového výskytu krvácení (ve prospěch tikagreloru). Redukce krvácivých komplikací byla dána zejména poklesem příhod spojených s kardiochirurgickými výkony, krvácení mimo tyto výkony bylo u obou léků srovnatelné. Také tolerance obou léků byla srovnatelná, procento nemocných, kteří přerušili léčbu, bylo identické.
Shrneme-li, pak prasugrel přináší výhodu nižšího výskytu trombóz v místě implantovaného stentu a léčba není tolik závislá na přesném dodržování léčebného schématu. Naproti tomu terapie tikagrelorem je spojena s nižším výskytem krvácivých komplikací spojených zejména s kardiochirurgickými zákroky. Výhodná je reverzibilita inhibice v případě krvácení, efekt léku dříve odezní. Daní však je nutnost dobré spolupráce nemocného s minimálním vynecháním dávek.
Indikace
Prasugrel je indikován v prevenci trombotických kardiovaskulárních příhod u nemocných s akutními koronárními příhodami typu nestabilní anginy pectoris a IM bez elevace úseku ST (NSTEMI příhody) či s IM s elevací úseku ST (STEMI příhody), u kterých se předpokládá indikace k intervenční léčbě perkutánní koronární angioplastikou. Léčba prasugrelem má být zahájena ihned po stanovení diagnózy akutní koronární příhody, nečekáme na výsledek invazivního vyšetření. Není-li kontraindikace, pak má být prasugrel podáván společně s ASA.
Praktický význam má indikace prasugrelu u nemocných, u nichž není znám anatomický nález a není potvrzeno, že bude PCI schůdná. Díky tomu, že se většina aterotrombotických příhod objevuje u akutních koronárních syndromů velmi časně, je indikováno podání duální protidestičkové léčby (prasugrel + ASA) co nejdříve. Vzhledem k tomu, že v našich podmínkách je naprostá většina nemocných indikována k PCI a jen malý zlomek k provedení aorto-koronárního bypassu, i vzhledem ke skutečnosti, že přínos při PCI významně převažuje nad rizikem krvácení při operačním řešení, je léčba prasugrelem v kombinaci s ASA indikována ihned po stanovení diagnózy akutní koronární příhody.
Kontraindikace
Kontraindikace podávání prasugrelu jsou v podstatě stejné jako u ostatních antitrombotik, dominuje riziko krvácení. Prasugrel je absolutně kontraindikován u aktivního krvácení a při závažné recentní hemoragické příhodě, zejména při krvácení nitrolebním (i v anamnéze), krvácení do zažívacího traktu apod. Opatrní jsme též u nemocných ohrožených krvácením kvůli vysokému riziku úrazu. Další důležitou kontraindikací je anamnéza předchozí tranzitorní mozkové ischemické ataky nebo iktu. Důvodem je vyšší riziko mozkových příhod, zejména mozkového krvácení. Třetí kontraindikací je přecitlivělost na prasugrel či na složky tablety.
V graviditě a při kojení sice není prasugrel přímo kontraindikován, nicméně jeho indikace je povolena pouze v případě, že přínos pro matku zásadně převýší riziko pro plod. V preklinických studiích nebyla zjištěna fetotoxicita, klinické zkušenosti s podáváním prasugrelu v graviditě nemáme. Není známo, zda prasugrel přechází do mateřského mléka.
Lékové interakce
Lékové interakce jsou u léčiv s úzkým terapeutickým oknem a rizikem krvácení důležitou otázkou. Z lékových interakcí na podkladě farmakodynamickém je logická potenciace účinku prasugrelu s anti-trombotiky, tj. jak s protidestičkovými léky (zejm. s ASA), tak s antikoagulancii (s warfarinem, hepariny, pentasacharidy, xabany či gatrany). Zvyšuje se nejen účinek v profylaxi tepenného uzávěru, ale i riziko krvácení. Výskyt krvácení též významně zvyšuje současné podání nesteroidních antirevmatik, pacient by měl být upozorněn na nevhodnost jejich užití. Jako alternativu je možno doporučit paracetamol či tramadol.
Interakce na bázi farmakokinetické, tj. vzájemné ovlivnění resorpce, biotransformace a eliminace, jsou u prasugrelu málo významné. Prasugrel má jen slabou afinitu k transportním pumpám, interakce na P-gp jeho hladinu významně neovlivňují [20].
Bioaktivace prasugrelu je realizována ve dvou krocích, hydrolýzy se účastní esterázy, poté je nutná oxidace izoenzymy CYP. Největší podíl na aktivaci zaujímají CYP3A4 a 2B6. Blokáda oxidázy CYP3A4 silnými inhibitory (z antimykotik zejména ketakonazolem a z makrolidových antibiotik klarithromycinem) vede pouze ke zpomalení bioaktivace, podání slabších inhibitorů farmakokinetiku prasugrelu neovlivňuje [21]. Významný inhibitor alternativního izoenzymu CYP2B6, který může prasugrel rovněž aktivovat, není znám.
Možnosti podání u specifických skupin nemocných
Užití v graviditě a laktaci
Jak již bylo uvedeno, preklinické studie neprokázaly fetotoxicitu prasugrelu, nicméně s podáním v graviditě nejsou zkušenosti. Proto je podání v graviditě vyhrazeno pouze pro situace, kdy přínos pro matku má zásadní význam a výrazně převýší riziko pro plod.
O přestupu prasugrelu do mateřského mléka nemáme doklady, nalezeny byly pouze metabolity. Klinické zkušenosti chybí. Nicméně také během laktace prasugrel nepodáváme s výjimkou platící pro graviditu.
Užití u seniorů
Zkušenosti s podáváním prasugrelu u seniorů vycházejí ze studie TRITON-TIMI 38, jíž se účastnilo téměř 40 % probandů ve věku . 65 let a téměř 15 % ve věku . 75 let. Stejně jako při podávání jiných protidestičkových léků též při léčbě prasugrelem narůstá s věkem riziko krvácení. U pacientů ve věku 75 let a starších se zvyšuje riziko fatálního krvácení na 1 % ročně, čtyři pětiny těchto příhod přitom představuje krvácení intrakraniální. Z těchto důvodů je podávání prasugrelu rezervováno u této skupiny seniorů pro nemocné s velmi vysokým rizikem aterotrombotické příhody, tj. se současně přítomným diabetem či s anamnézou překonaného IM, kdy přínos převažuje nad rizikem.
Užití u nemocných s nízkou hmotností
Nízká hmotnost přináší větší relativní expozici léčivu, tedy i větší riziko krvácení. U nemocných v hmotnostní kategorii pod 60 kg zvažujeme riziko krvácení a podání redukované dávky 5 mg prasugrelu denně.
Užití u nemocných s renální či jaterní insuficiencí
Prasugrel je eliminován jak renální, tak jaterní cestou, proto při renální insuficienci či při mírném a středním selhávání jater není nutno dávku redukovat, expozice se významně nezvyšuje. Podávání prasugrelu pacientům s terminálním renálním selháním a s těžkým jaterním selháním systematicky studováno nebylo. Data o eliminaci dialyzátorem nejsou k dispozici. V jedné studii, u dvou desítek nemocných v pravidelném hemodialyzačním léčení, byla léčba dávkou 10 mg prasugrelu denně dobře tolerována a při stanovení inhibice reaktivity destiček in vitro byly pozorovány hodnoty obdobné jako u běžné populace. Interindividuální kolísání inhibice a počet aktivních trombocytů při léčbě byly významně nižší nežli při léčbě klopidogrelem [22].
Ovlivnění účinku na podkladě farmakogenetického polymorfismu
Na rozdíl od klopidogrelu není léčba prasugrelem ovlivněna aktivitou běžných transportních (P-gp aj.) či metabolických systémů (izoenzymy CYP2B6, CYP2C9, CYP2C19 či CYP3A), resp. genetická variabilita farmakokinetiku prasugrelu neovlivnila.
Zařazení do současné palety léčiv
Porovnáváme-li stávající inhibitory ADP receptorů P2Y12 indikované k profylaxi trombotických příhod u akutních koronárních stavů, musíme srovnat tři aspekty: účinnost, bezpečnost a náklady.
Z hlediska účinnosti máme doklady, že podání standardních dávek prasugrelu v kombinaci s ASA u akutních koronárních stavů u nemocných indikovaných ke koronární intervenci vede k výraznějšímu poklesu výskytu kardiovaskulárních příhod nežli při léčbě standardními dávkami klopidogrelu v kombinaci s ASA. Byl doložen zejména pokles vývoje IM o čtvrtinu, snížení nutnosti revaskularizace o třetinu a redukce výskytu trombotické okluze tepny po implantaci stentu o polovinu. Při vzájemném srovnání prasugrelu s tikagrelorem je možno konstatovat na základě nepřímého srovnání proti klopidogrelu obdobný účinek na pokles výskytu trombotických komplikací. Testovaná skupina nemocných ve studiích TRITON-TIMI 38 a PLATO byla srovnatelná (nemocní s příhodami STEMI i NSTEMI, u kterých byla v rozhodující většině provedena koronární intervence). Rovněž riziko bylo obdobné, primární ukazatel efektu (KV mortalita, nefatální IM či iktus) se objevil v obou skupinách stejně často – přibližně v 10 %. Při rozboru účinku na primární kombinovaný ukazatel byl pokles proti standardní léčbě (klopidogrel s ASA) při obou hodnocených strategiích (prasugrel s ASA a tikagrelor s ASA) srovnatelný – při léčbě prvou kombinaci byl doložen pokles o 19 %, při podávání druhé o 16 %. Malý rozdíl byl zaznamenán v poklesu efektu na izolované ukazatele – při srovnání prasugrelu s klopidogrelem klesl výskyt nefatálního IM o 26 %, zatímco při stejném srovnání s tikagrelorem představoval pokles jen 16 %. Naopak pokles kardiovaskulární mortality byl ve studii TRITON-TIMI 38 nesignifikantní (o 11 %), ale ve studii PLATO byl pokles významný (o 21 %). Rovněž dopad na pokles výskytu trombóz v místě implantovaného stentu se mírně lišil, při užití prasugrelu se trombotická komplikace objevila o 52 % méně často, při užití tikagreloru činil pokles 33 %.
Praktický ukazatel efektu – NNT (Number Needed to Treat neboli počet pacientů, které je nutno léčit k zabránění jedné příhody) představoval u primárního ukazatele ve studii TRITON-TIMI 38 celkem 45 nemocných a v případě studie PLATO 53 nemocných. Uzavřeme-li, pak obě strategie jsou z hlediska účinnosti srovnatelné, prasugrel by mohl mít větší efekt na výskyt IM a trombóz v místě stentu, naopak tikagrelor by mohl více ovlivňovat kardiovaskulární mortalitu. Přímé srovnání však chybí.
V otázce bezpečnosti lze jen potvrdit předpoklad, že vyšší efekt prasugrelu na inhibici primární hemostázy bude zákonitě provázen nárůstem počtu krvácivých příhod. Oproti kombinaci klopidogrel s ASA vedla léčba prasugrelem s ASA k nárůstu výskytu větších krvácivých příhod o 32 %. Nicméně absolutní přínos léčby (při kombinaci efektu a rizika) zůstal stále významně pozitivní. Čistý přínos představoval 13 %. Při podskupinové analýze byl absolutní léčebný prospěch nejvýznamnější u diabetiků, rozdíl činil 26 %.
Při srovnání prasugrelu s tikagrelorem stran výskytu krvácení je situace obtížnější, při srovnání obou strategií je bezpečnost hodnocena odlišně – v případě prasugrelu zvlášť u nemocných s chirurgickou revaskularizací a bez ní. V případě tikagreloru je hodnocena skupina celá. Je však možno říci, že léčba tikagrelorem je zatížena nižším nárůstem krvácení, jehož výskyt je srovnatelný s výskytem krvácení při léčbě klopidogrelem. Rozdíl je dán zejména velmi nízkým výskytem krvácení při léčbě tikagrelorem v případě nutnosti revaskularizační operace.
Obdobný ukazatel jako NNT, ale v případě rizika – NNH (Number Needed to Harm čili počet léčených k vyvolání jedné nežádoucí příhody) – byl ve studii TRITON-TIMI 38 při hodnocení velkého krvácení celkem 167 léčených (bez chirurgické revaskularizace) a 10 léčených při indikaci chirurgické revaskularizace myokardu. Ve studii PLATO nebyl zjištěn žádný rozdíl ve výskytu velkého krvácení u všech hodnocených nemocných v tikagrelorové a klopidogrelové větvi. Pokud vezmeme v úvahu pouze nemocné bez chirurgické revaskularizace („non-CABG bleeding“), pak na každých 143 léčených tikagrelorem se objeví jedno významné krvácení oproti léčbě klopidogrelem. Tedy hodnotíme-li pouze nemocné neindikované k chirurgické revaskularizaci, je riziko závažného krvácení při léčbě prasugrelem a tikagrelorem stejně velké, naopak při nutnosti indikovat chirurgický zákrok je léčba prasugrelem výrazně rizikovější. Dále nám porovnání NNT a NNH v případě prasugrelu ukazuje, že přínos (tj. zabránění IM či kardiovaskulárnímu úmrtí) je asi trojnásobný proti riziku velkého krvácení.
Z praktického hlediska je zřejmé, že díky aplikaci prasugrelu jen v jedné denní dávce a díky spolehlivějšímu účinku i při vynechání dávky je léčba kombinací prasugrel s ASA výhodná zejména u nemocných s horší spoluprací, opomenutí dávky nebude mít tak rychlý dopad na snížení antitrombotického účinku. Léčba prasugrelem je dále výhodná zejména u nemocných s nižším rizikem krvácení. Naopak tikagrelor je podáván dvakrát denně a při vynechání dávky odezní účinek dříve. Léčba je proto náročnější na spolupráci pacienta. Naopak výhodou je rychlejší odeznění účinku, což přivítáme zejména při krvácení nebo indikaci operačního zákroku.
Posoudíme-li náklady, je patrné, že u obou nových inhibitorů ADP receptorů jsou při jejich srovnání s klopidogrelem zřejmé vyšší přímé náklady na vlastní lék. Při započtení všech nákladů, tedy i na léčbu příhod a podobně, analýzy ukazují výhodnost nových postupů, a to dokonce také v případě adaptace výsledků získaných jinde na poměry v České republice.
Dávkování
V indikaci profylaxe trombotických komplikací u akutních koronárních příhod je doporučena a schválena iniciální saturační dávka 60 mg prasugrelu, dále udržovací dávka 10 mg podávaná 1krát denně v přibližně 24hodinových intervalech. U pacientů s nízkou hmotností (pod 60 kg)
zvažujeme podávání nižší udržovací dávky, tj. 5 mg denně. U renální insuficience není nutno dávku redukovat, léčebná odpověď je plně zachována a výskyt významného krvácení není zvýšen. U mírné a středně závažné hepatální insuficience není rovněž doporučována redukce dávky. S léčbou nemocných s terminálním renálním selháním a s těžkým jaterním selháním nejsou zkušenosti. Jídlo významně neovlivňuje dostupnost prasugrelu, opožďuje se jen nástup účinku. Souběžně s prasugrelem by měl být pacient léčen ASA v dávce 75 mg až 325 mg denně.
Předávkování
Při předávkování či při nutnosti ukončit protidestičkový efekt není, stejně jako u ostatních inhibitorů ADP receptorů, dostupné antidotum. S podáním náplavů trombocytů nejsou zkušenosti, je však pravděpodobné, že v případě podání náplavu do 14 hodin po poslední dávce by došlo k inhibici i těchto trombocytů prasugrelem v plazmě. O eliminaci mateřské látky i aktivního metabolitu hemodialýzou či hemoperfuzí nejsou zprávy. Vzhledem k ireverzibilní inhibici ADP receptorů je nutno počítat po podání iniciační dávky s odezníváním efektu po dobu až 7–9 dnů, při léčbě dávkou udržovací po dobu asi 7 dnů.
Přetrvávání protidestičkového efektu lze monitorovat některým z uvedených laboratorních testů – světelnou agregometrií (po stimulaci 5–20 µM ADP), VerifyNow P2Y12 a VASP/VASP-P esejí.
Dostupné formy léčiva
Prasugrel je dostupný pro perorální aplikaci v tabletách a 5 mg a 10 mg.
Seznam použité literatury
- [1] Michelson AD. P2Y12 antagonism: promises and challenges. Arterioscler Thromb Vasc Biol 2008; 28: 33–38.
- [2] Akkerhuis KM, Neuhaus K-L, Wilcox RG, et al. for FROST Investigators Safety and preliminary efficacy of one month glycoprotein IIb/IIIa inhibition with lefradafiban in patients with acute coronary syndromes without ST-elevation; a phase II study. Eur Heart J 2000; 21: 2042–2055.
- [3] Product Information: EFFIENT(TM) oral tablets, prasugrel oral tablets. Eli Lilly, Indianapolis, IN, 2009.
- [4] Bernlochner I, Morath T, Brown PB, et al. A prospective randomized trial comparing the recovery of platelet function after loading dose administration of prasugrel or clopidogrel. Platelets 2012; doi:10.3109/09537104.2011.654003.
- [5] Jernberg T, Payne CD, Winters KJ, et al. Prasugrel achieves greater inhibition of platelet aggregation and a lower rate of non-responders compared with clopidogrel in aspirin-treated patients with stable coronary artery disease. Eur Heart J 2006; 27: 1166–1173.
- [6] http://www.emea.europa.eu/humandocs/Humans/EPAR/efient/efient.htm, aktualizace k 22. 3. 2012.
- [7] Wallentin L, Varenhorst C, James S, et al. Prasugrel achieves greater and faster P2Y12 receptor-mediated platelet inhibition than clopidogrel due to more efficient generation of its active metabolite in aspirin-treated patients with coronary artery disease. Eur Heart J 2008; 29: 21–30.
- [8] Wiviott SD, Trenk D, Frelinger AL and PRINCIPLE-TIMI 44 Investigators. Prasugrel compared with high loading- and maintenance-dose clopidogrel in patients with planned percutaneous coronary intervention: the Prasugrel in Comparison to Clopidogrel for Inhibition of Platelet Activation and Aggregation-Thrombolysis in Myocardial Infarction 44 trial. Circulation 2007; 116: 2923–2932.
- [9] Wiviott SD, Antman EM, Winters KJ, et al. Randomized comparison of prasugrel (CS-747, LY640315), a novel thienopyridine P2Y12 antagonist, with clopidogrel in percutaneous coronary intervention: results of the Joint Utilization of Medications to Block Platelets Optimally (JUMBO)-TIMI 26 trial. Circulation 2005; 111: 3366–3373.
- [10] Murphy SA, Antman EM, Wiviott SD, et al. Reduction in recurrent cardiovascular events with prasugrel compared with clopidogrel in patients with acute coronary syndromes from the TRITON-TIMI 38 trial. Eur Heart J 2008; 29: 2473–2479.
- [11] Wiviott SD, Braunwald E, Angiolillo DJ, et al. Greater clinical benefit of more intensive oral antiplatelet therapy with prasugrel in patients with diabetes mellitus in the trial to assess improvement in therapeutic outcomes by optimizing platelet inhibition with prasugrel-Thrombolysis in Myocardial Infarction 38. Circulation 2008; 118: 1626–1636.
- [12] Wiviott SD, Braunwald E, McCabe CH, et al. Intensive oral antiplatelet therapy for reduction of ischaemic events including stent thrombosis in patients with acute coronary syndromes treated with percutaneous coronary intervention and stenting in the TRITON-TIMI 38 trial: a subanalysis of a randomised trial. Lancet 2008; 371: 1353–1363.
- [13] Montalescot G, Wiviott SD, Braunwald E, et al. for TRITON-TIMI 38 investigators. Prasugrel compared with clopidogrel in patients undergoing percutaneous coronary intervention for ST-elevation myocardial infarction (TRITON-TIMI 38): double-blind, randomised controlled trial. Lancet 2009; 373: 723–731.
- [14] Chin CT, Roe MT, Fox KAA, et al. on behalf of TRILOGY ACS Steering Committee. Study design and rationale of a comparison of prasugrel and clopidogrel in medically managed patients with unstable angina/non-ST-segment elevation myocardial infarction: the TaRgeted platelet Inhibition to cLarify the Optimal strateGy to medicallY manage Acute Coronary Syndromes (TRILOGY ACS) trial. Am Heart J 2010; 160: 16–22.
- [15] Garratt KN, Lee DP, Rose EM, et al. Rationale and design of the TAXUS Liberte Post-Approval Study: examination of patients receiving the TAXUS Liberté stent with concomitant prasugrel therapy in routine interventional cardiology practice. Am Heart J 2012; 163: 142–148.
- [16] Jeger R, Pfisterer M, Albert H, et al. Newest-generation drug-eluting and bare-metal stents combined with prasugrel-based antiplatelet therapy in large coronary arteries: the BAsel Stent Kosten Effektivitäts Trial PROspective Validation Examination part II (BASKET-PROVE II) trial design. Am Heart J 2012; 163: 136–141.
- [17] Parodi G, Bellandi B, Venditti F, et al. Residual platelet reactivity, bleedings, and adherence to treatment in patients having coronary stent implantation treated with prasugrel. Am J Cardiol 2012; 109: 214–218.
- [18] Wiviott SD, Desai N, Murphy SA, et al. Efficacy and safety of intensive antiplatelet therapy with prasugrel from TRITON-TIMI 38 in a core clinical cohort defined by worldwide regulatory agencies. Am J Cardiol 2011; 108: 905–911.
- [19] Biondi-Zoccai G, Lotrionte M, Agostoni P, et al. Adjusted indirect comparison meta-analysis of prasugrel versus ticagrelor for patients with acute coronary syndromes. Int J Cardiol 2011; 150: 325–331.
- [20] Mega JL, Close SL, Wiviott SD, et al. Genetic variants in ABCB1 and CYP2C19 and cardiovascular outcomes following treatment with clopidogrel and prasugrel. Lancet 2010; 376: 1312–1319.
- [21] Fayer Rehmel JL, Eckstein JA, Farid NA, et al. Interactions of two major metabolites of prasugrel, a thienopyridine antiplatelet agent, with the cytochromes P450. Drug Metab Dispos 2006; 34: 600–607.
- [22] Alexopoulos D, Panagiotou A, Xanthopoulou I, et al. Antiplatelet effects of prasugrel vs. double clopidogrel in patients on hemodialysis and with high on-treatment platelet reactivity. J Thromb Haemost 2011; 9: 2379–2385.