Pregabalin
Nová možnost léčby neuropsychiatrických poruch a komorbidit: epilepsie, neuropatické bolesti, poruch spánku, generalizované úzkostné poruchy. Pregabalin (PGB) je antiepileptikum nové generace účinné při léčbě parciální epilepsie, neuropatické bolesti a generalizované úzkostné poruchy, příznivě ovlivňuje spánek, zejména jeho kontinuitu. Sdělení podává aktuální přehled o možnostech léčebného využití pregabalinu.
Farmakologická skupina
Pregabalin (PGB) patří do farmakologické skupiny antiepileptik, ATC kód: N03A(X16) [1]. Má i další terapeutické účinky u neuropsychiatrických poruch, jak uvádíme níže.
Chemické a fyzikální vlastnosti
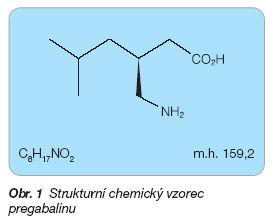
Pregabalin je chemicky kyselina 3S-3-(aminomethyl)-5-methylhexan-1-ová (obr. 1).
Sumární vzorec: C8H17NO2
Molekulová hmotnost: 159,2
Pregabalin je bílá krystalická látka dobře rozpustná ve vodě, a to v zásaditém i kyselém prostředí. Logaritmus rozdělovacího koeficientu oktanol/fosfátový pufr (pH 7,4) je 1,35.
Mechanismus účinku, farmakodynamika
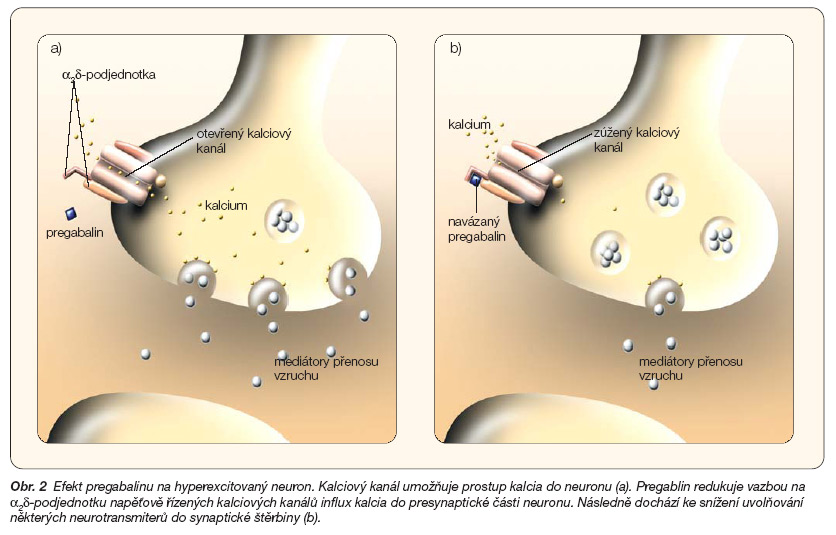
PGB se silně váže na přídatnou podjednotku (a2d-protein) napěťově řízených kalciových kanálů v centrálním nervovém systému. Důsledkem je redukce influxu kalcia do presynaptické části nervových buněk a následně redukce uvolňování některých neurotransmiterů, glutamátu, noradrenalinu, substance P (obr. 2) [1–7].
Preklinické a následné klinické studie prokázaly tři významné okruhy účinků PGB: antikonvulzivní, analgetické a anxiolytické. V dalších studiích bylo polysomnograficky zjištěno i zlepšení spánku, zvl. jeho kontinuity [4–11]. V neurologii je léčebné využití těchto tří účinků velmi významné, protože se uvedené poruchy často vyskytují ve vzájemných kombinacích.
Antikonvulzivní účinky pregabalinu byly experimentálně prokázány na různých modelech: u maximálních elektrošokových a pentazolových křečí, u hipokampálního kindlingu i u genetické audiogenní epilepsie. Na druhé straně PGB nebyl účinný v genetickém modelu generalizovaných absencí [3–5]. Tyto nálezy podpořily představu o tom, že PGB bude v klinických studiích účinný u záchvatů fokálních, parciálních a u záchvatů generalizovaných křečí, naopak nebude účinný u generalizovaných idiopatických záchvatů a epilepsií. PGB byl účinný u zvířecího modelu neuropatické bolesti [12–13] i u nemocných s bolestivou formou diabetické polyneuropatie (DPN) a postherpetické neuropatie (PHN) v randomizovaných dvojitě zaslepených a placebem kontrolovaných studiích [14–19].
Farmakokinetické vlastnosti
Farmakokinetika PGB v ustáleném stavu je u zdravých dobrovolníků, pacientů s epilepsií léčených antiepileptiky a u pacientů s chronickou bolestí podobná. Farmakokinetika PGB je v rozmezí doporučené denní dávky lineární. Variabilita farmakokinetiky PGB mezi jednotlivými osobami je nízká (< 20 %). Farmakokinetika při opakovaném podávání dávek je předpověditelná podle dat zjištěných při podání jednotlivé dávky. Proto není nutné běžné monitorování plazmatických koncentrací pregabalinu. Základní farmakokinetické údaje PGB shrnuje tab. 1.
Absorpce
PGB se po podání nalačno rychle absorbuje a dosahuje vrcholových plazmatických koncentrací za 1 hodinu po jednorázovém i opakovaném podání dávky léku. Perorální biologická dostupnost PGB je ≥≥ 90% a je nezávislá na dávce. Při opakovaném podání léku je ustáleného stavu dosaženo za 24–48 hodin. Rychlost absorpce PGB je snížená při podávání s jídlem, kdy dochází k poklesu cmax přibližně o 25–30 % a prodloužení tmax na přibližně 2,5 hod. Podání PGB s jídlem však nemá žádný klinicky významný efekt na rozsah jeho biologické dostupnosti.
Distribuce
V preklinických studiích bylo prokázáno, že PGB prochází hematoencefalickou bariérou u myší, potkanů a opic. Rovněž přechází placentou u potkanů a je přítomen v mléce potkanů v období laktace. U člověka činí distribuční objem PGB po perorálním podání přibližně 0,56 l/kg. PGB se neváže na plazmatické bílkoviny.
Metabolismus
Pregabalin podléhá u lidí pouze zanedbatelnému metabolismu. Přibližně 98 % radioaktivně značeného PGB vylučovaného močí je nezměněno. N-metylovaný derivát PGB, hlavní metabolit pregabalinu, který byl zjištěn v moči, tvořil 0,9 % podané dávky.
Eliminace
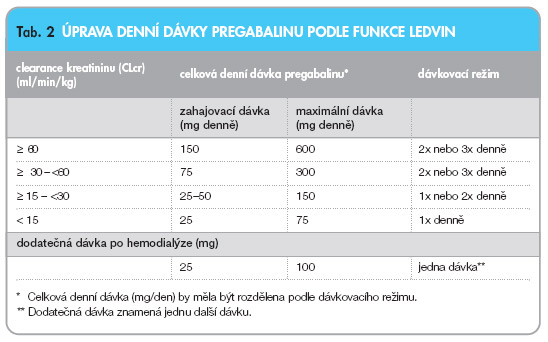
PGB je vylučován ze systémové cirkulace zejména renální exkrecí jako nezměněná látka. Průměrný eliminační poločas PGB je 6,3 hod. Plazmatická clearance a renální clearance PGB jsou přímo úměrné clearance kreatininu. Úprava dávky PGB u pacientů se sníženou funkcí ledvin a u pacientů léčených hemodialýzou je nezbytná.
Farmakokinetika u speciálních skupin pacientů
Pohlaví
Nemá klinicky významný vliv na plazmatické koncentrace PGB.
Porucha funkce ledvin
Clearance PGB je přímo úměrná clearance kreatininu. PGB je navíc účinně odstraňován z plazmy hemodialýzou (po čtyřhodinové hemodialýze se plazmatické koncentrace PGB snížily přibližně o 50 %). Protože hlavní metabolickou cestou PGB je vylučování ledvinami, je nezbytné snížení dávek u pacientů s poruchou funkce ledvin a po hemodialýze je nutná dodatečná dávka (viz tab. 2). Protože PGB se nijak významně nemetabolizuje a je vylučován převážně nezměněn močí, poškozená funkce jater proto zřejmě neovlivňuje plazmatickou koncentraci PGB. Žádné specifické farmakokinetické studie u pacientů s poškozenou funkcí jater nebyly prováděny.
Starší pacienti (nad 65 let věku)
S rostoucím věkem může clearance PGB klesat, a to ve shodě s poklesem clearance kreatininu. Snížení dávky PGB je nutno přizpůsobit poklesu renálních funkcí (tab. 2).
Klinické zkušenosti
Epilepsie
Jediným cílem protizáchvatové léčby u epilepsie je optimální kvalita života nemocných. U antiepileptik jde o vybalancovaný poměr mezi jejich dostatečnými antikonvulzivními účinky a jejich dobrou snášenlivostí a bezpečností. Navzdory řadě nových antiepileptik však i v současné době zůstává až 30 % nemocných s epilepsií nedostatečně kompenzováno, za cenu přijatelných vedlejších účinků léčby [20, 21]. To jsou hlavní důvody hledání nových antiepileptik, která by měla být v těchto ohledech lepší než antiepileptika dosud dostupná.
V případě epilepsie byly klinické studie na základě slibných preklinických údajů cíleny na léčbu fokálních, parciálních epilepsií s fokálními, parciálními záchvaty se sekundární generalizací a bez sekundární generalizace. Klinické studie potvrdily účinnost PGB při léčbě parciální epilepsie u pacientů nad 12 let, při podání ve třech i dvou denních dávkách.
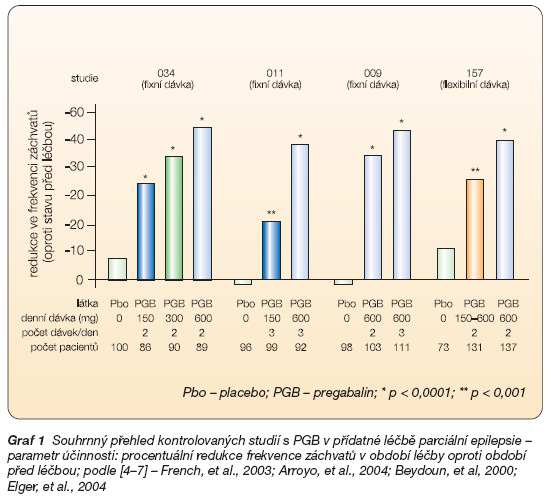
Primárně sledovaným ukazatelem účinnosti byla procentuální redukce ve frekvenci záchvatů během léčebné periody (12 týdnů) oproti období před léčbou (8 týdnů) (graf 1).
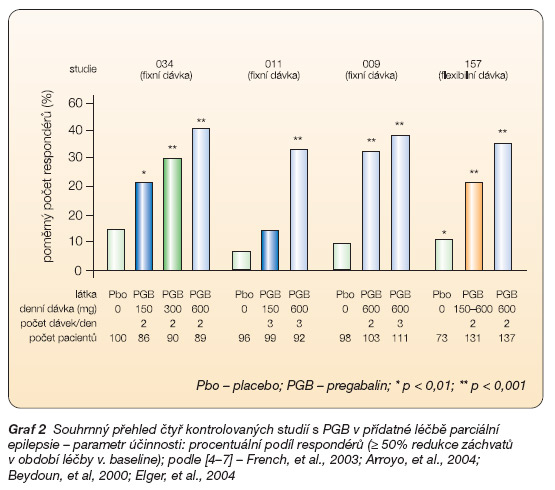
Dalším parametrem účinnosti byl procentuální podíl „respondérů", tedy pacientů, kteří při léčbě dosáhli ≥ 50% redukce záchvatů (graf 2).
Dávky PGB 50 mg/den byly ve srovnání s placebem neúčinné [5]. Naopak signifikantní účinnost PGB lineárně narůstala s dávkami 150, 300, 600 mg/den [4–7].
Například v jedné ze studií došlo při léčbě k redukci frekvence záchvatů o 7 % u placeba, o 12 % u PGB v dávkách 50 mg/den, o 34 % u 150 mg/den, o 44 % u 300 mg/den a o 54 % při dávce PGB 600 mg/den (graf 1) [4]. Podíl respondérů byl 14 % u placeba, 15 % při léčbě dávkou PGB 50 mg/den, 31 % u 150 mg/ den, 40 % u 300 mg/den a 51 % u PGB 600 mg/den [4]. Tento parametr umožňuje také porovnání účinnosti léčby PGB s výsledky studií účinnosti jiných antiepileptik v obdobné populaci nemocných. Za úspěšné nové antiepileptikum je obecně považováno takové, jehož „placebem korigovaný" podíl pacientů odpovídajících na léčbu (počet respondérů v populaci léčené aktivní látkou po odečtení jejich počtu u placeba) ve studiích je mezi 11,4–30,4 % [4, 22]. V tomto ohledu byl v citovaných studiích PGB úspěšný s hodnotami 17,4 % pro nejnižší účinnou dávku 150 mg/den až 36,6 % pro 600 mg/den [4]. Ukončení léčby z důvodů její neúčinnosti představovalo v této studii 5 % pacientů, kterým bylo podáváno placebo, 1,1 % léčených PGB v dávce 50 mg/den, 1,1 % u 150 mg/den, 2,2 % u 300 mg/den a 4,5 % u PGB v dávce 600 mg/den.
V jiné studii byla léčba PGB rovněž signifikantně účinnější oproti placebu. Při léčbě došlo k redukci frekvence záchvatů o 20 % při dávkování PGB 150 mg/den a o 47 % při dávce PGB 600 mg/den [5].
V recentní zaslepené placebem kontrolované studii bylo hodnoceno fixní dávkování PGB 600 mg/den a flexibilní dávkování 150–600 mg/den, které je blízké klinické praxi [7, 23]. PGB byl podáván ve dvou denních dávkách. Výsledky studie jsou prezentovány v grafech 1 a 2. Fixní i flexibilní dávkování PGB vedlo k signifikantní redukci frekvence záchvatů o 49,3 %, resp. 35,4 % a podávání placeba k redukci frekvence záchvatů o 10 %. Fixní dávkování bylo signifikantně účinnější než dávkování flexibilní. Naopak nežádoucí účinky léčby vedly k jejímu ukončení při fixním dávkování v 32,8 %, u flexibilního dávkování blízkého klinické praxi ve 12,2 % a u placeba v 6,8 % [23].
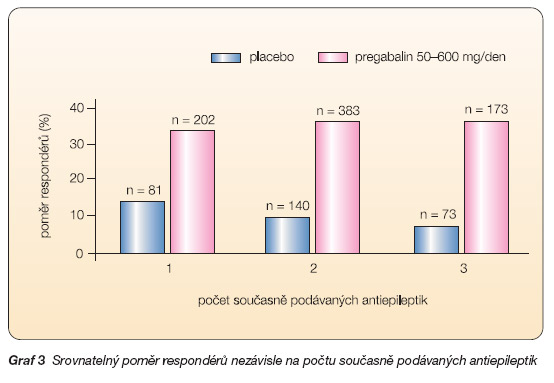
Při interpretaci výsledků klinických studií III. fáze u epilepsie je nutno brát v úvahu též závažnost onemocnění. Studií s PGB se účastnila populace pacientů s vysoce refrakterní epilepsií: přídatná léčba PGB byla podávána v kombinaci až se třemi již současně podávanými antiepileptiky (70 % pacientů užívalo více než 2 antiepileptika, 49,9 % užívalo 2 antiepileptika, 19,6 % tři antiepileptika), průměrná frekvence záchvatů byla 10/měsíc, průměrné trvání onemocnění bylo 25 let [4]. I přesto byla léčba PGB úspěšná. Poměr respondérů neklesá s počtem současně podávaných antiepileptik (graf 3), rovněž procentuální redukce počtu záchvatů byla ve skupinách s různou měsíční frekvencí záchvatů obdobná.
Tyto nálezy ukazují na to, že účinnost PGB neklesá se závažností epileptického onemocnění.
Z hlediska klinické praxe je rovněž významná rychlost nástupu terapeutických účinků antiepileptické léčby a její dlouhodobá účinnost. V retrospektivní studii hodnotící výsledky tří randomizovaných placebem kontrolovaných dvojitě zaslepených klinických studií přídatné léčby PGB u epilepsie byla posuzována rychlost nástupu účinku PGB. Hodnoceným parametrem byla proporce plně kompenzovaných nemocných, tedy pacientů bez záchvatů. Statisticky významný rozdíl mezi skupinou léčenou PGB a pacienty, kterým bylo podáváno placebo, byl zjištěn již od druhého dne a přetrvával po celou dobu léčebné fáze studie, tedy 12 týdnů [24]. Výsledky této studie jsou významné zejména pro situace, kdy je třeba léčbu rychle započít: například u dekompenzovaných nemocných, u nemocných, kde je nutno léčbu rychle změnit ze zdravotních důvodů, kde byla původní léčba vysazena například při plánovaném iktálním video-EEG vyšetření a kde plánujeme její změnu; a také u nemocných, kteří si léčbu spontánně ukončili a titrace původní např. ne zcela úspěšné léčby by byla dlouhodobá. V tomto ohledu jsou z nových antiepileptik použitelná pouze dvě, levetiracetam a gabapentin.
Minimálně stejně významným parametrem úspěšné antiepileptické léčby je její dlouhodobá účinnost. Ve čtyřech otevřených studiích byla hodnocena dlouhodobá přídatná léčba PGB. Počet respondérů byl po 12 týdnech 37 % a přetrvával i po 24 měsících léčby, zcela bez záchvatů bylo po 3 měsících léčby 24,5 % nemocných, po 6 měsících 9 % a po jednom roce 6 % nemocných [25]. Dlouhodobá účinnost přídatné léčby PGB byla prokázána i v další studii, 69 % nemocných užívalo nejméně dvojkombinaci antiepileptik, šlo tedy o nemocné s nekompenzovanou těžko léčitelnou formou epilepsie. Během léčebného období 24–52 týdnů bylo zcela bez záchvatů déle než měsíc 25 % nemocných, déle než 6 měsíců 9 % a déle než rok 6 % nemocných, počet respondérů byl 37 % a bylo dosaženo průměrné redukce záchvatové frekvence 38 %. Pro nežádoucí účinky přerušilo léčbu 13 % nemocných, nejčastějšími vedlejšími účinky byly závratě (33 %), somnolence (27 %), náhodná poranění (26 %), přírůstek na váze (22 %) [26]. Tyto studie naznačují rychle nastupující a dlouhodobý terapeutický efekt PGB v přídatné léčbě u parciální epilepsie.
Spánek a léčba PGB u epilepsie
Nerušený a efektivní spánek je pro léčbu epilepsie velmi významný: na jedné straně je důležitým faktorem pro kompenzaci vlastních záchvatů, na straně druhé podmiňuje i denní „svěžest a čilost" pacientů s epilepsií, a nepřímo tak ovlivňuje i úroveň jejich denních aktivit. Právě u nemocných s epilepsií jsou poruchy spánku a jejich důsledky pro denní aktivity časté. Tyto poruchy jsou podmíněny multifaktoriálně, včetně léčby antiepileptiky [27]. Antiepileptika s příznivým efektem na kvalitu spánku jsou pro léčbu epilepsie žádoucí. V zaslepené placebem kontrolované studii byl studován vliv přídatné léčby PGB 300 mg/den u nemocných s kompenzovanou parciální epilepsií, kteří uváděli poruchy spánku a jejich negativní dopad na životní aktivity. Polysomnograficky bylo prokázáno signifikantní zlepšení spánku, zejména jeho kontinuity. Efekt byl nezávislý na změně ve frekvenci záchvatů a pacienti referovali jeho příznivý dopad na kvalitu života. Signifikantní změny v profilu jednotlivých spánkových stadií nebyly zjištěny [28]. Oproti tomu u zdravých dobrovolníků byl v placebem kontrolované studii pozorován po podání PGB signifikantní nárůst pomalých „slow wave" spánkových stadií. Tato stadia byla naopak potlačena po podání alprazolamu, obdobné nálezy jsou popisovány i u pacientů s generalizovanou úzkostnou poruchou [27, 29]. Souhrnně je vliv PGB na spánek považován za příznivý: PGB zlepšuje efektivitu spánku, zkracuje spánkovou latenci, zlepšuje kontinuitu spánku, vede k nárůstu pomalých „slow wave" spánkových stadií, vliv na spánková stadia I a REM není znám. Paradoxně ale může léčba pregabalinem vést též ke zvýšené denní únavě či ospalosti [27].
Generalizovaná úzkostná porucha (GAD)
U psychiatrických pacientů bez epilepsie byl PGB signifikantně účinný při léčbě GAD ve srovnání s podáváním placeba a obdobně účinný jako léčba lorazepamem. Anxiolytický účinek nastupoval rychle, již během jednoho týdne [11]. Obdobné výsledky při léčbě GAD byly potvrzeny i v dalších studiích, například v recentní zaslepené placebem kontrolované studii: při hodnocení ve škále HAMA-A byly signifikantně účinné dávky 200–400–450 mg/den, účinek nastupoval rovněž rychle, během jednoho týdne, mezi podáním PGB ve dvou či třech denních dávkách nebyl rozdíl, ovlivněny byly faktory pro úzkost psychickou i somatickou. Přes fixní dávkování byla léčba dobře tolerována, pro nežádoucí účinky ukončilo léčbu 9–13 % pacientů léčených PGB oproti 8 % pacientů, jimž bylo podáváno placebo [31]. PGB by tak mohl být prvním novým anti-epileptikem s doloženými vlastními anxiolytickými účinky. Z toho by mohli potenciálně mít užitek i nemocní s komorbiditou epilepsie a GAD.
Neuropatická bolest
Neuropatická nebo také neurogenní bolest vzniká při primární lézi nebo dysfunkci nervového systému, která buďto vede k hyperaktivitě nociceptivních neuronů nebo dochází k dysbalanci mezi bolestivými a nebolestivými vstupy do centrálního nervového systému. Tento typ nevyžaduje stimulaci bolestivých receptorů, i když současná stimulace může tuto bolest zvýrazňovat. Jde o patologickou bolest, která nemá žádný protektivní význam.
Patofyziologie neuropatické bolesti je složitá, multifaktoriální, ale k hlavním mechanismům patří abnormální periferní a centrální senzitizace. Práh pro aktivaci primárních aferentních nociceptorů se snižuje (následkem působení různých mediátorů) a normálně nebolestivé stimuly mohou provokovat bolesti a rozšiřuje se i recepční pole.
Většina nemocných s neuropatickou bolestí patří do kategorie pacientů se syndromem chronické bolesti. Jako chronická bolest se označuje ta, která přetrvává i po době normální léčby nebo trvá více nežli 3 měsíce nebo podle některých autorů i více nežli 6 měsíců. Mezi charakteristické a relativně časté typy neuropatické bolesti patří bolestivá diabetická polyneuropatie (DPN) a postherpetická neuralgie (PHN). Prevalence diabetické neuropatie je průměrně kolem 50 % všech diabetiků, z toho u 15 % je symptomatická a u 5 % má charakter bolestivé neuropatie. Udává se, že až 45 % nemocných, kteří trpí diabetem déle než 25 let, má určitou zkušenost s bolestivou neuropatií. U DPN příznaky kolísají od mírných parestezií až po řezavé lancinující a silné bolesti.
PHN je definována jako perzistující bolest, která je přítomna i po 3 měsících po odeznění herpetické kožní erupce. Příznaky zahrnují konstantní i intermitentní ostrou nebo pálivou bolest nebo alodynii. Alodynie je definována jako bolest vyvolaná podnětem, který normálně bolest nevyvolá (např. dotykem, teplem). Prevalence postherpetické neuralgie se udává kolem 11 % a je výrazně závislá na věku.
V osmitýdenní studii bylo sledováno 173 pacientů s PHN [14]. Pacientům, kde clearance kreatininu byla > 60 ml/min, byl podáván PGB v dávce 600 mg/den, při clearance kreatininu 30–60 ml/min byl podáván PGB v dávce 300 mg/den. V obou skupinách léčených PGB došlo ke snížení skóre bolesti ≥ 50 % – u 50 % oproti skupině s placebem, kde ke snížení došlo jen u 20 %. Snížení skóre bolesti o ≥ 30 % bylo u obou skupin léčených PGB 63 % oproti 25 % ve skupině placeba. Výsledek je statisticky významný (p = 0,001). Významné bylo rovněž zlepšení spánku ve srovnání s placebem (p = 0,0001).
DPN byla studována v 5týdenní studii u 338 pacientů [15]. PGB byl podáván v dávkách 300 a 600 mg/den. V obou skupinách bylo pozorováno signifikantní zlepšení ve srovnání s placebem (p = 0,0001).
Snížení skóre bolesti ≥ 50 % bylo zaznamenáno u 46 % pacientů ve skupině léčené PGB v dávce 300 mg a u 48 % pacientů léčených dávkou 600 mg oproti 18 % nemocných ve skupině s placebem. I v této studii bylo ve skupině s PGB dosaženo zlepšení spánku. I další studie byla provedena u 146 pacientů s DPN [16], dávka PGB byla 300 mg/den. PGB signifikantně redukoval skóre bolesti, ke snížení skóre ≥ 50 % došlo u 40 % léčených PGB, ve skupině placeba jen u 14,5 % nemocných.
238 pacientů s PHN bylo randomizováno v 8týdenní multicentrické placebem kontrolované studii [17]. PGB byl podáván v dávkách 150 a 300 mg/den. Snížení skóre bolesti ≥ 50 % při dávce PGB 150 mg bylo zaznamenáno u 26 % nemocných (p = 0,006), při dávce 300 mg u 28 % (p = 0,003) a ve skupině placeba pouze u 10 % nemocných. Současně došlo i k signifikantnímu snížení poruch spánku v obou skupinách PGB.
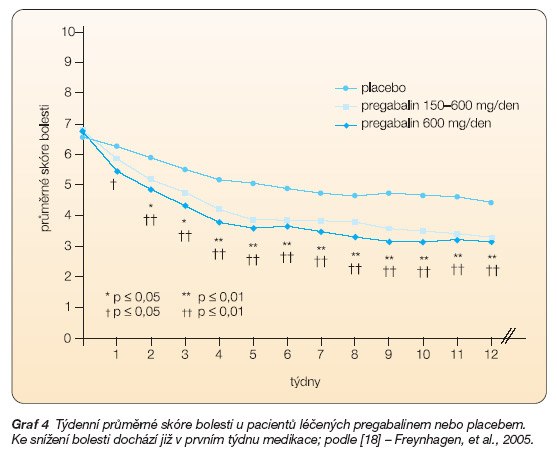
DPN a PHN bylo sledováno celkem u 338 pacientů ve 12týdenní studii [18]. PGB byl podáván 2krát denně jednak ve flexibilní dávce, kdy podle event. efektu se dávka zvyšovala od 150 až na 600 mg/den (141 pacientů), jednak ve fixní dávce 600 mg/ den (132 pacientů). Jak flexibilní, tak fixní dávky měly výrazně lepší efekt na zmenšení bolesti nežli placebo (graf 4). Snížení skóre bolesti o ≥ 50 % bylo dosaženo u 48,2 % pacientů léčených flexibilní dávkou, u 52,3 % léčených fixní dávkou, ale jen u 24,2 % pacientů, kteří dostávali placebo (p < 0,001 pro každou skupinu PGB v. placebo). Při hodnocení redukce skóre bolesti o ≥ 30 % udalo zlepšení 59,0 % pacientů léčených flexibilní dávkou, 66,4 % s fixní dávkou a 37,1 % ve skupině placeba (p = 0,003 pro flexibilní dávku a p < 0,001 pro fixní dávku v. placebo). Pregabalin v obou skupinách dávkování příznivě ovlivnil i poruchy spánku ve srovnání s placebem (p < 0,001 pro každou skupinu pregabalinu v. placebo).
V 6týdenní studii bylo sledováno 246 pacientů s DPN [19], podávané dávky PGB byly 150 a 600 mg/den. Při léčbě dávkou 150 mg/den nebyl zjištěn signifikantní efekt ve srovnání s placebem, účinná byla jen dávka 600 mg/den, kdy snížení skóre bolesti o ≥ 50 % dosáhlo 39 % pacientů oproti 15 % ve skupině placeba. Současně byl zaznamenán i účinek na zlepšení spánku.
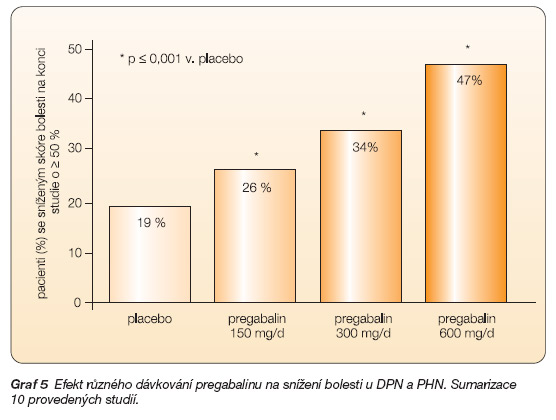
Účinek PGB při léčbě neuropatické bolesti byl studován celkem v 10 randomizovaných dvojitě zaslepených a placebem kontrolovaných studiích s celkovým počtem 2750 pacientů. Čtyři studie sledovaly účinek u 1034 nemocných s PHN léčených fixní dávkou PGB 75–600 mg/den po dobu 5–13 týdnů, 5 studií bylo provedeno u 1378 nemocných s DPN léčených rovněž fixní dávkou 75–600 mg/den po dobu 5–12 týdnů a 1 studie u 338 nemocných buď s DPN nebo PHN léčených flexibilní dávkou 150–600 nebo fixní dávkou 600 mg/den po dobu 12 týdnů. Dávka 75 mg/den se ukázala jako neúčinná, sumarizovaný efekt vyšších dávek PGB u všech provedených studií znázorňuje graf 5.
Nejčastějšími nežádoucími projevy při léčbě neuropatické bolesti byly závratě, somnolence, periferní edémy, bolesti hlavy a sucho v ústech.
Zařazení do současné palety léčiv
PGB má výhodný farmakokinetický profil s předvídatelnou lineární kinetikou, s biologickým poločasem umožňujícím podávání ve dvou denních dávkách, neváže se na plazmatické bílkoviny, jeho biologická dostupnost je vysoká. PGB se vylučuje bez tvorby aktivních metabolitů v nezměněné formě močí. Nebyly zjištěny významné farmakokinetické interakce PGB s ostatními antiepileptiky, perorálními kontraceptivy a dalšími léky. Léčba PGB je bezpečná a dobře snášená po stránce somatické i psychické. Toto jsou mimo jiné i předpoklady uplatnění PGB při léčbě polymorbidních a starších pacientů s polyterapií.
Výhodou PGB je i možnost příznivého ovlivnění neuro-psychiatrické komorbidity – úzkosti – „monoterapií": časté psychiatrické komorbidity jsou přítomny u epilepsie (úzkostné příznaky přítomné až u poloviny nemocných) [34–36] i u neuropatické bolesti. Výhodou je příznivé ovlivnění spánku, zvl. jeho kontinuity. Obdobně může být PGB léčena i neurologická komorbidita, např. neuropatická bolest u nemocných s epilepsií. PGB by se tak mohl v budoucnu uplatnit i při léčbě i v širším spektru neuropsychiatrických onemocnění, obdobně jako gabapentin [35, 36].
Epilepsie
Na pozadí představ o základních vlastnostech ideálního nového antiepileptika je možno hodnotit i potenciální přínos PGB v epileptologii. PGB je významně účinný při léčbě fokálních, parciálních záchvatů s případnou sekundární generalizací. Na druhé straně pravděpodobně nebude širokospektrým antiepileptikem účinným i při léčbě primárně generalizovaných epileptických záchvatů a idiopatických epilepsií. Je možné, že některé tyto záchvaty může i zhoršovat či provokovat (např. absence, myoklonické záchvaty).
PGB má známý mechanismus účinku, který se odlišuje od mechanismů účinku jiných antiepileptik. Mechanismy účinku PGB a dalších antiepileptik tak mohou být při kombinované antiepileptické léčbě vzájemně komplementární a mohou být i podkladem aditivního a supraaditivního efektu léčby. J. A. French (2003), hlavní autorka jedné ze stěžejních studií, uvádí [4]: „Robustní účinnost, výborná tolerance, absence farmakokinetických interakcí dávají PGB potenciální šanci, aby byl pro klinickou praxi velmi přínosný."
Neuropatická bolest
Většina neuropatických bolestí nereaguje na běžná analgetika a nesteroidní antirevmatika a je nutno použít léčiva, jež jsou označována souborným názvem adjuvantní analgetika. Jsou definována jako léky, které neobsahují paracetamol (acetaminofen) a nejsou řazeny k nesteroidním antirevmatikům ani opioidům. Nejsou také formálně klasifikovány jako analgetika, protože jejich primární indikace je většinou u jiných chorob nebo poruch. Převážně jde o neuroaktivní substance působící na centrální nebo periferní nervový systém. Tricyklická antidepresiva patří k nejčastější skupině léků používaných u neuropatické bolesti. Mechanismem jejich účinku je blokáda zpětného vychytávání noradrenalinu, serotoninu a dopaminu, neuro-transmiterů, které inhibují nociceptivní neurony. Mezi další léky patří některá antikonvulziva. Předpokládá se, že snižují spontánní neuronální výboje účinkem na iontové kanály nebo neurotransmitery, a mohou tak mít obdobný efekt na abnormální výboje bolestivých vláken.
Na základě provedených validních studií a podle standardů Americké neurologické akademie jsou pro léčbu postherpetické neuralgie indikována tricyklická antidepresiva (amitriptylin, nortriptylin), gabapentin, pregabalin, opioidy a lokálně lidokain, u nichž byla prokázána účinnost. Nedostatečné údaje jsou k dispozici pro karbamazepin [33]. PGB je novým lékem, který je rovněž v ČR schválen pro farmakoterapii neuropatické bolesti u dospělých pacientů. Rozšiřuje tak spektrum adjuvantních analgetik indikovaných pro léčbu neuropatické bolesti. Pozitivní jsou i vlastní zkušenosti autorů s PGB v léčbě neuropatické bolesti.
Indikace
PGB byl účinný ve studiích při léčbě fokální, parciální epilepsie se záchvaty parciálními a sekundárně generalizovanými. Účinnost PGB byla prokázána ve studiích u pacientů s diabetickou neuropatií a postherpetickou neuralgií. U jiných modelů neuropatické bolesti nebyla účinnost studována. Pregabalin byl též účinný v terapii generalizované úzkostné poruchy a zlepšoval průběh spánku.
PGB je v ČR schválen ve dvou terapeutických indikacích [1]:
– u epilepsie, jako přídatná léčba u dospělých s parciálními záchvaty se sekundární generalizací nebo bez ní;
– v léčbě periferní neuropatické bolesti u dospělých.
Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoliv pomocnou látku.
Nežádoucí účinky
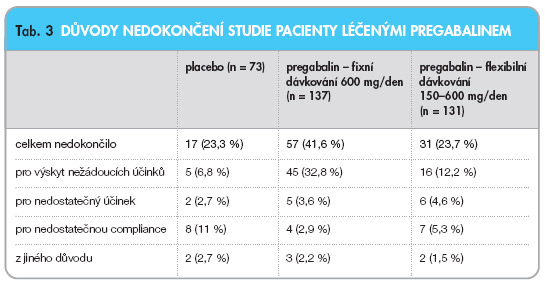
Léčba PGB v klinických studiích III. fáze byla hodnocena jako bezpečná, dobře snášená, s vysokým podílem pacientů, kteří studie dokončili (tab. 3), [4–7].
Léčba PGB nebyla asociována s klinicky významnými laboratorními odchylkami, změnami vitálních funkcí a s neurologickými abnormitami. Rovněž nebyly pozorovány defekty zorného pole [4].
Nežádoucí účinky byly vesměs lehké až střední intenzity. Jejich výskyt byl na dávce závislý, často jen tranzientního rázu, s maximem v období zahájení léčby, vyšší byl u pacientů, kde byla bez titrace nasazena léčba vyššími dávkami PGB (600 mg/den). Dominovaly obvyklé nežádoucí účinky plynoucí z ovlivnění CNS léčbou: nejistota, závratě (4,2 %), útlum, somnolence (3,1 %), ataxie (2 %) [4]. Dále byly pozorovány celková slabost, mírný váhový přírůstek a lehké myoklonické záškuby [5]. Nežádoucí účinky nebyly častým důvodem k ukončení léčby. Při jejich vzniku je diskutován i podíl interakcí při rozsáhlejší polypragmazii.
V jedné ze studií byla z důvodu nežádoucích účinků léčba ukončena u 5 % pacientů, kteří dostávali placebo, u 6,8 % léčených PGB 50 mg/den, u 1,2 % léčených dávkou PGB 150 mg/den, ve 14,4 % v případě dávky PGB 300 mg/den, ve 23,6 % u pacientů léčených PGB v dávce 600 mg/den [5]. V 73 % došlo k ukončení léčby během prvních dvou týdnů. Ukončení léčby z důvodů nežádoucích účinků bylo závislé na dávce PGB, nejvyšší při léčbě PBG v dávkách 600 mg/den a 300 mg/den, při léčbě dávkami 50 mg/den a 150 mg/den byl výskyt obdobný jako u placeba [4].
V jiné studii byla léčba ukončena kvůli nežádoucím účinkům v 6,2 % při podávání placeba, v 10 % při léčbě PGB 150 mg/den a v 18,5 % při léčbě PGB 600 mg/den [5]. V další studii bylo hodnoceno flexibilní dávkování PGB s ohledem na optimální účinnost a toleranci léčby. Ukončení léčby z důvodů nežádoucích účinků bylo u placeba v 6,8 %, při flexibilním dávkování PGB ve 12,2 % a při fixní dávce PGB 600 mg/den ve 32 % [7]. Tyto výsledky jsou uvedeny v tab. 3.
Výskyt psychických poruch ve studiích byl rovněž nízký. Poruchy kognitivních funkcí a koncentrace uvádělo okolo 4,5 % nemocných při léčbě dávkou PGB 600 mg/ den, vztah k dávce však nebyl jasný [4]. Jen ojediněle byly zjištěny příznaky deprese, úzkosti či jiné psychické poruchy [4, 5]. Aktuálně byly publikovány údaje o výskytu erektilní dysfunkce (ED) u mužů s epilepsií a s přídatnou léčbou PGB. V placebem kontrolovaných studiích byl výskyt ED u PGB 3 % a u placeba 1,9 %, rozdíl nebyl statisticky významný [32]. Rovněž v kazuistických sděleních je popsán výskyt ED u mužů s epilepsií léčených PGB, za rizikové faktory jsou považovány věk, polyterapie antiepileptiky a vyšší dávky PGB (400–600 mg/den). U některých nemocných byla ED jen přechodná, vázaná na zahájení léčby či zvýšení dávky PGB, trvala však až 151 dnů, u jiných byla reverzibilní a vymizela po ukončení léčby PGB. Další pacienti preferovali další léčbu PGB v kombinaci se symptomatickou léčbou ED [32].
Tab. 4 uvádí přehled velmi častých (frekvence výskytu > 1/10) a častých (> 1/100 a < 1/10) nežádoucích účinků. Méně častých a vzácných nežádoucích projevů léčby bylo pozorováno větší množství, uvedeny jsou např. v Summary of Product Characteristics přípravku obsahujícího pregabalin.
Lékové interakce
PGB se vylučuje převážně nezměněn močí, méně než 2 % dávky se objeví v moči jako metabolity, neváže se na plazmatické bílkoviny a neinhibuje metabolismus léků.
Není pravděpodobné, že by PGB vedl k farmakokinetickým interakcím nebo by byl jejich subjektem.
Ve studiích in vivo nebyly pozorovány žádné klinicky významné farmakokinetické interakce mezi PGB a fenytoinem, karbamazepinem, kyselinou valproovou, lamotriginem, gabapentinem, lorazepamem, oxykodonem nebo ethanolem. Perorální antidiabetika, diuretika, inzulin, fenobarbital, tiagabin a topiramát nemají klinicky významný účinek na clearance PGB. Současné podávání PGB s perorálními kontraceptivy obsahujícími norethisteron a/anebo ethinylestradiol neovlivňuje farmakokinetiku žádné z těchto látek v ustáleném stavu. Opakované perorální podávání PGB s oxykodonem, lorazepamem nebo ethanolem nemělo žádný klinicky významný účinek na dýchání. PGB má zřejmě aditivní účinek na zhoršení kognitivních a hrubých motorických funkcí způsobené oxykodonem. PGB může potencovat účinky ethanolu a lorazepamu.
Těhotenství a kojení
Nejsou k dispozici dostatečné údaje o použití PGB u těhotných žen.
Studie na zvířatech prokázaly reprodukční toxicitu PGB. Potenciální riziko u lidí není známo. Proto smějí ženy v těhotenství pregabalin užívat pouze v případech, kdy přínos léku pro matku jednoznačně převažuje nad potenciálními riziky pro plod. Ženy v reprodukčním věku musí používat účinnou antikoncepční metodu. Není známo, zda se pregabalin vylučuje do mateřského mléka. Byla však prokázána jeho přítomnost v mléce potkanů. Kojení během léčby PGB proto není doporučováno.
Ovlivnění pozornosti
Pregabalin může vyvolávat závratě a somnolenci, a může tudíž ovlivňovat schopnost řídit nebo obsluhovat stroje. Proto se doporučuje pacientům, aby neřídili motorová vozidla, neobsluhovali stroje ani neprováděli jiné potenciálně nebezpečné činnosti do doby, než se zjistí, zda tento lék neovlivňuje jejich schopnost provádět tyto činnosti.
Dávkování
Dávkovací rozmezí PGB je 150–600 mg denně rozdělené buď do dvou nebo tří p.o. dávek.
PGB lze podávat s jídlem nebo bez jídla. Léčba PGB může být zahájena dávkou 150 mg denně. V naší klinické praxi někdy zahajujeme léčbu i dávkou 75 mg podanou na noc, a to tam, kde očekáváme potenciálně větší senzitivitu k nežádoucím účinkům. V závislosti na individuální odpovědi a snášenlivosti pacienta může být dávka zvýšena na 300 mg denně v intervalu 3–7 dní (u neuropatické bolesti, u epilepsie po 7 dnech) a v případě potřeby po dalších 7 dnech až na maximální dávku 600 mg denně.
Nejsou k dispozici dostatečné údaje o postupu vysazování současně užívaných antiepileptických léčivých přípravků a případném přechodu na monoterapii PGB, bylo-li dosaženo kontroly záchvatů léčbou PGB. Pokud je nezbytné PGB vysadit, pak v souladu se současnou klinickou praxí se doporučuje vysazování postupné, minimálně během jednoho týdne.
Při předávkování až do dávky 15 g nebyly pozorovány žádné neočekávané nežádoucí účinky. Léčba předávkování PGB spočívá v obecných podpůrných postupech a může v případě potřeby zahrnovat hemodialýzu.
Pacienti s poruchou funkce ledvin
PGB se vylučuje ze systémového oběhu zejména v nezměněné formě ledvinami. Jeho clearance je přímo úměrná clearance kreatininu, a proto snížení dávek u pacientů s poruchou funkce ledvin musí být stanoveno individuálně podle clearance kreatininu (Clcr), podle následujícího vzorce.
PGB se účinně odstraňuje z plazmy hemodialýzou (50 % léku je odstraněno během 4 hodin). U pacientů léčených hemodialýzou je nutné denní dávku PGB upravit podle funkce ledvin. Kromě denní dávky má být ihned po každé 4hodinové hemodialýze podána dodatečná dávka PGB (viz tab. 2).
Jiné skupiny pacientů
U pacientů s poruchou funkce jater není nutná žádná úprava dávek. U starších pacientů (nad 65 let) je nutné pomýšlet na případné snížení dávky PGB při snížení funkce ledvin. U pediatrických pacientů do 12 let a dospívajících (12–17 let) nebyla bezpečnost a účinnost PGB stanovena. Použití u dětí se nedoporučuje.
Balení
Viz tab. 5.
Zpracování tématu a vlastní práce byly podpořeny výzkumným záměrem Patofyziologie neuropsychiatrických onemocnění a její klinické aplikace VZ 002 1620816.
Obr. 1 Strukturní chemický vzorec pregabalinu
Léčivé přípravky obsahující pregabalin aktuálně dostupné v ČR
Graf 1 Souhrnný přehled kontrolovaných studií s PGB v přídatné léčbě parciální epilepsie – parametr účinnosti: procentuální redukce frekvence záchvatů v období léčby oproti období před léčbou; podle [4–7] – French, et al., 2003; Arroyo, et al., 2004; Beydoun, et al, 2000; Elger, et al., 2004
Obr. 2 Efekt pregabalinu na hyperexcitovaný neuron. Kalciový kanál umožňuje prostup kalcia do neuronu (a). Pregablin redukuje vazbou na a2d-podjednotku napěťově řízených kalciových kanálů influx kalcia do presynaptické části neuronu. Následně dochází ke snížení uvolňování některých neurotransmiterů do synaptické štěrbiny (b).
Graf 2 Souhrnný přehled čtyř kontrolovaných studií s PGB v přídatné léčbě parciální epilepsie – parametr účinnosti: procentuální podíl respondérů (≥ 50% redukce záchvatů v období léčby v. baseline); podle [4–7] – French, et al., 2003; Arroyo, et al., 2004; Beydoun, et al, 2000; Elger, et al., 2004
Graf 4 Týdenní průměrné skóre bolesti u pacientů léčených pregabalinem nebo placebem. Ke snížení bolesti dochází již v prvním týdnu medikace; podle [18] – Freynhagen, et al., 2005.
Graf 5 Efekt různého dávkování pregabalinu na snížení bolesti u DPN a PHN. Sumarizace 10 provedených studií.
Seznam použité literatury
- [1] SPC. Souhrn údajů o přípravku: Lyrica (pregabalin), Pfizer, 8. 7. 2005.
- [2] Fink K, Doplet DJ, Meder WP, et al. Inhibition of neuronal Ca influx by gabapentin and pregabalin in human neocortex. Neuropharmacology 2002; 42: 226–236.
- [3] Taylor CP, Vetanian MG. Profile of anticonvulsant activity of pregabalin in animal models. Epilepsia 1997; 38 (suppl 8): 35.
- [4] French JA, Kugler AR, Robbins JL, et al. Dose-response trial of pregabalin adjunctive therapy in patients with partial seizures. Neurology 2003; 60: 1631–1637.
- [5] Arroyo S, Anhut H, Kugler A, et al. Pregabalin add-on treatment: A randomized, double-blind, placebo-controlled, dose-response study in adults with partial seizures. Epilepsia 2004; 45: 20–27.
- [6] Beydoun AA, Uthman BM, Ramsey RE, et. al. Pregabalin add-on trial: double-blind, multicenter study in patients with partial epilepsy. Epilepsia 2000; 41 (suppl 7): 253–254.
- [7] Elger CE, Anhut H, Messmer S. Pregabalin add-on trial: a double-blind, placebo controlled, multicentre study to compare flexible- and fixed-dose treatment in refractory patients with partial seizures. Epilepsia 2004; 45 (suppl 3): 67–68.
- [8] Sharma U, Iacobellis D, Glessner C, et al. The Pregabalin 1008–14/29 Study Group. Pregabalin effectively relieves pain in two studies of patients with painful diabetic peripheral neuropathy (Studies 1008–14/29). Presented at the Meeting of the American Pain Society; November 2–5, 2000; Atlanta, GA, 2000.
- [9] Dworkin RH, Corbin CM, Young Jr JP, et al. Pregabalin for the treatment of postherpetic neuralgia. Neurology 2003; 60: 1274–1283.
- [10] Rosenstock J, Tuchman M, LaMoreaux L, Sharma U. Pregabalin for the treatment of painful diabetic peripheral neuropathy: a double-blind, placebo-controled trial. Pain (v tisku).
- [11] Feltner DE, Crockatt JG, Dubovsky S, et al. A randomized, double-blind, placebo-controlled, fixed-dose, multicenter study of pregabalin in patients with generalized anxiety disorder. J Clin Psychopharmacol 2003; 23 (3): 240–249.
- [12] Chen SR, Xu Z, Pan HL. Stereospecific effect of pregabalin on ectopic afferent discharges and neuropathic pain induced by sciatic nerve ligation in rats. Anesthesiology 2001; 95: 1473–1479.
- [13] Wallin J, Cui JG, Yakhnitsa V, et al. Gabapentin and pregabalin suppress tactile allodynia and potentiate spinal cord stimulation in a model of neuropathy. Eur J Pain 2002; 6: 261–272.
- [14] Dworkin RH, Corbin AE, Young JP, et al. Pregabalin for the treatment of postherpetic neuralgia. A randomized, placebo-controlled trial. Neurology 2003; 60: 1274–1283.
- [15] Lesser H, Sharma U, LaMoreaux L, et al. Pregabalin relieves symptoms of painful diabetic neuropathy: A randomized controlled trial. Neurology 2004; 63: 2104–2110.
- [16] Rosenstock J, Tuchman M, LaMoreaux L, Sharma U. Pregabalin for the treatment of painful diabetic peripheral neuropathy. A double-blind placebo-controlled trial. Pain 2004; 110: 628–638.
- [17] Sabatowski R, Gálevz R, Cherry DA, et al. Pregabalin reduces pain and improves sleep and mood disturbances in patients with post-herpetic neuralgia: Results of a randomized, placebo-controlled clinical trial. Pain 2004; 109: 26–35.
- [18] Freynhagen R, Strojek K, Griesing T, et al. Efficacy of pregabalin in neuropathic pain evaluated in a 12-week, randomised, double-blind, multicentre, placebo-controlled trial of flexible- and fixed-dose regimens. Pain 2005; 115: 254–263.
- [19] Richter RW, Portenoy R, Sharma U, et al. Relief of painful diabetic peripheral neuropathy with pregabalin: a randomized, placebo-controlled trial. J Pain 2005; 6: 253–260.
- [20] Kwan P, Brodie MJ. Early identification of refractory epilepsy. N Engl J Med 2000; 342 (5): 314–319.
- [21] Schmidt D, Gram L. Monotherapy versus polytherapy in epilepsy. A reappraisal. CNS drugs 1995: 194–208.
- [22] Cramer JA, Fischer R, Ben-Menachem E, et al. New antiepileptic drugs: comparison of key clinical trials. Epilepsia 1999; 40: 590–600.
- [23] Elger ChE, Brodie M, Anhut H, et al. Pregabalin add-on treatment in patients with partial seizures: a novel evaluation of flexible-dose and fixed-dose treatment in double-blind, placebo-controlled study. Epilepsia 2005; 46: 1926–1936.
- [24] Perucca E, Ramsay RE, Robbins JL, et al. Pregabalin demostrates anticonvulsant activity by second day. Poster presented at the 55th Annual Meeting of the American Academy of neurology; Honolulu, Hawai; 29 Mar-5 Apr 2003.
- [25] Baulac M, Speigel K, Lee CM, Barrett JA. Long-term seizure freedom in patients with partial seizures treated with add-on pregabalin: update of an ongoing. Poster presented at the 6th European Congress on Epileptology: Vienna, Austria; 30 May-3 June 2004.
- [26] Uthman BM, Lee CM, Spiegel K. Long-term seizure freedom in patients with partial seizures treated with add-on pregabalin: An analysis of four, long-term, open-label trials. Epilepsia 2004; 45 (Suppl 7): 294.
- [27] Bazil CW. Epilepsy and sleep disturbance. Epilepsy Behavior 2003; 4: 39–45.
- [28] de Haas S, Otte A, et al. Exploratory polysomnographic evaluation of pregabalin on sleep disturbance in patients with epilepsy. Neurology 2005; 64 (Suppl 1) A190.
- [29] Hindmarch I, Dawson J, Stanley. The effects of pregabalin, alprazolam and placebo on cognitive and motor function, car driving and aspects of sleep in healthy volunteers. Paper presented at: American College of Neuropsychopharmacology (ACNP) 41 st Annual Meeting; 2001 December 8–12; San Juan, Puerto Rico.
- [30] Gore M, Brandenburg NA, et al. Pain severity in diabetic peripheral neuropathy is acssociated with patient fuctioning, symptom levels of anxiety and depression, and sleep. J Pain Symptom Management 2005; 4: 374–385.
- [31] Pohl RB, Feltner DE, et al. J Clin Psychopharmacol 2005; 2: 151–158.
- [32] Hitiris N, Barrett, Brodie M. Erectile dysfunction associated with pregabalin add-on treatment in patients with partial seizures: Five case reports. Epilepsy Behavior 2006; 8: 418–421.
- [33] Dubinsky RM, Kabbani H, El-Chami Z, et al. Practice Parameter: Treatment of postherpetic neuralgia. An evidence-based report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology 2004; 63: 959–965.
- [34] Hovorka J, Herman E. Neuropsychiatrické aspekty u epilepsie. Čes Slov Neurol Neurochir 2001 (suppl 11/2002): 1–15.
- [35] Hovorka J, Nežádal T, Herman E. Léčba gabapentinem ve spektru neuropsychiatrických onemocnění. Remedia 2000; 10 (reprint): 425–429.
- [36] Hovorka J, Hosák L, Nežádal T. Gabapentinum – léčba ve spektru neuropsychiatrických onemocnění II. Remedia 2006; 1: 46–55.