Ropinirol
Ropinirol je non-ergolinový agonista dopaminu se specifickou vazebnou afinitou k dopaminovým receptorům rodiny D2 v centrální nervové soustavě, srovnatelnou se selektivitou endogenního dopaminu, tj. D3 > D2 > D4. Ropinirol je indikován k léčbě pacientů postižených PN v časném i pokročilém stadiu, přičemž je účinný v časném stadiu nemoci u pacientů, u nichž je nezbytné zahájit terapii dopaminergními látkami. Parkinsonova nemoc je chronické progresivní onemocnění nervové soustavy, manifestující se na podkladě (především) degenerace melaninových neuronů v substantia nigra. Prevalence PN se odhaduje na 1 případ na 10 000 obyvatel. Dále je indikován k léčbě syndromu neklidných nohou mírného až středního stupně. Po perorálním podání se ropinirol prakticky úplně vstřebává, je přibližně z 90 % biotransformován v játrech prostřednictvím cytochromu P-450 1A2. Biologický poločas ropinirolu se pohybuje okolo 6 hodin. Z nežádoucích účinků při podávání ropinirolu v monoterapii patřily k častým nauzea, závratě, ospalost a synkopa. K velmi vzácným nežádoucím účinkům patří imperativní usínání bez předchozí ospalosti. Dávkování ropinirolu je individuální, podává se ve 3 denních dávkách. Doporučuje se titrace dávky od 0,75 mg/den přes 1,5 mg/den, 2,25 mg/den po 3 mg/den v týdenních intervalech. Dále se dávka zvyšuje dle výše účinku o 1,5–3 mg denní dávky za týden.
Farmakokogická skupina
Antiparkinsonikum, non-ergolinový agonista dopaminu. ATC N04BC04.
Chemické a fyzikální vlastnosti
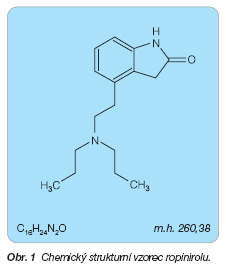
Ropinirol je chemicky 4-[2-(dipropyl-aminoethyl)]-2-indolinon (obr. 1).
V léčivých přípravcích je obsažen ve formě hydrochloridu.
Sumární vzorec:
C16H24N2O (ropinirol)
C16H25ClN2O (ropinirol-hydrochlorid)
Molekulová hmotnost:
260,38 (ropinirol)
296,84 (ropinirol-hydrochlorid)
Přibližně 1,14 mg ropinirol-hydrochloridu odpovídá 1 mg báze ropinirolu.
Ropinirol-hydrochlorid je bílý nebo světle zelenožlutý prášek, snadno rozpustný ve vodě.
Mechanismus účinku a farmakodynamika
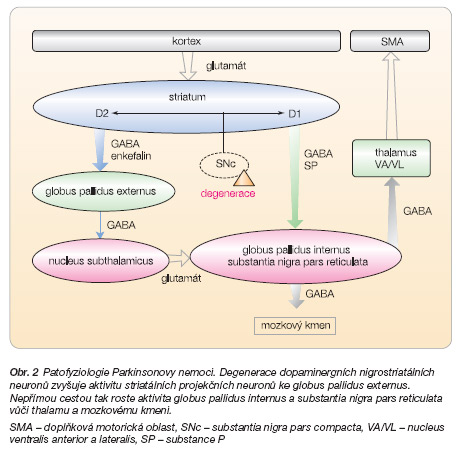
U Parkinsonovy nemoci (PN) má rozhodující význam selhání regulace v oblasti bazálních ganglií. Mozková kůra vysílá impulzy k neuronům ve striatu. Striatální neurony pak inhibují další neurony v globus pallidus. Odsud vedou GABAergní inhibiční projekce do motorických oblastí thalamu, anebo probíhají smyčkou přes nucleus subthalamicus. Výsledkem fungování popsaných okruhů je krátkodobé "odbrzdění" neuronů v motorické části thalamu, které působí neuronální excitaci v premotorických oblastech kortexu. Tato stimulace je předpokladem plynulého a koordinovaného pohybu. Snížené uvolňování dopaminu ve striatu následkem degenerace melaninových neuronů vedoucích sem ze substantia nigra pars compacta vyvolá rostoucí excitaci GABA-neuronů směřujících své axony ke globus pallidus externus. Tím se zvýší frekvence výbojů GABAergních (inhibičních) projekčních neuronů jader bazálních ganglií. Výsledná vyšší inhibice projekčních jader v thalamu (nucleus ventralis anterior) snižuje excitaci v premotorické mozkové kůře a zvláště v suplementární motorické areji. Tato porucha je pravděpodobně podstatou akineze či hypokineze u Parkinsonovy nemoci. Klidový tremor a zvýšení svalového tonu (rigor) vznikají potom spíše v důsledku poruch neuronální regulace v mozkovém kmeni a míše, kam komplex globus pallidus/substantia nigra pars reticulata také inhibičně projikuje (obr. 2) [1, 2].
Dopaminové receptory se rozdělují na dvě základní rodiny (třídy) – na dopaminové D1-like receptory (do této rodiny patří dopaminové D1- a D5-receptory) a na dopaminové D2-like receptory (do této rodiny patří dopaminové D2-, D3- a D4-receptory) [3]. Ropinirol je non-ergolinový agonista dopaminu se specifickou vazebnou afinitou k dopaminovým receptorům rodiny D2-like v centrální nervové soustavě, která je srovnatelná se selektivitou endogenního dopaminu, tj. D3 > D2 > D4 [4].
Farmakokinetické vlastnosti
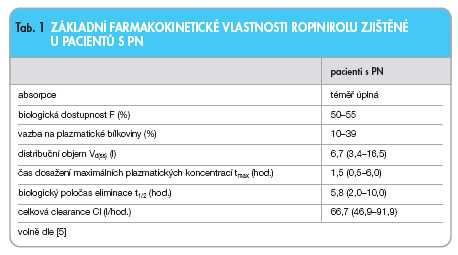
Po perorálním podání se ropinirol prakticky úplně vstřebává. Jeho absolutní biologická dostupnost se pohybuje mezi 50–55 % [5]. Maximálních plazmatických koncentrací dosahuje během 1,5 hodiny (0,5–6 hodin). Současný příjem potravy má malý, ale statisticky významný vliv na biologickou dostupnost ropinirolu. Podání spolu s jídlem vede ke snížení plochy pod křivkou ropinirolu o 13 %, ke snížení jeho maximálních plazmatických koncentrací o 25 % a k prodloužení času nutného k jejich dosažení z průměrných 1,5 hodiny na průměrně 2,6 hodiny [6].
Ropinirol je jako relativně nízkomolekulární bazická molekula rychle distribuován v organismu. Má nereálně velký distribuční objem (6,7–7,5 l/kg), který svědčí o extenzivní distribucí v tkáních a sekretech [5]. Vazba ropinirolu na plazmatické bílkoviny je nízká a dosahuje 10–39 % v závislosti na jeho plazmatických koncentracích [5].
Ropinirol je přibližně z 90 % biotransformován v játrech za vzniku farmakologicky neúčinných metabolitů. Biotransformuje se převážně N-depropylací a hydroxylací, a to prostřednictvím izoenzymu cytochromu P-450 1A2 (CYP1A2). Jen velmi omezenou až zanedbatelnou roli při biotransformaci ropinirolu hrají další izoenzymy cytochromu P-450 3A4 (CYP3A4) a 2C19 (CYP2C19) [7]. Díky pravděpodobně polymorfnímu charakteru CYP1A2 jsou zjišťovány značné interindivuduální rozdíly farmakokinetických vlastností ropinirolu. Z tohoto důvodu je naprosto nezbytné titrovat dávky ropinirolu pomalu a postupně. Část oxidovaných metabolitů ropinirolu je dále biotransformována na glukuronidy. Ropinirol se vylučuje prakticky úplně močí, a to převáženě ve formě metabolitů a z malé části (přibližně 10 %) v nezměněné formě [5].
Farmakokinetické vlastnosti ropinirolu jsou v rozmezí dávek 2–12 mg prakticky lineární, avšak se značnou interindividuální variabilitou [6]. Biologický poločas eliminace ropinirolu není závislý na dávce a pohybuje se v rozmezí 2–10 hodin (průměrně 6 hodin) [5].
Přehled základních farmakokinetických vlastností ropinirolu je uveden v tab. 1.
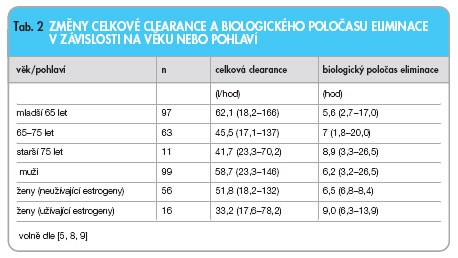
U pacientů starších 65 let dochází ke snížení celkové clearance ropinirolu a k prodloužení jeho biologického poločasu eliminace (tab. 2) [8].
Nebyly zjištěny statisticky významné rozdíly farmakokinetických vlastností ropinirolu u mužů a u žen, ženy užívající estrogeny (kombinovaná hormonální kontraceptiva nebo HRT) však mají výrazně nižší celkovou clearance ropinirolu a delší je biologický poločas (viz Lékové interakce) [9]. Snížení celkové clearance a prodloužení biologického poločasu eliminace bylo prokázáno též u pacientů s mírnou nebo středně závažnou poruchou funkce ledvin [5]. Farmakokinetické vlastnosti ropinirolu nebyly studovány u pacientů s těžkou poruchou funkce jater nebo ledvin (viz Kontraindikace).
Klinické zkušenosti
Parkinsonova nemoc
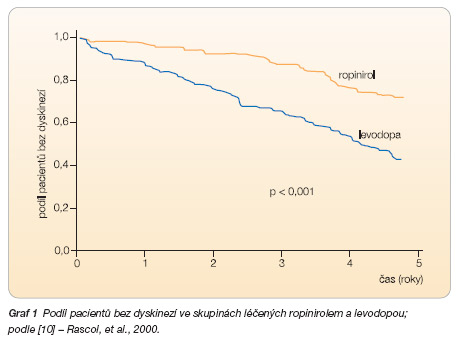
Účinnost a bezpečnost ropinirolu u PN byla zkoumána v několika velkých klinických studiích. Největší a zároveň nejdelší byla studie publikovaná v roce 2000 Rascolem a spolupracovníky [10]. V této studii mělo během pěti let signifikantně méně pacientů léčených ropinirolem zkušenost s dyskinezemi ve srovnání s levodopou (20 % v 45 %; p < 0,0001, graf 1).
V kterékoli fázi studie bylo riziko vzniku dyskinezí u pacientů užívajících ropinirol (s přidáním levodopy nebo bez ní) téměř třikrát nižší než u pacientů léčených levodopou (p < 0,0001). Lehce invalidizující nebo zhoršená diskineze byla hlášena u statisticky významně méně pacientů užívajících ropinirol, ve srovnání s levodopou (8 % v 23 %; p < 0,001). Pětiletou studii ukončilo 47 % pacientů ve skupině ropinirolu (85/179) a 51 % pacientů ve skupině levodopy (45/89). Z těchto pacientů ukončilo studii bez přidání/zvýšení dávky levodopy 34 % pacientů ve skupině ropinirolu (29/85) a 64 % pacientů ve skupině levodopy (29/45). Počáteční dávka ropinirolu byla 0,25 mg perorálně třikrát denně, která byla v týdenních intervalech titrována k maximální dávce 24 mg denně, a to na základě individuální odpovědi. Po pěti letech byla průměrná dávka u pacientů užívajících ropinirol 16,5 Î 6,6 mg denně, bez ohledu na případné podávání levodopy. Analýza pacientů, kteří dokončili studii (bez ohledu na přidání levodopy; ropinirol n = 85, levodopa n = 45) ukazuje, že průměrná změna skóre ve škále ADL (aktivity denního života) od původního výsledku se mezi skupinami statisticky významně nelišila (ropinirol 1,63 v levodopa 0,10; p = 0,08). Během pěti let byla incidence nežádoucích účinků léčby podobná v obou skupinách (97 % ropinorol a 96 % levodopa). Nejčastějším nežádoucím účinkem pacientů užívajících ropinirol ve srovnání s levodopou byla nauzea (49 % v 49 %), ospalost (27 % v 19 %) a nespavost (25 % v 24 %). Ačkoli byla u ropinirolu vyšší incidence halucinací (17 %) ve srovnání s levodopou (6 %), tyto halucinace byly mírné a většinou snadno zvládnutelné. K přerušení léčby vedly nežádoucí účinky u 4 % léčených ropinirolem a u 2 % pacientů léčených levodopou. Celkem 69 pacientů (42 ropinirol, 27 levodopa) ze 130, kteří dokončili 5letou studii, vstoupilo do 5leté, otevřené, přirozeně následující studie, která umožňuje posoudit dlouhodobější přínos terapie. Průměrná doba rozvoje dyskinezí byla signifikantně delší u pacientů užívajících ropinirol (8,6 roku) oproti pacientům užívajícím levodopu (7 roků), poměr rizika 0,4, 95% CI: 0,2–0,8 (p = 0,007). Incidence dyskinezí u pacientů užívajících ropinirol byla nižší než ve skupině pacientů užívajících levodopu, 52,4 % v 77,8 % (p = 0,05). Změny od základního skóre v celkové motorické škále UPDRS a škále ADL byly podobné v obou léčených skupinách.
Další studie, nazývaná REAL-PET, prokázala kromě účinnosti a bezpečnosti ropinirolu i jeho určitý neuroprotektivní potenciál [11]. U pacientů v této studii bylo prováděno vyšetření mozku pomocí 18F-dopa PET 4 týdny po zahájení léčby a po 2 letech terapie buď s ropinirolem, nebo levodopou. Po 2 letech bylo zjištěno, že u pacientů užívajících ropinirol byl zaznamenán pokles ztráty funkce dopaminergních zakončení ve striatu až o 34 % ve srovnání s pacienty užívajícími levodopu, tj. že progrese ztráty funkce byla méně výrazná, tedy pomalejší. V obou skupinách pacientů bylo patrné jasné zlepšení motoriky, pacienti užívající levodopu měli na konci sledování signifikantně nižší hodnoty UPDRS III skóre. U pacientů užívajících ropinirol bylo zaznamenáno signifikantně nižší riziko rozvoje dyskinezí.
Syndrom neklidných nohou
Účinnost a bezpečnost ropinirolu u syndromu neklidných nohou byla zkoumána v dvojitě slepé randomizované studii u 284 pacientů se středně těžkým až těžkým onemocněním se skóre IRLS (International Restless Legs Scale) nejméně 15 [12]. Pacienti byli randomizováni do dvou skupin, v první (n = 146) bylo zahájeno podávání ropinirolu v dávce 0,25 mg 1–3 hodiny před spaním a ve druhé (n = 138) bylo podáváno placebo. Dávky ropinirolu byly během 7 týdnů postupně titrovány až na maximální denní dávku 4 mg. Průměrná dosažená dávka v této skupině probandů činila 1,9 mg denně. Po 12 týdnech terapie došlo ve skupině pacientů užívajících ropinirol k poklesu IRLS skóre z 24,4 na 13,5 a ve skupině pacientů užívajících placebo z 25,2 na 17,1. Ropinirol byl ve srovnání s placebem statisticky významně účinnější (p = 0,0036). Další sledovaný parametr CGI-I (Clinical Global Impression – Global Improvement) se zlepšil u 53,4 % pacientů užívajících ropinirol a pouze u 40,9 % pacientů užívajících placebo (p = 0,0416). Z nežádoucích účinků ropinirolu dominovala nauzea a zvracení, ostatní nežádoucích účinky byly málo časté s výjimkou ospalosti a závratí.
Zařazení do současné palety léčiv
Parkinsonova nemoc
Agonisté dopaminu jako skupina mají své jasné indikační vymezení, publikované v algoritmech a doporučeních léčby mezinárodních, amerických, evropských i národních [13–17]. Zahajovací léčba agonisty dopaminu je preferovanou volbou pro pacienty, u kterých se rozvinulo funkční postižení v souvislosti s onemocněním ve všech těchto algoritmech a doporučeních. V pokročilém stadiu onemocnění je ropinirol léčivem, které je používáno k ovlivnění poruchy motoriky u těch pacientů, kde selhává léčba levodopou, eventuálně levodopou podávanou spolu s inhibitorem COMT. Primární léčebnou snahou je dosažení tzv. kontinuální (nebo spíše „kontinuálnější") dopaminergní stimulace rodiny D2 receptorů ve striatu a ovlivnění nejvíce obtěžujících příznaků pokročilého stadia, tj. „wearing-off" fenoménů, „on-off" fluktuací a dyskinezí.
Dávka ropinirolu, při které dochází k optimální terapeutické odpovědi, je 9 mg denně. První terapeutickou odpověď ale zaznamenává 75 % pacientů až od dávky 9 mg [18]. Pacienti v klinické praxi léčení jak kombinací s levodopou, tak monoterapií vyžadují postupné zvyšování dávek, které umožňuje přizpůsobovat léčbu progresi onemocnění. Po 5 letech léčby dosahovala průměrná dávka ropinirolu 16,5 mg [10]. I při tomto dávkování je ropinirol v současnosti považován za patrně nejbezpečnějšího zástupce skupiny agonistů dopaminu z důvodu významně nízkého výskytu nežádoucích účinků psychiatrického charakteru [19–21].
Vzájemná zaměnitelnost jednotlivých agonistů dopaminu vzhledem ke klinickým vlastnostem ropinirolu (oddálení nástupu dyskinezí, oddálení nutnosti zahájení léčby levodopou až o 5 let, uzpůsobení dávek progresi onemocnění, potenciál pro zpomalení progrese onemocnění, absence psychiatrických vedlejších účinků) je velmi omezená. Jedinou alternativou ropinirolu je v současnosti pramipexol.
V počátečním stadiu PN je tedy v současnosti v zásadě doporučováno zahájení dopaminergní terapie za použití agonisty dopaminu, a teprve tehdy, když tato léčba nepostačuje ke kompenzaci stavu pacienta, přidat levodopu, ev. levodopu s inhibitorem COMT. Léčba agonisty dopaminu je v počátečním stadiu většinou dobře kontrolovatelná a ve většině případů není provázena významnějšími vedlejšími účinky.
Pokročilé stadium PN je v zásadě charakterizováno rozvojem komplikací nemoci samotné i komplikací léčby. Jedná se o záležitost výsostně individuální, u některých pacientů se mohou komplikace objevit již po prvních 3–4 letech terapie, u některých pacientů nedojde k rozvoji komplikací nemoci i léčby po dobu delší než např. 7 let. Patofyziologickou podstatou vzniku komplikací je změna „nastavení" dopaminových receptorů ve striatu, a to jak direktních receptorů nigrostriatálních drah, tak i receptorů zpětnovazebných. Kromě toho se na vzniku komplikací podílí i „resetting" receptorů cholinergních, NMDA-receptorů a nepochybně i adenozinových receptorů.
Klinicky rozvoj komplikací zahrnuje manifestaci tzv. wearing-off fenoménu, kdy se zkracuje doba efektu dávky dopaminergní léčby, dále postupný rozvoj „on-off" fluktuací, a konečně rozvoj dyskinezí nejrůznějšího typu : „on", „off", „peak-of-dose", „end-of-dose" a dyskinezí bifázických [22]. Každý z vyjmenovaných typů dyskinezí se může manifestovat buď samostatně, anebo se mohou různé druhy dyskinezí kombinovat. V každém případě jsou dyskineze nejvíce obtěžujícím typem komplikace progrese nemoci i léčby a jejich eliminace či minimalizace je pro pacienta i lékaře nejvýznamnějším terapeutickým cílem v pokročilé, komplikované fázi PN. Co se týče role agonistů dopaminu v této fázi léčby, lze zde shrnout, že se tato léčiva uplatňují za použití alternativních scénářů terapie motorických komplikací PN o několika krocích: přidat k terapii levodopou agonistu dopaminu, anebo přidat inhibitor COMT (fakticky zaměnit dosud užívanou formu levodopy za novou, inhibitor COMT již obsahující), anebo kombinovat oba postupy [23]. Cílem je ve všech případech již zmíněná snaha o tzv. „kontinuální" stimulaci dopaminových receptorů ve striatu a snaha o redukci dávky levodopy.
Je nezbytné zde poznamenat, že dobrého nastavení antiparkinsonské terapie, zejména používáme-li agonisty dopaminu, nelze dosáhnout bez dokonalé kontroly stavu pacienta, hodinu po hodině, po dobu několika dnů. I když lze pacienty instruovat o vedení parkinsonského deníku, údaje z těchto deníků jsou zatíženy subjektivní chybou, která pohled lékaře zkresluje [10]. Proto se jako žádoucí jeví, aby výše uvedené změny medikace v případě objevení se motorických komplikací pokročilé PN byly prováděny za hospitalizace.
Syndrom neklidných nohou
Syndrom neklidných nohou (restless legs syndrome – RLS) je charakterizován nucením k pohybu končetinami spojenému s nepříjemnými paresteziemi (pálením, svíráním, mravenčením apod.) projevujícími se hlavně v klidu a přechodně mizejícími s pohybem končetin. Charakteristický je i cirkadiánní výskyt potíží, nejčastěji večer a v noci. Proto často dochází i k poruchám spánku [23].
V terapii tohoto syndromu je nejdříve vhodné léčit faktory, které mohou tento syndrom sekundárně navodit. Nejčastější příčinou RLS je nedostatek železa, které lze snadno suplementovat. Pokud není zjištěna příčina, je první volbou léčby levodopa. Avšak po delší době léčby dochází k tzv. augmentaci, kdy se obtíže přesunují z večerních do odpoledních hodin. Agonisté dopaminu mohou být též léky první volby, augmentace u nich nebyla zatím pozorována. Pokud obtíže přetrvávají, lze dopaminové agonisty kombinovat s opiáty, benzodiazepiny či některými antiepileptiky (gabapentin, valproát) [24].
Indikace
PN u dospělých pacientů, zejména v časné fázi onemocnění. Ropinirol lze podávat v monoterapii nebo v kombinaci s levodopou, kdy zvyšuje její účinek včetně omezení efektu „on-off" fluktuací a efektu „end of dose" a kdy umožňuje snížení dávek levodopy.
Syndrom neklidných nohou u dospělých pacientů.
Kontraindikace
Přecitlivělost na ropinirol. Těžká porucha funkce ledvin (Clcr < 30 ml/min) nebo jater (pro nedostatek zkušeností). Podání dětem (pro nedostatek zkušeností), gravidita a laktace (pro nedostatek zkušeností).
Opatrnosti je třeba u pacientů se závažným kardiovaskulárním onemocněním, zejména u pacientů se sklonem k hypotenzi nebo ortostatické hypotenzi, a to pro riziko hypotenze, bradykardie nebo jiných poruch srdečního rytmu. Dále je třeba opatrnosti u pacientů se závažným psychiatrickým onemocněním pro riziko vzniku nebo exacerabace halucinací.
Nežádoucí účinky
Nežádoucí účinky ropinirolu se objevují především na začátku terapie a většina z nich je závislá na dávkách ropinirolu. V kontrolovaných klinických studiích se incidence nežádoucích účinků pohybovala mezi 20–60 % v závislosti na dávce ropinirolu a na tom, zda byl podáván v monoterapii či kombinaci s levodopou.
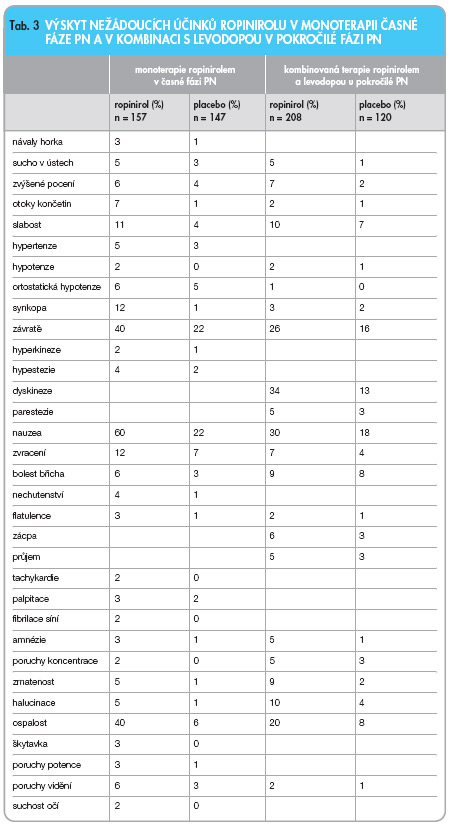
Z nežádoucích účinků při podávání ropinirolu v monoterapii patřily k častým (ve většině studií incidence 10 % nebo vyšší) nauzea, závratě, ospalost a synkopa. Nejvyšší výskyt nauzey a závratí byl zaznamenán v období 1.–4. týdne terapie (nauzea), respektive 4.–8. týdne terapie (závratě). Ropinirol vykazoval ve srovnání s bromokriptinem nebo levodopou obdobný výskyt nežádoucích účinků (halucinace, zmatenost, hypotenze včetně ortostatické hypotenze). Rozvoj dyskinezí byl při podávání ropinirolu v pětiletém sledování 4x méně pravděpodobný ve srovnání se skupinou pacientů s PN léčených levodopou. Dyskineze se u pacientů léčených ropinirolem v různých klinických studiích vyskytly v 7,5–20 %, u pacientů léčených levodopou ve 23–45 %.
Z nežádoucích účinků při podávání ropinirolu v kombinaci s levodopou patřily k častým (ve většině studií incidence 15 % nebo vyšší) dyskineze, nauzea, závratě a ospalost.
K velmi vzácným nežádoucím účinkům patří imperativní usínání [25, 26], které se může vyskytnout náhle bez jakýchkoli předchozích varovných projevů, jako je například ospalost. Na tuto skutečnost by měli být upozorněni pacienti, kteří vykonávají činnosti vyžadující zvýšenou pozornost (řízení motorových vozidel, obsluha strojů či zařízení). Pokud se takové příhody u pacientů vyskytly, nesmějí řídit motorové vozidlo nebo obsluhovat stroje či zařízení.
Výskyt nežádoucích účinků zjištěných ve studiích kontrolovaných placebem je uveden v tab. 3.
Lékové interakce
Ropinirol se extenzivně biotransformuje v játrech převážně N-depropylací a hydroxylací na izoenzymu cytochromu P-450 1A2. Ropinirol neovlivňuje aktivitu jednotlivých izoenzymů cytochromu P-450 a není jejich inhibitorem nebo induktorem [27, 28].
Expozici ropinirolu zvyšuje inhibitor CYP1A2 ciprofloxacin [29]. V dosud nepublikované studii provedené výrobcem ropinirolu [27, 28] u 12 pacientů s PN léčených ropinirolem v dávkách 2 mg 3x denně vedlo současné podávání ciprofloxacinu v dávkách 500 mg 2x denně ke zvýšení plochy pod křivkou ropinirolu o 84 % a ke zvýšení jeho maximálních plazmatických koncentrací o 60 %. Výrobce ropinirolu očekává obdobnou lékovou interakci při současném podávání ropinirolu s jinými inhibitory CYP1A2, jako jsou fluvoxamin nebo mexiletin, dosud však nebyly provedeny žádné studie ani nebyly publikovány jiné zprávy potvrzující takové lékové interakce.
Expozice ropinirolu je naopak snížena u kuřáků, u kterých vede závislost na tabáku k indukci CYP1A2. V dosud nepublikované studii provedené výrobcem ropinirolu [27, 28] u 18 pacientů se syndromem neklidných nohou léčených ropinirolem bylo zjištěno, že u kuřáků (n = 7) ve srovnání s nekuřáky (n = 11) dochází ke snížení plochy pod křivkou ropinirolu o 30 % a ke snížení jeho maximálních plazmatických koncentrací o 38 %. Výrobce ropinirolu očekává obdobnou lékovou interakci při současném podávání ropinirolu s jinými induktory CYP1A2, jako je omeprazol; dosud však nebyly provedeny žádné studie ani nebyly publikovány jiné zprávy potvrzující takové lékové interakce.
Současné podávání ropinirolu v dávkách 2 mg 3x denně u 23 pacientů s PN léčených kombinací levodopy s karbidopou v dávkách 100 mg/10 mg 2x denně vedlo ke zvýšení maximálních plazmatických koncentrací levodopy o 20 %, bez statisticky významného vlivu na její plochu pod křivkou [27, 28]. V další dosud nepublikované studii provedené výrobcem nemělo podávání kombinace levodopy s karbidopou v dávkách 100 mg/10 mg 2x denně vliv na farmakokinetické parametry ropinirolu podávaného v dávkách 2 mg 3x denně 28 pacientům s PN. V jiné studii provedené u 12 čínských zdravých dobrovolníků [30] bylo zjištěno mírné, ale statisticky významné zvýšení plochy pod křivkou ropinirolu (o 17 %) podaného v jednorázové dávce ve výši 1 mg v kombinaci s levodopou a benserazidem v jednorázové dávce 250 mg/50 mg. Přidání ropinirolu u pacientů s PN (n = 148) nedostatečně kompenzovaných podáváním levodopy (v kombinaci s inhibitorem dekarboxylázy) vedlo ke zlepšení kompenzace onemocnění při současném snížení dávek levodopy u 31 % pacientů. V jiné studii porovnávající efekt přidání ropinirolu nebo bromokriptinu pacientům již léčeným kombinací levodopy s inhibitorem dekarboxylázy došlo k průměrnému snížení dávek levodopy u pacientů léčených ropinirolem o 163,2 mg/den, kdežto u pacientů léčených bromokriptinem o 61,9 mg/ den. Navíc dávky levodopy byly sníženy ve skupině užívající ropinirol o více než 20 % u 54,1 % pacientů, zatímco ve skupině užívající bromokriptin pouze u 28,7 % pacientů [31]. Ve dvojitě slepé studii trvající 6 měsíců byl pacientům s pokročilou PN [32] podáván ropinirol (n = 95) v průměrných dávkách 7,5 mg denně nebo bylo podáváno placebo (n = 54). Všichni pacienti zařazení do studie byli léčeni levodopou. Po 6 měsících došlo ve skupině pacientů užívajících ropinirol ke snížení dávek levodopy o 242 mg denně, zatímco ve skupině pacientů užívajících placebo pouze o 51 mg denně (p < 0,001).
Současné podávání ropinirolu a ethinylestradiolu v dávkách 0,6–3 mg denně vedlo u 16 pacientek s Parkinsonovou nemocí ke snížení celkové clearance ropinirolu o 36 % [27, 28].
Podávání ropinirolu v dávkách 2 mg 3x denně 10 pacientům s PN nemělo vliv na farmakokinetické parametry digoxinu podávaného v dávkách 0,125–0,25 mg 1x denně v ustáleném stavu [27, 28]. Stejně tak ropinirol podávaný v dávkách 2 mg 3x denně 12 pacientům s PN neměl statisticky významný vliv na farmakokinetické parametry theofylinu podávaného v dávkách 300 mg 2x denně [33], podobně ropinirol v dávkách 2 mg 3x denně 12 pacientům s PN statisticky významně neovlivnil farmakokinetické parametry jednorázové dávky aminofylinu ve výši 5 mg/kg [33].
Byla popsána kazuistika 63letého pacienta s PN [34] dlouhodobě léčeného warfarinem v dávkách 4 mg denně a kombinací levodopy a karbidopy v dávkách 250 mg/25 mg 4x denně. Během 9 dnů po zahájení podávání ropinirolu v dávkách 0,25 mg 3x denně došlo ke zvýšení hodnot INR na 4,6 a podávání warfarinu bylo nutné přerušit. Po několika dnech bylo podávání warfarinu opětovně zahájeno, zpočátku v dávkách 2 mg denně, později v dávkách 3 mg denně.
Analýza populačních farmakokinetických dat prokázala, že současné podávání selegilinu, amantadinu, tricyklických antidepresiv, benzodiazepinů, ibuprofenu, thiazidových diuretik, antihistaminik nebo anticholinergik nemělo vliv na celkovou clearance ropinirolu [27, 28].
Výrobce ropinirolu [27, 28] upozorňuje, že ačkoli dosud nebyly provedeny žádné studie, je velmi pravděpodobné, že ropinirol jako agonista na dopaminových receptorech D2, D3 a D4 může antagonizovat účinek dopaminových antagonistů, jako jsou antipsychotika (zejména fenothiazinová, thioxanthenová nebo butyrofenonová) nebo benzamidy, jako jsou metoklopramid nebo sulpirid či amisulprid. Byla však provedena studie, jejímž cílem bylo zjistit, zda současné podávání ropinirolu s domperidonem povede ke snížení nepříznivého periferního působení ropinirolu, a tím i k omezení výskytu nauzey a zvracení, zejména při rychlé eskalaci dávek ropinirolu. Bylo prokázáno, že podávání domperidonu snižuje výskyt periferních nežádoucích účinků léčby ropinirolem, zejména nauzey a zvracení [35]. Cílená farmakokinetická studie provedená u 9 zdravých dobrovolníků [36], kterým byla podána jednorázová dávka ropinirolu ve výši 0,8 mg samotná nebo současně s jednorázovou dávkou domperidonu ve výši 20 mg, prokázala, že nedochází k žádnému statisticky významnému ovlivnění farmakokinetických vlastností ropinirolu. Bylo však prokázáno snížení výskytu periferních nežádoucích účinků ropinirolu. Pokud byl podán samotný, byla u 6 dobrovolníků (z 9 dobrovolníků) pozorována hypotenze, nauzea, slabost, závratě), v případě současného podání domperidonu se vyskytl pouze jeden případ hypotenze (z 9 dobrovolníků).
Dávkování
Dávkování je vždy individuální. Určuje se postupnou titrací takové dávky, která bude dostatečně účinná a zároveň dobře tolerovaná. Pokud je nutné dávkování postupně snížit z důvodu výskytu jiných nežádoucích účinků, je následně možné, po vymizení těchto nežádoucích účinků, dávku opět postupně zvyšovat na optimální terapeutickou úroveň.
Ropinirol by měl být podáván ve třech dílčích dávkách, pokud možno současně s jídlem, aby se zlepšila gastrointestinální snášenlivost.
Jako počáteční dávka by mělo být podáváno 0,25 mg třikrát denně. Následně by měla být dávka každý týden zvyšována o 0,25 mg třikrát denně po dobu 4 týdnů, tedy do dávky 1 mg 3x denně. Po počáteční titraci dávky by měla být vyhledána udržovací dávka tak, že se postupně (vždy po 1 týdnu) zvyšuje denní dávka o 1,5 až 3,0 mg/den (0,5–1 mg 3x denně). Terapeutický účinek je obvykle pozorován po dávce 3–9 mg/den. Pokud není dosaženo uspokojivé kontroly příznaků onemocnění, může být dávka ropinirolu dále zvyšována až do maximální dávky 24 mg/den.
Pokud je ropinirol používán jako adjuvantní terapie k léčbě levodopou, může být dávka levodopy postupně snižována, a to celkem až o 20 %.
Pokud je pacient převáděn z terapie jiným dopaminovým agonistou na terapii ropinirolem, měla by být léčba touto látkou postupně ukončována ještě předtím, než se zahájí léčba ropinirolem.
Pokud je nutné vysadit užívání ropinirolu, provádí se (stejně jako u jiných dopaminových agonistů) tak, že se postupně, vždy po 1 týdnu, snižuje počet denních dávek.
U pacientů s mírným nebo středním poškozením funkce ledvin (clearance kreatininu 0,5–0,83 ml/s) nebyla pozorována změna clearance ropinirolu, a proto není nutné u těchto pacientů upravovat dávkování. Podávání ropinirolu pacientům s těžkým poškozením ledvin (clearance < 0,5 ml/s) nebo s poškozením jater nebylo studováno. U pacientů starších než 65 let se clearance ropinirolu snižuje, ale přesto je možno titrovat účinnou dávku a tuto dále udržovat výše doporučeným způsobem. U dětí nebylo podávání ropinirolu studováno, proto by ropinirol neměl být dětem podáván.
Balení
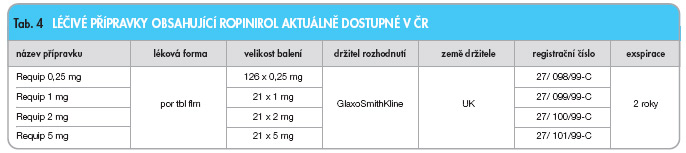
Přehled léčivých přípravků obsahujících ropinirol je uveden v tab. 4.
Seznam použité literatury
- [1] Lullmann H, Mohr K, Wehling M. Farmakologie a toxikologie. Praha, Grada, 2004. 15. vydání (2. české), kap. 10.3 Antiparkinsonika.
- [2] Folsch UR, Kochsiek K, Schmidt RF. Patologická fyziologie. Praha, Grada, 2003. 1. české vydání, kap. 32.4 Onemocnění bazálních ganglií.
- [3] Gardner B, Strange PG. Agonist action at D2(long) dopamine receptors: ligand binding and functional assays. Br J Pharmacol 1998; 124: 978–984.
- [4] Ravikumar K, Sridhar B. Ropinirole hydrochloride, a dopamine agonist. Acta Crystallogr C 2006; 62: 265–267.
- [5] Kaye CM, Nicholls B. Clinical pharmacokinetics of ropinirole. Clin Pharmacokinet 2000; 39: 243–254.
- [6] Brefel C, Thalamas C, Rayet S, et al. Effect of food on the pharmacokinetics of ropinirole in parkinsonian patients. Br J Clin Pharmacol 1998; 45: 412–415.
- [7] Bloomer JC, Clarke SE, Chenery RJ. In vitro identification of the P450 enzymes responsible for the metabolism of ropinirole. Drug Metab Dispos 1997; 25: 840–844.
- [8] Beerahee A, Nichols AI, Aluri J, et al. Population pharmacokinetics of ropinirole in patients with Parkinson´s disease. Br J Clin Pharmacol 1997; 43: 556P–557P.
- [9] Beerahee A, Nichols AI, Aluri J, et al. Population pharmacokinetics of ropinirole in parkinsonian patients. Int Pharm Abstr 1996; 33: 21.
- [10] Rascol O, Brooks DJ, Korczyn AD, et al. A five-year study of the incidence of dyskinesia in patients with early Parkinson´s disease who were treated with ropinirole or levodopa. 056 Study Group. N Engl J Med 2000; 342: 1484–1491.
- [11] Whone AL, Watts RL, Stoessl AJ, et al. Slower progression of Parkinson´s disease with ropini role versus levodopa: The REAL-PET study. Ann Neurol 2003; 54: 93–101.
- [12] Trenkwalder C, Garcia-Borregeuro D, Montagna P, et al: Ropinirole in the treatment of restless legs syndrome: results from the TREAT RLS 1 study, a 12 week, randomised, placebo controlled study in 10 European countries. J Neurol Neurosurg Psychiatry 2004; 75: 92–97.
- [13] Horstink M, Tolosa E, Bonucelli U, et al. Review of the therapeutic management of Parkinson´s disease. Report of a joint task force of the European Federation of Neurological Societies and the Movement Disorder Society. Part I: early Parkinson´s disease. Eur J Neurol 2006; 13: 1170–1186.
- [14] Horstink M, Tolosa E, Bonucelli U, et al. Review of the therapeutic management of Parkinson´s disease. Report of a joint task force of the European Federation of Neurological Societies and the Movement Disorder Society. Part II: late (complicated) Parkinson´s disease. Eur J Neurol 2006; 1186–1202.
- [15] Pahwa R, Factor SA, Lyons KE, et al. Duality Standards Subcommittee of the American Academy of Neurology. Practice parameter: treatment of Parkinson´s disease with motor fluctuations and dyskinesia (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology 2006; 66: 983–995.
- [16] Voelker R: Parkinson´s disease guidelines aid, diagnosis, management. JAMA 2006; 295: 2126–2128.
- [17] Růžička E, Roth J, Kaňovský P: Parkinsonova nemoc a parkinsonské syndromy. Praha, Galén, 2001.
- [18] Korczyn AD, Talamas C, Adler CH. Dosing with ropinirole in a clinical setting. Acta Neurol Scand 2002; 106: 200–204
- [19] Radad K, Gille G, Rausch WD. Short review on dopamine agonists: insight into clinical and research studies relevant to Parkinson´s disease. Pharmacol Rep 2005; 57: 701–712.
- [20] Kaňovský P, Nestrašil I, Nevrlý M, Ressner P. Léčba počátečního stadia Parkinsonovy nemoci. Neurol pro praxi 2006; 7: 32–35.
- [21] Kaňovský P, Nestrašil I, Nevrlý M, Ressner P. Farmakoterapie pokročilé Parkinsonovy nemoci. Neurol pro praxi 2006;, 7: 16–18.
- [22] Peralta C, Wolf E, Alber H, et al. Valvular heart disease in Parkinson´s disease vs. controls: an echocardigraphic study. Mov Disord 2006; Apr 18 (Epub ahead of print).
- [23] Allen RP, Picchietti D, Hening WA, et al. Restless Legs Syndrome Diagnosis and Epidemiology workshop at the National Institutes of Health; International Restless Legs Syndrome Study Group. Restless legs syndrome: diagnostic criteria, special considerations, and epidemiology. A report from the restless legs syndrome diagnosis and epidemiology workshop at the National Institutes of Health. Sleep Med 2003; 4: 101–119.
- [24] Gamaldo ChE, Earley ChJ. Restless legs syndrome. A clinical update. Chest 2006; 130: 1596–1604.
- [25] Ryan M, Slevin JT, Wells A. Non-ergot dopamine agonist-induced sleep attacks. Pharmacotherapy 2000; 20: 724–726.
- [26] Fine J, Lang AE. Dose-induced penile erections in response to ropinirole therapy for Parkinson´s disease. Mov Disord 1999; 14: 701–702.
- [27] Product Information: Requip® (ropinirole), GlaxoSmithKline, May 2005 (PDR, 2006).
- [28] Souhrn údajů o přípravku: Requip® (ropinirol), GlaxoSmithKline, 2005 (AISLP, 2006/4).
- [29] Suchopár J (editor). Kompendium lékových interakcí Infopharm. Praha, Infopharm, 2005.
- [30] Wen AD, Jia YY, Luo XX, et al. The effect of Madopar on the pharmacokinetics of ropinirole in healthy Chinese volunteers. J Pharm Biomed Anal 2007; 43: 774–778. Epub 2006 Oct 19.
- [31] Im JH, Ha JH, Cho IS, Lee MC. Ropinirole as an adjunct to levodopa in the treatment of Parkinson´s disease: a 16-week bromocriptine controlled study. J Neurol 2003; 250: 90–96.
- [32] Lieberman A, Olanow CW, Sethi K, et al: A multicenter trial of ropinirole as adjunct treatment for Parkinson´s disease. Neurology 1998; 51: 1057–1062.
- [33] Thalamas C, Taylor A, Brefel-Courbon C, et al. Lack of pharmacokinetic interaction between ropinirole and theophylline in patients with Parkinson´s disease. Eur J Clin Pharmacol 1999; 55: 299–303.
- [34] Bair JD, Oppelt TF. Warfarin and ropinirole interaction. Ann Pharmacother 2001; 35: 1202–1204.
- [35] Stocchi F, Destée A. Co-administration of ropinirole and domperidone during rapid dose escalation of the dopamine agonist. Parkinsonism Relat Disord 1998; 4: 183–188.
- [36] de Mey C, Enterling D, Meineke I, et al. Interactions between domperidone and ropinirole, a novel dopamine D2 receptor agonist. Br J Clin Pharmacol 1991; 32: 483–488.