Sekukinumab
Souhrn:
Viktorová K, Suchý D. Sekukinumab. Remedia 2019; 29: 180–187.
Biologická léčba se v průběhu posledních let stala významnou modalitou systémové terapie, která prokazuje svoji dobrou účinnost zejména u aktivních a závažných forem onemocnění nereagujících na konvenční léčbu a významně zvyšuje kvalitu života nemocných. Sekukinumab představuje monoklonální protilátku cílící na interleukin 17. Tento cytokin hraje klíčovou roli v patogenezi ložiskové psoriázy, psoriatické artritidy a ankylozující spondylitidy a u nemocných byla doložena jeho zvýšená produkce. Inhibicí interleukinu 17 dochází k potlačení zánětu a autoimunitních procesů. Sdělení přinášejí přehled základních farmakologických charakteristik sekukinumabu, shrnutí účinnosti přípravku v uskutečněných klinických hodnoceních a pohled na bezpečnost léčby.
Summary:
Viktorova K, Suchy D. Secukinumab. Remedia 2019; 29: 180–187.
In recent years, biologic therapy has become an important part of systemic treatment that proves its beneficial efficacy mainly in active and severe forms of the disease that do not respond to conventional treatment and significantly improves the quality of life for patients. Secukinumab is a monoclonal antibody that targets interleukine 17. This cytokine plays an important role in the pathogenesis of psoriasis, psoriatic arthritis and ankylosing spndoylitis and its increased production has been documented in patients. Inhibiting interleukine 17 leads to the suppression of inflammation and autoimmune processes. This report reviews the basic pharmacological characteristics of secukinumab, summarizes the efficacy of the product in finished clinical trials and offers a view of its safety.
Key words: secukinumab, interleukin 17, psoriasis, psoriatic arthritis, ankylosing spondylitis.
Farmakologická skupina
Sekukinumab je řazen do skupiny Imunosupresiva, Inhibitory interleukinu, ATC kód L04AC10. Představuje terapeutickou monoklonální protilátku ovlivňující signalizaci.
Mechanismus účinku, farmakodynamický efekt
Sekukinumab je plně humánní
monoklonální protilátka IgG1/κ, která se selektivně
váže na interleukin 17A (IL 17A) a inhibuje jeho
interakci s receptorem pro IL 17 a následné pochody
(obr. 1).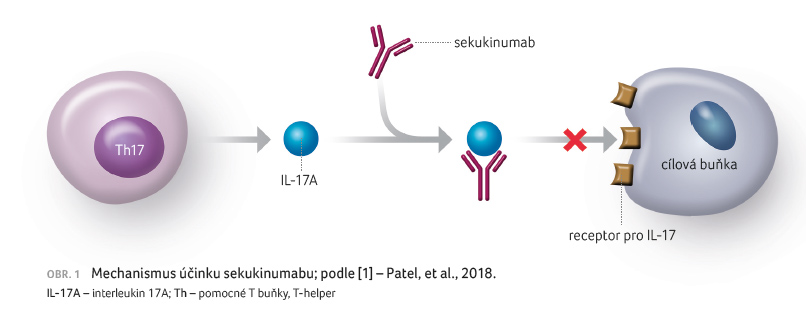 Interleukin
17A je přirozeně se vyskytující cytokin, který se normálně
účastní zánětlivé odpovědi, hraje klíčovou roli v patogenezi
ložiskové psoriázy, psoriatické artritidy a ankylozující
spondylitidy, u nemocných s těmito onemocněními byla
doložena jeho zvýšená produkce [1,2]. Receptory pro IL 17
jsou exprimovány na keratinocytech, endoteliálních buňkách,
chondrocytech a osteoblastech. Inhibicí jeho působení je
blokována produkce dalších prozánětlivých cytokinů, mediátorů
tkáňového poškození a chemokinů, které se podílejí
na patologických zánětlivých a autoimunitních dějích
(obr. 2).
Interleukin
17A je přirozeně se vyskytující cytokin, který se normálně
účastní zánětlivé odpovědi, hraje klíčovou roli v patogenezi
ložiskové psoriázy, psoriatické artritidy a ankylozující
spondylitidy, u nemocných s těmito onemocněními byla
doložena jeho zvýšená produkce [1,2]. Receptory pro IL 17
jsou exprimovány na keratinocytech, endoteliálních buňkách,
chondrocytech a osteoblastech. Inhibicí jeho působení je
blokována produkce dalších prozánětlivých cytokinů, mediátorů
tkáňového poškození a chemokinů, které se podílejí
na patologických zánětlivých a autoimunitních dějích
(obr. 2).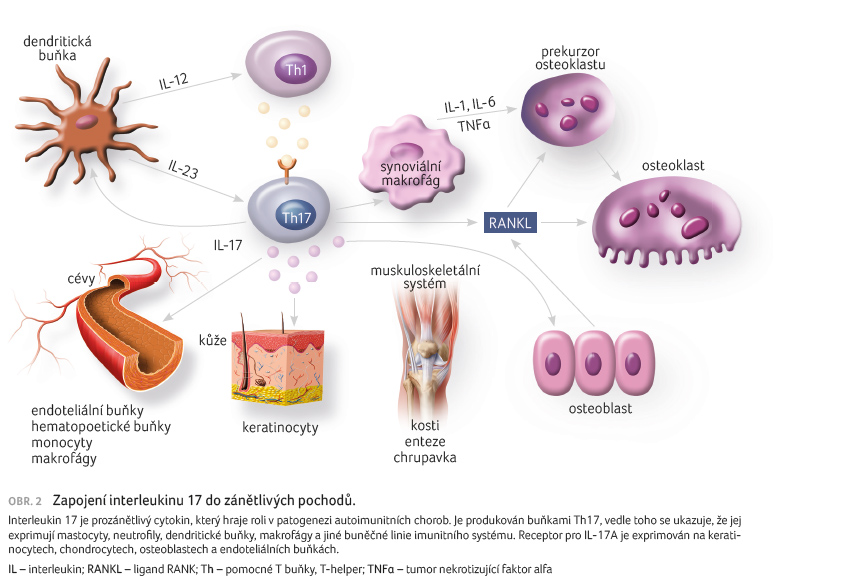
Farmakokinetické vlastnosti
Biologická dostupnost sekukinumabu po subkutánním podání se odhaduje na 73 % [3,4]. Po jednorázovém subkutánním podání dávky 150 mg nebo 300 mg bylo vrcholových koncentrací v séru dosaženo za pět a šest dní. Při měsíčním dávkovacím schématu byly zaznamenány dvojnásobné vrcholové koncentrace, rovnovážného stavu bylo dosaženo po 20 týdnech. Sekukinumab se jen omezeně distribuuje do periferních kompartmentů (distribuční objem se pohybuje v rozmezí 7,1–8,6 l). Podobně jako endogenní imunoglobuliny je sekukinumab metabolizován prostřednictvím intracelulárního katabolismu na malé peptidy a aminokyseliny. Zdá se, že metabolismus a exkrece sekukinumabu nejsou ovlivněny věkem ani zhoršenou funkcí jater a ledvin. Střední eliminační poločas se pohybuje kolem 27 dnů, clearance léčiva je závislá na dávce a času, ale neovlivňují ji pohlaví, rasa ani závažnost onemocnění.
Indikace
Sekukinumab je indikován:
- k léčbě středně těžké až těžké ložiskové psoriázy dospělých, kteří jsou kandidáty pro systémovou léčbu;
- samotný nebo v kombinaci s metotrexátem k léčbě aktivní psoriatické artritidy u dospělých pacientů, u nichž se nedostavila adekvátní odpověď na předchozí léčbu chorobu modifikujícími antirevmatiky (DMARD);
- k léčbě aktivní ankylozující spondylitidy u dospělých, kteří nedostatečně reagovali na konvenční léčbu.
Dávkování
Sekukinumab je podáván ve formě subkutánní injekce iniciálně v týdnech 0, 1, 2, 3 a 4 a dále v intervalu jeden měsíc v dávce udržovací. V případě ložiskové psoriázy je indikována dávka 300 mg (dávka 300 mg je vždy podána ve dvou dílčích 150mg subkutánních injekcích). Pro ankylozující spondylitidu je doporučena dávka 150 mg. U psoriatické artritidy je indikována dávka 150 mg, na základě klinické odpovědi může být zvýšena na 300 mg. U pacientů trpících zároveň středně těžkou až těžkou ložiskovou psoriázou nebo u nemocných nereagujících na léčbu anti TNFα je doporučena aplikace 300 mg sekukinumabu.
Klinická odpověď se obvykle dostaví do 16 týdnů, při částečné odpovědi je při dalším pokračování léčby možné očekávat ještě další zlepšení.
U pacientů ve věku 65 let a více není potřeba úprava dávkování. U pediatrických pacientů nejsou k dispozici data týkající se dávkování, přípravek je určen dospělým pacientům. U nemocných se zhoršenou funkcí jater nebo ledvin nelze učinit žádná doporučení ohledně dávkování, přípravek u těchto populací nebyl zkoumán.
Klinické zkušenosti
Vzhledem k obsáhlosti klinického hodnocení uvádíme stručné shrnutí hlavních výsledků studií, pro detailnější studium odkazujeme na uvedenou literaturu.
Ložisková psoriáza
Bezpečnost a účinnost sekukinumabu v léčbě plakové psoriázy hodnotily čtyři randomizované, dvojitě zaslepené studie fáze III kontrolované placebem. Hodnocenými byli nemocní se středně závažnou až závažnou ložiskovou psoriázou, kteří byli kandidáty pro fototerapii nebo systémovou léčbu.
V klinických studiích ERASURE (n = 738) a FIXTURE (n = 1 306) [5] byla hodnocena léčba sekukinumabem v dávce 300 mg nebo 150 mg (podávané jednou týdně do pátého týdne, dále jednou za čtyři týdny) oproti placebu a ve studii FIXTURE také oproti etanerceptu (50 mg dvakrát týdně po dobu 12 týdnů, dále jednou týdně). Sledováno bylo dosažení odpovědi PASI 75 a více (75% a větší zlepšení ve skóre Psoriasis Area Severity Index) v týdnu 12. Ve studii ERASURE představoval v jednotlivých ramenech podíl hodnocených, kteří dosáhli odpovědi PASI 75, 81,6 % (300 mg sekukinumabu), 71,6 % (150 mg sekukinumabu) a 4,5 % (placebo); ve studii FIXTURE 77,1 % (300 mg sekukinumabu), 67,0 % (150 mg sekukinumabu), 44,0 % (etanercept) a 4,9 % (placebo), p < 0,001.
Klinické hodnocení FEATURE testovalo subkutánní podání sekukinumabu (300 mg nebo 150 mg) v předplněné stříkačce oproti placebu. Primární cílové ukazatele (PASI 75 a více) potvrdily účinnost sekukinumabu a aplikace pomocí předplněné stříkačky se ukázala jako velmi přínosná, pozitivně vnímaná a bezpečná forma podání léčiva [6].
Ve studii JUNCTURE byli pacienti rozděleni podobně jako v předchozí studii, hodnocení sledovalo vedle účinnosti a bezpečnosti sekukinumabu podávání léčiva pomocí autoinjektoru (pera). Studie opět potvrdila superioritu aktivní léčby oproti placebu (PASI 75 v týdnu 12 pro dávku 300 mg sekukinumabu 86,7 %, 71,7 % pro dávku 150 mg a 3,3 % pro placebo, p < 0,0001). Aplikace pomocí pera byla nemocnými přijímána pozitivně [7].
Psoriatická artritida
Účinnost a bezpečnost sekukinumabu v léčbě psoriatické artritidy sledoval program klinických studií FUTURE. Jednalo se o dvojitě zaslepené, placebem kontrolované studie fáze III hodnotící pacienty s aktivním onemocněním i navzdory léčbě nesteroidními antiflogistiky (NSA), kortikoidy nebo antirevmatiky modifikujícími chorobu (DMARD).
Ve studii FUTURE 1 bylo celkem 606 pacientů s aktivním onemocněním randomizováno v poměru 1 : 1 : 1 k léčbě sekukinumabem v dávce 150 mg podávaných subkutánně každé čtyři týdny (od týdne 8), k léčbě dávkou 75 mg nebo k podávání placeba [8]. Primárním cílovým ukazatelem bylo 20% zlepšení dle kritérií American College of Rheumatology (ACR 20), kterého dosáhl ve skupině se sekukinumabem výrazně vyšší podíl nemocných (50 % při dávce 150 mg a 50,5 % při dávce 75 mg) než v placebové skupině (17,3 %, p < 0,001).
Pacienti léčení sekukinumabem vykazovali významně menší radiografickou progresi od výchozích hodnot do 24. týdne léčby než pacienti užívající placebo. Radiografická progrese je u pacientů s aktivní psoriatickou artritidou po 52. týdnech léčby sekukinumabem inhibována [9].
Extenze studie [10], do které vstoupilo 460 pacientů, dokládá, že i po třech letech léčby poskytuje subkutánní podávání sekukinumabu trvalé zmírnění příznaků, zlepšení kvality života a fyzických funkcí. Během tří let sledování došlo jen k mírné radiografické progresi.
V klinickém hodnocení FUTURE 2 bylo 397 nemocných randomizováno v poměru 1 : 1 : 1 : 1 k léčbě sekukinumabem 300 mg, 150 mg a 75 mg nebo k podávání placeba [11]. Studijní medikace byla podávána do 4. týdne jednou týdně, dále pak každé čtyři týdny. Výrazně vyšší podíl pacientů, kteří dostávali sekukinumab v dávce 300 mg a 150 mg, dosáhl v týdnu 24 odpovědi ACR 20 (54 % a 51 %) oproti dávce 75 mg (29 %) a placebu (15 %).
Jak dávka 150 mg, tak 300 mg navodily klinicky relevantní účinnost i u skupiny pacientů nedostatečně reagujících na léčbu inhibitory TNF. Post hoc analýzy prokázaly zlepšení v míře odpovědi dle ACR u sekukinumabu oproti placebu ve 24. týdnu bez ohledu na souběžné podávání metotrexátu [11].
Klinická studie FUTURE 3 sledovala podávání sekukinumabu pomocí autoinjektoru [12]. Celkem 414 nemocných bylo randomizováno v poměru 1 : 1 : 1 k subkutánnímu podávání sekukinumabu v dávce 300 mg, 150 mg nebo k podávání placeba. Sekukinumab opět potvrdil výrazné zlepšení v dosažení parametru ACR 20 v týdnu 24 (48,2 %, 42 %, 16,1 %; p < 0,0001) a setrvalou odpověď v týdnu 54. S aplikací pomocí autoinjektoru bylo dle Self Injection Assessment Questionnaire spokojeno nebo velmi spokojeno více než 93 % sledovaných.
Studie FUTURE 4 porovnávala pacienty randomizované do ramene s léčbou sekukinumabem v dávce 150 mg s úvodní dávkou (loading dose), do ramene s dávkou 150 mg bez loading dose a do placebové větve. V týdnu 16 dosáhlo skóre ACR 20 42,2 %, 39,8 % a 18,4 % hodnocených (dle pořadí skupin), v týdnu 52 dosáhlo ukazatele ACR 20 celkem 60,5 % nemocných léčených sekukinumabem s úvodní dávkou a 57,5 % bez úvodní dávky [13].
Ve studii FUTURE 5 bylo randomizováno 996 pacientů k léčbě sekukinumabem v dávce 300 mg nebo 150 mg s úvodní dávkou (loading dose) nebo k terapii 150 mg bez loading dose nebo k podávání placeba [13]. Odpovědi ACR 20 dosáhlo v týdnu 16 výrazně více pacientů s aktivní léčbou (62,6 %, 55,5 %, 59,5 %) než ve větvi s placebem (27,4 %).
Radiografická progrese měřená celkovým Sharpovým skóre, modifikace dle van der Heijdové, byla ve 24. týdnu léčby výrazně inhibována ve všech ramenech se sekukinumabem v porovnání s placebem (p < 0,01 pro 300 mg s úvodní dávkou a 150 mg bez úvodní dávky a p < 0,05 pro 150 mg s úvodní dávkou) [14].
Ankylozující spondylitida
Bezpečnost a účinnost sekukinumabu v léčbě ankylozující spondylitidy potvrdily ve třetí fázi klinického hodnocení studie MEASURE. Ve studii MEASURE 1 bylo 371 pacientů randomizováno k podávání sekukinumabu nebo placeba. Aktivní léčba byla zahájena intravenózním podáním dávky 10 mg/kg v týdnu 0, 2 a 4 a dále byli nemocní sledováni ve dvou větvích, s dávkou sekukinumabu 150 mg nebo 75 mg subkutánně každé čtyři týdny [15]. Primární cílový ukazatel ASAS 20 (20% zlepšení dle kritérií Assessment of Spondyloarthritis International Society) v týdnu 16 potvrdil superioritu sekukinumabu (61 %, 60 % a 29 % pro sekukinumab 150 mg, 75 mg a placebo).
Ve studii MEASURE 2 bylo 219 pacientů randomizováno k léčbě sekukinumabem podávaným v dávce 150 mg nebo 75 mg v týdny 1, 2, 3 a 4 a dále každé čtyři týdny nebo k podávání placeba. Podíl odpovědí ASAS 20 činil 61 %, 41 % a 28 % [15]. Signifikantní zlepšení přetrvávalo v průběhu 52 týdnů. Tříletá data ze studie MEASURE 2 dokládají, že vysoký podíl odpovědi ASAS 20/40 přetrvával i v týdnu 156 (70,1 %/60,9 % pro dávku 150 mg v porovnání se 74,2 %/57,0 % v týdnu 52; pro dávku 75 mg pak lehký pokles 54,3 %/37,0 % oproti 62,5 %/43,2 % v týdnu 52) [16].
Klinická studie MEASURE 3 randomizovala 226 nemocných s aktivní ankylozující spondylitidou do větví s léčbou sekukinumabem v dávce 300 mg nebo 150 mg (zahájeno vždy intravenózním podáním sekukinumabu 10 mg/kg v týdnech 0, 2 a 4) nebo do placebové větve. Primárního cílového ukazatele ASAS 20 bylo v týdnu 16 dosaženo (60,5 %, 58,1 % a 36,8 %) a následná analýza v týdnu 52 doložila setrvalou účinnost [17].
Nežádoucí účinky
Bezpečnost léčby sekukinumabem byla hodnocena v rámci klinického hodnocení pro různé indikace. Léčeno bylo celkem 11 900 pacientů, více než 7 100 nemocných bylo léčeno nejméně jeden rok [2]. Nejčastěji hlášenými nežádoucími účinky byly infekce horních cest dýchacích (nejčastěji nazofaryngitida, rinitida), vzrostl výskyt mukózních a kožních kandidóz. Většina reakcí byla mírná nebo středně závažná, reagovala na standardní léčbu a nevyžadovala přerušení léčby.
Bezpečnostní profil pacientů
léčených sekukinumabem u ankylozující spondylitidy
i psoriatické artritidy byl v souladu s bezpečnostním
profilem u psoriázy [2]. Přehled nežádoucích účinků
z klinického hodnocení fáze III i postmarketingového
sledování přibližuje tabulka 1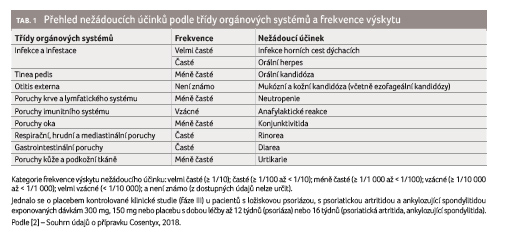 .
.
Kontraindikace
Léčba sekukinumabem je kontraindikována při klinicky významné aktivní infekci a při těžké reakci z přecitlivělosti.
Infekce a další opatření
Sekukinumab má potenciál zvyšovat výskyt infekcí. V případě anamnézy opakovaných infekcí nebo u pacientů s chronickou infekcí je potřeba opatrnosti. V klinických studiích nebyla hlášena zvýšená citlivost vůči tuberkulóze.
U aktivní tuberkulózy se léčba sekukinumabem nesmí podávat. V případě latentní infekce je třeba před zahájením terapie sekukinumabem zvážit antituberkulózní léčbu [2]. Pečlivá monitorace a opatrnost jsou potřeba u nemocných se zánětlivými onemocněními střev. V nejnovější rozsáhlé analýze bezpečnosti u 7 355 pacientů z 21 klinických studií z roku 2019 se případy zánětlivých onemocnění střev při léčbě sekukinumabem vyskytovaly jen neobvykle. Pozorované EAIR (incidence adjustovaná dle expozice) pro tato onemocnění se při léčbě sekukinumabem nezvyšovaly s časem [18].
Dostupná data naznačují, že sekukinumab u chřipkové nebo meningokokové vakcíny nepotlačuje látkovou imunitní odpověď a je možné absolvovat současné očkování inaktivovanými nebo neživými vakcínami. Živé vakcíny ale nesmějí být podávány současně s léčbou sekukinumabem.
Těhotenství a kojení
Léčba sekukinumabem se v těhotenství z preventivních důvodů nedoporučuje. Ženy ve fertilním věku by měly po dobu léčby a alespoň 20 týdnů po ní používat účinnou kontracepci.
Imunoglobuliny se do mateřského mléka vylučují. Zda je sekukinumab vylučován do mateřského mléka, není známo. Ohledně kojení se doporučuje zvážit jeho možná rizika pro dítě a přínos léčby pro matku. Následně přerušit kojení, nebo léčbu sekukinumabem [2].
Redakčně zpracovala PharmDr. Kateřina Viktorová
Seznam použité literatury
- [1] Patel DD, Lee DM, Kolbinger F, Antoni Ch. Effect of IL‑17A blockade with secukinumab in autoimmune diseases. Ann Rheum Dis 2018; 72(Suppl 2): iii116–iii123.
- [2] Souhrn údajů o přípravku Cosentyx. Dostupné na www.sukl.cz. Navštíveno 26. 2. 2019.
- [3] Bruin G, Loesche C, Nyirady J, Sander O. Population Pharmacokinetic Modeling of Secukinumab in Patients With Moderate to Severe Psoriasis. J Clin Pharmacol 2017; 57: 876–885.
- [4] Frieder J, Kivelevitch D, Menter A. Secukinumab: a review of the anti‑IL‑17A biologic for the treatment of psoriasis. Ther Adv Chronic Dis 2018; 9: 5–21.
- [5] Langley RG, Elewski BE, Lebwohl M, et al. Secukinumab in Plaque Psoriasis – Results of Two Phase 3 Trials. N Engl J Med 2014; 371: 326−338.
- [6] Blauvelt A, Prinz JC, Gottlieb AB, et al. Secukinumab administration by pre‑filled syringe: efficacy, safety and usability results from a randomized controlled trial in psoriasis (FEATURE). Br J Dermatol 2015; 172: 484−493.
- [7] Paul C, Lacour JP, Tedremets L, et al. Efficacy, safety and usability of secukinumab administration by autoinjector/pen in psoriasis: a randomized, controlled trial (JUNCTURE). J Eur Acad Dermatol Venereol 2015; 29: 1082−1090.
- [8] Mease PJ, McInnes IB, Kirgham B, et al. Secukinumab Inhibition of Interleukin‑17A in Patients with Psoriatic Arthritis. N Engl J Med 2015; 373: 1329–1339.
- [9] van der Heijde D, Landewé RB, Mease PJ, et al. Brief Report: Secukinumab Provides Significant and Sustained Inhibition of Joint Structural Damage in a Phase III Study of Active Psoriatic Arthritis. Arthritis Rheumatol 2016; 68: 1914−1921.
- [10] Mease PJ, Kavanaugh A, Reimold A, et al. Secukinumab in the treatment of psoriatic arthritis: efficacy and safety results through 3 years from the year 1 extension of the randomised phase III FUTURE 1 trial. RMD Open 2018; 4: e000723.
- [11] McInnes IB, Mease PJ, Kirkham B, et al. Secukinumab, a human anti‑interleukin‑17A monoclonal antibody, in patients with psoriatic arthritis (FUTURE 2): a randomised, double‑blind, placebo‑controlled, phase 3 trial. Lancet 2015; 386: 1137–1146.
- [12] Nash P, Mease PJ, McInnes IB, et al. Efficacy and safety of secukinumab administration by autoinjector in patients with psoriatic arthritis: results from a randomized, placebo‑controlled trial (FUTURE 3). Arthritis Res Ther 2018; 20: 47.
- [13] Garcia‑Montoya L, Marzo‑Ortega H. The role of secukinumab in the treatment of psoriatic arthritis and ankylosing spondylitis. Ther Adv Musculoskelet Dis 2018; 10: 169–180.
- [14] Mease P, van der Heijde D, Landewé R, et al. Secukinumab improves active psoriatic arthritis symptoms and inhibits radiographic progression: primary results from the randomised, double‑blind, phase III FUTURE 5 study. Ann Rheum Dis 2018; 77: 890−897.
- [15] Baeten D, Sieper J, Braun J, et al. Secukinumab, an Interleukin‑17A Inhibitor, in Ankylosing Spondylitis. N Engl J Med 2015; 373: 2534−2548.
- [16] Marzo‑Ortega H, Sieper J, Kivitz A, et al. Secukinumab provides sustained improvements in the signs and symptoms of active ankylosing spondylitis with high retention rate: 3‑year results from the phase III trial, MEASURE 2. RMD Open 2017; 3: e000592.
- [17] Pavelka K, Kivitz A, Dokoupilova E, et al. Efficacy, safety, and tolerability of secukinumab in patients with active ankylosing spondylitis: a randomized, double‑blind phase 3 study, MEASURE 3. Arthritis Res Ther 2017; 19: 285.
- [18] Schreiber S, Colombel JF, Feagan BG, et al. Incidence rates of inflammatory bowel disease in patients with psoriasis, psoriatic arthritis and ankylosing spondylitis treated with secukinumab: a retrospective analysis of pooled data from 21 clinical trials. Ann Rheum Dis 2019; 78: 473−479.