Sitagliptin/metformin – fixní kombinace
Zásadním úkolem péče o pacienta s diabetem je dosažení adekvátní kompenzace onemocnění a její dlouhodobé udržení. Z klinické praxe je známo, že k dosažení tohoto cíle je v řadě případů nutné zvolit kombinační terapii perorálními antidiabetiky. Novinkou v této oblasti je fixní kombinace inhibitoru dipeptidyl peptidázy 4 a biguanidu – sitagliptin/metformin. Kombinace je indikována u pacientů s diabetem 2. typu, kteří nebyli odpovídajícím způsobem kompenzováni 1) při podávání maximální tolerované dávky metforminu a 2) při podávání maximální tolerované dávky metforminu a derivátu sulfonylurey. V dosud provedených klinických studiích bylo prokázáno, že kombinace sitagliptinu a metforminu je podobně účinná ve snižování HbA1c jako ostatní léčebné alternativy a její podávání není spojeno se zvýšením rizika hypoglykémií a se vzestupem hmotnosti léčených osob. Kombinace má rovněž nízký potenciál interakcí s ostatními léčivy. Fixní kombinace je k dispozici v silách s 50 mg sitagliptinu a s 850 mg metforminu nebo s 1000 mg metforminu. Tablety je nutno podávat dvakrát denně spolu s jídlem, aby se omezily nežádoucí gastrointestinální účinky.
Úvod
Epidemiologické analýzy posledních desetiletí prokázaly vztah hyperglykémie ke zvýšení rizika vzniku mikrovaskulárních a makrovaskulárních komplikací u nemocných s diabetem [1, 2]. Tyto epidemiologické výsledky byly nedávno dále doplněny rovněž daty z intervenčních studií, která podporují strategii zahájení intenzivní léčby diabetu co nejdříve po zjištění onemocnění, protože v této době je intenzivní léčba spojena s největším ochranným účinkem před vznikem vaskulárních příhod [3, 4]. Časné dosažení adekvátní kompenzace diabetu a její další udržení je tedy klíčovým úkolem péče o nemocného s diabetem. Na základě dosažených léčebných výsledků ve studiích se stal metformin lékem doporučeným pro léčbu diabetu 2. typu již od doby diagnózy tohoto onemocnění nezávisle na hmotnosti u osob, které nemají kontraindikaci [5]. Je ovšem dobře známým faktem, že kompenzace nemocných s diabetem 2. typu se postupně zhoršuje (zpravidla v průběhu několika let po zahájení léčby perorálními antidiabetiky) a stav vyžaduje doplnění dalšího preparátu, tedy kombinační terapii [6]. Tento fenomén je zapříčiněn především progresivním charakterem dysfunkce b -buňky pankreatu. Patofyziologie diabetu 2. typu má ovšem komplexní charakter a efekt léčby se odvíjí od současné intervence několika mechanismů, které se podílejí na rozvoji choroby. Potvrzují to rovněž zkušenosti z klinické praxe, kdy řada nemocných s diabetem 2. typu vyžaduje kombinační terapii perorálními antidiabetiky i relativně časně po zjištění diagnózy.
Farmakologická skupina
Fixní kombinace perorálních antidiabetik, fosfát sitagliptinu, což je inhibitor dipeptidyl peptidázy 4 (DPP-4), a hydrochlorid metforminu, který patří do třídy biguanidů. ATC kód: A10BD07.
Mechanismus účinku a farmakodynamika
Farmakodynamika metforminu
Základním antihyperglykemickým mechanismem účinku metforminu je zvýšení inzulinové senzitivity zejména v játrech a ve svalu, které vede ke snížení výdeje glukózy játry a ke zlepšení vychytávání glukózy ve svalové tkáni, viz obr. 1 . Důležitým doplňkovým mechanismem je i zvýšení metabolismu glukózy ve splanchnické oblasti. 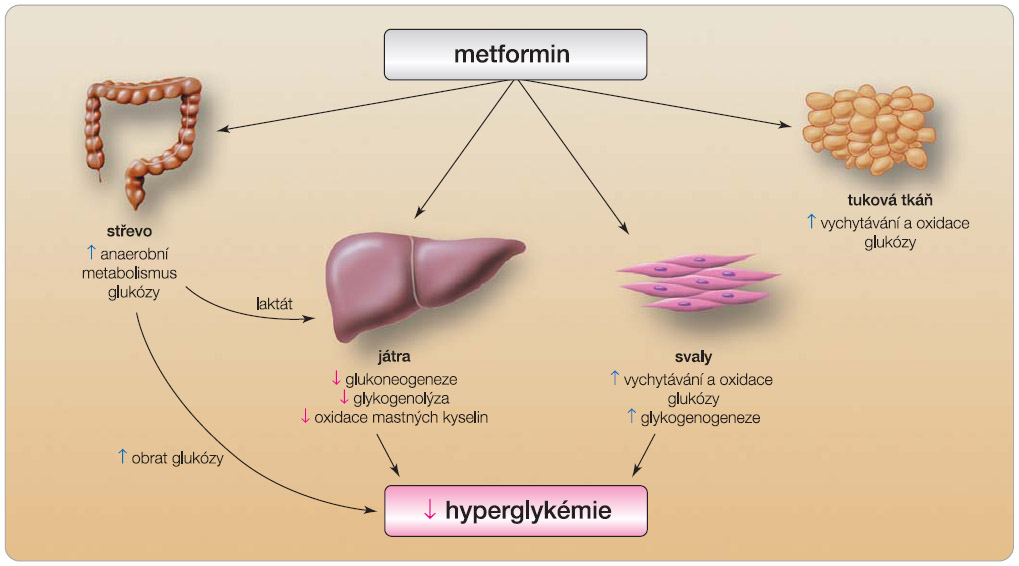 Metformin přispívá dále ke zlepšení metabolismu glukózy tím, že za stavu inzulinové rezistence snižuje hladiny volných mastných kyselin. Na rozdíl od derivátů sulfonylurey (SU) a meglitinidů metformin nezvyšuje sekreci inzulinu z b -buňky. I když přesný molekulární mechanismus, kterým metformin zvyšuje účinek inzulinu, není zcela detailně znám, výsledky výzkumů svědčí pro působení metforminu prostřednictvím zvýšení aktivity AMP-kinázy, a dále se předpokládá účinek na změnu fyzikálně-chemických vlastností plazmatických membrán [7]. Léčba metforminem je spojena s mírnou úpravou lipidogramu charakterizovanou poklesem hladiny celkového cholesterolu, LDL cholesterolu a triglyceridů. Hladina HDL cholesterolu není metforminem ovlivněna. I když jsou tyto účinky užitečným doplněním léčebného profilu metforminu, přesto jejich velikost nevysvětluje kardiovaskulární přínos léčby, jaký byl demonstrován ve studii UKPDS [3, 8].
Metformin přispívá dále ke zlepšení metabolismu glukózy tím, že za stavu inzulinové rezistence snižuje hladiny volných mastných kyselin. Na rozdíl od derivátů sulfonylurey (SU) a meglitinidů metformin nezvyšuje sekreci inzulinu z b -buňky. I když přesný molekulární mechanismus, kterým metformin zvyšuje účinek inzulinu, není zcela detailně znám, výsledky výzkumů svědčí pro působení metforminu prostřednictvím zvýšení aktivity AMP-kinázy, a dále se předpokládá účinek na změnu fyzikálně-chemických vlastností plazmatických membrán [7]. Léčba metforminem je spojena s mírnou úpravou lipidogramu charakterizovanou poklesem hladiny celkového cholesterolu, LDL cholesterolu a triglyceridů. Hladina HDL cholesterolu není metforminem ovlivněna. I když jsou tyto účinky užitečným doplněním léčebného profilu metforminu, přesto jejich velikost nevysvětluje kardiovaskulární přínos léčby, jaký byl demonstrován ve studii UKPDS [3, 8].
Farmakodynamika sitagliptinu
Primárním regulačním mechanismem syntézy a sekrece inzulinu v b -buňce pankreatu je koncentrace okolní glukózy. Proces syntézy a sekrece inzulinu je ovšem modulován peptidovými hormony vylučovanými z endokrinních buněk gastrointestinálního traktu v návaznosti na požití stravy, které nazýváme inkretiny. Z hlediska kvantity účinku jsou nejvýznamnějšími inkretiny glukagonu podobný peptid 1 (GLP-1) a na glukóze závislý inzulinotropní peptid (GIP) [9, 10].
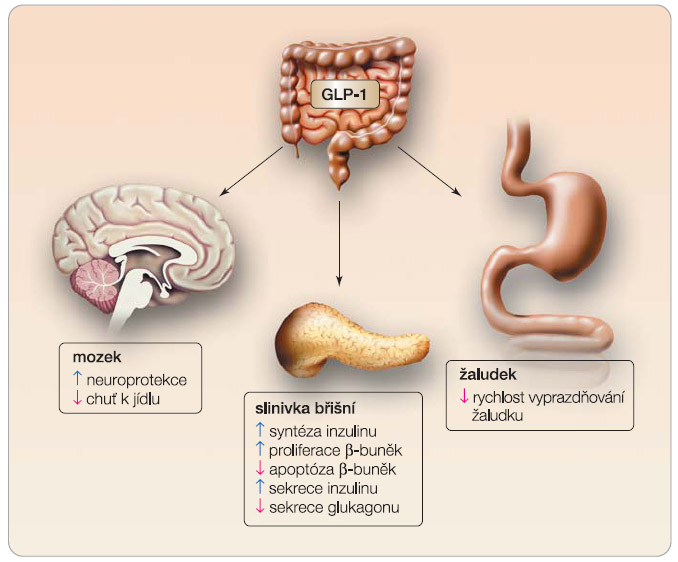 GLP-1 v β -buňkách pankreatu působí zvýšení glukózou stimulované inzulinové sekrece [11]. GLP-1 působí nejen na sekreci inzulinu, ale navíc zvyšuje transkripci genu pro inzulin, stabilitu mRNA a biosyntézu inzulinu, čímž zajišťuje doplňování inzulinu do granulí a brání vyčerpání rezerv inzulinu intracelulárně [12, 13]. Dále GLP-1 inhibuje sekreci glukagonu a naopak stimuluje sekreci somatostatinu. I bazální hladiny GLP-1 jsou významným regulátorem hladin glukózy nalačno, protože i velmi nízké hladiny GLP-1 inhibují sekreci glukagonu z a -buněk. Důležitou skutečností dále je, že inzulinotropní i glukagonostatický efekt GLP-1 jsou závislé na hladině glukózy [14]. Pokud dojde k poklesu hladin glukózy, GLP-1 již dále nestimuluje sekreci inzulinu ani neinhibuje sekreci glukagonu, což výrazně redukuje riziko vzniku hypoglykémie. GLP-1 dále inhibuje sekreci HCl v žaludeční sliznici a vyprazdňování žaludku a je potvrzen i inhibiční vliv GLP-1 na příjem potravy [15–18], viz obr. 2 .
GLP-1 v β -buňkách pankreatu působí zvýšení glukózou stimulované inzulinové sekrece [11]. GLP-1 působí nejen na sekreci inzulinu, ale navíc zvyšuje transkripci genu pro inzulin, stabilitu mRNA a biosyntézu inzulinu, čímž zajišťuje doplňování inzulinu do granulí a brání vyčerpání rezerv inzulinu intracelulárně [12, 13]. Dále GLP-1 inhibuje sekreci glukagonu a naopak stimuluje sekreci somatostatinu. I bazální hladiny GLP-1 jsou významným regulátorem hladin glukózy nalačno, protože i velmi nízké hladiny GLP-1 inhibují sekreci glukagonu z a -buněk. Důležitou skutečností dále je, že inzulinotropní i glukagonostatický efekt GLP-1 jsou závislé na hladině glukózy [14]. Pokud dojde k poklesu hladin glukózy, GLP-1 již dále nestimuluje sekreci inzulinu ani neinhibuje sekreci glukagonu, což výrazně redukuje riziko vzniku hypoglykémie. GLP-1 dále inhibuje sekreci HCl v žaludeční sliznici a vyprazdňování žaludku a je potvrzen i inhibiční vliv GLP-1 na příjem potravy [15–18], viz obr. 2 .
Farmakokinetické vlastnosti
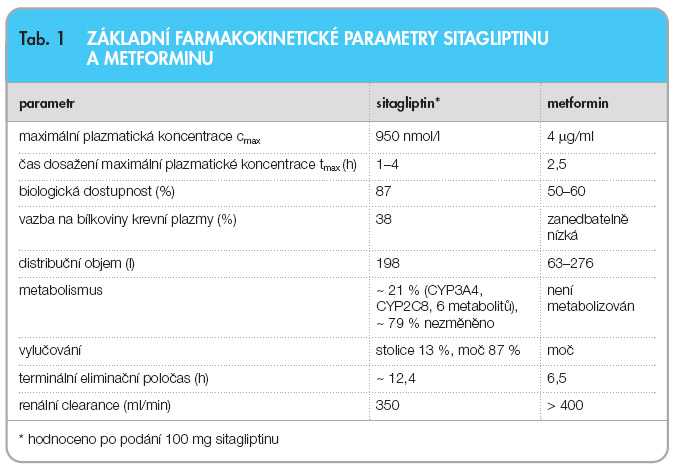 Bioekvivalenční studie na zdravých dobrovolnících ukázala, že podávání kombinovaných tablet, které obsahují sitagliptin/hydrochlorid metforminu, je bioekvivalentní současnému podávání fosfátu sitagliptinu a hydrochloridu metforminu v podobě jednotlivých tablet. Základní farmakokinetické parametry obou účinných látek jsou shrnuty v tab. 1 .
Bioekvivalenční studie na zdravých dobrovolnících ukázala, že podávání kombinovaných tablet, které obsahují sitagliptin/hydrochlorid metforminu, je bioekvivalentní současnému podávání fosfátu sitagliptinu a hydrochloridu metforminu v podobě jednotlivých tablet. Základní farmakokinetické parametry obou účinných látek jsou shrnuty v tab. 1 .
Sitagliptin
Sitagliptin je kompetitivní, reverzibilní a vysoce selektivní inhibitor DPP-4 (IC 50 = 17 nmol/l, Ki = 9 nmol/l), ale v klinicky relevantních dávkách neinhibuje příbuzné peptidázy DPP-8 a DPP-9 (IC 50 > 50 µ mol). Vysoká selektivita je velmi důležitá, protože látky, které působí inhibici DPP neselektivně, vykazují vysokou míru toxicity právě prostřednictvím blokády DPP-8 a DPP-9. Farmakokinetika sitagliptinu byla studována po podání jednotlivé dávky u zdravých osob i u nemocných s diabetem 2. typu. Sitagliptin podaný v dávce 100 mg per os je rychle absorbován s vrcholovými plazmatickými koncentracemi (medián t max ) v odstupu jedné až čtyř hodin po podání. Po podání této dávky byla maximální koncentrace c max 950 nmol/l a intraindividuální i interindividuální koeficienty variace AUC sitagliptinu byly nízké (5,8 % a 15,1 %). Farmakokinetika sitagliptinu je obecně velmi podobná u zdravých osob i u nemocných s DM 2. typu.
Sitagliptin má po podání per os vysokou biologickou dostupnost (cca 87 %), která není ovlivněna příjmem potravy. Zhruba 79 % sitagliptinu je z těla odstraněno ledvinami v nezměněné formě. Jen malá část sitagliptinu podléhá metabolismu prostřednictvím izoenzymu CYP3A4 s přispěním CYP2C8. Bylo detekováno celkově 6 metabolitů ve stopových množstvích a předpokládá se, že tyto metabolity nepůsobí inhibičně na DPP-4 [19]. Sitagliptin se vylučuje převážně ledvinami, a to aktivní tubulární sekrecí. Renální clearance je přibližně 350 ml/min. Sitagliptin je substrátem lidského organického aniontového transportéru 3 (human organic aniont transporter-3, hOAT-3). Zdánlivý terminální poločas t 1/2 po perorální dávce 100 mg sitagliptinu je přibližně 12,4 hodiny a v doporučeném dávkování se sitagliptin i při opakovaném podání hromadí pouze minimálně.
Farmakokinetika sitagliptinu byla také posuzována u osob s různým stupněm renální nedostatečnosti a srovnávána se zdravými osobami jako s kontrolní skupinou. Při clearance kreatininu 50 ml/min až < 80 ml/ min, tj. u osob s mírnou renální insuficiencí, bylo patrné zvýšení AUC sitagliptinu v rozsahu 1,1–1,6násobku hodnot u zdravých osob. Dávkování sitagliptinu tedy u osob s mírnou renální insuficiencí nemusí být redukováno. U osob se střední (clearance kreatininu 30 ml/min až < 50 ml/min) či s těžkou renální insuficiencí (clearance kreatininu < 30 ml/min) jsou plazmatické AUC sitagliptinu 2 – 4násobné ve srovnání se zdravými osobami, proto by u osob se střední a těžkou renální insuficiencí byla nutná korekce dávek sitagliptinu.
V případě jaterní insuficience byl sitagliptin podáván osobám s mírnou až středně těžkou poruchou jaterní funkce (Childovo-Pughovo skóre ≤ 9). Farmakokinetické parametry sitagliptinu u těchto osob umožňují podávat tento preparát bez úpravy dávkování, tedy stejně jako u zdravé populace. U nemocných s těžkou jaterní nedostatečností (Childovo-Pughovo skóre > 9) nejsou k dispozici žádné klinické zkušenosti. Vzhledem k tomu, že eliminace sitagliptinu probíhá převážně prostřednictvím ledvin, předpokládá se, že ani těžká jaterní insuficience nemění výrazněji farmakokinetiku sitagliptinu. Z populační farmakokinetické analýzy studií fáze I a II vyplývá, že věk nemá na farmakokinetiku sitagliptinu klinicky významný vliv, a tedy úprava dávkování podle věkové kategorie není nutná.
Metformin
Po perorálním podání dávky metforminu je t max 2,5 hodiny. Absolutní biologická dostupnost tablety o obsahu 500 mg je u zdravých dobrovolníků přibližně 50 % až 60 %. Po perorální dávce dosahuje neabsorbovaná frakce obsažená ve stolici 20 % až 30 %. Po perorálním podání je absorpce metforminu saturabilní a neúplná. Předpokládá se, že farmakokinetika absorpce metforminu je nelineární. Při podávání obvyklých dávek v běžných intervalech je koncentrací v rovnovážném stavu dosaženo do 24 až 48 hodin a tyto koncentrace jsou většinou nižší než 1 µ g/ml. Vazba na plazmatické bílkoviny je zanedbatelně nízká. Metformin prostupuje do erytrocytů. Maximální hladina v krvi je nižší než maximální hladina v plazmě, přičemž obou maxim se dosahuje ve stejném čase. Erytrocyty pravděpodobně představují druhý kompartment distribuce. Střední hodnota distribučního objemu (V d ) se pohybuje mezi 63 l a 276 l. Metformin je nezměněný vylučován v moči. U člověka nebyly nalezeny žádné metabolity. Renální clearance metforminu je vyšší než 400 ml/min, což naznačuje, že metformin je eliminován glomerulární filtrací a tubulární sekrecí. Po perorální dávce je zdánlivý terminální eliminační poločas přibližně 6,5 hodiny. Při poruše renálních funkcí je renální clearance snížena poměrně ke clearance kreatininu, je tak prodloužen eliminační poločas metforminu a jeho plazmatické koncentrace jsou zvýšeny.
Klinické zkušenosti
Studie sitagliptinu v kombinaci s metforminem
Ve 24týdenní placebem kontrolované klinické studii byl přidán sitagliptin v dávce 100 mg jednou denně osobám s nedostatečnou kompenzací diabetu (průměrný HbA 1c = 8 % dle DCCT) léčeným do té doby jen metforminem v dávce nejméně 1500 mg a byl porovnáván s placebem. Přidání sitagliptinu po dobu 24 týdnů vedlo ke zlepšení kompenzace diabetu vyjádřenému snížením HbA 1c o 0,65 % [20]. Změna hmotnosti ve srovnání s výchozími hodnotami byla u pacientů léčených sitagliptinem i placebem podobná. Incidence hypoglykémií u pacientů léčených sitagliptinem byla podobná jako u osob, které dostávaly placebo [21].
Studie srovnávající sitagliptin v kombinaci s metforminem a derivát SU v kombinaci s metforminem
![Graf 1 Srovnání účinnosti sitagliptinu a glipizidu přidaného k monoterapii metforminem – hodnoceno dle poklesu HbA1c; podle [22] – Nauck, et al., 2007.](https://www.remedia.cz/photo-a-27346---.jpg) 52týdenní studie porovnávala účinnost a bezpečnost přidání sitagliptinu v dávce 100 mg jednou denně nebo přidání glipizidu u pacientů s nedostatečnou kompenzací diabetu při monoterapii metforminem (výchozí hodnota HbA 1c byla v obou skupinách 7,5 % dle DCCT). Léčba sitagliptinem snížila HbA 1c o 0,67 % (proti výchozí hodnotě), podobně jako léčba glipizidem ( graf 1 ). Střední hodnota dávky glipizidu používané v porovnávací skupině byla 10 mg/den. Ve skupině
52týdenní studie porovnávala účinnost a bezpečnost přidání sitagliptinu v dávce 100 mg jednou denně nebo přidání glipizidu u pacientů s nedostatečnou kompenzací diabetu při monoterapii metforminem (výchozí hodnota HbA 1c byla v obou skupinách 7,5 % dle DCCT). Léčba sitagliptinem snížila HbA 1c o 0,67 % (proti výchozí hodnotě), podobně jako léčba glipizidem ( graf 1 ). Střední hodnota dávky glipizidu používané v porovnávací skupině byla 10 mg/den. Ve skupině ![Graf 2 Změna hmotnosti u pacientů, kterým byl k monoterapii metforminem přidán sitagliptin nebo glipizid; podle [22] – Nauck, et al., 2007.](https://www.remedia.cz/photo-a-27347---.jpg) léčené sitagliptinem však léčbu v důsledku nedostatečného účinku ukončilo více pacientů než ve skupině léčené glipizidem. V této studii byla léčba sitagliptinem spojena s poklesem tělesné hmotnosti v porovnání s výchozí hodnotou (–1,5 kg), na rozdíl od významného přírůstku tělesné hmotnosti na konci studie u pacientů, kterým byl podáván glipizid (+1,1 kg), viz graf 2. Incidence hypoglykémií byla ve skupině léčené sitagliptinem významně nižší (4,9 %) než ve skupině léčené glipizidem (32,0 %) [22].
léčené sitagliptinem však léčbu v důsledku nedostatečného účinku ukončilo více pacientů než ve skupině léčené glipizidem. V této studii byla léčba sitagliptinem spojena s poklesem tělesné hmotnosti v porovnání s výchozí hodnotou (–1,5 kg), na rozdíl od významného přírůstku tělesné hmotnosti na konci studie u pacientů, kterým byl podáván glipizid (+1,1 kg), viz graf 2. Incidence hypoglykémií byla ve skupině léčené sitagliptinem významně nižší (4,9 %) než ve skupině léčené glipizidem (32,0 %) [22].
Studie sitagliptinu v kombinaci s metforminem a derivátem sulfonylurey
Ve 24týdenní randomizované studii byla hodnocena účinnost a bezpečnost přidání sitagliptinu (100 mg jednou denně) ve srovnání s placebem u nemocných s DM 2. typu léčených glimepiridem (samotným nebo v kombinaci s metforminem). Ve skupině nemocných léčených kombinací glimepiridu a metforminu (s výchozí hodnotou HbA 1c 8,3 % dle DCCT) vedlo přidání sitagliptinu ke snížení HbA 1c o 0,9 % oproti placebu na konci studie. U pacientů léčených sitagliptinem došlo v porovnání s pacienty léčenými placebem k mírnému přírůstku tělesné hmotnosti (+1,1 kg). Ve skupině léčené sitagliptinem byl vyšší výskyt hypoglykemických epizod, který ovšem odpovídá výsledkům studií, kdy se k původní léčbě derivátem sulfonylurey přidává další perorální antidiabetikum [23].
Vliv kombinované léčby sitagliptinem a metforminem na snížení hodnoty HbA 1c v placebem kontrolovaných studiích
![Graf 3 Vliv kombinované léčby sitagliptinem (SITA) a metforminem (MF) na snížení hodnoty HbA1c – hodnoceno po 24 týdnech léčby; podle [24] – Goldstein, et al., 2007.](https://www.remedia.cz/photo-a-27348---.jpg) Doposud nejdelší sledování účinků kombinace sitagliptinu s metforminem bylo uskutečněno v sérii na sebe navazujících studií v celkové délce 104 týdnů [24–26]. Kombinační léčba zde byla podána jako úvodní farmakoterapie a srovnávána s efektem monoterapie metforminem a sitagliptinem u osob s DM 2. typu po selhání efektu diety. V úvodní studii byly zařazené osoby (průměrný vstupní HbA 1c byl 8,8 % dle DCCT) randomizovány do 6 léčebných skupin: sitagliptin 100 mg/metformin 2000 mg, sitagliptin 100 mg/metformin 1000 mg, metformin 2000 mg, metformin 1000 mg, sitagliptin 100 mg a placebo. Již v této úvodní 24týdenní etapě projektu vedlo podávání kombinace sitagliptin/metformin k signifikantně lepším výsledkům než použití jednotlivých látek v monoterapii ( graf 3 ). Léčba sitagliptinem 100 mg v kombinaci s
Doposud nejdelší sledování účinků kombinace sitagliptinu s metforminem bylo uskutečněno v sérii na sebe navazujících studií v celkové délce 104 týdnů [24–26]. Kombinační léčba zde byla podána jako úvodní farmakoterapie a srovnávána s efektem monoterapie metforminem a sitagliptinem u osob s DM 2. typu po selhání efektu diety. V úvodní studii byly zařazené osoby (průměrný vstupní HbA 1c byl 8,8 % dle DCCT) randomizovány do 6 léčebných skupin: sitagliptin 100 mg/metformin 2000 mg, sitagliptin 100 mg/metformin 1000 mg, metformin 2000 mg, metformin 1000 mg, sitagliptin 100 mg a placebo. Již v této úvodní 24týdenní etapě projektu vedlo podávání kombinace sitagliptin/metformin k signifikantně lepším výsledkům než použití jednotlivých látek v monoterapii ( graf 3 ). Léčba sitagliptinem 100 mg v kombinaci s 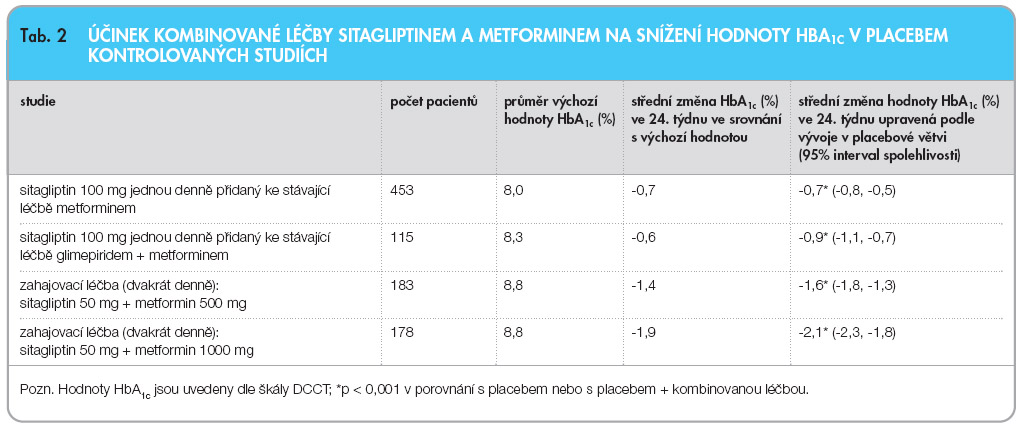 metforminem 2000 mg snížila HbA 1c o 2,07 %, zatímco metformin 2000 mg podávaný v monoterapii snížil HbA 1c o 0,99 % a podávání samotného sitagliptinu v dávce 100 mg denně snížilo HbA 1c o 0,83 % oproti vstupní hodnotě (viz tab. 2 ). Četnost gastrointestinálních nežádoucích účinků byla u kombinační terapie sitagliptin + metformin podobná jako u monoterapie metforminem [24].
metforminem 2000 mg snížila HbA 1c o 2,07 %, zatímco metformin 2000 mg podávaný v monoterapii snížil HbA 1c o 0,99 % a podávání samotného sitagliptinu v dávce 100 mg denně snížilo HbA 1c o 0,83 % oproti vstupní hodnotě (viz tab. 2 ). Četnost gastrointestinálních nežádoucích účinků byla u kombinační terapie sitagliptin + metformin podobná jako u monoterapie metforminem [24].
Zařazení do současné palety léčiv
Podávání kombinace sitagliptinu a metforminu v jednom preparátu bude významnou novou alternativou k dosavadním možnostem kombinační terapie perorálními antidiabetiky nebo k použití kombinace léčby metforminem s inzulinem NPH podávaným v jedné dávce před spaním. Řada studií hodnotících efekt přidání derivátu sulfonylurey k metforminu prokázala snížení hladiny HbA 1c o 0,8–1,5 %, např. [27–29]; tato míra účinku derivátů sulfonyl-urey je obecně akceptována, ovšem jejich použití s sebou nese vyšší riziko vzniku hypoglykémií a vzestup hmotnosti léčených osob. Účinek přidání derivátů meglitinidu (repaglinid, nateglinid) k metforminu je podobný jako přidání derivátů sulfonyl-urey. Účinek kombinace metforminu s thiazolidindiony je taktéž prověřen v řadě studií a snížení hladiny HbA 1c po přidání rosiglitazonu či pioglitazonu v běžných dávkách je podobné jako po přidání derivátu sulfonylurey [30–32]. Tato kombinace perorálních antidiabetik je jistě bezpečná z hlediska nízkého výskytu hypoglykémií, ovšem použití thiazolidindionu zvyšuje riziko vzniku edémů a fraktur kostí u postmenopauzálních žen a je spojeno se vzestupem hmotnosti.
Podání inzulinu v dávce před spaním přidaného k dosavadní terapii metforminem je alternativou, která není častá v naší klinické praxi, především pro snahu nemocných pokračovat co nejdéle v léčbě pomocí perorálních antidiabetik. Efektivita této terapie vyjádřená poklesem HbA 1c byla prokázána v řadě studií, ovšem zároveň je tato léčba spojena se zvyšováním tělesné hmotnosti a především se vzestupem rizika nočních hypoglykémií; to vedlo v řadě zemí k náhradě inzulinu NPH za dlouhodobá inzulinová analoga, jejichž působení je spjato s nižší incidencí hypoglykémií [33–35]. V kontextu výše uvedeného je kombinace sitagliptinu a metforminu podobně účinná ve snižování HbA 1c jako ostatní léčebné alternativy, ovšem její podávání není spojeno se zvýšením rizika hypoglykémií a se vzestupem hmotnosti léčených osob. Tato skutečnost je klinicky významná, neboť řada nemocných s DM 2. typu má nadváhu nebo trpí obezitou. Je tedy velmi důležité, aby při léčbě diabetu byl další eventuální vzestup tělesné hmotnosti minimalizován. Zatímco léčba inzulinovými sekretagogy, thiazolidindiony a inzulinem vede k nárůstu tělesné hmotnosti, terapie metforminem nevede ke změně hmotnosti nebo je spojena s jejím mírným poklesem; podobně i vliv sitagliptinu na hmotnost je považován za neutrální. Příznivým aspektem je i nízké riziko interakcí této kombinace s ostatními léčivy, což je zvláště cenné u osob s diabetem 2. typu, které užívají poměrně často řadu dalších preparátů.
Indikace
Fixní kombinace sitagliptin/metformin je indikována k léčbě nemocných s diabetem 2. typu a je určena:
- pro osoby, jejichž diabetes není odpovídajícím způsobem kompenzován při podávání maximální tolerované dávky samotného metforminu, nebo u pacientů, kteří jsou již kombinací sitagliptinu a metforminu léčeni;
- ke kombinaci s deriváty sulfonylurey (tj. k trojkombinační léčbě) jako doplněk k dietním opatřením a ke cvičení u pacientů, jejichž diabetes není odpovídajícím způsobem kompenzován při podávání maximální tolerované dávky metforminu a derivátu sulfonylurey.
Kontraindikace
Podávání fixní kombinace sitagliptinu a metforminu je kontraindikováno u pacientů s hypersenzitivitou na léčivé látky nebo na kteroukoli pomocnou látku tohoto přípravku. Dále u nemocných se středně těžkou nebo těžkou poruchou funkce ledvin (clearance kreatininu < 60 ml/min) či u nemocných s akutními stavy, které mohou narušit renální funkce (dehydratace, těžká infekce, šok, intravaskulární podání jodovaných kontrastních látek). Přítomnost metforminu v přípravku vylučuje jeho použití u osob s akutním nebo chronickým onemocněním, které může způsobit tkáňovou hypoxii (např. srdeční nebo respirační selhání, čerstvý infarkt myokardu, šok), a dále u osob se závažným poškozením jater, u osob intoxikovaných alkoholem a trpících alkoholismem. Kombinace je dále kontraindikována u kojících žen (viz níže). Jelikož fixní kombinace obsahuje hydrochlorid metforminu, musí být léčba ukončena 48 hodin před plánovaným chirurgickým zákrokem prováděným v celkové, spinální nebo epidurální anestezii. Léčba se obvykle obnovuje nejdříve za 48 hodin po zákroku, přičemž před započetím je potřebná kontrola renálních funkcí, jejichž úroveň musí zajistit bezpečnou léčbu.
Intravaskulární podání jodovaných kontrastních látek při radiologických vyšetřeních může vést k selhání ledvin, což u pacientů léčených metforminem bylo spojeno s laktátovou acidózou. Podávání fixní kombinace má být proto před vyšetřením nebo v době provedení vyšetření přerušeno, přičemž léčba má být obnovena až po 48 hodinách, a to pouze po vyšetření renálních funkcí a zhodnocení, zda jejich úroveň zajišťuje bezpečnou léčbu.
Nežádoucí účinky
Profil nežádoucích účinků metforminu je za více než 50 let jeho používání v klinické praxi velmi dobře znám. Při léčbě se nejčastěji setkáváme s gastrointestinálními symptomy, jako je nauzea, zvracení, průjem, bolest břicha či nechutenství. Tyto příznaky se nejčastěji objevují na začátku léčby a ve většině případů po několika dnech spontánně vymizí. Dalším často pozorovaným vedlejším účinkem je kovová chuť v ústech. Při dlouhodobé léčbě metforminem bylo pozorováno snížení hladin vitaminu B 12 v plazmě [36]. Snížení absorpce vitaminu B 12 u osob léčených metforminem může být preventivně ovlivněno adekvátním obsahem kalcia a mléčných produktů v dietě [37], pouze zcela vzácně může vést ke klinicky významnému nedostatku vitaminu B 12 spojenému s megaloblastickou anémií [38]. Dříve diskutované riziko vzniku laktátové acidózy při použití metforminu podle posledních analýz není větší než u ostatních perorálních antidiabetik, za předpokladu, že jsou respektovány kontraindikace použití metforminu [39].
Sitagliptin je ovšem zcela novým perorálním antidiabetikem a jeho bezpečnostní profil je nyní intenzivně studován. Nedávno publikovaná analýza 12 rozsáhlých klinických studií, v nichž dostávalo sitagliptin v dávce 100 mg denně 3415 nemocných, srovnávala profil vedlejších účinků s 2724 osobami, jimž v těchto studiích bylo podáváno placebo nebo aktivní komparátor [40]. Četnost nežádoucích příhod obecně byla podobná v obou hodnocených skupinách, ovšem četnost nežádoucích příhod vztažených k léčivu byla vyšší u kontrolní skupiny, a to kvůli hypoglykemickým epizodám u nemocných léčených deriváty sulfonylurey. Četnost ischemických příhod i frekvence výskytu angioedému byla podobná v obou sledovaných skupinách, což svědčí o nepřítomnosti negativního působení sitagliptinu na kardiovaskulární aparát. Velmi pečlivě sledovanou oblastí byly infekce močového a respiračního traktu, kde byl u osob léčených sitagliptinem zaznamenán poněkud vyšší výskyt nazofaryngitid a bronchitid, ve srovnání s kontrolní skupinou nebyl však statisticky signifikantní. Při podávání sitagliptinu byly zaznamenány některé vedlejší účinky na gastrointestinální trakt, převážně zácpa, dyspepsie, průjem či nauzea, které jsou klasifikovány jako časté (frekvence ≥ 1/100 a zároveň < 1/10). Žádný z těchto nežádoucích účinků nebyl ovšem statisticky významně častější ve skupině léčené sitagliptinem oproti skupině kontrolní.
Přehlednou ilustrací četnosti možných nežádoucích účinků kombinace sitagliptinu a metforminu ve srovnání s jednotlivými preparáty v monoterapii jsou výsledky již zmíněné 24týdenní studie zahajovací kombinované léčby sitagliptinem a metforminem podávanými dvakrát denně v dávce 50 mg/ 500 mg nebo v dávce 50 mg/1000 mg [24]. V této studii byla celková incidence nežádoucích účinků přisuzovaných léčivu u pacientů léčených kombinací sitagliptinu a metforminu v porovnání s pacienty léčenými placebem 14,0 % vs. 9,7 %. Celková incidence nežádoucích účinků přisuzovaných léčivu u pacientů léčených kombinací sitagliptinu a metforminu byla srovnatelná s léčbou metforminem samotným (v obou případech 14,0 %) a byla vyšší než při léčbě sitagliptinem samotným (6,7 %), přičemž rozdíl ve prospěch monoterapie sitagliptinem byl důsledkem nižší incidence gastrointestinálních nežádoucích účinků.
Riziko vzniku hypoglykémie při podávání samotné fixní kombinace je velmi nízké, ovšem osoby léčené fixní kombinací spolu s deriváty sulfonylurey mohou být ohroženy hypoglykémií, proto musí lékař zvážit snížení dávky derivátu sulfonylurey, pokud je potřebné. Po uvedení fixní kombinace sitagliptin/metformin na trh byly hlášeny závažné reakce přecitlivělosti zahrnující anafylaxi, angioedém a exfoliativní kožní stavy, včetně Stevensova-Johnsonova syndromu. K nástupu těchto reakcí došlo během prvních 3 měsíců po zahájení léčby sitagliptinem, přičemž některá hlášení se objevila po první dávce.
Lékové interakce
Farmakokinetické interakce
Studie, která sledovala vzájemné ovlivnění kinetiky jednotlivých účinných komponent – metforminu a sitagliptinu, neprokázala žádné farmakokinetické interakce mezi těmito látkami [20]. Sitagliptin neinhibuje ani neindukuje izoenzymy systému CYP-450. V klinických studiích podání sitagliptinu neměnilo významně farmakokinetiku glibenklamidu, simvastatinu, rosiglitazonu, warfarinu ani perorálních kontraceptiv. Sitagliptin má tedy velmi nízkou tendenci k interakcím se substráty CYP3A4, CYP2C8, CYP2C9 a s organickým kationtovým transportérem.
Farmakodynamické interakce
Glukokortikoidy (podávané systémově nebo lokálně), β 2 -agonisté a thiazidová diuretika mohou způsobit vzestup glykémie. Pacienta je o této skutečnosti nutno informo-vat, přičemž monitorování krevní glukózy musí být při léčbě těmito léčivými přípravky prováděno častěji. V případě potřeby musí být dávka antidiabetického léčivého přípravku upravena. Inhibitory ACE naopak mohou snižovat hladiny glukózy v krvi. V případě potřeby musí být dávka antidiabetického léčivého přípravku během léčby těmito účinnými látkami upravena.
Těhotenství a kojení
Adekvátní údaje o podávání sitagliptinu těhotným ženám nejsou k dispozici. Omezené množství údajů naznačuje, že užívání metforminu u těhotných žen není spojeno se zvýšeným rizikem vrozených malformací. Studie na zvířatech s metforminem nenaznačují škodlivé účinky na průběh těhotenství, embryonální/fetální vývoj, porod nebo na postnatální vývoj. Přesto by se fixní kombinace neměla během těhotenství užívat. Pokud pacientka hodlá otěhotnět nebo pokud otěhotní, léčba má být co nejdříve ukončena a pacientka převedena na léčbu inzulinem. Metformin je vylučován v malém množství i do lidského mléka. Není známo, zda se sitagliptin vylučuje do lidského mléka, kojící ženy proto nesmějí fixní kombinaci užívat.
Ovlivnění pozornosti
Možná ztráta pozornosti je spojena se stavem případné hypoglykémie při současném používání fixní kombinace sitagliptin/metformin s deriváty sulfonylurey.
Dávkování
U pacientů, jejichž diabetes není odpovídajícím způsobem kompenzován při podávání samotného metforminu, musí obvyklá zahajovací dávka fixní kombinace obsahovat dávku sitagliptinu 50 mg dvakrát denně (celková denní dávka 100 mg) a již užívanou dávku metforminu. U nemocných, u nichž není diabetes odpovídajícím způsobem kompenzován při podávání kombinace maximální tolerované dávky metforminu a derivátu sulfonyl-urey, je doporučeno dávkování fixní kombinace s obsahem sitagliptinu 50 mg dvakrát denně (celková denní dávka 100 mg) a metforminu v dávce podobné dávce již užívané. Podávání fixní kombinace spolu s deriváty sulfonylurey může vést k potřebě redukovat dávku sulfonylurey, aby bylo sníženo riziko vzniku hypoglykémie. K dosažení různých dávek metforminu je fixní kombinace k dispozici v silách s 50 mg sitagliptinu a s 850 mg hydrochloridu metforminu nebo s 1000 mg hydrochloridu metforminu. Fixní kombinaci je nutno podávat dvakrát denně spolu s jídlem, aby se omezily případné nežádoucí gastrointestinální účinky, které mohou být spojeny s léčbou metforminem.
Seznam použité literatury
- [1] Diabetes Control and Complications Trial Research Group. The effect of intensive treatment of diabetes on the development and progression of long-term complications of insulin-dependent diabetes mellitus. New England Journal of Medicine 1993; 329: 977–986.
- [2] Stratton IM, Adler AI, Neil HA, et al. Association of glycaemia with macrovascular and microvascular complications of type 2 diabetes (UKPDS 35): prospective observational study. British Medical Journal 2000; 321: 405–412.
- [3] Holman RR, Sanjoy PK, Angelyn Bethel M, et al. 10-Year Follow-up of Intensive Glucose Control in Type 2 Diabetes. N Engl J Med 2008; 359: 1577–1589.
- [4] Skyler JS, Bergenstal R, Bonow RO, et al. Intensive Glycemic Control and the Prevention of Cardiovascular Events: Implications of the ACCORD, ADVANCE, and VA Diabetes Trials. J Am Coll Cardiol 2009; 53: 298–304.
- [5] Nathan DM, Buse JB, Davidson MB, et al. Management of hyperglycaemia in type 2 diabetes: a consensus algorithm for the initiation and adjustment of therapy: A consensus statement from the American Diabetes Association and the European Association ofor the study of Diabetes. Diabetologia 2006; 49: 1711–1721.
- [6] Turner RC, Cull CA, Frighi V, Holman RR. Glycaemic control with diet, sulphonylurea, metformin or insulin in patients with type 2 diabetes mellitus: Progressive requirement for multiple therapies (UKPDS 49). JAMA 1999; 281: 2005–2012.
- [7] Wiernsperger NF, Bailey CJ. The antihyperglycaemic effect of metformin: therapeutic and cellular mechanims. Drugs 1999; 58, (Suppl. 1): 31–39.
- [8] UK Prospective Diabetes Study Group. Effect of intensive glucose control with metformin on complications in overweight patients with type 2 diabetes mellitus (UKPDS 34). Lancet 1998; 352: 854–865.
- [9] Dupre J, Ross SA, Watson D, Brown JC. Stimulation of insulin secretion by gastric inhibitory polypeptide in man. J Clin Endocrinol Metab 1973; 37: 826–828.
- [10] Drucker DJ. The glucagon-like peptides. Diabetes 1998; 47: 159–169.
- [11] Kreymann B, Ghatei MA, Williams G, Bloom SR. Glucagon-like peptide-1 7-36: a physiological incretin in man. Lancet 1987; ii: 1300–1304.
- [12] Skoglund G, Hussain MA, Holz GG. Glucagon-like peptide1 stimulates insulin gene promoter activity by protein kinase A – independent activation of the rat insulin I gene cAMP response element. Diabetes 2000; 49: 1156–1164.
- [13] Lawrence MC, Bhatt HS, Easom RA. NFAT regulates insulin gene promoter activity in response to synergistic pathways induced by glucose and glucagon-like peptide-1. Diabetes 2002; 51: 691–698.
- [14] Nauck MA, Heimesaat MM, Behle K, et al. Effects of glucagon-like peptide-1 on counter regulatory hormone responses, cognitive functions, and insulin secretion during hyperinsulinemic, stepped hypoglycemic clamp experiments in healthy volunteers. J Clin Endocrinol Metab 2002; 87: 1239–1246.
- [15] Toft-Nielsen MB, Madsbad S, Holst JJ. Continuous subcutaneous infusion of glucagons-like peptide-1 lowers plasma glucose and reduces appetite in type 2 diabetic patients. Diabetes Care 1998; 22: 1137–1143.
- [16] Flint A, Raben A, Astrup A, Holst JJ. Glucagon-like peptide 1 promotes satiety and suppresses energy intake in humans. J Clin Invest 1998; 101: 515–520.
- [17] Gutzwiller JP, Drewe J, Goke B, et al. Glucagon-like peptide-1 promotes satiety and reduces food intake in patients with diabetes mellitus type 2. Am J Physiol 1999; 276: R1541–1544.
- [18] Naslund E, Barkeling B, King N, et al. Energy in-take and appetite are suppressed by glucagon-like peptide-1(GLP-1) in obese men. Int J Obes Relat Metab Disord 1999; 23: 304–311.
- [19] Vincent SH, Reed JR, Bergman AJ, et al. Metabolism and excretion of the dipeptidyl peptidase 4 inhibitor [14C]sitagliptin in humans. Drug Metab Dispos 2007; 35: 533–538.
- [20] Herman GA, Bergman A, Yi B, Kipnes M. Toler-ability and pharmakokinetics of metformin and the dipeptidyl peptidase-4 inhibitor sitagliptin when coadministered in patients with type 2 diabetes. Current Medical Research and Opinion 2006; 22: 1939–1947.
- [21] Charbonnel B, Karasik A, Liu J, et al. Efficacy and safety of the dipeptidyl peptidase-4 inhibitor sitagliptin added to ongoing metformin therapy in patients with type 2 diabetes inadequately controlled with metformin alone Diabetes Care. 2006; 29: 2638–2643.
- [22] Nauck MA, Meininger G, Sheng D, et al. Efficacy and safety of the dipeptidyl peptidase-4 inhibitor, sitagliptin, compared with the sulfonylurea, glipizid, in patients with type 2 diabetes inadequately controlled with metformin alone: a randomized, double blind, non-inferiority trial. Diabetes, Obesity and Metabolism 2007; 9: 194–205.
- [23] Hermansen K, Kipnes M, Luo E, et al. Efficacy and Safety of the Dipeptidyl Peptidase-4 Inhibitor, Sitagliptin, in Patients With Type 2 Diabetes Mellitus Inadequately Controlled on Glimepiride Alone or on Glimepiride and Metformin. Diabetes Obes Metab 2007; 9: 733–745.
- [24] Goldstein BJ, Feinglos MN, Lunceford JK, et al. Effect of Initial Combination Therapy with Sitagliptin, a Dipeptidyl Peptidase-4 Inhibitor, and Metformin on Glycemic Control in Patients with Type 2 Diabetes. Diabetes Care 2007; 30: 1979–1987.
- [25] Williams-Herman D, Johnson J, Lunceford J, et al. Initial combination therapy with sitagliptin and metformin provides effective and durable glycemic control over 1 year in patients with type 2 diabetes: A pivotal Phase III clinical trial. Diabetes Care 2007; 56 (Suppl. 1): 534-P.
- [26] Qi DS, Teng R, Jiang M, et al. Two-year treatment with sitagliptin and initial combination therapy of sitagliptin and metformin provides substantial and durable glycaemic control in patients with type 2 diabetes. Diabetologia 2008; 51 (Suppl. 1): S36.
- [27] Feinglos M, Dailey G, Cefalu W, et al. Effect on glycemic control of the addition of 2.5 mg glipizide GITS to metformin in type 2 diabetic patients. Diabetic Medicine 2005; 18: 828–834.
- [28] Hanefeld M, Brunetti P, Schernthaner GH, et al. One-year glycemic control with sulfonylurea plus pioglitazone versus sulfonylurea plus metformin in patients with type 2 diabetes. Diabetes Care 2004; 27: 141–147.
- [29] Schernthaner G, Grimaldi A, Di Mario U, et al. GUIDE study: double blind comparison of once daily gliclazide MR and glimepiride in type 2 diabetic patients. European Journal of Clinical Investigation 2004; 34: 535–542.
- [30] Umpierrez G, Issa M, Vlajnic A. Glimepiride versus pioglitazone combination therapy in subjects with type 2 diabetes inadequatelly controlled on metformin monotherapy: results of a randomized clinical trial. Current Medical Research and Opinion 2006; 22: 751–759.
- [31] Garber A, Klein E, Bruce S, et al. Metformin-glibenclamide versus metformin plus rosiglitazone in patients with type 2 diabetes inadequately controlled on metformin. Diabetes, Obesity & Metabolism 2006; 8: 156–163.
- [32] Derosa G, Gaddi AV, Piccini MN, et al. Differential effect of glimepiride and rosiglitazone of type 2 diabetic patients treated with metformin: a randomized, double-blind, clinical trial. Diabetes, Obesity & Metabolism 2006; 8: 197–205.
- [33] Yki-Jarvinen H, Dressler A, Ziemen M. Less nocturnal hypoglycemia and better post-dinner glucose control with bedtime insulin glargine compared with bedtime NPH insulin during insulin combination therapy in type 2 diabetes. HOE 901/3002 Study Group. Diabetes Care 2000; 23: 1130–1136.
- [34] Yki-Jarvinen H, Kauppinen-Makelin R, Tiikanen M, et al. Insulin glargine or NPH combined with metformin in type 2 diabetes: the LANMET study. Diabetologia 2006; 49: 442–451.
- [35] Hermansen K, Davies M, Derezinski T, et al. A 26-week, randomized, parallel, treat to target trial comparing insulin detemir with NPH insulin as add-on therapy to oral glucose-lowering drugs in insulin-naive people with type 2 diabetes. Diabetes Care 2006; 29: 1269–1274.
- [36] Liu KW, Dai LK, Jean W. Metformin-related vitamin B12 deficiency. Age Ageing 2006; 35: 200–201.
- [37] Bauman WA, Shaw S, Jayatilleke E, et al. Increased intake of calcium reverses vitamin B12 malabsorption induced by metformin. Diabetes Care 2000; 23: 1227–1231.
- [38] Callaghan TS, Hadden DR, Tomkin GH. Megaloblastic anaemia due to vitamin B12 malabsorption associated with long-term metformin treatment. British Medical Journal 1980; 280: 1214–1215.
- [39] Salpeter S, Greyber E, Pasternak G, et al. Risk of fatal and nonfatal lactic acidosis with metformin use in type 2 diabetes mellitus. Cochrane Database of Systematic Reviews 2006; (1): CD002967.
- [40] Williams-Herman D, Round E, Swern A, et al. Safety and tolerability of sitagliptin, a selective DPP-4 inhibitor, in patients with type 2 diabetes: pooled analysis of 6139 patients in clinical trials for up to 2 years. BMC Endocrine Disorders 2008; 8: 14.