Strontii ranelas
Strontium ranelat je nová účinná látka určená k terapii osteoporózy u postmenopauzálních žen. Přesný mechanismus účinku strontium ranelatu dosud není zcela znám. In vitro v tkáňových kulturách kosti zvyšuje replikaci prekurzorů osteoblastů a snižuje diferenciaci osteoklastů. To vede ke zvýšení kostní formace a snížení resorpce kostní hmoty. V kontrolovaných randomizovaných klinických studiích bylo prokázáno statisticky velmi významné snížení rizika vzniku fraktur krčku kyčelního kloubu a vertebrálních fraktur. Strontium ranelat je indikován k léčbě postmenopauzální osteoporózy a ke snížení rizika vertebrálních a kyčelních fraktur. Strontium ranelat má velmi dobrou toleranci a nízký výskyt nežádoucích účinků. Strontium ranelat je kontraindikovaný při přecitlivělosti na účinnou látku a u pacientek s těžkou poruchou funkce ledvin (clearance kreatininu pod 30 ml/min). Opatrnosti je třeba u pacientek s anamnézou hluboké žilní trombózy pro mírné zvýšení relativního rizika vzniku tromboembolismu. Strontium ranelat se užívá v jedné denní dávce, nejlépe večer alespoň 2 hodiny po jídle. Strontium ranelat je od roku 2004 v ČR registrován (v rámci tzv. Evropské registrace) a od července 2005 byl uveden na trh.
Farmakologická skupina
Strontium ranelat má dvojí mechanismus účinku: zvyšuje replikaci prekurzorů osteoblastů a snižuje diferenciaci osteoklastů. Tím vede ke zvýšení kostní formace a ke snížení resorpce kostní hmoty. Strontium ranelat patří do anatomicko-terapeuticko-chemické skupiny ostatních léčiv ovlivňujících stavbu a mineralizaci kostí (M05BX), kde má přidělený kód M05BX03.
Chemické a fyzikální vlastnosti
Strontium je stopový prvek, jehož podíl v přírodě činí kolem 0,01 %. Je známo celkem 11 izotopů strontia, z nichž 4 jsou stabilní (84Sr, 86Sr, 87Sr a 88Sr) a ostatní nestabilní (radioaktivní) s poločasem rozpadu několik desítek hodin až několik desítek dnů [1]. V medicíně se využívá radioaktivní izotop strontia (89Sr s poločasem rozpadu 50,5 dne), který je b-zářičem, a jeho hlavní využití spočívá v paliativní terapii kostních metastáz různých nádorových onemocnění [2].
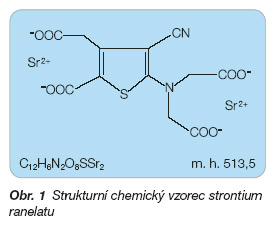
Strontium obsažené ve strontium ranelatu je výhradně ve formě stabilních izotopů přirozeně se vyskytujících v přírodě. Ranelová sůl strontia zajišťuje dobrou biologickou dostupnost strontia po perorálním podání a jeho dobrou toleranci (obr. 1) [3].
Sumární chemický vzorec: C12H6N2O8SSr2
Molekulová hmotnost: 513,5
Mechanismus účinku
První informace o možném vlivu solí strontia na kost pochází z roku 1910 [4]. Ve dvacátých letech minulého století bylo zjištěno, že podávání vysokých dávek solí strontia zvířatům s deficitem vápníku vede k rachitickým změnám [5]. Již v padesátých letech minulého století pak bylo zjištěno, že podávání nízkých dávek solí strontia pacientům s osteoporózou vede k nárůstu kostní hmoty [6]. V 80. letech minulého století bylo provedeno několik experimentálních prací se zvířaty, které prokázaly, že podávání nízkých i vysokých dávek solí strontia laboratorním zvířatům při adekvátním přísunu solí vápníku vede k nárůstu kostní hmoty bez vzniku rachitických změn nebo změn laboratorních parametrů [7, 8]. Na přelomu 80. a 90. let bylo prováděno klinické hodnocení látky S12911 – strontium ranelatu.
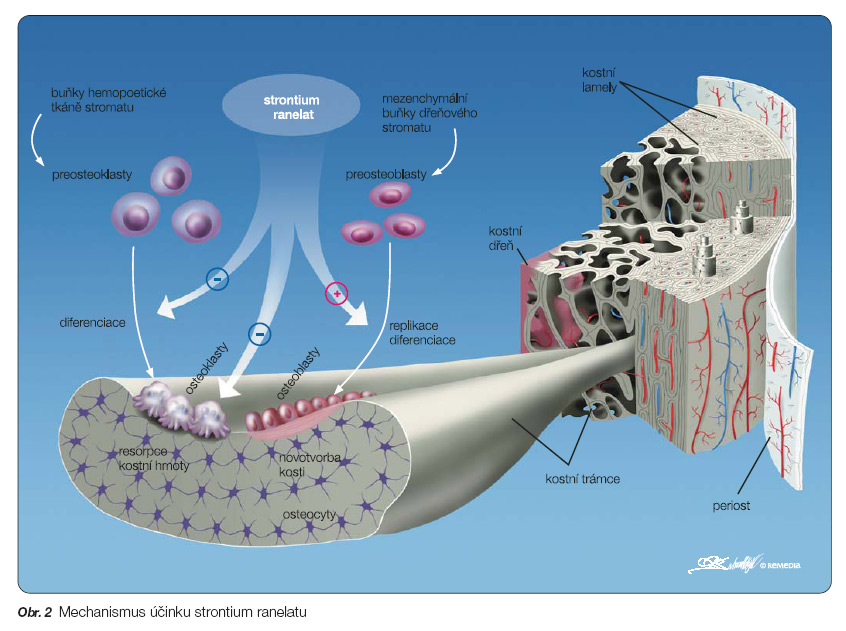
Přesný mechanismus účinku strontium ranelatu dosud není zcela znám.In vitro v tkáňových kulturách kosti zvyšuje replikaci prekurzorů osteoblastů a snižuje diferenciaci osteoklastů [9, 10]. To vede ke zvýšení kostní formace a snížení resorpce kostní hmoty. Tyto účinky strontium ranelatu nejsou závislé na koncentracích vitaminu D nebo parathormonu. Při podávání strontium ranelatu potkanům dochází k nárůstu hmoty trámčité kosti, zvýšení počtu trámců a jejich tloušťky. Strontium se jen velmi málo inkorporuje do krystalické mřížky hydroxyapatitu, přesto však má nově vytvořená kostní hmota pravidelnější strukturu a je mechanicky pevnější. Strontium in vitro působí agonisticky na „vápníkový receptor", má však nižší afinitu ve srovnání s vápníkem [11]. Strontium ranelat v experimentech in vitro stimuluje též tvorbu chrupavky [12].
Strontium má komplexní, dosud ne zcela objasněný mechanismus účinku, má tzv. duální účinek, tj. vede ke zvýšení kostní formace (podobně jako teriparatid) a snížení kostní resorpce (podobně jako bisfosfonáty) a jeho dlouhodobé podávání vede ke zvýšení kostní formace (obr. 2).
Farmakodynamické vlastnosti
Strontium se v kostní tkáni zvířat i lidí adsorbuje na povrchu apatitových krystalů a jen minimálně substituuje vápník v jejich struktuře. V rámci preklinického hodnocení nebyly zjištěny žádné nepříznivé vlivy strontia na kvalitu kostní tkáně nebo na mineralizaci kostí.
Dlouhodobé podávání strontia vede u lidí k mírnému snížení plazmatických koncentrací vápníku a parathormonu, a naopak k mírnému zvýšení plazmatických koncentrací fosfátů a celkové aktivity alkalické fosfatázy. Tyto změny biochemických parametrů nebyly spojeny s přímými klinickými důsledky.
Strontium nemá mutagenní ani kancerogenní účinky. Strontium chlorid vykazuje v tkáňových kulturách klastogenní účinky [13].
Strontium u experimentálních zvířat prostupuje placentární bariérou [14] a přestupuje do mateřského mléka [15].
Při chronickém podávání velmi vysokých dávek strontia laboratorním zvířatům byly pozorovány abnormality kostí a zubů. Docházelo ke zvýšení výskytu spontánních fraktur a ke zpožděné mineralizaci kostí. Tyto efekty byly plně reverzibilní po ukončení podávání strontia.
Farmakokinetické vlastnosti
Po perorálním podání se vstřebává kolem 25 % podané dávky strontia (19–27 %) a kyselina ranelová se jen minimálně vstřebává (2,5 %) [3, 16]. Vstřebaná kyselina ranelová se v organismu nebiotransformuje a vylučuje se v nezměněné formě močí. Po perorálním podání strontium ranelatu je maximálních plazmatických koncentrací strontia dosahováno za 3–5 hodin, současný příjem potravy nebo podání solí vápníku vede k prodloužení času nutného k dosažení maximálních plazmatických koncentrací a ke snížení biologické dostupnosti strontia o 60–70 % [3]. Strontium se jen minimálně váže na plazmatické bílkoviny (kolem 25 %) a má relativně velký distribuční objem (1 l/kg), což svědčí o významné tkáňové distribuci [2,3]. Má především vysokou afinitu ke kostní tkáni, ve které se mírně koncentruje a jen pomalu se z ní uvolňuje [17]. Biologický poločas eliminace strontia je kolem 60 hodin (tab. 1).
Strontium se vylučuje jak močí (renální clearance činí 7 ml/min), tak i stolicí (celková clearance činí 12 ml/min) [2, 3]. Nebyly zjištěny žádné významné změny farmakokinetických vlastností strontia u starších osob. Není pravděpodobné, že by těžší porucha funkce jater měla vliv na farmakokinetické vlastnosti strontia (nebo kyseliny ranelové). Těžší porucha funkce ledvin (clearance kreatininu 70–30 ml/min) vede ke zvýšení plazmatických koncentrací strontia, které však není klinicky významné, a není třeba upravovat dávky strontium ranelatu. U těžkého snížení funkce ledvin (clearance kreatininu pod 30 ml/min) není strontium ranelat doporučován pro nedostatek zkušeností [3, 16].
Klinické zkušenosti
Všechny dosud uskutečněné randomizované kontrolované studie se strontium ranelatem byly provedeny u postmenopauzálních žen.
Studie II. fáze klinického hodnocení
V rámci II. fáze klinického hodnocení strontium ranelatu byly provedeny dvě randomizované dvojitě slepé kontrolované studie (PREVOS a STRATOS), ve kterých byl postmenopauzálním ženám podáván strontium ranelat, nebo bylo podáváno placebo.
Do studie PREVOS [18] bylo zařazeno 160 neobézních (BMI < 30) žen nad 45 let, které byly 6 měsíců až 5 let po menopauze, neměly projevy osteoporózy a nebyly léčeny v předcházejících 3 měsících léčivy ovlivňujícími kostní metabolismus (např. vápník > 500 mg/den, ERT, vitamin D apod.). Ženy zařazené do studie byly randomizovány do 4 podskupin: první dostávala strontium ranelat v dávkách 125 mg denně, druhá 500 mg denně, třetí 1 000 mg denně a čtvrtá skupina dostávala placebo. Všem pacientkám byl současně podáván vápník v množství 500 mg denně. Studie trvala 2 roky. Primárním cílem studie bylo sledování účinku strontium ranelatu na hustotu kostního minerálu (bone mineral density – BMD) bederních obratlů (L), měřenou metodou absorpciometrie využívající rentgenového záření o dvojí energetické hladině (dual energy X-ray absorptiometry – DXA). Dalšími sledovanými parametry byly změny BMD v kyčelní kosti, BMD v krčku stehenní kosti a hodnoty biochemických ukazatelů kostní resorpce a novotvorby. Bylo prokázáno, že podávání strontium ranelatu v dávkách 1 000 mg denně ve srovnání s placebem statisticky významně zvyšuje hustotu kostního minerálu ve vertebrální oblasti (BMD L2–L4: 5,53 ve srovnání s –0,75 v případě placeba; p < 0,001) i v oblasti kyčle (BMD: 3,21 ve srovnání –0,88 v případě placeba; p < 0,001). Podávání nižších dávek strontium ranelatu nevykázalo dostatečný klinický efekt.
Do studie STRATOS [19] bylo zařazeno celkem 353 postmenopauzálních žen ve věku 45–78 let. Dalšími vstupními kritérii byly: období od menopauzy delší než 12 měsíců, minimálně jedna fraktura obratle (ale ne více než 2 fraktury v oblasti L1 a L4), BMD < 0,842 g/cm2, bederní T-skóre < –2,4 SD. V této studii byly pacientky rozděleny do čtyř skupin: první dostávala strontium ranelat v dávkách 500 mg denně, druhá v dávkách 1 000 mg denně, třetí v dávkách 2 000 mg denně a čtvrtá dostávala placebo. Všem pacientkám byl současně podáván vápník v množství 500 mg denně a vitamin D v dávkách 800 IU denně. I tato studie trvala 2 roky. Primárním cílem bylo stejně jako ve studii PREVOS sledování účinku strontium ranelatu na hustotu kostního minerálu (BMD) bederních obratlů. Dalšími cíli bylo sledování nových deformit obratlů, hustota kostního minerálu v oblasti kyčle a biochemických markerů. Studii dokončilo 272 pacientek (77,1 %). Bylo prokázáno, že podávání strontium ranelatu v dávkách 1 000 mg denně nebo 2 000 mg denně vedlo ke statisticky významnému nárůstu BMD v oblasti bederní páteře o 4,5 % za rok (po dávkách 1 000 mg denně), respektive 7,3 % ročně (po dávkách 2 000 mg denně) a k nárůstu BMD v oblasti krčku stehenní kosti o 1,4 % za rok (po dávkách 1 000 mg denně), respektive 3,1 % za rok (po dávkách 2 000 mg denně).
Studie III. fáze klinického hodnocení
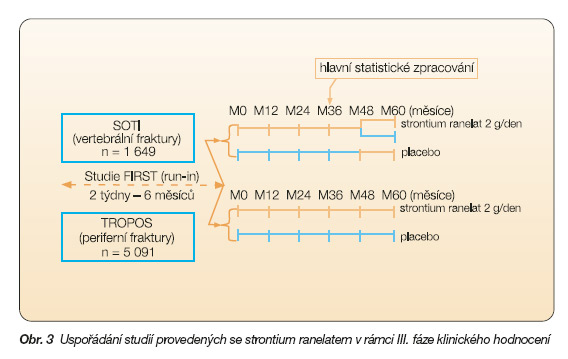
Následně v rámci III. fáze klinického hodnocení byly provedeny 2 rozsáhlé randomizované dvojitě slepé a placebem kontrolované studie (SOTI a TROPOS), jimž předcházela pilotní studie FIRST s cílem vybrat pacientky pro studie SOTI a TROPOS a stabilizovat jejich plazmatické hladiny vápníku a vitaminu D suplementací po dobu 2–24 týdnů. Uspořádání studií viz obr. 3.
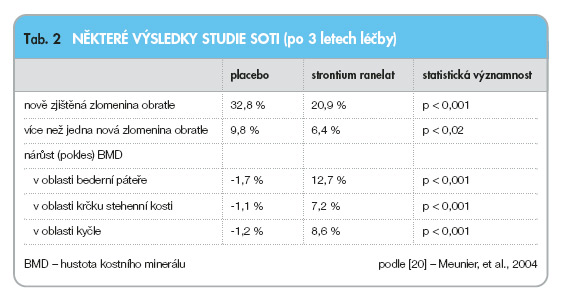
Do studie SOTI [20] bylo zařazeno 1 649 postmenopauzálních pacientek s osteoporózou (průkaz snížení BMD v oblasti bederní páteře < 0,840 g/cm2 s T-skóre <–2,4 SD a vertebrální fraktura v anamnéze, minimálně 5 let od menopauzy) starších 50 let (průměrného věku 69,7 let). Do studie nebyly zařazeny pacientky již užívající antiosteoporotickou léčbu či trpící vážnou nemocí ovlivňující kostní metabolismus. Hodnoceno bylo 1 442 pacientek. Pacientky užívaly strontium ranelat v dávkách 2 000 mg denně (n = 719), nebo placebo (n = 723), současně obě skupiny užívaly vitamin D a vápník. Studie trvala 3 roky a byla dále extendována (polovina pacientek, které užívaly strontium ranelat, dostávala poté placebo a všechny pacientky, které dostávaly placebo, byly převedeny na strontium ranelat). Primárním cílem této studie bylo zjistit, zda podávání strontium ranelatu snižuje riziko vertebrálních fraktur, sekundárním cílem pak bylo zjistit, zda podávání strontium ranelatu snižuje riziko mimoobratlových zlomenin, a též vyhodnocení dynamiky ukazatelů kostního obratu, změny tělesné výšky a kvality života pacientek. Po třech letech léčby strontium ranelat snížil o 41 % incidenci nových vertebrálních fraktur ve srovnání s placebem (20,9 % ve srovnání s 32,8 %, relativní riziko 0,59; 95% CI: 0,46–0,73; p < 0,001). Již po roce léčby byl pozorován statisticky významný rozdíl v počtu nových fraktur mezi oběma skupinami (6,1 % strontium ranelat ve srovnání s 11,8 % v případě placeba, relativní riziko 0,51; 95% CI: 0,36–0,74; p < 0,001). Ve skupině léčené strontium ranelatem bylo zaznamenáno zvýšení BMD oproti placebu o 14,4 % (8,1 % po zohlednění na obsah strontia) u obratlů v bederní oblasti, o 8,3 % u krčku stehenní kosti a o 9,8 % v oblasti kyčelní. U pacientek léčených strontium ranelatem byla již po třech měsících statisticky významně zvýšená hladina kostního izoenzymu alkalické fosfatázy, a naopak snížená hladina C-telopeptidu kolagenu oproti placebu. Základní výsledky studie jsou shrnuty v tab. 2.
Zatím poslední rozsáhlou randomizovanou dvojitě slepou a placebem kontrolovanou studií byla studie TROPOS [21], do které bylo zařazeno celkem 5 091 postmenopauzálních žen s osteoporózou (s T-skóre < –2,5 SD, průměrná hodnota T-skóre byla –3,1 SD), starších 70 let (průměrného věku 76,8 roku). Hodnoceno bylo 4 932 žen (analýza intention-to-treat). Rizikovou skupinu tvořilo 39 % pacientek starších 74 let s BMD ≤ –3 SD. Pacientky užívaly strontium ranelat v dávkách 2 000 mg denně (n = 2 479), nebo placebo (n = 2 453), suplementace vápníkem a vitaminem D pokračovala na základě dávek zjištěných v „run-in" fázi. Studie trvala 3 roky a byla dále extendována. Do studie nebyly zařazeny pacientky již užívající antiosteoporotickou léčbu či trpící vážnou nemocí ovlivňující kostní metabolismus. Zlomeniny kostrče, lebky, článků prstů, kotníků nebyly považovány za způsobené osteoporózou, a nebyly proto do studie zahrnuty. Za nonvertebrální fraktury způsobené osteoporózou byly považovány zlomeniny kyčle, zápěstí, krčku kosti stehenní, pánevní kosti, žeber a hrudní kosti, klíční kosti, kosti pažní apod. Primárním cílem této studie bylo zjistit, zda podávání strontium ranelatu snižuje riziko mimoobratlových zlomenin, sekundárním cílem pak bylo zjistit, zda podávání strontium ranelatu snižuje riziko fraktur obratlů a zda ovlivňuje dynamiku ukazatelů kostního obratu a rozsah nežádoucích účinků. Léčba strontium ranelatem vedla v průběhu tří let k 16% snížení rizika mimoobratlových zlomenin (relativní riziko 0,84, 95% CI: 0,702–0,995; p = 0,04). U mimoobratlových fraktur definovaných jako hlavní mimoobratlové fraktury (krčku kosti stehenní, pánve, zápěstí, kosti hrudní, žeber, klíční a pažní kosti) byl zaznamenán pokles 19 % (relativní riziko 0,81, 95% CI: 0,66–0,98, p = 0,031). V rizikové skupině pacientek došlo k 36% snížení zlomenin v oblasti kyčle (relativní riziko 0,64, 95% CI: 0,412–0,997; p = 0,046). Snížení rizika zlomenin obratlů bylo sledováno podobné jako ve studii SOTI (39 % po 3 letech, 45 % po roce léčby). Na konci studie činil rozdíl BMD ve skupině strontium ranelatu oproti placebu 8,2 % u krčku kosti stehenní a 9,8 % v oblasti kyčle. Některé základní výsledky studie jsou shrnuty v tab. 3.
Důkazy o klinické účinnosti strontium ranelatu mají značnou vypovídací hodnotu. V dlouhodobých randomizovaných, placebem kontrolovaných a zaslepených studiích na velkém počtu postmenopauzálních žen (téměř 8 000) bylo prokázáno, že strontium ranelat snižuje u pacientek s předchozí zlomeninou obratle riziko vertebrálních fraktur o 41 % (při 3leté terapii) a mimoobratlových zlomenin o 16 %. K zabránění jedné vertebrální fraktuře v sekundární prevenci je třeba po dobu 3 let léčit 9 pacientek. Metaanalýza studií SOTI a TROPOS prokázala vedle snížení rizika fraktur též výrazné zlepšení kvality života pacientek léčených strontium ranelatem ve srovnání s placebem (p < 0,03).
Zařazení do současné palety léčiv
Příčinou osteoporózy je nerovnováha mezi procesy novotvorby a resorpce kosti. Řada dnes používaných léčiv působí proti resorpci kostní hmoty, aniž by výrazněji zasahovala do procesů její novotvorby. Mezi tato „antiresorpční" léčiva patří např. bisfosfonáty (clodronat, pamidronat, alendronat, risedronat, zoledronat), selektivní modulátory estrogenových receptorů (raloxifen), kalcitonin, vitamin D a jeho analoga a soli vápníku. Strontium ranelat nepůsobí jen jako antiresorpční léčivo, existují důkazy o jeho pozitivně modulačních účincích na kostní novotvorbu, které jej společně s deriváty parathormonu řadí do skupiny léčiv označovaných jako kostní anabolika.
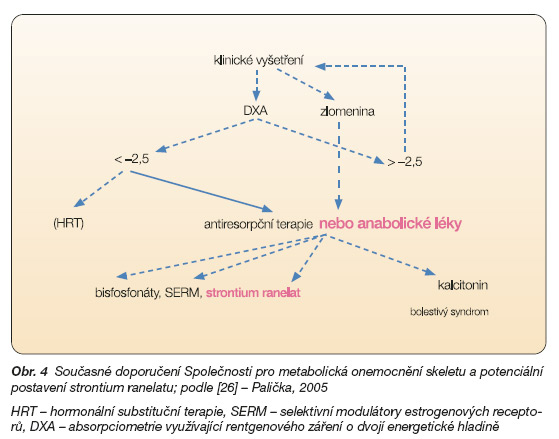
Prevence zlomenin je prvořadým cílem antiosteoporotické léčby. Ačkoliv chybí údaje přímého srovnání strontium ranelatu s dalšími léčivy, snížení rizika fraktur obratlů se zdá být podobné, jako je tomu v případě alendronatu (47 %) [22], 5mg risedronatu (49 %) [23], 60mg raloxifenu (30 %) [24] a derivátu parathormonu (65 % po 21 měsících léčby) [25]. Možné budoucí postavení strontium ranelatu na pozadí současného doporučení Společnosti pro metabolická onemocnění skeletu ukazuje obr. 4.
Uvážíme-li, že např. ve Velké Británii trpí osteoporózou po 50. roce života každá 3. žena, že přibližně 20 % lůžkového fondu oboru ortopedie „zaujímají" pacienti po zlomenině krčku kyčelního kloubu a že z nich kolem 20 % zemře v prvním roce po zlomenině [27], je zřejmé, že terapie osteoporózy má značný celospolečenský význam.
Obsáhlé přehledy podávající podrobné informace o mechanismu účinku, farmakokinetických i farmakodynamických vlastnostech strontium ranelatu a dosud provedených kontrolovaných klinických studiích se strontium ranelatem byly v našem písemnictví nedávno publikovány [28, 29]. Z dostupných informací vyplývá, že strontium ranelat je léčivem, které snižuje kostní resorpci a stimuluje kostní formaci, což prokazatelně vede k významnému snížení rizika vzniku vertebrálních a nonvertebrálních fraktur. Navíc má strontium ranelat velmi dobrou toleranci a nízký výskyt nežádoucích účinků.
Indikace
Léčba postmenopauzální osteoporózy vede ke snížení rizika vertebrálních a kyčelních fraktur [16]. Od 1. července 2005 je strontium ranelat hrazen z prostředků veřejného zdravotního pojištění s následujícím indikačním omezením [30]: léčbu strontium ranelatem ordinuje internista, ortoped, revmatolog, endokrinolog a gynekolog u pacientek:
a) ‑s komplikovanou osteoporózou definovanou jako T-skóre –2,5 na standardních měřených místech (bederní páteř, proximální femur, event. předloktí) metodou dvoufotonové kostní denzitometrie a pokud má pacientka osteoporotickou frakturu;
b) ‑u kterých jsou kontraindikovány bisfosfonáty nebo raloxifen;
c) ‑nesnášejících jiná antiresorpční léčiva nebo při projevech závažných nežádoucích účinků této léčby.
Léčba delší než 2 roky je indikována pouze u pacientek s prokazatelnou zástavou úbytku kostní denzity.
Kontraindikace
Strontium ranelat je kontraindikován u pacientek s přecitlivělostí na účinnou látku a není pro nedostatek zkušeností doporučován u pacientek s těžkou poruchou funkce ledviny (clearance kreatininu pod 30 ml/min) [16].
Strontium ranelat je určen pouze pro ženy v postmenopauze, podávání v graviditě, při kojení a u dětí tedy nepřichází v úvahu [16].
Nežádoucí účinky
V dosud provedených randomizovaných placebem kontrolovaných klinických studiích byl strontium ranelat podáván více než 3 000 pacientek a placebo též více než 3 000 pacientek. Výskyt nežádoucích účinků se výrazně nelišil od výskytu nežádoucích účinků hlášených po podávání placeba [19–21, 31].
Nejčastěji se objevujícím nežádoucím účinkem byla nauzea a průjem, které vedly k ukončení terapie u 2,2 % pacientek užívajících strontium ranelat (ve srovnání s 1,3 % pacientek užívajících placebo).
K dalším měně častým nežádoucím účinkům patří bolesti hlavy, dermatitida nebo kožní ekzémy a zvýšení hodnot jaterních transamináz.
V rámci klinického hodnocení strontium ranelatu před registrací bylo zjištěno mírné zvýšení rizika venózního tromboembolismu (zvýšení relativního rizika o 42 %, s rozmezím 2–98 %, p = 0,036) a mírné zvýšení výskytu nežádoucích účinků na CNS (poruchy vědomí, ztráta paměti).
Lékové interakce
Biologickou dostupnost strontium ranelatu snižují adsorpční antacida (např. hydroxid hlinitý nebo hydroxid hořečnatý), a to o 20–25 %, a soli vápníku, a to o 60–70 % [16]. Strontium jako dvojmocný kation může vytvářet špatně vstřebatelné komplexy s tetracyklinovými antibiotiky (doxycyclinem, minocyclinem) nebo chinolonovými chemoterapeutiky (např. ofloxacinem, ciprofloxacinem) [16].
Kyselina ranelová se v organismu nebiotransformuje, není ani induktorem, ani inhibitorem žádného z izoenzymů cytochromu P-450, a je tedy vysoce nepravděpodobné, že by mohla vést k lékovým interakcím při současném podávání s jinými léčivy [16].
V dosud provedených klinických studiích a v postmarketingovém sledování nebyly zjištěny lékové interakce v případě současného podávání strontium ranelatu s NSAIDs, kyselinou acetylsalicylovou, paracetamolem, H2-blokátory, inhibitory protonové pumpy, digoxinem, nitráty, blokátory vápníkových kanálů, b-blokátory, léčivy ovlivňujícími renin-angiotenzinový systém, perorálními antikoagulancii, antiagregancii, statiny, fibráty, benzodiazepiny nebo b2-sympatomimetiky [16].
Těhotenství a kojení
Strontium u experimentálních zvířat prostupuje placentární bariérou [14] a přestupuje do mateřského mléka [15]. Není známo, zda a v jakém množství přechází strontium placentou nebo do mateřského mléka u lidí. Vzhledem k nedostatku zkušeností a vzhledem ke skutečnosti, že je strontium ranelat určen pro postmenopauzální ženy, nedoporučuje výrobce strontium ranelatu jeho podávání v těhotenství a v období kojení [16].
Zvláštní upozornění a bezpečnostní varování
Opatrnosti je třeba u pacientek trpících hlubokou žilní trombózou v anamnéze nebo u pacientek s predispozicí k tromboembolismu [16].
Ovlivnění pozornosti
Podávání strontium ranelatu nevede ke snížení pozornosti nebo ke stavům, které by mohly vyústit ve vznik jakéhokoli rizika při obsluhování strojů nebo řízení motorových vozidel [16].
Předávkování
Podávání vysokých dávek strontium ranelatu (4 g denně po dobu 25 dnů) zdravým dobrovolnicím nevedlo ke zvýšení výskytu nežádoucích účinků nebo k projevům předávkování. Ani významně vyšší dávky (11 g jednorázově) nevedly v případě mužských zdravých dobrovolníků k projevům předávkování nebo neočekávaným nežádoucím účinkům [16].
Neradioaktivní strontium má velmi nízkou toxicitu po perorálním podání [32].
Při náhodném předávkování strontium ranelatem doporučuje výrobce podání antacid nebo mléka či vyvolání zvracení [16].
Dávkování
Podávají se 2 g strontium ranelatu 1krát denně, nejlépe večer před spaním alespoň 2 hodiny po večeři [16].
Složení
Každý sáček obsahuje strontium ranelat v množství 2 g a jako pomocné látky obsahuje aspartam v množství 20 mg (odpovídá 11,2 mg fenylalaninu) [33], dále obsahuje manitol a maltodextrin.
Balení
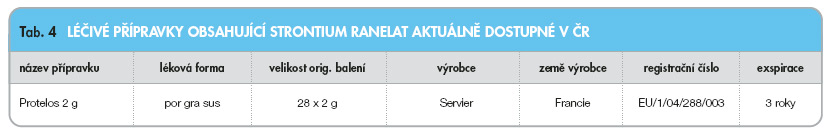
Viz tab. 4.
Seznam použité literatury
- [1] http://de.wikipedia.org/wiki/Strontium.
- [2] USP DI® Drug Information for the Health Care Professional: Strontium chloride SR 89 (Systemic), Thomson MICROMEDEX, vol 124, 2005.
- [3] Reginster JY, et al. Strontium ranelate: a new paradigm on the treatment of osteoporosis. Drugs of Today 2003; 39: 89–101.
- [4] Lehnerdt F. Zur frage der substitution des calciums in knochensystem durch strontium. Beitr Path Anat 1910; 47: 215–245.
- [5] Shipley PG, Park EA. Studies on experimental rickets. XX. The effects of strontium administration on the histological structure of growing bones. Bull Johns Hopkins Hosp Balt 1922; 33: 216–220.
- [6] Janes JM, McCaslin F. The effect of strontium lactate in ther treatment of osteoporosis. Mayo Clin Proc 1959; 34: 329–334.
- [7] Ferraro EF, et al. A comparison of the effects of strontium chloride and calcium chloride on alveo-lar bone. Calcif Tissue Int 1983; 35: 258–260.
- [8] Reid IR, et al. The assessment of intestinal calcium absorption using stable strontium. Calcif Tissue Int 1986; 38: 303–305.
- [9] Marie PJ, et al. Mechanism of action and therapeutic potential of strontium in bone. Calcif Tissue Int 2001; 69: 121–129.
- [10] Marie PJ, et al. Optimising bone metabolism in osteoporosis: insight into the pharmacologic profile of strontium ranelate. Osteoporos Int 2003; 14 (suppl 3): S9–S12.
- [11] Coulombe J, et al. In vitro effects of strontium ranelate on the extracellular calcium-sensing receptor. Biochem Biophys Res Commun 2004; 323; 1184–1190.
- [12] Reginster JY, et al. Strontium Ranelate in Osteoporosis. Curr Pharm Design 2002; 8: 1907–1916.
- [13] Ghosh S, Talukder G, Sharma A. Clastogenic activity of strontium chloride on bone marrow cells in vivo. Biol Trace Elem Res 1990; 25: 51–56.
- [14] Onyskowova Z, Josifko M. Strontium-85 in the fetuses of pregnant rats and mice. J Hyg Epidemiol Microbiol Immunol 1985; 29: 1–7.
- [15] Anderson RR. Trace elements in milk of guinea pigs during a 20-day lactation. J Dairy Sci 1990; 73: 2327–2332.
- [16] Souhrn údajů o přípravku: Protelos® 2 g por gra sus (Servier, 20. 10. 2004).
- [17] Dahl SG, et al. Incorporation and distribution of strontium in bone. Bone 2001; 28: 446–453.
- [18] Reginster JY, et al. Strontium ranelate reduces the risk of hip fracture in women with postmenopausal osteoporosis. PREVOS trial (prevention of early postmenopausal bone loss by strontium ranelate). Osteoporosis Int 2002; 13: 925–931.
- [19] Reginster JY, Meunier PJ. Strontium ranelate phase 2 dose-ranging studies PREVOS and STRATOS studies. Osteoporosis Int 2003; 14 (suppl 3): 56–65.
- [20] Meunier PJ, et al. The effects of strontium ranelate on the risk of vertebral fracture in women with postmenopausal osteoporosis. SOTI trial (Spinal Osteoporosis Therapeutic Intervention Trial). N Engl J Med 2004; 350: 459–468.
- [21] Reginster JY, et al. Strontium Ranelate Reduces the Risk of Nonvertebral Fractures in Postmenopausal Women with Osteoporosis: Treatment of Periferal Osteoporosis (TROPOS) Study. J Clin Endocrinol Metab 2005; 90: 2816–2822.
- [22] Black DM, Cummings SR, Karpf DB, et al. Randomised trial of effect of alendronate on risk of fracture in women with existing vertebral fractures. Fracture Intervention Trial Research Group. Lancet 1996; 348: 1535–1541.
- [23] Reginster JY, Minne HW, Sorensen OH, et al. Randomized trial of the effects of risedronate on vertebral fractures in women with established postmenopausal osteoporosis. Osteopor Int 2000; 11: 83–91.
- [24] Ettinger B, Black DM, Mitlak BH, et al. Reduction of vertebral fracture risk in postmenopausal women with osteoporosis treated with raloxifene: results from a 3-year randomized clinical trial. Multiple Outcomes of Raloxifene Evaluation (MORE) Investigators. JAMA 1999 Aug 18; 282: 637–645, Erratum in: JAMA 1999; 282: 2124.
- [25] Neer RM, Arnaud CD, Zanchetta JR, et al. Effect of parathyroid hormone (1-34) on fractures and bone mineral density in postmenopausal women with osteoporosis. N Engl J Med 2001; 344: 1434–1441.
- [26] Symposium společnosti Servier (viz www.osteozlin.cz).
- [27] National Osteoporosis Society. What is osteoporosis? www.nos.org.uk/osteo.asp.
- [28] Jenšovský J. Stroncium ranelát – nový lék a nový princip v léčbě osteroporózy. Medicína po promoci 2004; 5: 71–75.
- [29] Kutílek Š. Stroncium ranelát – perspektivní přípravek pro léčbu osteoporózy. Osteologický bulletin 2005; 10: 7–11.
- [30] Vyhláška, kterou se mění vyhláška č. 589/2004 Sb., o úhradách léčiv a potravin pro zvláštní účely. Sbírka zákonů, Česká republika, částka 82, rozeslána 15. června 2005, strana 4593.
- [31] Spector T, Selby P. Strontium ranelate: a new treatment for osteoporosis. Osteoporosis Rev 2004; 12: 8–10.
- [32] Bingham E, Cohrssen B, & Powell CH. Patty´s Toxicology, 5th ed, John Wiley & Sons, New York, NY, 2001.
- [33] Laboratoires Servier, osobní komunikace, září 2005.