Telmisartan v sekundární prevenci
S ohledem na dříve publikovaná data [1, 2] jsme farmakologickou charakteristiku látky omezili na nejdůležitější parametry a zaměřili se zejména na nové poznatky v oblasti klinických zkušeností. Jedná se především o výsledky mortalitních studií prezentovaných a publikovaných v roce 2008. Studie ONTARGET ukázala srovnatelnou účinnost telmisartanu s ramiprilem u nemocných v sekundární prevenci ischemické choroby srdeční a nepotvrdila, že kombinace ramipril/telmisartan je účinnější, naopak byl pozorován častější výskyt zhoršení renálních funkcí a hypotenze. Studie TRANSCEND potvrdila příznivý vliv telmisartanu u nemocných netolerujících inhibitory ACE v sekundární prevenci ischemické choroby srdeční a studie PRoFESS ukázala pozitivní trend ke snížení výskytu kardiovaskulárních příhod a nového diabetu mellitu u nemocných v sekundární prevenci cévní mozkové příhody. Rozsáhlý program PROTECTION potvrdil metabolicky pozitivní a reno-protektivní vlastnosti telmisartanu.
Farmakologická skupina
Antihypertenzivum; antagonista angiotenzinu II, ATC kód: C09CA07
Chemické a fyzikální vlastnosti
viz [1]
Mechanismus účinku, farmakodynamika
Telmisartan je nepeptidový, reverzibilní, nekompetitivní antagonista angiotenzinu II na AT1-receptorech. Angiotenzin II (AT II) je aktivní oktapeptid, který vzniká odstraněním 2 aminokyselin z angiotenzinu I působením angiotenzin konvertujícího enzymu (ACE). Celý systém renin-angiotenzin-aldosteron (RAAS) hraje důležitou roli při rozvoji hypertenze a srdečního selhání, a představuje tedy i klíčové místo pro terapeutické intervence. Cirkulující AT II vyvolává vazokonstrikci a zvyšuje tak periferní cévní odpor. Tkáňový AT II má dlouhodobé vazoaktivní, mitogenní a proliferační účinky. V organismu byly objeveny dva subtypy receptorů pro AT II, typ AT1 a AT2. Stimulace AT1-receptorů je zodpovědná za negativní důsledky aktivace systému RAAS. Může vést k hypertenzi v důsledku vazokonstrikce, reabsorpce sodíku v ledvinách a stimulace sekrece aldosteronu; dále má proliferativní vliv, účastní se remodelace a podporuje vznik hypertrofie myokardu. Na druhou stranu stimulace AT2-receptorů vyvolává vazodilataci, má natriuretický účinek, řídí buněčnou proliferaci a diferenciaci, rozvoj angiogeneze, regeneraci tkání a hojení ran [3–7].
Telmisartan nevyvíjí na receptoru AT1 žádnou parciální agonistickou aktivitu a váže se selektivně a dlouhodobě na tento receptor bez ovlivnění jiných receptorových typů a skupin. Afinita telmisartanu k receptorovému subtypu AT1 je 3000krát vyšší než k subtypu AT2, tím jsou inhibovány všechny negativní projevy spojené s aktivací AT1 při současném zachování aktivity receptorů typu AT2 [8–11]. Podáváním telmisartanu se zvyšují plazmatické hladiny angiotenzinu II a snižují se plazmatické hladiny aldosteronu. Telmisartan neovlivňuje plazmatický renin ani angiotenzin konvertující enzym (ACE), a nepředpokládá se tedy vznik nežádoucích účinků zprostředkovaných bradykininem v důsledku inhibice kinázy [8]. Incidence typického kašle byla ve studiích stejná jako ve skupině placeba [12].
Při porovnání chemických struktur sartanů si můžeme všimnout, že telmisartan svojí strukturou spíše připomíná molekulu thiazolidindionů, senzitizátorů inzulinových receptorů pioglitazonu a rosiglitazonu. Díky tomu má jako jediný ze sartanů schopnost aktivovat receptory PPAR-g (peroxisome proliferator-activated receptor g), a v důsledku toho zlepšuje metabolismus lipidů a cukrů. Kromě strukturální podobnosti s thiazolidindiony má telmisartan oproti ostatním sartanům větší distribuční objem, což vypovídá o významné extravaskulární distribuci látky a může to znamenat lepší průnik k PPAR-g. Díky těmto vlastnostem bývá řazen mezi látky s kardiometabolickými účinky [2].
Farmakokinetické vlastnosti
Výhodou telmisartanu oproti ostatním antagonistům AT1-receptorů je jeho vysoká lipofilita a velký distribuční objem, což předurčuje dobrou absorpci a klinicky významný tkáňový průnik. Telmisartan se po perorálním podání rychle vstřebává, průměrná hodnota biologické dostupnosti je asi 50 %. Maximální plazmatické koncentrace (cmax) a v menší míře plocha pod křivkou plazmatických koncentrací v závislosti na čase (AUC) rostou nerovnoměrně s dávkou. Rozdíly v plazmatických hladinách byly pozorovány v závislosti na pohlaví; hodnoty cmax jsou přibližně třikrát vyšší a hodnoty AUC dvakrát vyšší u žen než u mužů, avšak bez významného ovlivnění 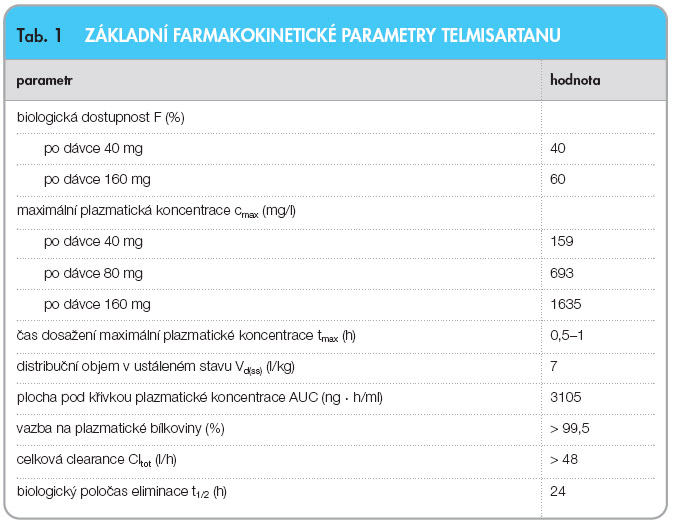 účinnosti. V přítomnosti potravy s vysokým obsahem tuků dochází k mírnému snížení biologické dostupnosti, avšak studie kontrolovaná placebem u hypertenzních pacientů potvrdila, že telmisartan může být podáván s jídlem bez nutnosti úpravy dávky. Oproti ostatním sartanům je výhodou podání aktivní molekuly bez nutnosti aktivace z formy prodrug (např. losartan a kandesartan). Telmisartan se významně váže na plazmatické bílkoviny (> 99,5 %), především na albumin a α1-kyselý glykoprotein. Byla prokázána reverzibilní distribuce do erytrocytů. Distribuční objem v ustáleném stavu dosahuje přibližně 500 l. Ustálené koncentrace je dosaženo během 5–7 dnů. Telmisartan se v organismu prakticky nebiotransformuje, jen ve velmi malém rozsahu podléhá konjugaci s kyselinou glukuronovou. Vzniklý acylglukuronid telmisartanu je farmakologicky inaktivní a vylučuje se rychleji než mateřská molekula. Telmisartan není metabolizován systémem cytochromu P-450. Z toho vyplývá, že nemá farmakokinetické lékové interakce způsobené inhibicí nebo indukcí na úrovni některých izoforem cytochromů (CYP), pouze mírně zvyšuje expozici digoxinu. Biologický poločas je ve srovnání s ostatními zástupci skupiny prodloužený a telmisartan je podáván pouze jednou denně. Po perorálním i nitrožilním podání se telmisartan eliminuje stolicí, kumulativní vylučování močí představuje < 1 % dávky. Celková plazmatická clearance (Cltot) je vysoká (přibližně 1000 ml/min) v porovnání s průtokem krve játry (kolem 1500 ml/min). Více než 90 % podané dávky je vyloučeno během 120 hodin, úplná exkrece je ukončena 144 hodin po podání. Základní farmakokinetické parametry telmisartanu shrnuje tab. 1.
účinnosti. V přítomnosti potravy s vysokým obsahem tuků dochází k mírnému snížení biologické dostupnosti, avšak studie kontrolovaná placebem u hypertenzních pacientů potvrdila, že telmisartan může být podáván s jídlem bez nutnosti úpravy dávky. Oproti ostatním sartanům je výhodou podání aktivní molekuly bez nutnosti aktivace z formy prodrug (např. losartan a kandesartan). Telmisartan se významně váže na plazmatické bílkoviny (> 99,5 %), především na albumin a α1-kyselý glykoprotein. Byla prokázána reverzibilní distribuce do erytrocytů. Distribuční objem v ustáleném stavu dosahuje přibližně 500 l. Ustálené koncentrace je dosaženo během 5–7 dnů. Telmisartan se v organismu prakticky nebiotransformuje, jen ve velmi malém rozsahu podléhá konjugaci s kyselinou glukuronovou. Vzniklý acylglukuronid telmisartanu je farmakologicky inaktivní a vylučuje se rychleji než mateřská molekula. Telmisartan není metabolizován systémem cytochromu P-450. Z toho vyplývá, že nemá farmakokinetické lékové interakce způsobené inhibicí nebo indukcí na úrovni některých izoforem cytochromů (CYP), pouze mírně zvyšuje expozici digoxinu. Biologický poločas je ve srovnání s ostatními zástupci skupiny prodloužený a telmisartan je podáván pouze jednou denně. Po perorálním i nitrožilním podání se telmisartan eliminuje stolicí, kumulativní vylučování močí představuje < 1 % dávky. Celková plazmatická clearance (Cltot) je vysoká (přibližně 1000 ml/min) v porovnání s průtokem krve játry (kolem 1500 ml/min). Více než 90 % podané dávky je vyloučeno během 120 hodin, úplná exkrece je ukončena 144 hodin po podání. Základní farmakokinetické parametry telmisartanu shrnuje tab. 1.
U pacientů s insuficiencí ledvin není nutné upravovat dávky; u hemodialyzovaných se plazmatické hladiny telmisartanu značně snižují a zvyšuje se podíl volné složky telmisartanu. U pacientů s poruchou jater vzrůstá absolutní biologická dostupnost téměř na 100 %, celková clearance klesá, ale poločas eliminace ani vazba na plazmatické bílkoviny se nemění. Podání telmisartanu je u těchto pacientů vhodné v nejnižších dostupných dávkách. Farmakokinetika telmisartanu není závislá na věku [13–15].
Klinické zkušenosti
O klinických studiích s telmisartanem bylo v tomto časopise již opakovaně referováno [1, 2]. Dokončen byl program PROTECTION (Programme of Research tO show Telmisartan End-organ proteCTION), který srovnával účinost telmisartanu s jinými antihypertenzivy – enalaprilem, ramiprilem, losartanem, amlodipinem. Tento program se skládal z 9 randomizovaných studií prováděných ve 32 zemích a zahrnul celkem 6875 nemocných. Ve všech studiích byl telmisartan vysoce účinným antihypertenzivem s metabolicky pozitivními a renoprotektivními účinky a ani v jednom parametru nebyl horší než výše uvedená léčiva. Telmisartan snižoval proteinurii (studie AMADEO, VIVALDI a další), dobře kontroloval krevní tlak po dobu 24 hodin (studie PRISMA I a PRISMA II). V roce 2008 byly prezentovány 3 velké mezinárodní, multicentrické mortalitní studie s telmisartanem – ONTARGET, TRANSCEND a PRoFESS.
Studie ONTARGET
Odpověď na otázku, zda telmisartan v dávce 80 mg denně a ramipiril 10 mg denně v sekundární prevenci nemocných s ischemickou chorobou srdeční, ischemickou chorobou dolních končetin, po cévní mozkové příhodě (CMP) a s diabetem mellitem a orgánovým postižením jsou rovnocenné, přinesla až studie ONTARGET [1–3], která byla přednesena na kongresu American College of Cardiology v Chicagu na jaře 2008 a následně publikována v New England Journal of Medicine [16–18]. Studie sledovala 25 577 nemocných a probíhala v 733 centrech ve 40 zemích (včetně České republiky). Studie začínala tzv. run in periodou, kdy bylo užíváno 2,5 mg ramiprilu nebo 40 mg telmisartanu a byla zjišťována tolerance léčiv. Pokud pacienti lék netolerovali, nebyli dále randomizováni. Celkem bylo takto vyloučeno 3399 nemocných, většina pro špatnou compliance, 597 pro hypotenzi, 223 pro hyperkalémii. Nemocní pak byli randomizováni k léčbě ramiprilem v dávce 10 mg denně nebo telmisartanem v dávce 80 mg denně nebo k léčbě jejich kombinací. Studie byla ukončena v souladu s protokolem po dosažení konečného počtu sledovaných cílů (endpointů). Všichni nemocní dostávali velmi dobrou doprovodnou léčbu.
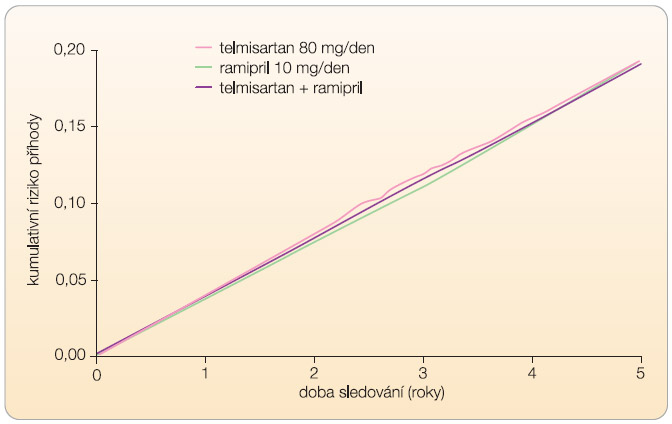
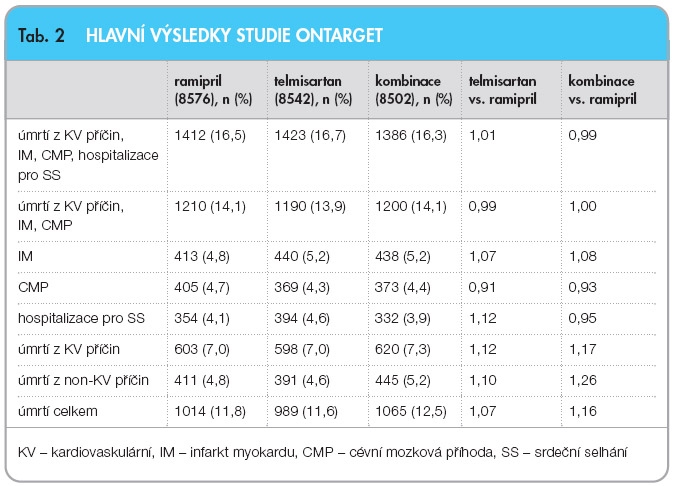 Za šest týdnů poklesl krevní tlak o 6,4/4,3 mm Hg při léčbě ramiprilem, o 7,4/5,0 mm Hg při léčbě telmisartanem a o 9,8/6,3 mm Hg při léčbě kombinací. Tento trend pokračoval po celou dobu studie, kdy pokles tlaku při léčbě telmisartanem byl o 0,9/0,6 mm Hg větší a při léčbě kombinací o 2,4/1,4 mm Hg větší než při léčbě ramiprilem i na konci studie. Počet nemocných, kteří ukončili účast ve studii pro nežádoucí účinky při léčbě ramiprilem, byl 2099 (24,5 %), při léčbě telmisartanem 1962 (23,0 %) a při léčbě kombinací 2495 (29,3 %), p < 0,001. Hlavní rozdíl byl ve vyšším výskytu hypotenze (p < 0,001), průjmu (p < 0,001) a renální insuficience (p < 0,001) při léčbě kombinací. Zásadní výsledky studie ONTARGET ukazuje tab. 2 a graf 1. Ani jeden rozdíl v uvedených parametrech nedosáhl statistické významnosti a z pohledů hlavních cílů je léčba ramiprilem, telmisartanem i jejich kombinací srovnatelná.
Za šest týdnů poklesl krevní tlak o 6,4/4,3 mm Hg při léčbě ramiprilem, o 7,4/5,0 mm Hg při léčbě telmisartanem a o 9,8/6,3 mm Hg při léčbě kombinací. Tento trend pokračoval po celou dobu studie, kdy pokles tlaku při léčbě telmisartanem byl o 0,9/0,6 mm Hg větší a při léčbě kombinací o 2,4/1,4 mm Hg větší než při léčbě ramiprilem i na konci studie. Počet nemocných, kteří ukončili účast ve studii pro nežádoucí účinky při léčbě ramiprilem, byl 2099 (24,5 %), při léčbě telmisartanem 1962 (23,0 %) a při léčbě kombinací 2495 (29,3 %), p < 0,001. Hlavní rozdíl byl ve vyšším výskytu hypotenze (p < 0,001), průjmu (p < 0,001) a renální insuficience (p < 0,001) při léčbě kombinací. Zásadní výsledky studie ONTARGET ukazuje tab. 2 a graf 1. Ani jeden rozdíl v uvedených parametrech nedosáhl statistické významnosti a z pohledů hlavních cílů je léčba ramiprilem, telmisartanem i jejich kombinací srovnatelná.
 V hodnocení vedlejších cílů nebyl zaznamenán rozdíl v počtu revaskularizací, v počtu hospitalizací pro anginu pectoris, v počtu nově diagnostikovaných případů diabetu, srdečního selhání a fibrilace síní. Jediný rozdíl byl ve výskytu renálního selhání, které bylo statisticky významně častější při kombinační léčbě (10,2 % vs. 10,6 % vs. 13,5 %; p < 0,001). Studie ONTARGET potvrdila srovnatelnou účinnost antagonisty AII telmisartanu (80 mg denně) a inhibitoru ACE ramiprilu (10 mg denně) v sekundární prevenci ischemické choroby srdeční, ischemické choroby dolních končetin, u pacientů po CMP, s diabetem mellitem a orgánovým postižením. Léčba telmisartanem však byla lépe tolerována. Studie naopak nepotvrdila vhodnost kombinace obou léčiv pro nebezpečí zhoršení renálních funkcí. Výsledky studie ONTARGET jsou velmi podobné výsledkům studie VALIANT, obě studie ukazují, že léčba kombinací antagonistů AII a inhibitorů ACE je provázena významným rizikem nežádoucích účinků [19]. Kombinační léčba u nemocných po infarktu myokardu není proto doporučena. Studie ONTARGET a VALIANT byly provedeny u nemocných s ischemickou chorobou srdeční, resp. u nemocných po infarktu myokardu. Jejich výsledky jsou v rozporu s výsledky studií u srdečního selhání CHARM a Val-HeFT, kde kombinační léčba naopak vedla ke snížení počtu hospitalizací bez zvýšení výskytu nežádoucích účinků.
V hodnocení vedlejších cílů nebyl zaznamenán rozdíl v počtu revaskularizací, v počtu hospitalizací pro anginu pectoris, v počtu nově diagnostikovaných případů diabetu, srdečního selhání a fibrilace síní. Jediný rozdíl byl ve výskytu renálního selhání, které bylo statisticky významně častější při kombinační léčbě (10,2 % vs. 10,6 % vs. 13,5 %; p < 0,001). Studie ONTARGET potvrdila srovnatelnou účinnost antagonisty AII telmisartanu (80 mg denně) a inhibitoru ACE ramiprilu (10 mg denně) v sekundární prevenci ischemické choroby srdeční, ischemické choroby dolních končetin, u pacientů po CMP, s diabetem mellitem a orgánovým postižením. Léčba telmisartanem však byla lépe tolerována. Studie naopak nepotvrdila vhodnost kombinace obou léčiv pro nebezpečí zhoršení renálních funkcí. Výsledky studie ONTARGET jsou velmi podobné výsledkům studie VALIANT, obě studie ukazují, že léčba kombinací antagonistů AII a inhibitorů ACE je provázena významným rizikem nežádoucích účinků [19]. Kombinační léčba u nemocných po infarktu myokardu není proto doporučena. Studie ONTARGET a VALIANT byly provedeny u nemocných s ischemickou chorobou srdeční, resp. u nemocných po infarktu myokardu. Jejich výsledky jsou v rozporu s výsledky studií u srdečního selhání CHARM a Val-HeFT, kde kombinační léčba naopak vedla ke snížení počtu hospitalizací bez zvýšení výskytu nežádoucích účinků.
Studie TRANSCEND
Výsledky studie TRANSCEND byly předneseny na kongresu Evropské kardiologické společnosti v Mnichově v září 2008 a následně publikovány v časopise Lancet [20]. Studie s plným názvem the Telmisartan Randomised AssessmeNt Study in ACE iNtolerant subjects with 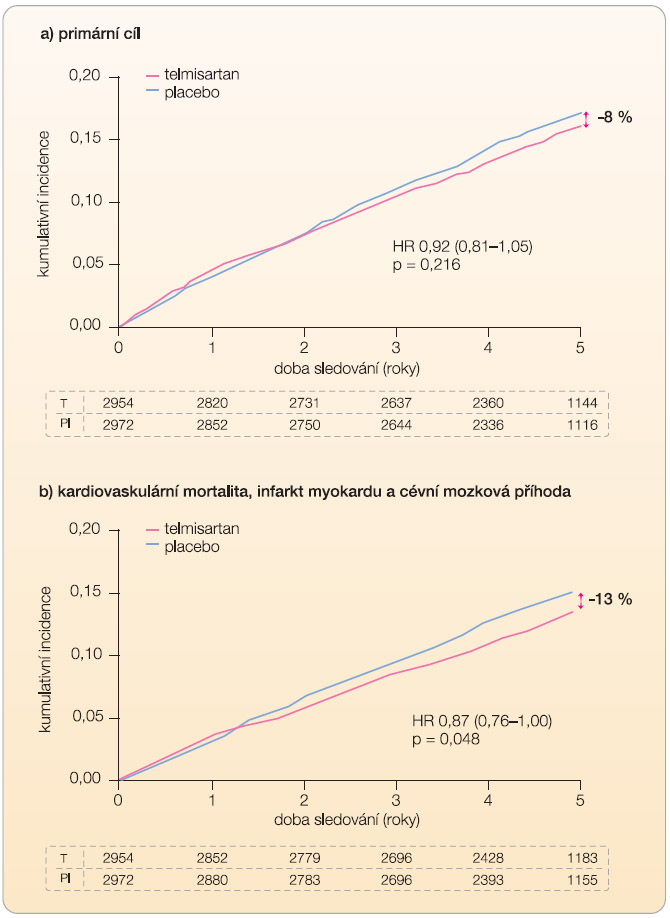 cardiovascular disease vycházela ze základního předpokladu, že inhibitory ACE snižují mortalitu u nemocných s kardiovaskulárními onemocněními, ale až 20 % nemocných – především ženy a Asiati – je netoleruje (pro českou populaci se odhaduje 5–15 %). Telmisartan byl porovnáván s placebem a nemocní měli kompletní doplňující medikaci, včetně β-blokátorů, antiagregace a statinů. Po 3týdenní periodě byli nemocní randomizováni k léčbě telmisartanem v dávce 80 mg denně (n = 2954) nebo k podávání placeba (n = 2972). Primární cíl byl složený – kardiovaskulární úmrtí, infarkt myokardu, CMP a hospitalizace pro srdeční selhání. Průměrný věk při randomizaci byl 66,9 roku v obou skupinách, průměrný krevní tlak 140,7/81,8 mm Hg v telmisartanové skupině a 141,3/82,0 mm Hg v placebové skupině. Ženy tvořily 43 % a zastoupení Asiatů bylo 21 %. Nemocným v obou skupinách byly často podávány statiny (55,7 %, resp. 54,7 %), β-blokátory (59,3 %, resp. 57,2 %), kyselina acetylsalicylová (75,0 %, resp. 74,4 %) a 10 % pacientům byl v obou skupinách podáván klopidogrel.
cardiovascular disease vycházela ze základního předpokladu, že inhibitory ACE snižují mortalitu u nemocných s kardiovaskulárními onemocněními, ale až 20 % nemocných – především ženy a Asiati – je netoleruje (pro českou populaci se odhaduje 5–15 %). Telmisartan byl porovnáván s placebem a nemocní měli kompletní doplňující medikaci, včetně β-blokátorů, antiagregace a statinů. Po 3týdenní periodě byli nemocní randomizováni k léčbě telmisartanem v dávce 80 mg denně (n = 2954) nebo k podávání placeba (n = 2972). Primární cíl byl složený – kardiovaskulární úmrtí, infarkt myokardu, CMP a hospitalizace pro srdeční selhání. Průměrný věk při randomizaci byl 66,9 roku v obou skupinách, průměrný krevní tlak 140,7/81,8 mm Hg v telmisartanové skupině a 141,3/82,0 mm Hg v placebové skupině. Ženy tvořily 43 % a zastoupení Asiatů bylo 21 %. Nemocným v obou skupinách byly často podávány statiny (55,7 %, resp. 54,7 %), β-blokátory (59,3 %, resp. 57,2 %), kyselina acetylsalicylová (75,0 %, resp. 74,4 %) a 10 % pacientům byl v obou skupinách podáván klopidogrel.
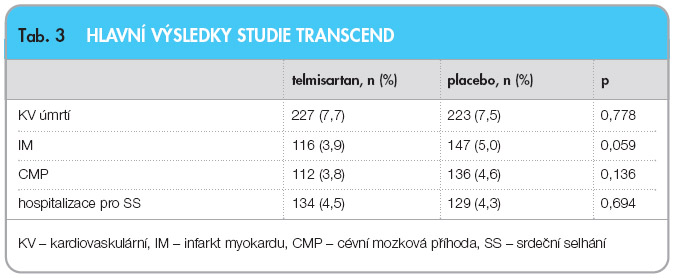 Procento nemocných, kteří ukončili léčbu pro podobné příznaky jako při intoleranci inhibitorů ACE, bylo minimální (0,54 %, resp. 0,57 %). Pokles krevního tlaku byl na konci studie o 3,2/1,3 mm Hg vyšší po podávání telmisartanu než po podávání placeba. Hlavní výsledky studie TRANSCEND ukazuje tab. 3 a graf 2. Podávání telmisartanu po dobu průměrně 56 měsíců vedlo ke snížení primárního cíle pouze o 8 % (15,8 % vs. 17 % v placebové větvi), což nedosáhlo statistické významnosti. Zajímavé jsou některé vedlejší cíle, především nově diagnostikovaný diabetes mellitus u 209 (11,0 %) vs. 245 (12,8 %) pacientů (p = 0,08) a nová hypertrofie levé komory, u 128 (5,0 %) vs. 202 (7,9 %) pacientů (p < 0,001). Studie TRANSCEND ukázala, že v dnešní době kvalitní farmakoterapie po infarktu myokardu není pravděpodobné další výrazné snižování mortality novou lékovou skupinou [21].
Procento nemocných, kteří ukončili léčbu pro podobné příznaky jako při intoleranci inhibitorů ACE, bylo minimální (0,54 %, resp. 0,57 %). Pokles krevního tlaku byl na konci studie o 3,2/1,3 mm Hg vyšší po podávání telmisartanu než po podávání placeba. Hlavní výsledky studie TRANSCEND ukazuje tab. 3 a graf 2. Podávání telmisartanu po dobu průměrně 56 měsíců vedlo ke snížení primárního cíle pouze o 8 % (15,8 % vs. 17 % v placebové větvi), což nedosáhlo statistické významnosti. Zajímavé jsou některé vedlejší cíle, především nově diagnostikovaný diabetes mellitus u 209 (11,0 %) vs. 245 (12,8 %) pacientů (p = 0,08) a nová hypertrofie levé komory, u 128 (5,0 %) vs. 202 (7,9 %) pacientů (p < 0,001). Studie TRANSCEND ukázala, že v dnešní době kvalitní farmakoterapie po infarktu myokardu není pravděpodobné další výrazné snižování mortality novou lékovou skupinou [21].
Studie PRoFESS
Cílem studie PRoFESS – Telmisartan to Prevent Recurrent Stroke and Cardiovascular Events – bylo potvrdit, že dlouhodobé snižování krevního tlaku telmisartanem po CMP povede ke snížení rizika opakování CMP [22]. Význam blokády renin-angio-tenzinového systému je podrobně popsán po infarktu myokardu a u srdečního selhání, zda má ale tato blokáda význam i časně po CMP, nebylo zatím ve větší klinické studii zkoumáno.
PRoFESS je mezinárodní multicentrická klinická studie, která zařadila 20 332 nemocných s čerstvě prodělanou CMP. Vhodní k zařazení do studie byli nemocní starší 55 let s anamnézou CMP v 90 dnech před randomizací. Po zařazení prvních 6000 nemocných byla věková hranice zařazovaných pacientů snížena na 50 let. Randomizace proběhla způsobem 2 x 2, nejprve k léčbě fixní kombinací kyselina acetylsalicylová 25 mg/dipyridamol 200 mg 2krát denně nebo k léčbě klopidogrelem 75 mg denně a následně k podávání telmisartanu nebo placeba. 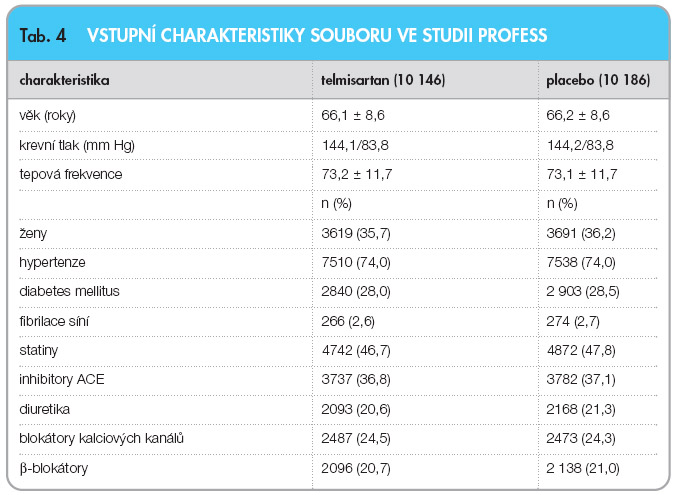 Celkem 10 146 nemocných dostávalo telmisartan v dávce 80 mg jednou denně a 10 186 pacientů užívalo placebo. Jakákoliv další medikace s výjimkou AII antagonistů byla povolena. Primárním cílem studie bylo sledování výskytu nových CMP, sekundárním cílem byl výskyt velkých kardiovaskulárních příhod (úmrtí na KV příhodu, nová CMP, infarkt myokardu, zhoršení srdečního selhání) a nově diagnostikovaný diabetes mellitus. Průměrná doba mezi vznikem CMP a zařazením do studie byla 15 dní, průměrná doba sledování 2,5 roku. Krevní tlak na začátku studie dosahoval 144,1/83,8 mm Hg a po léčbě telmisartanem byl o 3,8/2,0 mm Hg nižší než po podávání placeba. Charakteristiku souboru ukazuje tab. 4.
Celkem 10 146 nemocných dostávalo telmisartan v dávce 80 mg jednou denně a 10 186 pacientů užívalo placebo. Jakákoliv další medikace s výjimkou AII antagonistů byla povolena. Primárním cílem studie bylo sledování výskytu nových CMP, sekundárním cílem byl výskyt velkých kardiovaskulárních příhod (úmrtí na KV příhodu, nová CMP, infarkt myokardu, zhoršení srdečního selhání) a nově diagnostikovaný diabetes mellitus. Průměrná doba mezi vznikem CMP a zařazením do studie byla 15 dní, průměrná doba sledování 2,5 roku. Krevní tlak na začátku studie dosahoval 144,1/83,8 mm Hg a po léčbě telmisartanem byl o 3,8/2,0 mm Hg nižší než po podávání placeba. Charakteristiku souboru ukazuje tab. 4.
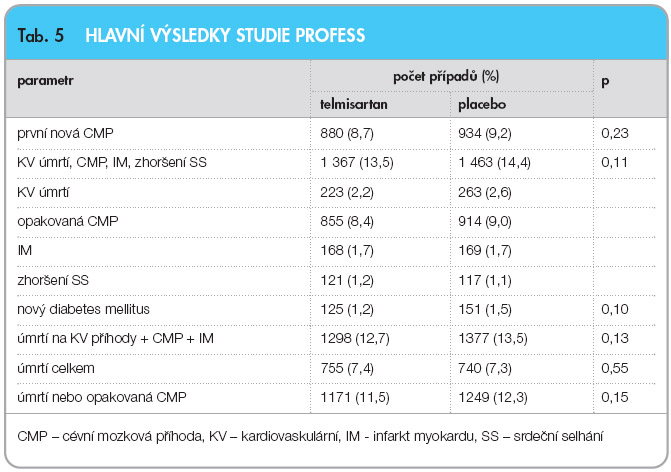 Celkem 880 (8,7 %) nemocných léčených telmisartanem a 934 (9,2 %) léčených placebem prodělalo novou CMP (p = 0,23). Na konci studie bylo v placebové větvi zaznamenáno výrazně častější užívání jiné antihypertenzní medikace, a to: diuretika 22,6 % vs. 28,2 %, inhibitory ACE 28,4 % vs. 33,9 %, kalciové blokátory 26,5 % vs. 30,9 % a β-blokátory 22,3 % vs. 25,4 %. Výskyt nežádoucích účinků byl vyšší po podávání telmisartanu – 14,3 % vs. 11,1 % (p < 0,001), a to především kvůli hypotenzi – 3,9 % vs. 1,8 % (p < 0,001). Velké kardiovaskulární příhody se vyskytly u 1367 (13,5 %) pacientů aktivně léčených a u 1463 (14,4 %) nemocných v placebové větvi (p = 0,11). Nový diabetes byl zjištěn u 1,2 % pacientů léčených telmisartanem a u 1,5 % pacientů, kteří dostávali placebo (p = 0,10), viz tab. 5.
Celkem 880 (8,7 %) nemocných léčených telmisartanem a 934 (9,2 %) léčených placebem prodělalo novou CMP (p = 0,23). Na konci studie bylo v placebové větvi zaznamenáno výrazně častější užívání jiné antihypertenzní medikace, a to: diuretika 22,6 % vs. 28,2 %, inhibitory ACE 28,4 % vs. 33,9 %, kalciové blokátory 26,5 % vs. 30,9 % a β-blokátory 22,3 % vs. 25,4 %. Výskyt nežádoucích účinků byl vyšší po podávání telmisartanu – 14,3 % vs. 11,1 % (p < 0,001), a to především kvůli hypotenzi – 3,9 % vs. 1,8 % (p < 0,001). Velké kardiovaskulární příhody se vyskytly u 1367 (13,5 %) pacientů aktivně léčených a u 1463 (14,4 %) nemocných v placebové větvi (p = 0,11). Nový diabetes byl zjištěn u 1,2 % pacientů léčených telmisartanem a u 1,5 % pacientů, kteří dostávali placebo (p = 0,10), viz tab. 5.
Studie PRoFESS prokázala příznivý trend ve snížení výskytu CMP, kardiovaskulárních příhod i nově diagnostikovaného diabetu mellitu u nemocných po CMP léčených telmisartanem oproti placebu. Pokles nedosáhl statistické významnosti především kvůli krátkému trvání studie – 2,5 roku. Je třeba zdůraznit, že ani rozdíly mezi léčebnými větvemi velkých klinických studií s inhibitory ACE po infarktu myokardu, jako byly HOPE, EUROPA a PEACE, po 2,5 letech ještě nedosahovaly statistické významnosti; bylo třeba sledování minimálně tříleté, aby alespoň některé ukazatele dosáhly hranice významnosti. Na základě výsledků studie PRoFESS můžeme uzavřít, že telmisartan by měl být samozřejmou součástí sekundární prevence u nemocných po CMP.
Zařazení do současné palety léčiv
Antagonisté angiotenzinu II patří k pěti základním skupinám léčiv určených k iniciální terapii hypertenze podle Evropské společnosti pro hypertenzi (ESH). Upřednostňována jsou tato léčiva především u nemocných s metabolickým syndromem, diabetem mellitem, s diabetickou i nediabetickou nefropatií, s ischemickou chorobou srdeční či u nemocných se srdečním selháním a s paroxysmální fibrilací síní. Samozřejmou indikací je intolerance inhibitorů ACE kvůli kašli. Telmisartan splňuje požadavky na moderní antihypertenzivum s dávkováním jednou denně a s 24hodinovým antihypertenzním účinkem. Léčba antagonisty AII je indikována u nemocných se srdečním selháním a jako nová indikace se rýsuje sekundární prevence po CMP. Jasnou indikací je při těchto onemocněních intolerance inhibitorů ACE proto, že způsobují kašel. Telmisartan má navíc jako jediný zástupce skupiny sartanů potvrzenou účinnost v sekundární prevenci u nemocných s ischemickou chorobou srdeční, s ischemickou chorobou dolních končetin, po CMP a s diabetem mellitem a orgánovým postižením.
Indikace
viz [1]
Kontraindikace
viz [1]
Nežádoucí účinky
viz [1]
Lékové interakce
viz [1]
Dávkování
Doporučuje se podávání 80 mg telmisartanu v jedné denní dávce, což je dávka ověřená mortalitními studiemi. Maximální terapeutický účinek se dostavuje během 4 až 8 týdnů od zahájení léčby.
Práce vznikla v rámci Výzkumného záměru MŠMT – MSM0021622402.
Seznam použité literatury
- [1] Doležal T. Telmisartanum. Remedia 2002; 2: 85–91.
- [2] Slanař O. Metabolické účinky telmisartanu. Remedia 2006; 2: 214–216.
- [3] Unger T, Culman J, Gohlke P. Angiotensin II receptor blockade and end-organ protection: Pharmacological rationale and evidence. J Hypertens Suppl 1998; 16: S3–S9.
- [4] Strawn WB, Dean RH, Ferrario CM. Novel mechanisms linking angiotensin II and early atherogenesis. J Renin Angiotensin Aldosterone Syst 2000; 1: 11–17.
- [5] Unger T, Sandmann S. Angiotensin receptor blocker selectivity at the AT1- and AT2-receptors: Conceptual and clinical effects. J Renin Angiotensin Aldosterone Syst 2000; l (Suppl. 2): 6–9.
- [6] Lucius R, Gallinat S, Busche S, et al. Beyond blood pressure: New roles for angiotensin II. Cell MO/Life Sci 1999; 56: 1008–1019.
- [7] Widimský J, Monhart V. Antagonisté receptorů angiotenzinu II typ AT1 (AT1-blokátory) in Widimský a kol. Hypertenze. 2. rozšířené a přepracované vydání, Praha: Triton, 2004. 590 s. ISBN 80-7254-515-9.
- [8] McClellan KJ, Markham A. Telmisartan. Drugs 1998; 56: 1039–1044.
- [9] Kirk JK. Angiotensin-II receptor antagonists: their place in therapy. Am Fam Physician 1999; 59: 3140–3148.
- [10] Chung O, Unger T. Angiotensin II receptor blockade and end-organ protection. Am J Hypertens 1999; 12: 150S–156S.
- [11] Chung O, Stoll M, Unger T. Physiologic and pharmacologic implications of AT1, versus AT2, receptors. Blood Press Suppl 1996; 5: 47–52.
- [12] Mazzolai L, Burnier M. Comparative safety and tolerability of angiotensin II receptor antagonists. Drug Saf 1999; 21: 23–33.
- [13] Stangier J, Schmid J, Türck D, et al. Absorption, metabolism, and excretion of intravenously and orally administered [14C]telmisartan in healthy volunteers. J Clin Pharmacol 2000; 40: 1312-1322.
- [14] Stangier J, Su CA, Schöndorfer G, Roth W. Pharmacokinetics and safety of intravenous and oral telmisartan 20 mg and 120 mg in subjects with hepatic impairment compared with healthy volunteers. J Clin Pharmacol 2000; 40: 1355–1364.
- [15] Wienen W, Entzeroth M, van Meel JCA, et al. Review on Telmisartan: A Novel, Long-Acting Angiotensin II-Receptor Antagonist. Cardiovascular Drug Reviews 2000; 18: 127–154.
- [16] ONTARGET study investigators: Telmisartan, ramipril or both in patients at high risk for vascular events. N Engl J Med 2008; 358: 1547–1559.
- [17] Špinar J, Vítovec J. Inhibitory ACE nebo sartany u ischemické choroby srdeční? Interní medicína pro praxi 2008; 10: 273–276.
- [18] Špinar J, Vítovec J. Studie ONTARGET. Bulletin hypertenze 2008; 11: 40–43.
- [19] Pfeffer MA, McMurray JJV, Velazquez EJ, et al. (for VALIANT Investigators): Valsartan, Captopril, or Both in Myocardial Infarction Complicated by Heart Failure, Left Ventricular Dysfunction, or Both. N Engl J Med 2003; 349: 1893–1906.
- [20] Yusuf S for the TRANSCEND investigators: Effects of the angiotensin-receptor blocker telmisartan on cardiovscular event in high risk patients intolerant to angiotensin-converting enzyme inhibitors: a randomised controlled trial. Lancet 2008DOI: 10.1016/S0140-6736(08)61242-8.
- [21] Pfeffer MA, Domanski M, Rosenberg Y, et al. Prevention of events with angiotensin-converting enzyme inhibition (the PEACE study design). Prevention of Events with Angiotensin-Converting Enzyme Inhibition. Am J Cardiol 1998; 82: 25H–30H.
- [22] Yusuf S, Diener H, Sacco RL, et al. Telmisartan to prevent recurrent stroke and cardiovascular events. N Engl J Med 2008; 359: 1223–1237.