Teriflunomid
Teriflunomid je perorální imunomodulační léčivá látka, která je vyvinuta k léčbě remitující-relabující formy roztroušené sklerózy. Roztroušená skleróza je autoimunitní onemocnění s postižením celulární i humorální části imunitního systému. Teriflunomid blokuje novou syntézu pyrimidinu přes nekompetitivní a reverzibilní inhibici enzymu dihydroorotát dehydrogenázy, inhibuje proliferaci autoagresivních aktivovaných lymfocytů T a B a suprimuje produkci protilátek na periferii. Nedostatek pyrimidinu zasahuje buněčnou funkci, která je spojena s přemrštěnou imunitní odpovědí bez ovlivnění bazálního homeostatického metabolismu. Účinek teriflunomidu v dávce 14 mg denně na vznik relapsů, progresi onemocnění a aktivitu zjistitelnou na magnetické rezonanci je srovnatelný s účinkem imunomodulačních injekčně podávaných léků první line. Díky příznivému bezpečnostnímu profilu a účinnosti představuje teriflunomid nadějnou léčebnou možnost pro nemocné s roztroušenou sklerózou.
Farmakologická skupina
Teriflunomid (ATC kód L04AA31) je aktivní metabolit leflunomidu. V roce 1998 byl leflunomid schválen FDA (Food and Drug Administration) jako imunomodulační lék pro léčbu revmatoidní artritidy. Díky účinnosti a příznivému bezpečnostnímu profilu byl dále testován v preklinických studiích u experimentální autoimunitní neuritidy, encefalitidy a transplantací. Bylo prokázáno, že výchozí substance leflunomid rychle a neenzymaticky konvertuje do aktivního otevřeného okruhu (open ring) malononitritu metabolitu A771726 – teriflunomidu [1]. Antiproliferativní a protizánětlivý účinek řadí teriflunomid do skupiny imunomodulačních léků určených k léčbě roztroušené sklerózy (RS). Teriflunomid patří do farmakoterapeutické skupiny selektivních imunosupresiv.
Chemické vlastnosti
Teriflu
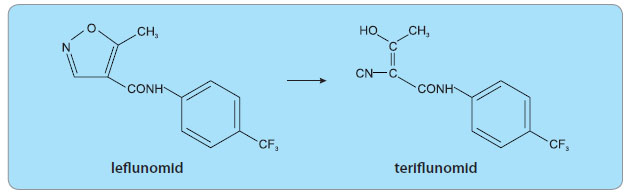 nomid je chemicky (2Z)-2-cyano-3--hydroxy-N-[4-(trifluoromethyl)phenyl]but-2--enamid, viz obr. 1.
nomid je chemicky (2Z)-2-cyano-3--hydroxy-N-[4-(trifluoromethyl)phenyl]but-2--enamid, viz obr. 1. Sumární vzorec: C12H9F3N2O2
Molekulová hmotnost: 270,207 g/mol
Mechanismus účinku, farmakodynamika
Teriflunomid působí selektivní, nekompetitivní a reverzibilní inhibici mitochondriálního enzymu – dihydroorotátu dehydrogenázy (DHODH). Tento enzym je jediný v pyrimidinové kaskádě, který není lokalizován v multienzymovém komplexu v cytosolu, ale nachází se na povrchu vnitřní mitochondriální membrány, takže dihydroorotát i jeho produkt orotát musí difundovat přes vnější membránu. Důsledkem inhibice DHODH je blokáda nové syntézy pyrimidinu, který je potřebný pro rychle se dělící aktivované lymfocyty k DNA replikaci (obr. 2). Následkem toho je redukována aktivita T a B buněk na periferii, jejich proliferace a mění se reakce na autoantigeny [2, 3]. Buňky, jejichž pyrimidinová syntéza je nezávislá na okruhu DHODH, jsou nedotčené antiproliferativním působením teriflunomidu, což snižuje riziko lymfopenie. Redukovaná dostupnost pyrimidinů může také o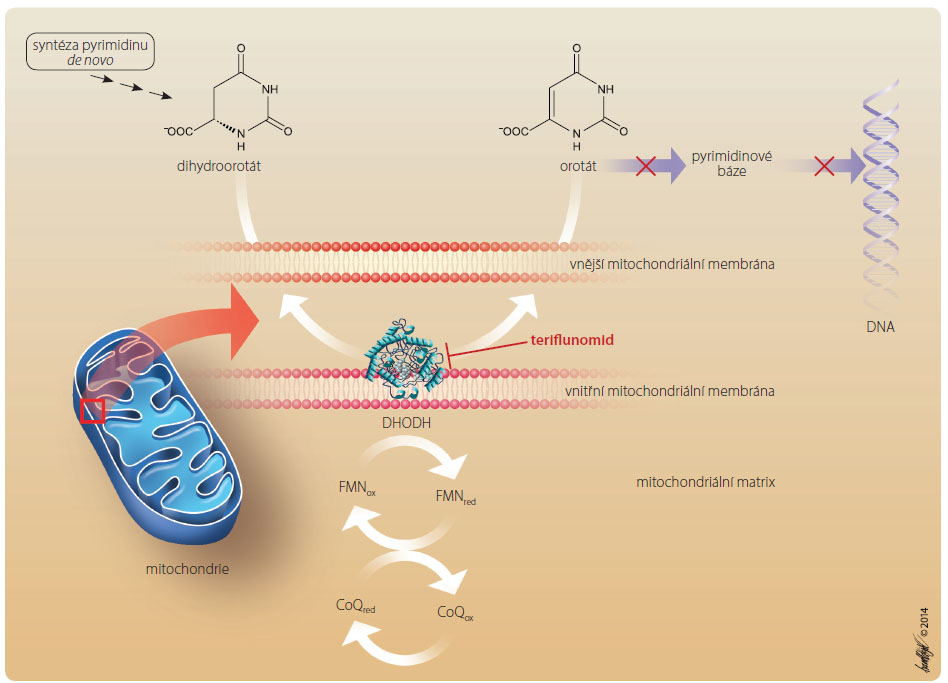 vlivnit syntézu fosfolipidů a glykosylaci proteinů imunitních buněk a tak narušit tvorbu lipidových nosičů a funkci buněčných povrchových molekul [2]. Dále teriflunomid inhibuje syntézu tyrosinkinázy, čímž redukuje proliferaci a aktivaci T lymfocytů a produkci cytosinů. Také zasahuje do interakce mezi T buňkami a antigen prezentujícími buňkami, což je klíčové pro imunitní odpovědi. Jsou také důkazy o tom, že teriflunomid může blokovat tumor nekrotizující faktor alfa (TNFα), indukuje aktivaci nukleárního faktoru kappa B (NFκB), inhibuje buněčn
vlivnit syntézu fosfolipidů a glykosylaci proteinů imunitních buněk a tak narušit tvorbu lipidových nosičů a funkci buněčných povrchových molekul [2]. Dále teriflunomid inhibuje syntézu tyrosinkinázy, čímž redukuje proliferaci a aktivaci T lymfocytů a produkci cytosinů. Také zasahuje do interakce mezi T buňkami a antigen prezentujícími buňkami, což je klíčové pro imunitní odpovědi. Jsou také důkazy o tom, že teriflunomid může blokovat tumor nekrotizující faktor alfa (TNFα), indukuje aktivaci nukleárního faktoru kappa B (NFκB), inhibuje buněčn![Obr. 3 Ovlivnění proliferace lymfocytů teriflunomidem; podle [5] – Bar-Or, et al., 2014. Důsledkem inhibice DHODH teriflunomidem je blokáda syntézy pyrimidinu de novo, který je potřebný pro rychle se dělící aktivované lymfocyty k DNA replikaci. DHODH – dihydroorotát dehydrogenáza](https://www.remedia.cz/photo-a-29892---.jpg) é adhezní molekuly a matrix metaloproteináz [4]. Teriflunomid neovlivňuje replikaci pomalu se dělících neaktivovaných buněk, které užívají exogenní zásobu pyrimidinových nukleotidů díky záchranným cestám (salvage pathways). Cytostatický efekt teriflunomidu na proliferaci T a B lymfocytů na periferii je bez zřejmé cytotoxicity, nezpůsobuje tedy zánik lymfocytů [5]. Zjednodušené schéma účinku teriflunomidu na proliferaci lymfocytů je zachyceno na obr. 3.
é adhezní molekuly a matrix metaloproteináz [4]. Teriflunomid neovlivňuje replikaci pomalu se dělících neaktivovaných buněk, které užívají exogenní zásobu pyrimidinových nukleotidů díky záchranným cestám (salvage pathways). Cytostatický efekt teriflunomidu na proliferaci T a B lymfocytů na periferii je bez zřejmé cytotoxicity, nezpůsobuje tedy zánik lymfocytů [5]. Zjednodušené schéma účinku teriflunomidu na proliferaci lymfocytů je zachyceno na obr. 3.
Farmakokinetické vlastnosti
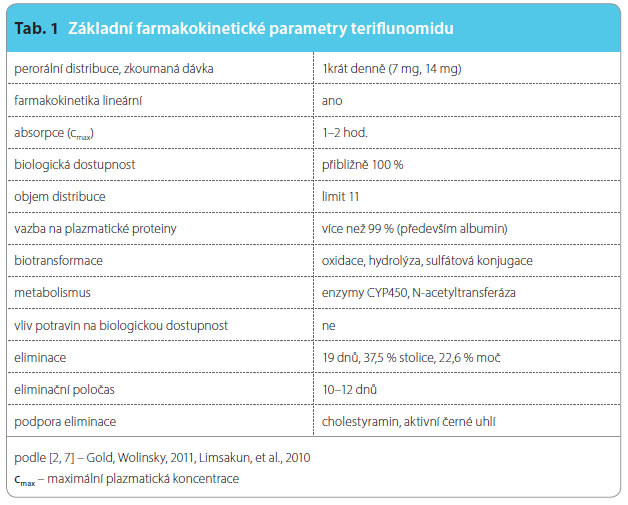
Farmakokinetika teriflunomidu byla zkoumána v 11 studiích u zdravých subjektů a v jedné klinické studii u nemocných s RS. Teriflunomid se po aplikaci per os rychle absorbuje. Nebyl zjištěn rozdíl ve farmakokinetice teriflunomidu mezi pohlavími ani ve farmakokinetice teriflunomidu u zdravých subjektů ve srovnání s nemocnými s RS; rovněž nebyla prokázána závislost na věku. Farmakokinetika této látky je přehledná a lék může být podáván jedenkrát denně perorálně, což pro nemocné s RS představuje pohodlný způsob léčby [7]. Údaje shrnuje tab. 1.
Zařazení do současné palety imunomodulačních léků RS
Roztroušená skleróza je autoimunitní zánětlivé demyelinizační a neurodegenerativní onemocnění, které je způsobeno patologickou imunitní reakcí, jež je namířena proti nervovému systému, mozku a míše. Proces se vysvětluje tím, že po rozpoznání vlastních antigenů útočí aktivované autoagresivní lymfocyty na centrální nervové struktury a dochází k poškození neuronů, myelinu, oligodendroglie, astrocytů, mikroglie a axonů. Postupně přibývá znalostí o procesech a mechanismech, které vedou k poškození až zániku neuroaxonálního cytoskeletu [8]. Intenzivně se hledá lék, který by nejen zpomalil a oddálil progresi nemoci, ale rovněž docílil toho, aby došlo k plné klinické, imunologické i radiologické stabilitě [9]. Teriflunomid ovliňuje aktivitu autoagresivních T a B lymfocytů na periferii blokádou jejich pyrimidinové syntézy se současným ušetřením klidových lymfocytů, což se zdá jako elegantní cesta k ovlivnění přemrštěné buněčné reakce, která provokuje složitou patologickou imunitní odpověď. Současně nezasahuje homeostatický metabolismus a léčba není provázena cytotoxickými projevy [1, 5].
Klinické zkušenosti
Teriflunomid je ověřován v rozsáhlém výzkumném programu zaměřeném na jeho účinnost a bezpečnost v rámci klinického průběhu a ovlivně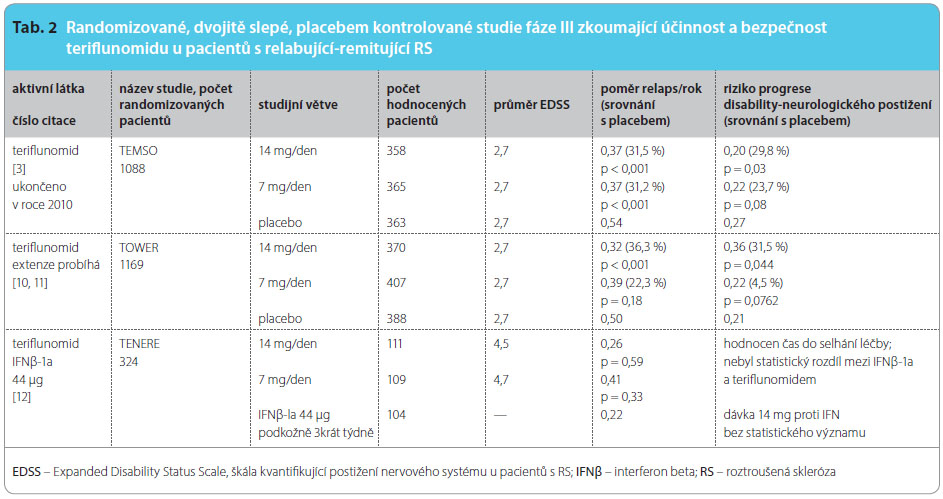 ní patologie RS na magnetické rezonanci (MR). Je studován jako lék podávaný v monoterapii nebo jako přídatný lék k již probíhající léčbě se zavedeným imunomodulátorem (DMD – disease modyfying drug).
ní patologie RS na magnetické rezonanci (MR). Je studován jako lék podávaný v monoterapii nebo jako přídatný lék k již probíhající léčbě se zavedeným imunomodulátorem (DMD – disease modyfying drug).
Uskutečnily se dvě randomizované, dvojitě slepé, placebem kontrolované klinické studie fáze II, které sledovaly bezpečnost a efektivitu teriflunomidu přidaného k již probíhající léčbě interferonem beta (IFNβ) nebo glatiramer acetátem (GA). Za ní následovala dlouhodobá extenze [2], viz tab. 2, 3, 4.
Pr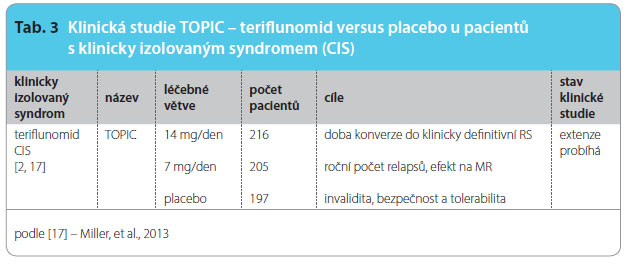 imárním cílem studie TOPIC je ověřit účinnost teriflunomidu u pacientů s první atakou klinicky izolovaného syndromu (clinically isolated syndrome, CIS) a zjistit délku doby konverze do klinicky definitivní RS, tedy do vzniku dalšího relapsu nebo léze patrné při vyšetření MR. Data získaná v tomto sledování ještě nejsou uzavřena, po základní části s placebem probíhá extenzní fáze studie. Je sledována bezpečnost a tolerabilita léčby teriflunomidem. Zhodnocení dosavadních výsledků ukazuje na větší efekt dávky 14 mg a konzistentní bezpečnost a snášenlivost léčby [17].
imárním cílem studie TOPIC je ověřit účinnost teriflunomidu u pacientů s první atakou klinicky izolovaného syndromu (clinically isolated syndrome, CIS) a zjistit délku doby konverze do klinicky definitivní RS, tedy do vzniku dalšího relapsu nebo léze patrné při vyšetření MR. Data získaná v tomto sledování ještě nejsou uzavřena, po základní části s placebem probíhá extenzní fáze studie. Je sledována bezpečnost a tolerabilita léčby teriflunomidem. Zhodnocení dosavadních výsledků ukazuje na větší efekt dávky 14 mg a konzistentní bezpečnost a snášenlivost léčby [17].
Účinnost teriflunomidu u remitující-relabující RS (RR RS) s lehkou nebo střední závažností byla ověřena jednak v klinické studii TEMSO (Teriflunomide Multiple Sclerosis Oral), která již byla ukončena, a také v klinickém sledování TOWER (Teriflunomide in patients With relapsing Multiple Sclerosis). Tyto studie také sledovaly zvlášť v oddělené podskupině vysoce aktivní průběh RR RS. V klinické studii TENERE byla srovnávána účinnost a bezpečnost teriflunomidu s interferonem beta-1a (IFNβ-1a) podávaným subkutánně v dávce 44 μg 3krát týdně. Byl pozorován účinek na klinický průběh; byl sledován roční počet relapsů (relaps rate), progrese neurologického nálezu vyjádřená stup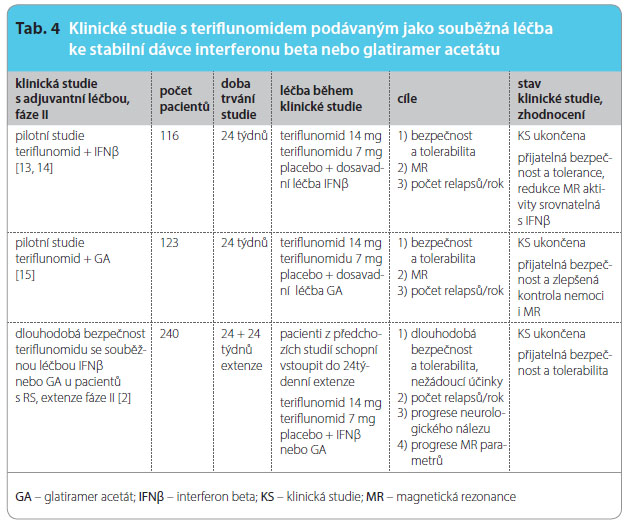 něm postižení EDSS (Expanded Disability Status Scale) a disabilita – míra postižení, invalidita. Dále jsou v centru pozornosti parametry aktivity při vyšetření MR, bezpečnost a snášenlivost léčby.
něm postižení EDSS (Expanded Disability Status Scale) a disabilita – míra postižení, invalidita. Dále jsou v centru pozornosti parametry aktivity při vyšetření MR, bezpečnost a snášenlivost léčby.
V současnosti probíhá extenze studie TOWER, do níž jsou zařazeni pacienti s RR RS. Data svědčí o tom, že teriflunomid podávaný v dávce 14 mg jedenkrát denně je signifikantně účinnější než placebo, redukuje roční průměr počtu relapsů a také snižuje rozsah a závažnost neurologického postižení – disabilitu nemocných, což bylo hodnoceno ve 12týdenních intervalech. Dávka 7 mg teriflunomidu denně rovněž redukuje počet a tíži relapsů, ale nebyla prokázána stejná účinnost na progresi neurologického postižení. Účinnost je potvrzena u mírné, střední i vysoké aktivity RR RS. Data o bezpečnosti a snášenlivosti jsou příznivá [3, 10, 11].
Studie TENERE sleduje efektivitu a bezpečnost teriflunomidu ve srovnání s léčbou IFNβ-1a s ohledem na výskyt prvního relapsu ve studii nebo přerušení léčby z jakéhokoliv důvodu (doba, která uplyne do selhání léčby – time to failure) a roční počet relapsů. Ve skupině léčené 14 mg teriflunomidu byla léčba trvale ukončena u 22 ze 111 pacientů (19,8 %), ve skupině s IFNβ u 30 ze 104 pacientů (28,8 %). Důvodem byly nežádoucí účinky, ztráta účinnosti, jiné příčiny nebo nedostatečná spolupráce. Teriflunomid 14 mg v primárním cíli nedosahoval statisticky významně vyšší hodnoty než IFNβ. Nebyl zjištěn rozdíl mezi spokojeností s léčbou ve vztahu k efektivitě mezi teriflunomidem a IFNβ [12].
Klinické zkoušky s teriflunomidem (7 mg, 14 mg, placebo), který byl podáván k již existující léčbě IFNβ nebo GA s následnou dlouhodobou bezpečnostní fází, jsou hodnoceny pozitivně. Přidaný teriflunomid ovlivnil klinický průběh více než IFNβ v monoterapii. Také nález na MR – počet a objem gadoliniem ohraničených lézí (T1-Gd) – byl při podávání dávky 7 mg teriflunomidu redukován o 56 % a při podávání dávky 14 mg o 81 % (p < 0,001) proti placebu a větší část pacientů zůstala při léčbě teriflunomidem ve srovnání s placebem bez nových T1-Gd lézí (placebo – 57,9 %, teriflunomid v dávce 7 mg – 69,4 %, v dávce 14 mg – 81,6 %). Stejně tomu bylo při léčbě GA. Ve srovnání s placebem byl počet T1-Gd lézí redukován u skupiny s léčbou teriflunomidem v dávce 7 mg
s významností p = 0,011 a u skupiny s léčbou teriflunomidem v dávce 14 mg s významností p = 0,039. Studie trvala 24 týdnů, její extenze pak 48 týdnů [2, 13–15].
Shrneme-li dosavadní poznatky o klinické účinnosti a bezpečnosti získané z výše uvedených a již zveřejněných údajů klinických studií, můžeme konstatovat, že u RR RS je účinnost teriflunomidu na snížení počtu relapsů, omezení progrese nemoci a MR aktivity potvrzena pro dávku 14 mg/den a je srovnatelná s injekčně podávanými DMD léky první linie [18]. Běžné nežádoucí účinky se většinou objevovaly v mírné až střední intenzitě a obvykle nevedly k přerušení léčby. V dosavadní databázi nejsou zaznamenána těžká infekční postižení nebo malignity [10].
Indikace
Teriflunomid byl dne 12. září 2012 schválen americkou komisí FDA [19] a určen k léčbě RR RS. Evropská komise EMA (European Medicines Agency) udělila rozhodnutí o registraci přípravku v celé Evropské unii 26. srpna 2013 [20]. Přípravek je indikován k léčbě dospělých jedinců s relabující-remitující roztroušenou sklerózou. Nespornou výhodou teriflunomidu je perorální podávání.
Použití u speciálních skupin pacientů
Starší dospělí a děti
Vzhledem k nedostatečným údajům o účinnosti a bezpečnosti u starší populace má být teriflunomid používán s opatrností u pacientů ve věku 65 a více let. Bezpečnost a účinnost nebyla stanovena u dětí a dospívajících ve věkovém rozmezí 10–18 let a použití teriflunomidu u dětí ve věku do 10 let není relevantní, údaje nejsou dostupné [20].
Fertilita a těhotenství
Podle hodnocení, jímž FDA klasifikuje míru rizika léků pro graviditu jako A, B, C, D, X,
je teriflunomid zařazen do kategorie X. Léčba teriflunomidem je kontraindikována pro těhotné ženy, jelikož v pokusech na zvířatech byla během periody organogeneze zjištěna teratogenita. U pokusných krys a králíků byla zaznamenána vysoká incidence kraniofaciálních, axiálních a dalších skeletálních defektů [21] a je popisována častější embryofetální smrt [22]. Teriflunomid byl detekován v mužském semeni, ale riziko mužem způsobené plodové toxicity se považuje za nízké. Dávka u partnerky může být až 100krát nižší, než kdyby žena lék sama užívala [22]. Studie zkoumající genotoxicitu neprokázala, že by teriflunomid produkoval mužem způsobenou fetální toxicitu postižením DNA spermií (studováno u samečků krys léčených teriflunomidem) [23]. V databázi lidských klinických studií bylo v roce 2012 uvedeno 43 gravidit (n = 43) a není zaznamenáno zvýšené riziko spontánních potratů, menší porodní hmotnost, nižší gestační věk nebo kongenitální malformace [24]. Teriflunomid prochází placentou a je prokázán v mléku krys, údaje u žen nejsou [22, 24]. Autoři se shodují, že během léčby u žen v reprodukčním věku je nutné používat spolehlivou antikoncepci a v případě plánované koncepce je nutno vyčkat poklesu plazmatické hladiny teriflunomidu na hodnotu nižší než 0,02 mg/l.
Pacienti se závažnými chorobami
Podávání teriflunomidu je kontraindikováno u pacientů s těžkou poruchou funkce ledvin a jater. Lék je nevhodný pro pacienty se závažnými imunodeficitními stavy, s významně narušenou funkcí kostní dřeně nebo s vážnými hematologickými poruchami, s těžkými infekčními stavy a s hypersenzitivitou na léčivo.
Nežádoucí účinky hlášené ze studií kontrolovaných placebem
K nežádoucím účinkům léčby teriflunomidem, popsaným ve výše uvedených klinických studiích, patří zvýšení aktivity jaterních enzymů, především alaninaminotransferázy (ALT), úbytek vlasů až alopecie, bolest hlavy, zánět nosohltanu, průjem, únava, nauzea, úbytek neutrofilů, infekce horních cest dýchacích, bolest v zádech, infekce močových cest, hypertenzní choroba, periferní neuropatie. Ojediněle byl hlášen zánět slepého střeva, zánět ledvinové pánvičky a infekce dýchacího systému [2–4, 11].
Alopecie
Častým nežádoucím účinkem léčby teriflunomidem bývá alopecie, která se projevuje jako řídnutí vlasů, snížení hustoty vlasů a jejich vypadávání u pacientů užívajících teriflunomid v dávce 14 mg (výskyt 15,2 % ve skupině s teriflunomidem ve srovnání se 4,3 % v placebové skupině). Problém se nejčastěji objevoval během prvních 6 měsíců a u 90 % pacientů léčených teriflunomidem došlo k ústupu potíží. K přerušení léčby v důsledku alopecie došlo u 1,4 % pacientů ze skupiny s léčbou teriflunomidem ve srovnání s 0 % ve skupině s placebem.
Jaterní enzymy
Léčba teriflunomidem může mít rovněž nežádoucí účinky na játra – mírné zvýšení aktivity transamináz a hodnota ALT rovnající se trojnásobku normy nebo nižší byly častější ve skupině s teriflunomidem. Ke zvýšení došlo během prvních 6 měsíců léčby a po ukončení léčby se hodnoty vracely k normálnímu stavu v horizontu měsíců až let.
Krevní tlak
U pacientů léčených teriflunomidem 14 mg byl zjištěn systolický tlak (tlak krve, TK) vyšší než 140 mm Hg v 18,6 % případů ve srovnání se 17,8 % u pacientů s placebem, TK vyšší než 160 mm Hg ve 4,1 % oproti 2,6 % u pacientů užívajících placebo. Diastolický TK vyšší než 90 mm Hg byl zaznamenán u 20,3 % pacientů s teriflunomidem 14 mg ve srovnání se 17,1 % pacientů užívajících placebo.
Infekce
Ve studiích kontrolovaných placebem nebylo pozorováno zvýšení výskytu závažných infekcí při léčbě teriflunomidem (2,2 %) oproti placebu (2,1 %). Závažné oportunní infekce se vyskytly v obou skupinách s frekvencí 0,2 %.
Hematologické účinky
Byl pozorován mírný pokles počtu bílých krvinek (< 15 %) od výchozí hodnoty, především počet neutrofilů a lymfocytů. K poklesu došlo během prvních 6 týdnů léčby a poté se počet stabilizoval na nižších hladinách (< 15 %). Účinek na červené krvinky (< 2 %) a krevní destičky (< 10 %) byl méně výrazný.
Periferní neuropatie
Periferní neuropatie byla popisována jako polyneuropatie nebo mononeuropatie častěji u nemocných užívajících teriflunomid než u pacientů s placebem. Postižení bylo potvrzeno vyšetřením rychlosti vedení nervem. Ve skupině léčených teriflunomidem bylo zaznamenáno 2,2 % neuropatií ve srovnání s 0,6 % ve skupině s placebem. K ústupu potíží po ukončení léčby došlo u 2 nemocných.
Lékové interakce
Předpokládaná cesta biotransformace teriflunomidu zahrnuje oxidaci, sulfátovou konjugaci a především hydrolýzu. Dominantní je systém enzymů cytochromu P450 (CYP) a N-acetyltransferázy. Ve studii se zdravými subjekty vedly opakované dávky rifampicinu (induktor nespecifických cytochromů a transportérů P-glykoproteinu) podávané s teriflunomidem ke snížení expozice teriflunomidu na 40 % [2, 7]. Dále se doporučuje, aby pacienti léčení teriflunomidem neužívali cholestyramin, aktivní uhlí, pokud není přímo vyžadována urychlená eliminace [7]. Lze předpokládat, že induktory CYP 4503A budou akcelerovat vylučování teriflunomidu, zatímco teriflunomid prodlouží poločas léků, které jsou eliminovány cestou CYP 4502C9, jako je například fenytoin, karbamazepin, fenobarbital nebo nesteroidní antiflogistika [1]. I když nebyla hlášena signifikantní interakce teriflunomidu s warfarinem (substrát CYP2C9) [2], při jejich současném podávání je doporučeno pečlivě monitorovat koagulační parametry (international normalised ratio, INR) vzhledem k dříve popsanému účinku leflunomidu [25]. Teriflunomid působí na substrát cytochromu CYP2C8 repaglinid, proto je nutné používat léčivé látky repaglinid, paklitaxel, pioglitazon nebo rosiglitazon s opatrností [20].
Teriflunomid lehce zvýšil hladinu jednotlivých hormonálních látek perorální antikoncepce (0,03 mg ethinylestradiolu a 0,15 mg levonorgestrelu), nepředpokládá se však, že tato interakce nepříznivě ovlivní její účinnost. Přesto je nutné zvážit typ a dávku antikoncepce při dlouhodobém používání v této kombinaci.
Při opakovaném podávání teriflunomidu došlo ke snížení průměrné hodnoty kofeinu (substrát cytochromu CYP1A2), proto léčiva metabolizovaná tímto cytochromem, např.duloxetin, alosetron, theofylin a tizanidin, je nutné používat opatrně. Může být snížena jejich účinnost.Teriflunomid zvyšuje průměrnou hodnotu cefakloru (substrát OAT3) a doporučuje se postupovat opatrně v kombinační léčbě s léčivými přípravky cefaklor, benzylpenicilin, ciprofloxacin, indometacin, ketoprofen, furosemid, cimetidin, methotrexát nebo zidovudin. Stejně tak působí na rosuvastatin. Proto se při kombinaci s rosuvastatinem doporučuje snížit dávku o 50 % a také u dalších léčivých látek, jako je simvastatin, atorvastatin, pravastatin, methotrexát, nateglinid a repaglinid, je nutné monitorovat známky a příznaky nadměrné expozice a dle potřeby zvážit snížení dávek těchto léčivých látek [20].
Dávkování
Doporučená dávka teriflunomidu je 14 mg denně podávaných perorálně. Léčba má být zahájena a vedena pod dohledem zkušeného lékaře-neurologa a lék bude určen pro léčbu v Centru pro diagnostiku a léčbu demyelinizačních onemocnění.
Závěr
Teriflunomid je inhibitor enzymu DHODH, působí inhibici proliferace autoreaktivních B a T lymfocytů. Tento cytostatický efekt a mechanismus účinku je specifický a unikátní. Ve výše uvedených klinických studiích u nemocných s RS je u dávky teriflunomidu 14 mg prokázán efekt v redukci ročního průměru relapsů, ovlivnění aktivity nemoci na MR a progresi neurologického nálezu – disability. Jeho bezpečnostní profil a tolerabilita vyhovuje. Byla prokázána srovnatelná účinnost s injekčními imunomodulačními léky první linie. Je zařazen do seznamu schválených léků pro léčbu roztroušené sklerózy, přičemž perorální podávání teriflunomidu představuje nespornou výhodu.
Seznam použité literatury
- [1] Claussen MC, Korn T. Immune mechanisms of new therapeutic strategies in MS –Teriflunomide. Clinical Immunology 2012; 142: 49–56.
- [2] Gold R, Wolinsky JS. Pathophysiology of multiple sclerosis and the place of teriflunomide. Acta Neurol Scand 2011; 124: 75–84.
- [3] O‘Connor P, Wolinsky JS, Confavreux Ch, et al., for the TEMSO Trial group. Randomized trial of oral teriflunomide for relapsing multiple sclerosis. N Engl J Med 2011; 365: 1293–1303.
- [4] Warnke C, Hörste GM, Hartung HP, et al. Review of teriflunomide and its potential in the treatment of multiple sclerosis. Neuropsychiatr Dis Treat 2009; 5: 333–340.
- [5] Bar-Or A, Pachner A, Menguy-Vacheron F, et al. Teriflunomide and its mechanism of action in multiple sclerosis. Drugs 2014; 74: 659–674.
- [6] Philips MA, Rathod PK. Plasmodium dihydroorotate dehydrogenase: a promising target for novel anti-malarial chemotherapy. Infect Disord Drug Targets 2010; 10: 236–239.
- [7] Limsakun T, Bridgwater NJ, Menguy-Vancheron F, Mazanin C. Pharmacokinetics of oral teriflunomide, a novel oral disease-modifying agent under investigation for the treatment of multiple sclerosis. Presented at AAN, 2010; Neurology 74, March 2 Suppl.
- [8] Zapletalová O. Atrofie mozku u roztroušené sklerózy a možnosti medikamentózního ovlivnění. Remedia 2013; 23: 334–341.
- [9] Multiple Sclerosis consensus Group (MSTCG), Wiendl H, Toyka KV, et al. Basic et escalating immunomodulatory treatments in multiple sclerosis: current therapeutic recommendations. J Neurol 2008; 255: 1449–1463.
- [10] Kappos L, Comi G, Confavreau C, et al. The efficacy and safety of teriflunomide in patients with relapsing MS: results from TOWER, a phase III, placebo controlled study. Presented at: Congress of the European Committee for Treatment and Research in Multiple Sclerosis 2012, abstract 153. Mult Scler J 2012; 18: 50–51.
- [11] Confavreux Ch, O‘Connor P, Comi G, et al. Oral teriflunomide for patients with relapsing multiple sclerosis (TOWER): a randomised, double blind, placebo controlled, phase 3 trial. Lancet Neurol 2014; 13: 247–256.
- [12] Vermersch P, Czlonkowska A, Grimaldi LM, et al. Teriflunomide versus subcutaneous interferon Beta 1a in patients with relapsing multiple sclerosis: a randomised, controlled phase 3 trial. Mult Scler 2014; 20: 705–716.
- [13] Freedman MS, Wolinsky JS, Wamil B, et al. Teriflunomide to added to interferon β in relapsing multiple sclerosis: a randomized phase II trial. Neurology 2012; 78: 1877–1885.
- [14] Freedman MS, Wolinsky JS, Byrnes WJ, et al. Oral teriflunomide or placebo to added to interferon beta for 6 months in patients with relapsing multiple sclerosis: safety and efficacy results. Presented at 25 Congress of the European Committee for Treatment and Research in Multiple Sclerosis (ECTRIMS); September 11, 2009; Düsseldorf.
- [15] Freedman MS, Wolinsky JS, Frangin GA, et al. Oral teriflunomide or placebo to added to glatiramer acetate for 6 months in patients with relapsing multiple sclerosis: safety and efficacy results. Presented at the Annual Meeting of the American Academy of Neurology (AAN); April 14, 2010; Toronto.
- [16] Sorensen PS. New management algorithms in multiple sclerosis. Curr Opin Neurol 2014; 27: 246–259.
- [17] Miller AE, Wolinsky JS, Kappos L, et al. TOPIC main outcomes: efficacy and safety of once-daily oral teriflunomide in patients with clinically isolated syndrome. Presented at 29 Congress of the European Committee for Treatment and Research in Multiple Sclerosis (ECTRIMS) 2-5 October, 2013; Copenhagen.
- [18] Wolinsky JS, Narayana PA, Nelson F, et al. Magnetic resonance imaging outcomes from a phase III trial of teriflunomide. Mult Scler 2013; 19: 1310–1319.
- [19] http://www.fda.gov/newsevents/newsroom/pressannouncements/ucm319277.htm Navštíveno 19. 8. 2014.
- [20] Summary of product characteristics (SPC) Aubagio. Dostupné na: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_-_Product_Information/human/002514/WC500148682.pdf Navštíveno 20. 8. 2014.
- [21] Cree BA. Update on reproductive safety of current and emerging disease modifying therapies for multiple sclerosis. Mult Scler 2013; 19: 835–843.
- [22] Coyle PK. Multiple sclerosis in pregnancy. Continuum (MineapMinn) 2014; 20: 42–59.
- [23] Davenport L, Czich A, Trupault S. Teriflunomide: No effects on sperm DNA. Presented at 29 Congress of the European Committee for Treatment and Research in Multiple Sclerosis (ECTRIMS) 2-5 October, 2013; Copenhagen.
- [24] Lu E, Wang BW, Guimond C, et al. Safety and disease-modyfying drugs for multiple sclerosis in pregnancy: current challenges and future considerations for effective pharmacovigilance. Expert Rev Neurother 2013; 13: 251–261.
- [25] Lim V, Pande I. Leflunomide can potentiate the anticoagulant effect of warfarin. BMJ 2002; 325: 1333.