Trametinib
Souhrn:
Trametinib patří do skupiny selektivních inhibitorů mitogenem aktivované proteinové kinázy 1 a 2 (MEK1, MEK2). Tato kináza je součástí kinázy regulované extracelulárním signálem (MAP) ovlivňující buněčnou proliferaci, diferenciaci a transkripci. Kináza MAP je trvale aktivována přítomností mutace v genu BRAF, která je nejčastěji detekována v buňkách maligního melanomu. Trametinib se užívá k perorálnímu podávání u pacientů s neresekovatelným či s metastazujícím (pokročilým) melanomem s přítomností mutace v genu BRAF, a to jak v monoterapii, tak v kombinaci s inhibitorem BRAF dabrafenibem. Účinnost léčby byla ověřena v multicentrických randomizovaných klinických studiích fáze III jak v monoterapii, tak v kombinaci s dabrafenibem. V monoterapii byl účinek trametinibu srovnáván s chemoterapií, v kombinované léčbě s dabrafenibem byla účinnost trametinibu porovnávána s inhibitory BRAF v monoterapii. Výsledky dostupných studií dokládají, že trametinib v monoterapii a v kombinaci s dabrafenibem oproti srovnávané léčbě významně ovlivňuje jak celkové přežívání pacientů s pokročilým melanomem, tak i dobu přežití do progrese onemocnění. V současnosti se trametinib nejvíce využívá v kombinaci s dabrafenibem pro oddálení vzniku rezistence k terapii inhibitory BRAF. Trametinib, a to především v kombinované terapii s dabrafenibem, zaujímá v dnešní době přední místo v nových léčebných schématech u pokročilého melanomu.
Key words: trametinib – MEK inhibitor – BRAF inhibitors – BRAF mutation – melanoma.
Summary:
Trametinib is one of the selective inhibitors of mitogen‑activated kinase 1 and 2 (MEK1, MEK2). This kinase is a part of extracellular signal‑regulated kinase (MAP) influencing cellular proliferation, differentiation, and transcription. MAP kinase is permanently activated by BRAF gene mutation, most often present in malignant melanoma. Trametinib is being given orally to patients with non‑resectable or metastatic (advanced) melanoma with BRAF gene mutation, both in monotherapy and in combination with BRAF inhibitor dabrafenib. Its effectiveness has been validated in phase III multicentric randomized clinical trials (again, both for monotherapy and combination with dabrafenib). Trametinib monotherapy was compared with chemotherapy while combination therapy (trametinib plus dabrafenib) was compared with BRAF inhibitor monotherapy. According to the available trials, trametinib – in monotherapy or combined with dabrafenib – significantly prolongs both overall survival and progression‑free survival in patients with advanced melanoma. Currently, trametinib is mostly used together with dabrafenib in order to postpone the development of resistance to BRAF inhibitors. Trametinib, especially when combined with dabrafenib, has become a crucial of new therapeutic schemes used in advanced melanoma.
Farmakologická skupina
Trametinib je podle Anatomicko‑terapeuticko‑chemické klasifikace léčiv (ATC) řazen do skupiny Cytostatika, inhibitory proteinkináz, ATC skupina je L01XE25.
Chemické a fyzikální vlastnosti
Trametinib, trametinibum (GSK1120212), chemický vzorec: C26H23FIN5O4; molekulová hmotnost: 615,39 g/mol.
Mechanismus účinku‚ farmakodynamika
Trametinib je reverzibilní, vysoce selektivní inhibitor mitogenem aktivované proteinové kinázy (mitogen‑activated protein kinase kinase, MEK) 1 a 2 (MEK1, MEK2). Proteiny MEK jsou součástí kaskády mitogenem aktivované proteinové kinázy (MAP-kinázy – RAS/RAF/MEK/ERK), označované též jako kinázy regulované extracelulárním (mimobuněčným) signálem (extracellular signal‑regulated kinases, ERK) (obr. 1) [1]. Tato kináza významně ovlivňuje řadu buněčných procesů, jako je proliferace, buněčná diferenciace a regulace transkripce. Kinázová kaskáda MAP je aktivována mutací genu BRAF (nejčastěji se jedná o mutaci V600E) kódující serin/threonin proteinovou kinázu BRAF [2]. Tato mutace je detekována asi u 50 % primárních kožních melanomů. V dalších nádorech se nejčastěji vyskytuje u papilárního karcinomu štítné žlázy, méně pak (asi v 5 %) u kolorektálního karcinomu a u nemalobuněčného karcinomu plic [3]. Trametinib inhibuje aktivaci kináz MEK vyvolanou mutovanou kinázou BRAF a inhibuje tak aktivitu celé MAP-kinázy [1]. Trametinib v modelu in vitro selektivně inhibuje růst nádorových linií melanomu s mutací BRAF (V600), tento účinek byl pozorován a ověřen i v myším xenograftovém modelu melanomu s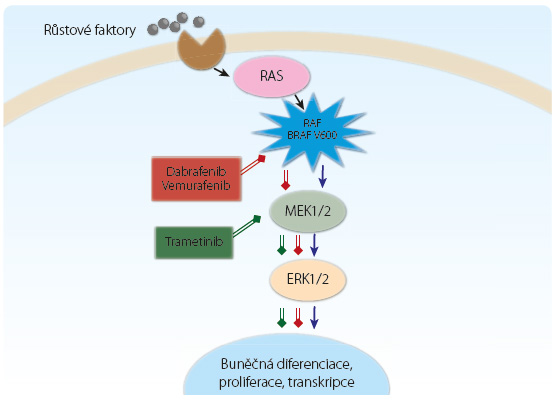 mutací BRAF (V600). Trametinib v závislosti na dávce inhibuje fosforylaci MAP-kinázové dráhy a snižuje její aktivitu, která se projeví zvýšenou expresí markerů apoptózy p27 a snížením proliferace nádorových buněk. Opakované dávky 2 mg trametinibu podávané jednou denně ve 24hodinovém intervalu jsou schopné zajistit trvalou inhibici kináz MEK [4]. Trametinib je v terapii melanomu s mutací BRAF kombinován s dabrafenibem, který je inhibitorem kináz RAF. Proonkogenní mutace v genu BRAF vedou ke konstitutivní aktivaci celé MAP-kinázové dráhy. Kombinace trametinibu s dabrafenibem tedy selektivně inhibuje dvě různé kinázy této dráhy, MEK a RAF. Při monoterapii dabrafenibem a jinými inhibitory BRAF dochází ke vzniku rezistence právě alternativní aktivací kináz MEK a ERK [3,5]. Kombinace dabrafenibu a trametinibu tuto rezistenci významně oddaluje [6].
mutací BRAF (V600). Trametinib v závislosti na dávce inhibuje fosforylaci MAP-kinázové dráhy a snižuje její aktivitu, která se projeví zvýšenou expresí markerů apoptózy p27 a snížením proliferace nádorových buněk. Opakované dávky 2 mg trametinibu podávané jednou denně ve 24hodinovém intervalu jsou schopné zajistit trvalou inhibici kináz MEK [4]. Trametinib je v terapii melanomu s mutací BRAF kombinován s dabrafenibem, který je inhibitorem kináz RAF. Proonkogenní mutace v genu BRAF vedou ke konstitutivní aktivaci celé MAP-kinázové dráhy. Kombinace trametinibu s dabrafenibem tedy selektivně inhibuje dvě různé kinázy této dráhy, MEK a RAF. Při monoterapii dabrafenibem a jinými inhibitory BRAF dochází ke vzniku rezistence právě alternativní aktivací kináz MEK a ERK [3,5]. Kombinace dabrafenibu a trametinibu tuto rezistenci významně oddaluje [6].
Farmakokinetické vlastnosti
Trametinib je po perorálním podání absorbován s mediánem doby do dosažení maximálních plazmatických koncentrací (tmax) 1,5 hodiny. Průměrná absolutní biologická dostupnost trametinibu po podání jedné 2mg tablety je 72 %. Expozice trametinibu (cmax a AUC [area under curve, plocha pod křivkou plazmatické koncentrace]) se po opakovaném podání zvyšuje úměrně podané dávce. Podání jedné dávky trametinibu se stravou s vysokým obsahem tuků nebo s vysoce kalorickým jídlem sníží AUC trametinibu o 24 % a cmax o 70 %, tmax se prodlužuje o 4 hodiny ve srovnání s užitím trametinibu nalačno. Po podání dávky 2 mg denně byl geometrický průměr cmax a AUC v ustáleném stavu 22,2 ng/ml a 370 ng·h/ml a koncentrace před podáním dávky byla 12,1 ng/ml s nízkým poměrem maximální a minimální koncentrace [1,7]. Trametinib je při opakovaném podávání dávky 2 mg jednou denně kumulován s poměrem průměrné kumulace 6,0. Rovnovážného stavu je dosaženo do 15. dne od zahájení terapie. Distribuce trametinibu je z 97,4 % dána navázáním na plazmatické bílkoviny. Biotransformace trametinibu je prováděna deacetylací samotnou nebo deacetylací s monooxygenací v kombinaci s glukuronidací. Deacetylace je zprostředkována karboxylesterázami, ale může být zprostředkována i jinými hydrolytickými enzymy. Po jednorázovém a opakovaném podání dávek trametinibu je nemetabolizovaný trametinib hlavní cirkulující složkou v plazmě. Biologický poločas eliminace trametinibu po podání jednorázové dávky dosahuje v průměru 105 hodin [4,7,8]. Celková vyloučená dávka radionuklidem značeného trametinibu po jednorázovém podání dávky je po deseti dnech nízká (< 50 %) z důvodu dlouhého biologického poločasu eliminace. Po podání perorální dávky radionuklidem značeného trametinibu (14C) je více než 80 % vyloučeno stolicí a asi 19 % je vyloučeno močí [7] (tab. 1).
Klinické zkušenosti
Největší klinické zkušenosti jsou s využitím trametinibu v léčbě metastazujícího (pokročilého) melanomu, a to jak v monoterapii, tak v kombinaci s dabrafenibem. Účinnost a bezpečnost trametinibu v monoterapii byly hodnoceny u pacientů s melanomem s mutací genu BRAF (V600E a V600K) v randomizované otevřené studii fáze III (MEK114267). Do této studie bylo zařazeno celkem 322 pacientů v poměru 2 : 1 ve prospěch léčby trametinibem (n = 214) v dávce 2 mg denně v porovnání s chemoterapií (n = 108) dacarbazinem (1 000 mg/m2) nebo paclitaxelem (175 mg/m2) podávanou v třítýdenních intervalech. Pacienti léčení konvenční chemoterapií měli možnost přejít po progresi onemocnění do větve s trametinibem. Hlavním cílovým ukazatelem studie bylo přežití do progrese onemocnění (progression‑free survival, PFS) a celkové přežití (overall survival, OS). Medián doby přežití do progrese byl při léčbě trametinibem 4,8 měsíce, zatímco ve skupině pacientů léčených chemoterapií jen 1,5 měsíce. Podíl přeživších pacientů po 6 měsících byl při léčbě trametinibem 81 % a ve skupině pacientů léčených chemoterapií 67 % (tab. 2). Po doplnění dat ve dvouletém sledování byl podíl přeživších pacientů léčených trametinibem 61 % (s mediánem OS 15,6 měsíce) a 50 % (s mediánem OS 11,3 měsíce) při podávané chemoterapii. Nejčastějším nežádoucím účinkem léčby s nutností jejího přerušení nebo snížení dávky byl kožní erytém, průjmovité stolice a otoky končetin. V rámci klinického hodnocení nebyl pozorován výskyt jiných kožních nádorů [9–11].
Monoterapie trametinibem u pacientů s pokročilým neresekovatelným nebo metastazujícím melanomem s mutací genu BRAF V600 nebyla v klinických studiích srovnávána s monoterapií inhibitory BRAF nebo s jejich kombinací s inhibitory MEK. Při porovnání mezi studiemi se ukazuje, že celkové přežití a přežití bez progrese je srovnatelné v případě léčby trametinibem a inhibitory BRAF. U pacientů léčených inhibitory BRAF však byl prokázán lepší celkový podíl odpovědí na léčbu [5,9].
Zásadním terapeutickým přístupem při léčbě trametinibem je kombinace inhibitorů BRAF a MEK, resp. kombinace dabrafenibu s trametinibem. Tato kombinace byla hodnocena ve studii fáze III MEK115306 označovaná jako COMBI‑d a MEK116513 s označením COMBI‑v. Jednalo se o randomizovanou, dvojitě zaslepenou studii porovnávající kombinaci dabrafenibu (150 mg 2× denně) a trametinibu (2 mg denně) s dabrafenibem (150 mg 2× denně) v kombinaci s placebem (v poměru 1 : 1) v léčbě první linie u pacientů s neresekovatelným melanomem stadia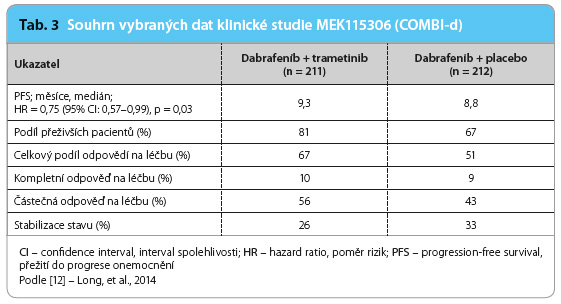 IIIC a s metastazujícím melanomem stadia IV s pozitivní mutací genu BRAF (V600E a V600K). Primárním cílovým ukazatelem byla PFS, sekundárním cílovým ukazatelem OS. Pacienti byli stratifikováni podle aktivity laktátdehydrogenázy (LDH) s normální či zvýšenou hodnotou a podle přítomné mutace v genu BRAF (V600E a V600K). V této studii bylo celkově randomizováno 423 pacientů ke kombinované léčbě (n = 211) a k terapii dabrafenibem s placebem (n = 212). Většina pacientů léčených kombinovanou terapií se při zahájení studie nacházela v klinickém stadiu nemoci IVM1c (67 %) a bez elevace LDH (63 %). Mutace genu BRAF V600E byla pozitivní v 85 %. U pacientů léčených kombinací dabrafenibu a trametinibu byl medián PFS 9,3 měsíce ve srovnání s pacienty léčenými kombinací dabrafenibu a placeba, u nichž činil medián PFS 8,8 měsíce. Podíl přeživších pacientů při půlročním sledování ve větvi s kombinovanou léčbou dosahoval až 93 % oproti 85 % ve větvi, kde byl podáván dabrafenib s placebem (tab. 3). Nejčastější nežádoucí účinky byly podobné v obou ramenech této studie, největší rozdíl byl pozorován v případě horečky, která byla přítomna až v 51 % ve větvi s kombinovanou léčbou oproti 28% výskytu u pacientů léčených monoterapií s placebem. Asi nejzásadnější výsledek byl zaznamenán při porovnání léčby kombinací dabrafenibu s trametinibem (n = 77) ve srovnání s monoterapií dabrafenibem a placebem (n = 71) u pacientů se zvýšením aktivity LDH: medián PFS byl 7,1 měsíce při kombinované terapii oproti 3,8 měsíce při monoterapii. Nebyl pozorován významný rozdíl v účinnosti mezi subtypem mutace genu BRAF V600E a V600K. Výskyt sekundárních nádorů, a to především dlaždicobuněčného karcinomu a keratoakantomu, byl častější při monoterapii dabrafenibem (9 %), při kombinované terapii činil okolo 2 %.
IIIC a s metastazujícím melanomem stadia IV s pozitivní mutací genu BRAF (V600E a V600K). Primárním cílovým ukazatelem byla PFS, sekundárním cílovým ukazatelem OS. Pacienti byli stratifikováni podle aktivity laktátdehydrogenázy (LDH) s normální či zvýšenou hodnotou a podle přítomné mutace v genu BRAF (V600E a V600K). V této studii bylo celkově randomizováno 423 pacientů ke kombinované léčbě (n = 211) a k terapii dabrafenibem s placebem (n = 212). Většina pacientů léčených kombinovanou terapií se při zahájení studie nacházela v klinickém stadiu nemoci IVM1c (67 %) a bez elevace LDH (63 %). Mutace genu BRAF V600E byla pozitivní v 85 %. U pacientů léčených kombinací dabrafenibu a trametinibu byl medián PFS 9,3 měsíce ve srovnání s pacienty léčenými kombinací dabrafenibu a placeba, u nichž činil medián PFS 8,8 měsíce. Podíl přeživších pacientů při půlročním sledování ve větvi s kombinovanou léčbou dosahoval až 93 % oproti 85 % ve větvi, kde byl podáván dabrafenib s placebem (tab. 3). Nejčastější nežádoucí účinky byly podobné v obou ramenech této studie, největší rozdíl byl pozorován v případě horečky, která byla přítomna až v 51 % ve větvi s kombinovanou léčbou oproti 28% výskytu u pacientů léčených monoterapií s placebem. Asi nejzásadnější výsledek byl zaznamenán při porovnání léčby kombinací dabrafenibu s trametinibem (n = 77) ve srovnání s monoterapií dabrafenibem a placebem (n = 71) u pacientů se zvýšením aktivity LDH: medián PFS byl 7,1 měsíce při kombinované terapii oproti 3,8 měsíce při monoterapii. Nebyl pozorován významný rozdíl v účinnosti mezi subtypem mutace genu BRAF V600E a V600K. Výskyt sekundárních nádorů, a to především dlaždicobuněčného karcinomu a keratoakantomu, byl častější při monoterapii dabrafenibem (9 %), při kombinované terapii činil okolo 2 %.
Následná analýza dat prokázala statisticky významné prodloužení celkového přežití při kombinované terapii ve srovnání s monoterapií dabrafenibem s placebem. Podíl přeživších po dvou letech od zahájení léčby dosahoval ve větvi s kombinovanou léčbou 68 % (medián celkového přežití byl 25,1 měsíce) oproti 42 % ve větvi s monoterapií dabrafenibem (medián celkového přežití 18,7 měsíce) [12,13].
V obdobné studii MEK116513 (COMBI‑v) byla porovnávána kombinace dabrafenibu (150 mg 2× denně; n = 352) a trametinibu (2 mg denně; n = 352) s vemurafenibem (960 mg 2× denně) v poměru 1 : 1 v léčbě první linie u pacientů s neresekovatelným melanomem stadia IIIC a s metastazujícím melanomem stadia IV s pozitivní mutací genu BRAF (V600E a V600K). Jednalo se o randomizovanou otevřenou studii fáze III. Primárním cílovým ukazatelem bylo oproti předchozí studii hodnocení doby celkového přežití, sekundárním cílovým parametrem byla PFS a bezpečnost léčby. Do studie bylo zařazeno celkem 704 pacientů s postižením IVM1c v 61 % a bez zvýšení aktivity LDH v 67 %. Mutace V600E byla přítomna v 89 %. Po 12 měsících léčby dosáhl při kombinované terapii dabrafenibem a trametinibem podíl přeživších 72 %, zatímco ve větvi s monoterapií vemurafenibem 65 %. Statisticky výz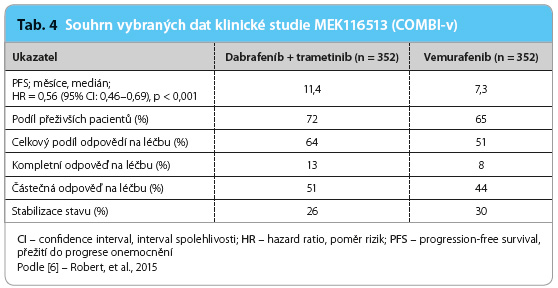 namné zlepšení bylo pozorováno i v hodnocení sekundárních ukazatelů. Medián přežití do progrese dosahoval ve větvi s kombinovanou léčbou až 11,4 měsíce oproti monoterapii, kde medián PFS byl 7,3 měsíce (tab. 4). V toxicitě byl pozorován výraznější rozdíl především v častějším výskytu horeček a zimnic u kombinované léčby a v kožních nežádoucích účincích častějších u vemurafenibu. Výskyt sekundárních malignit v podobě kožních dlaždicobuněčných karcinomů a keratoakantomů nepřesahoval ve větvi studie s kombinovanou léčbou 1 %, ale při monoterapii vemurafenibem činil až 18 % [6].
namné zlepšení bylo pozorováno i v hodnocení sekundárních ukazatelů. Medián přežití do progrese dosahoval ve větvi s kombinovanou léčbou až 11,4 měsíce oproti monoterapii, kde medián PFS byl 7,3 měsíce (tab. 4). V toxicitě byl pozorován výraznější rozdíl především v častějším výskytu horeček a zimnic u kombinované léčby a v kožních nežádoucích účincích častějších u vemurafenibu. Výskyt sekundárních malignit v podobě kožních dlaždicobuněčných karcinomů a keratoakantomů nepřesahoval ve větvi studie s kombinovanou léčbou 1 %, ale při monoterapii vemurafenibem činil až 18 % [6].
Podle dostupných klinických studií existují jen omezená data o účinku léčby kombinací dabrafenibu a trametinibu u pacientů, u nichž došlo k progresi onemocnění po předcházející léčbě inhibitorem BRAF v monoterapii. V části B studie BRF (BRF113220) vedla ve skupině 26 pacientů po progresi onemocnění při monoterapii inhibitorem BRAF následná kombinovaná léčba (ve standardní dávce) k terapeutické odpovědi jen u 15 % léčených s mediánem PFS 3,6 měsíce. Obdobné výsledky byly pozorovány i v části C (n = 45) této studie po progresi při léčbě dabrafenibem (terapeutická odpověď 13 %, PFS 3,6 měsíce) [14].
V poslední době se objevují klinické studie fáze I a Ib s využitím trametinibu v léčbě jiných solidních nádorů, a to především karcinomu pankreatu s mutací a bez mutace genu KRAS. V tomto případě je použita kombinace s chemoterapií (gemcitabinem) [15]. Jiné studie kombinují trametinib se selektivními inhibitory PI3K/AKT (afuresertib) u solidních nádorů a mnohočetného myelomu. Dostupné výsledky jsou zatím zatíženy častými nežádoucími účinky vedoucími k přerušení či k ukončení léčby [16]. Slibné se zdají výsledky terapeutické odpovědi u pacientů s kolorektálními karcinomy s mutací BRAF léčených kombinací dabrafenibu a trametinibu [17].
Zařazení do současné palety léčiv
Trametinib patří do skupiny biologických protinádorových léčiv selektivně inhibujících kinázy MEK1 a MEK2. V současné době se standardně nepoužívá v monoterapii metastazujícího melanomu, ale pro vyšší účinnost je podáván v kombinaci s dabrafenibem. Možná terapeutická kombinace dabrafenibu a trametinibu představuje v současné době jednu z nejúčinnějších léčebných možností pro pacienty s metastazujícím melanomem [18].
Indikace
Léčba trametinibem je indikována pouze u neresekovatelného nebo metastazujícího melanomu s prokázanou mutací BRAF V600 [6,9,17]. V indikačním omezení je trametinib schválen jak pro monoterapii, tak v kombinaci s dabrafenibem.
Kontraindikace
Absolutní kontraindikací léčby trametinibem je přecitlivělost na účinnou látku trametinib, případně na pomocné látky. Vzhledem k nutné pozitivitě mutace genu BRAF je kontraindikováno i zahájení léčby u pacientů bez  přítomnosti této mutace. Relativní kontraindikace vycházejí z nejčastějších nežádoucích účinků léčby, jakými jsou např. onemocnění sítnice, prodloužení intervalu QTc nad 500 ms (především v kombinaci s dabrafenibem) nebo dysfunkce levé komory s ejekční frakcí pod dolním limitem normy před zahájením terapie.
přítomnosti této mutace. Relativní kontraindikace vycházejí z nejčastějších nežádoucích účinků léčby, jakými jsou např. onemocnění sítnice, prodloužení intervalu QTc nad 500 ms (především v kombinaci s dabrafenibem) nebo dysfunkce levé komory s ejekční frakcí pod dolním limitem normy před zahájením terapie.
Nežádoucí účinky
Nežádoucí účinky léčby vycházejí ze zmíněných klinických studií trametinibu podávaného jak v monoterapii, tak i v kombinaci s dabrafenibem (COMBI‑d a COMBI‑v). Nežádoucí účinky podle četnosti výskytu shrnují tab. 5 a 6 [6,9,12,14,17,19].
Horečnaté stavy
Horečka byla jedním z nejčastěji pozorovaných nežádoucích účinků léčby s jednoznačně vyšším výskytem při kombinované terapii dabrafenibem a trametinebem (51–53 %) oproti monoterapii inhibitorem BRAF (21–28 %; dabrafenib, vemurafenib). Jednalo se zpravidla o nižší stupeň závažnosti, odeznívající po přerušení terapie, ale v celkovém hodnocení to byl jeden z nejčastějších důvodů ukončení léčby trametinibem pro nežádoucí účinky při podávání kombinované terapie (COMBI‑d).
Snížení ejekční frakce/dysfunkce levé komory
Při léčbě trametinibem bylo pozorováno snížení ejekční frakce levé komory (EF LK) u 6 % pacientů ve skupině léčené monoterapií a u 8 % pacientů ve skupině s kombinací trametinibu s dabrafenibem. Pacienti byli ve většině případů asymptomatičtí a změny byly reverzibilní, počátek obtíží nastal po prvních měsících od zahájení terapie (2–5 měsíců). Pacienti s EF LK nižší než dolní hranice normy nebyli do klinické studie s trametinibem zařazováni. U pacientů s hraničním nálezem EF LK má být trametinib používán s opatrností a před zahájením terapie se doporučuje provést echokardiografické vyšetření.
Hypertenze
Při monoterapii trametinibem i při podávání kombinace trametinibu s dabrafenibem byl zaznamenán výskyt zvýšeného krevního tlaku rovněž u pacientů bez předchozí léčby hypertenze. Doporučuje se pravidelné monitorování krevního tlaku před zahájením terapie i v jejím průběhu a řádné léčení případné hypertenze.
Exantém
Exantém byl pozorován u 60 % pacientů ve větvi s monoterapií trametinibem, ale asi jen u 25 % pacientů ze skupiny kombinované terapie s dabrafenibem. Většina ze zaznamenaných případů byla mírnějšího stupně (stupně 1 a 2) a nevyžadovala přerušení léčby nebo snížení dávky.
Hemoragie
U pacientů užívajících trametinib v monoterapii a v kombinaci s dabrafenibem se vyskytly krvácivé příhody. Ve většině případů šlo o mírné krvácení, ale byly hlášeny i závažnější hemoragické komplikace až fatální intrakraniální krvácení; jejich výskyt byl zaznamenán u pacientů léčených kombinovanou terapií a nepřesahoval 1 %. Riziko hemoragií může být zvýšené při současné antiagregační a antikoagulační léčbě, i když nejsou dokumentovány jednoznačné lékové interakce s touto skupinou léčiv.
Hepatotoxicita
V klinických studiích s monoterapií trametinibem a v kombinaci s dabrafenibem byly hlášeny nežádoucí účinky v podobě hepatotoxicity projevující se často asymptomatickou elevací hodnot jaterních aminotransferáz (ALT a AST). Většinou se jednalo o mírnější postižení (stupně 1 a 2) v prvním půlroce terapie. Vzhledem k těmto nálezům se doporučuje provádět pravidelné kontroly jaterních funkcí každé čtyři týdny alespoň v prvních šesti měsících terapie.
Oční komplikace
U pacientů užívajících trametinib především v monoterapii, ale i při kombinaci s dabrafenibem byly popsány poruchy vidění projevující se rozmazaným viděním a rozostřeností vizu. Nejzávažnější komplikace – odchlípení pigmentového epitelu sítnice a okluze centrální retinální žíly – byly vzácné, ale jsou indikací k ukončení léčby, pokud nedojde k úpravě po jejím přerušení.
Intersticiální plicní onemocnění, pneumonitida
Při podávání trametinibu jak v monoterapii, tak v kombinaci se může vyskytovat intersticiální plicní onemocnění nebo pneumonitida. Při podezření na tuto komplikaci je nutné léčbu neprodleně přerušit a při potvrzení onemocnění ji ukončit. Doporučuje se důkladné sledování při výskytu nových symptomů, jako je kašel, dušnost, plicní infiltráty či tvorba výpotku.
Výskyt duplicitních maligních nádorů
Výskyt nových maligních nádorů byl pozorován při terapii kombinací trametinibu a dabrafenibu. Z kožního postižení byl nejčastěji zaznamenán výskyt dlaždicobuněčného karcinomu, kam byl podle klinického hodnocení zařazen i výskyt keratoakantomu, i když se jedná o benigní nádor (histologicky někdy obtížně odlišitelný od dlaždicobuněčného karcinomu). Byly zaznamenány i případy nového primárního melanomu kůže. V obou případech je terapeuticky dostačující radikální excize bez nutnosti přerušení či změny léčby.
Lékové interakce
Trametinib je substrátem transportéru P‑gp. Silná inhibice jaterního P‑gp může vést ke zvýšení koncentrací trametinibu, doporučuje se obezřetnost při současném podávání s léčivými přípravky, které jsou inhibitory P‑gp, jako je např. verapamil, cyklosporin, ritonavir, chinidin, itraconazol. Trametinib může způsobit přechodnou inhibici substrátů BCRP (breast cancer resistance protein), např. pitavastatinu, ve střevě, která může být minimalizována odděleným podáváním trametinibu a jiných léčiv s dvouhodinovým odstupem.
Těhotenství a kojení
V současné době nejsou k dispozici klinické studie účinnosti a bezpečnosti léčby trametinibem u gravidních pacientek. Vzhledem k reprodukční toxicitě prokázané na zvířecím modelu lze při této léčbě předpokládat i riziko pro plod pacientek. Před zahájením léčby trametinibem je vhodné provést test gravidity a informovat pacientky ve fertilním věku o možném riziku a doporučit kombinaci více forem antikoncepce (hormonální, bariérová) [20]. Nebyla prokázána interakce trametinibu a hormonální antikoncepce. Nejsou dostupné informace o vylučování trametinibu do mateřského mléka, při kojení je proto nutné postupovat s opatrností a přihlédnout k přínosům léčby pro pacientku a k riziku, které může podávání trametinibu představovat pro plod a kojení.
Ovlivnění pozornosti
Dle dostupných údajů trametinib jen málo ovlivňuje pozornost a schopnost řídit motorová vozidla. Je však nutné pacienty poučit, že tyto činnosti mohou být druhotně ovlivněny některým z nežádoucích účinků trametinibu (únava, závratě, nevolnost, poruchy vizu aj.). Stejně tak mohou být tyto činnosti ovlivněny závažností stavu pacienta při generalizaci onemocnění, u něhož je trametinib indikován.
Dávkovaní
Doporučená dávka trametinibu při perorálním podání vycházející z klinických sledování v monoterapii i v kombinaci s dabrafenibem je 2 mg jednou denně. Dabrafenib se podává dvakrát denně v dávce 150 mg. Trametinib se užívá nalačno, alespoň jednu hodinu před jídlem nebo nejméně dvě hodiny po jídle, vždy přibližně ve stejnou dobu. Při výskytu nežádoucích účinků a toxicity (stupeň 2) se léčba přeruší; k terapii se lze vrátit, pokud obtíže ustoupí do přijatelné tolerance nebo vymizejí (stupeň 0–1). Při znovuzahájení léčby se dávka snižuje o 0,5 mg/den. V monoterapii a v kombinaci s dabrafenibem se nedoporučuje snížení dávky na méně než 1 mg/den. Při opomenutí užití dávky trametinibu se doporučuje pokračovat v užívání až následující den pravidelnou dávkou, lék lze podat nejpozději 12 hodin před další pravidelnou dávkou. Trametinib je možné podávat do doby, kdy má pacient z léčby prospěch a nedojde k progresi onemocnění nebo ke vzniku nepřijatelné toxicity bez zlepšení po přerušení léčby (stupeň 4) [6,9,12].
Stabilita a kompatibilita
Trametinib se dlouhodobě uchovává v chladničce (při teplotě 2–8 °C), po otevření lze lék uchovávat měsíc (30 dní) při pokojové teplotě do 30 °C. Je vhodné chránit lék před světelným zářením a uchovávat jej v originálním obalu.
Seznam použité literatury
- [1] Sullivan RJ, Flaherty K. MAP kinase signaling and inhibition in melanoma. Oncogene 2013; 32: 2373–2379.
- [2] Wellbrock C, Arozarena I. The Complexity of the ERK/MAP Kinase Pathway and the Treatment of Melanoma Skin Cancer. Front Cell Dev Biol 2016; 4: 33.
- [3] Pritchard AL, Hayward NK. Molecular pathways: mitogen activated protein kinase pathway mutations and drug resistance. Clin Cancer Res 2013; 19: 2301–2309.
- [4] Gilmartin AG, Bleam MR, Groy A, et al. GSK1120212 (JTP 74057) is an inhibitor of MEK activity and activation with favorable pharmacokinetic properties for sustained in vivo pathway inhibition. Clin Cancer Res 2011; 17: 989–1000.
- [5] Larkin J, Del Vecchio M, Ascierto PA, et al. Vemurafenib in patients with BRAF(V600) mutated metastatic melanoma: an open label, multicentre, safety study. Lancet Oncol 2014; 15: 436–444.
- [6] Robert C, Karaszewska B, Schachter J, et al. Improved overall survival in melanoma with combined dabrafenib and trametinib. N Engl J Med 2015; 372: 30–39.
- [7] Ouellet D, Kassir N, Chiu J, et al. Population pharmacokinetics and exposure response of trametinib, a MEK inhibitor, in patients with BRAF V600 mutation positive melanoma. Cancer Chemother Pharmacol 2016; 77: 807–817.
- [8] Infante JR, Fecher LA, Falchook GS, et al. Safety, pharmacokinetic, pharmacodynamic, and efficacy data for the oral MEK inhibitor trametinib: a phase 1 dose escalation trial. Lancet Oncol 2012; 13: 773–781.
- [9] Flaherty KT, Robert C, Hersey P, et al. Improved survival with MEK inhibition in BRAF mutated melanoma. N Engl J Med 2012; 367: 107–114.
- [10] Schadendorf D, Amonkar MM, Milhem M, et al. Functional and symptom impact of trametinib versus chemotherapy in BRAF V600E advanced or metastatic melanoma: quality of life analyses of the METRIC study. Ann Oncol 2014; 25: 700–706.
- [11] Latimer NR, Bell H, Abrams KR, et al. Adjusting for treatment switching in the METRIC study shows further improved overall survival with trametinib compared with chemotherapy. Cancer Med 2016; 5: 806–815.
- [12] Long GV, Stroyakovskiy D, Gogas H, et al. Combined BRAF and MEK inhibition versus BRAF inhibition alone in melanoma. N Engl J Med 2014; 371: 1877–1888.
- [13] Long GV, Stroyakovskiy D, Gogas H, et al. Dabrafenib and trametinib versus dabrafenib and placebo for Val600 BRAF mutant melanoma: a multicentre, double blind, phase 3 randomised controlled trial. Lancet 2015; 386: 444–451.
- [14] Johnson DB, Flaherty KT, Weber JS, et al. Combined BRAF (Dabrafenib) and MEK inhibition (Trametinib) in patients with BRAFV600 mutant melanoma experiencing progression with single agent BRAF inhibitor. J Clin Oncol 2014; 32: 3697–3704.
- [15] Kasuga A, Nakagawa K, Nagashima F, et al. A phase I/Ib study of trametinib (GSK1120212) alone and in combination with gemcitabine in Japanese patients with advanced solid tumors. Invest Drugs 2015; 33: 1058–1067.
- [16] Tolcher AW, Patnaik A, Papadopoulos KP, et al. Phase I
- [17] Corcoran RB, Atreya CE, Falchook GS, et al. Combined BRAF and MEK Inhibition With Dabrafenib and Trametinib in BRAF V600 Mutant Colorectal Cancer. J Clin Oncol 2015; 33: 4023–4031.
- [18] Matter Walstra K, Braun R, Kolb C, et al. A cost effectiveness analysis of trametinib plus dabrafenib as first line therapy for metastatic BRAF V600 mutated melanoma in the Swiss setting. Br J Dermatol 2015; 173: 1462–1470.
- [19] Dossett LA, Kudchadkar RR, Zager JS. BRAF and MEK inhibition in melanoma. Expert Opin Drug Saf 2015; 14: 559–570.
- [20] Grunewald S, Jank A. New systemic agents in dermatology with respect to fertility, pregnancy, and lactation. J Dtsch Dermatol Ges 2015; 13: 277–289; quiz 290.