Trastuzumab
Trastuzumab je rekombinantní humanizovaná monoklonální protilátka IgG1, která se selektivně váže na extracelulární doménu receptoru 2 pro lidský epidermální růstový faktor (HER2). Mechanismus účinku trastuzumabu není doposud přesně znám. Nejčastěji jsou popisovány aktivace cytotoxicity závislé na protilátkách a blokáda proteolytického štěpení extracelulární domény. Trastuzumab je možno indikovat v terapii HER2 pozitivního karcinomu prsu: v 1. linii metastatického onemocnění v kombinaci s paklitaxelem nebo v kombinaci s docetaxelem, v 1. linii metastatického onemocnění v kombinaci s inhibitorem aromatáz nebo v monoterapii u pacientek, které jsou předléčeny 2 liniemi paliativní chemoterapie. V adjuvantním podání je možno indikovat trastuzumab u pacientek po chirurgickém zákroku, po chemoterapii a po radioterapii. Nově je možné podávat trastuzumab v kombinaci s kapecitabinem nebo s 5-fluorouracilem a cisplatinou u nemocných s HER2 pozitivním metastazujícím adenokarcinomem žaludku. K závažným nežádoucím účinkům při léčbě trastuzumabem patří kardiotoxicita, která se častěji vyskytuje při nebo po terapii antracykliny. Dávkování trastuzumabu se liší dle indikace, konkomitantní chemoterapie a výskytu nežádoucích účinků.
Farmakologická skupina
Chemické a fyzikální vlastnosti
Trastuzumab je produkován rekombinantní DNA technologií – buněčnými liniemi savčích buněk získaných z ovarií čínských křečků. Následně je protilátka čištěna využitím standardních chromatografických a filtračních metod. Trastuzumab je sterilní bílá až světle žlutá lyofilizovaná substance pro intravenózní podání, jejíž součástí je a, a dihydrát trehalózy, L-histidin-hydrochlorid, L-histidin a polysorbát 20.
Mechanismus účinku, farmakodynamika
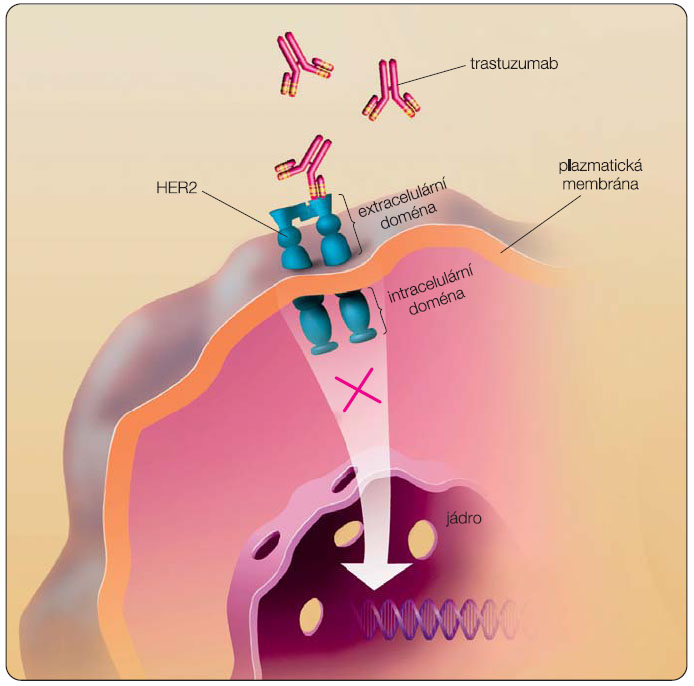 Trastuzumab je rekombinantní humanizovaná monoklonální protilátka IgG1, která se selektivně váže s vysokou afinitou na extracelulární doménu receptoru 2 pro lidský epidermální růstový faktor (HER2, ErbB-2), viz obr. 1. HER2 receptor patří do rodiny lidských receptorů pro epidermální růstové faktory EGFR 1–4. Je kódován HER2/neu genem lokalizovaným na 17. chromozomu 17q21. Jedná se o transmembránový receptor, který může být aktivován několika způsoby. Procesem heterodimerizace spolu s jinými receptory EGFR nebo i homodimerizací, a to při nadměrné expresi [1]. Dále může nastat aktivace receptoru při jeho štěpení, kdy dochází k proteolytickému odštěpení extracelulární části receptoru a intracelulární část se stává aktivní [2]. Aktivace HER2 signální dráhy je spojena s agresivním chováním onemocnění, s vysokým rizikem relapsu a kratší dobou přežívání nemocných [3]. Mechanismus účinku trastuzumabu není doposud přesně znám, je popisováno několik možností jeho působení.
Trastuzumab je rekombinantní humanizovaná monoklonální protilátka IgG1, která se selektivně váže s vysokou afinitou na extracelulární doménu receptoru 2 pro lidský epidermální růstový faktor (HER2, ErbB-2), viz obr. 1. HER2 receptor patří do rodiny lidských receptorů pro epidermální růstové faktory EGFR 1–4. Je kódován HER2/neu genem lokalizovaným na 17. chromozomu 17q21. Jedná se o transmembránový receptor, který může být aktivován několika způsoby. Procesem heterodimerizace spolu s jinými receptory EGFR nebo i homodimerizací, a to při nadměrné expresi [1]. Dále může nastat aktivace receptoru při jeho štěpení, kdy dochází k proteolytickému odštěpení extracelulární části receptoru a intracelulární část se stává aktivní [2]. Aktivace HER2 signální dráhy je spojena s agresivním chováním onemocnění, s vysokým rizikem relapsu a kratší dobou přežívání nemocných [3]. Mechanismus účinku trastuzumabu není doposud přesně znám, je popisováno několik možností jeho působení.
Aktivace cytotoxicity závislé na protilátkách (antibody-dependent cellular cytotoxicity, ADCC)
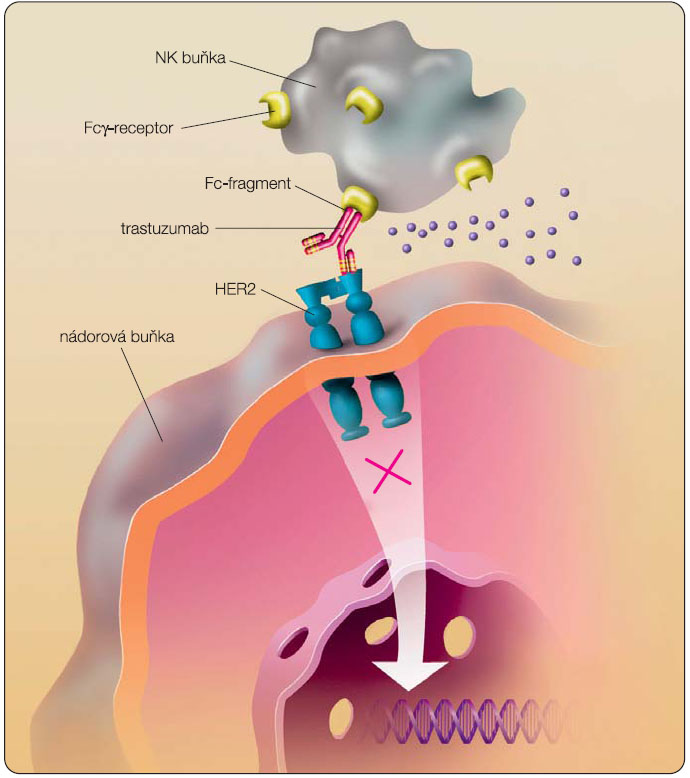 Trastuzumab obsahuje IgG1 Fc-strukturu. Po vazbě trastuzumabu na receptor HER2 se na Fc-fragment naváže Fcg-receptor efektorové imunitní buňky, nejčastěji NK, a dojde k destrukci nádorové buňky, viz obr. 2 [4]. Jak výsledky preklinických, tak výsledky pilotních klinických studií podporují teorii, že trastuzumab je aktivní v oblasti Fcg-receptoru efektorových imunitních buněk. V recentně publikované klinické studii byla pozorována signifikantně vyšší infiltrace tumoru NK buňkami a vyšší lymfocytární aktivita po předchozí chemoterapii s trastuzumabem ve srovnání s kontrolní skupinou [5]. Také další studie ukazují klíčovou roli NK buněk v ADCC zprostředkované trastuzumabem. V poměrně malé klinické studii s 11 pacientkami s HER2 pozitivitou byla prokázána 3,8krát vyšší ADCC ve skupině žen, které odpověděly na neoadjuvantní terapii trastuzumabem [6]. Objevují se již i práce zaměřené na roli polymorfismů IgG Fcg-receptoru, dosavadní data jsou nejednoznačná.
Trastuzumab obsahuje IgG1 Fc-strukturu. Po vazbě trastuzumabu na receptor HER2 se na Fc-fragment naváže Fcg-receptor efektorové imunitní buňky, nejčastěji NK, a dojde k destrukci nádorové buňky, viz obr. 2 [4]. Jak výsledky preklinických, tak výsledky pilotních klinických studií podporují teorii, že trastuzumab je aktivní v oblasti Fcg-receptoru efektorových imunitních buněk. V recentně publikované klinické studii byla pozorována signifikantně vyšší infiltrace tumoru NK buňkami a vyšší lymfocytární aktivita po předchozí chemoterapii s trastuzumabem ve srovnání s kontrolní skupinou [5]. Také další studie ukazují klíčovou roli NK buněk v ADCC zprostředkované trastuzumabem. V poměrně malé klinické studii s 11 pacientkami s HER2 pozitivitou byla prokázána 3,8krát vyšší ADCC ve skupině žen, které odpověděly na neoadjuvantní terapii trastuzumabem [6]. Objevují se již i práce zaměřené na roli polymorfismů IgG Fcg-receptoru, dosavadní data jsou nejednoznačná.
Blokáda proteolytického štěpení extracelulární domény HER2 (ECD HER2)
Extracelulární doména HER2 může být uvolněna do cirkulace, kde ji lze v séru detekovat a kvantifikovat [7]. Dle publikovaných dat chybí extracelulární doména pouze u limitovaného množství HER2 receptorů [8, 9]. V preklinických studiích bylo prokázáno, že trastuzumab inhibuje bazální a indukované proteolytické štěpení ECD, a tím předchází aktivaci intracelulární části receptoru (vzniku fosforylovaného p95) [10]. Dalšími možnými mechanismy účinků trastuzumabu jsou inhibice intracelulární signální transdukce, inhibice tumorem indukované angiogeneze, eventuálně inhibice reparace poškozené DNA v důsledku protinádorové terapie [11].
Farmakokinetickévlastnosti
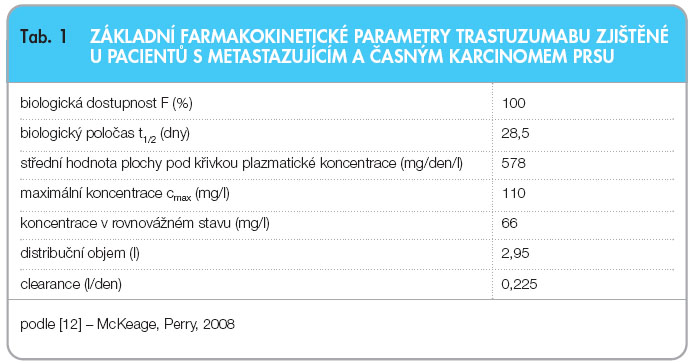 Farmakokinetika trastuzumabu byla hodnocena u pacientů s metastazujícím a časným karcinomem prsu (tab. 1). Při krátkodobých infuzích, kdy byl podáván trastuzumab v dávkách 10 mg, 50 mg, 100 mg, 250 mg a 500 mg jedenkrát týdně, byla u pacientů prokázána na dávce závislá farmakokinetika. Studie, které by se zabývaly lékovými interakcemi trastuzumabu, nebyly prováděny.
Farmakokinetika trastuzumabu byla hodnocena u pacientů s metastazujícím a časným karcinomem prsu (tab. 1). Při krátkodobých infuzích, kdy byl podáván trastuzumab v dávkách 10 mg, 50 mg, 100 mg, 250 mg a 500 mg jedenkrát týdně, byla u pacientů prokázána na dávce závislá farmakokinetika. Studie, které by se zabývaly lékovými interakcemi trastuzumabu, nebyly prováděny.
Biologický poločas je přibližně 28,5 dne (95% interval spolehlivosti: 25,5–32,8 dne). Vymývací perioda je až 24 týdnů (95% CI: 18–24 týdnů) [12]. Rovnovážného farmakokinetického stavu by mělo být dosaženo přibližně do 20 týdnů (95% CI: 18–24 týdnů). Při hodnocení populační farmakokinetiky v klinických studiích fáze I, II a III u metastatického karcinomu prsu byla střední hodnota plochy pod křivkou plazmatické koncentrace (měřená po dobu jednoho týdne) 578 mg/den/l, průměrná vrcholová koncentrace 110 mg/l a koncentrace v rovnovážném stavu 66 mg/l [12]. U pacientů s časným karcinomem prsu, jimž byl podáván trastuzumab v úvodní nasycovací dávce 8 mg/kg a následně v dávce 6 mg/kg jedenkrát za 21 dní, bylo rovnovážné koncentrace 63 mg/l dosaženo do cyklu 13 (37. týden). Koncentrace byla srovnatelná s dříve zjištěnými hodnotami u pacientů s metastatickým karcinomem prsu.
Clearance se snižuje se zvyšující se dávkou. V klinických studiích, v nichž byla podávána nasycovací dávka 4 mg/kg trastuzumabu a dále týdenní dávky 2 mg/kg, byla průměrná clearance 0,225 l/den [12]. Byl též hodnocen vliv charakteristiky pacienta (např. věku nebo sérového kreatininu) na vylučování trastuzumabu. Údaje naznačují, že vylučování trastuzumabu není ovlivněno u žádné z těchto skupin pacientů, nicméně studie nebyly zaměřeny specificky na posouzení vlivu renálního poškození na farmakokinetiku. Ve všech klinických studiích se distribuční objem přibližoval objemu séra a činil 2,95 l [12].
Cirkulující uvolněný antigen
U některých pacientů s HER2 pozitivním karcinomem prsu byly v séru nalezeny detekovatelné koncentrace cirkulující extracelulární domény HER2 receptoru (ECD HER2). Stanovení tohoto antigenu ve výchozích vzorcích séra prokázalo, že 64 % (286/447) pacientů mělo detekovatelný uvolněný antigen, hodnoty dosahovaly až 1880 ng/ml (medián 11 ng/ml). U pacientů s vysokou výchozí hladinou tohoto antigenu byly pravděpodobnější nižší hodnoty sérových koncentrací trastuzumabu v rovnovážném stavu. Nicméně při týdenních dávkách bylo u většiny pacientů se zvýšenou hladinou ECD HER2 dosaženo cílové koncentrace trastuzumabu v séru do 6. týdne léčby a nebyl pozorován žádný významný vztah mezi výchozí hladinou ECD HER2 a klinickou odpovědí [13].
Podání u starších pacientek
Trastuzumab byl podáván u 386 pacientek s karcinomem prsu starších 65 let. Ve srovnání s mladšími pacientkami bylo zjištěno vyšší riziko kardiotoxicity jak v adjuvantní terapii, tak i v léčbě metastatického onemocnění. Studie zaměřené speciálně na posouzení farmakokinetiky u starších pacientů nebyly prováděny.
Klinické zkušenosti
Trastuzumab je používán v klinické praxi od roku 1998 ve Spojených státech, od roku 2000 v Evropě a od roku 2001 v České republice. Zpočátku byl indikován pouze u pacientek s metastatickým onemocněním, od roku 2006 je indikován i v adjuvantním podání. Jedná se o cílenou terapii pro pacientky s HER2 pozitivním karcinomem prsu. 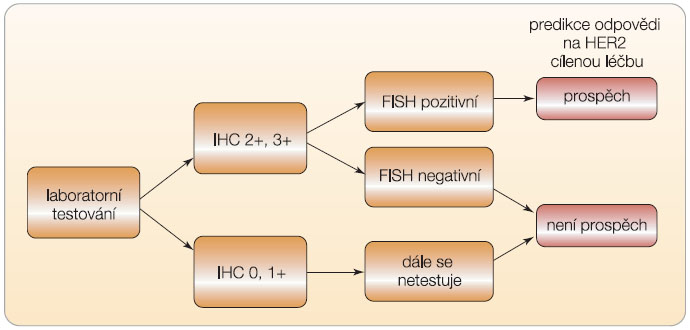 Stanovení statusu HER2 je základní podmínkou pro správnou indikaci k terapii. Trastuzumab je indikován pouze u pacientek s prokázanou overexpresí nebo amplifikací HER2. Amplifikace se vyskytuje asi u 15–25 % žen s karcinomem prsu. Na našem pracovišti jsme prokázali výskyt HER2 amplifikace u 14,2 % žen s karcinomem prsu [14]. V každodenní klinické praxi je u každé pacientky s karcinomem prsu vyšetřen HER2 receptor imunohistochemicky (IHC), a pouze v případě IHC pozitivity HER2 2+ a 3+ je dále provedeno stanovení genové exprese pomocí FISH (fluorescenční hybridizace in situ). V případě hodnot IHC 0 nebo 1+ se jedná o negativní nález, v případě HER2 2+ je potřeba doplnit ještě vyšetření metodou FISH a při nálezu HER2 3+ je tento výsledek označován za pozitivní, tzn. je přítomna HER2 pozitivita. Pro léčbu trastuzumabem v naší republice je potřeba vždy při HER2 2+ a 3+ doplnit vyšetření HER2 metodou FISH (obr. 3).
Stanovení statusu HER2 je základní podmínkou pro správnou indikaci k terapii. Trastuzumab je indikován pouze u pacientek s prokázanou overexpresí nebo amplifikací HER2. Amplifikace se vyskytuje asi u 15–25 % žen s karcinomem prsu. Na našem pracovišti jsme prokázali výskyt HER2 amplifikace u 14,2 % žen s karcinomem prsu [14]. V každodenní klinické praxi je u každé pacientky s karcinomem prsu vyšetřen HER2 receptor imunohistochemicky (IHC), a pouze v případě IHC pozitivity HER2 2+ a 3+ je dále provedeno stanovení genové exprese pomocí FISH (fluorescenční hybridizace in situ). V případě hodnot IHC 0 nebo 1+ se jedná o negativní nález, v případě HER2 2+ je potřeba doplnit ještě vyšetření metodou FISH a při nálezu HER2 3+ je tento výsledek označován za pozitivní, tzn. je přítomna HER2 pozitivita. Pro léčbu trastuzumabem v naší republice je potřeba vždy při HER2 2+ a 3+ doplnit vyšetření HER2 metodou FISH (obr. 3).
V letošním roce bylo Evropskou komisí schváleno použití trastuzumabu v léčbě pacientů s metastatickým adenokarcinomem žaludku. Vysoké hladiny proteinu HER2 jsou zjištěny přibližně u 15–18 % případů karcinomu žaludku. Trastuzumab je indikován pouze u pacientů, u nichž byla imunohistochemicky prokázána pozitivita HER2 definovaná jako IHC2+ a potvrzená výsledky FISH+ nebo IHC3+.
Léčba metastatického karcinomu prsu
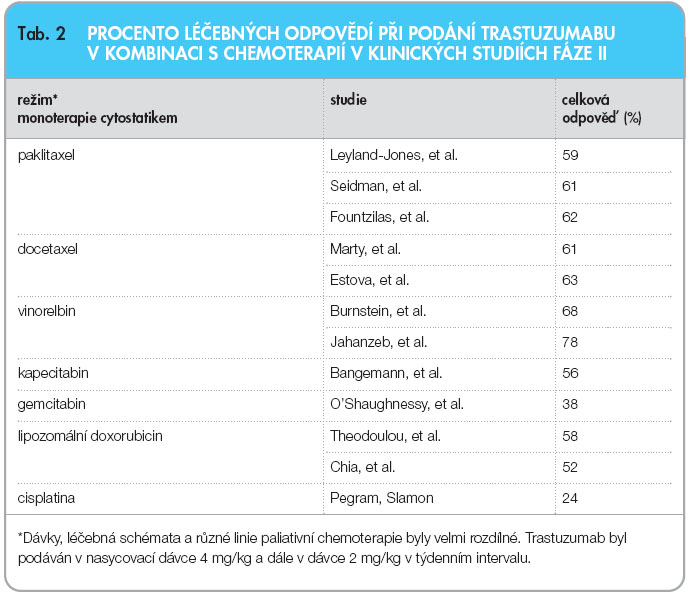 Klinické studie fáze I a II, které probíhaly od roku 1992, přinesly nadějné výsledky. V monoterapii bylo dosaženo celkové odpovědi (ORR) v 1. linii u 23–28 % léčených [15, 16], v dalších liniích 11,6–15 % [17, 18]. Množství nerandomizovaných klinických studií fáze II prokázalo efektivitu a relativní bezpečnost trastuzumabu v kombinacích s cytostatiky používanými v terapii karcinomu prsu (tab. 2). Původně byly zařazovány pacientky s HER2 2+ a 3+ pozitivitou. Subanalýzy těchto studií prokázaly, že nejlepších odpovědí bylo dosaženo u pacientek s HER2 3+ nebo u pacientek s potvrzenou amplifikací. Dále navazovalo celé množství klinických studií fáze III; tady zmíním pouze několik z nich, především studii registrační. Ve studii H0648g byla srovnávána efektivita paklitaxelu v monoterapii s kombinací paklitaxel plus trastuzumab. Do studie bylo zařazeno 469 pacientek s metastatickým karcinomem prsu. Paklitaxel byl podáván v třítýdenním intervalu, trastuzumab standardně 1krát týdně – zahájení nasycovací dávkou 4 mg/kg a a následné pokračování terapie v dávce 2 mg/kg týdně. Pacientky léčené samotnou chemoterapií mohly při progresi onemocnění pokračovat ve studii H0659, kde byly již léčeny trastuzumabem v monoterapii, nebo kombinací dle rozhodnutí lékaře. Ve studii bylo prokázáno signifikantní prodloužení doby do progrese onemocnění (primární cíl studie) 7,4 měsíce vs. 4,6 měsíce ve prospěch kombinace. Signifikantní byl také rozdíl v procentu
Klinické studie fáze I a II, které probíhaly od roku 1992, přinesly nadějné výsledky. V monoterapii bylo dosaženo celkové odpovědi (ORR) v 1. linii u 23–28 % léčených [15, 16], v dalších liniích 11,6–15 % [17, 18]. Množství nerandomizovaných klinických studií fáze II prokázalo efektivitu a relativní bezpečnost trastuzumabu v kombinacích s cytostatiky používanými v terapii karcinomu prsu (tab. 2). Původně byly zařazovány pacientky s HER2 2+ a 3+ pozitivitou. Subanalýzy těchto studií prokázaly, že nejlepších odpovědí bylo dosaženo u pacientek s HER2 3+ nebo u pacientek s potvrzenou amplifikací. Dále navazovalo celé množství klinických studií fáze III; tady zmíním pouze několik z nich, především studii registrační. Ve studii H0648g byla srovnávána efektivita paklitaxelu v monoterapii s kombinací paklitaxel plus trastuzumab. Do studie bylo zařazeno 469 pacientek s metastatickým karcinomem prsu. Paklitaxel byl podáván v třítýdenním intervalu, trastuzumab standardně 1krát týdně – zahájení nasycovací dávkou 4 mg/kg a a následné pokračování terapie v dávce 2 mg/kg týdně. Pacientky léčené samotnou chemoterapií mohly při progresi onemocnění pokračovat ve studii H0659, kde byly již léčeny trastuzumabem v monoterapii, nebo kombinací dle rozhodnutí lékaře. Ve studii bylo prokázáno signifikantní prodloužení doby do progrese onemocnění (primární cíl studie) 7,4 měsíce vs. 4,6 měsíce ve prospěch kombinace. Signifikantní byl také rozdíl v procentu 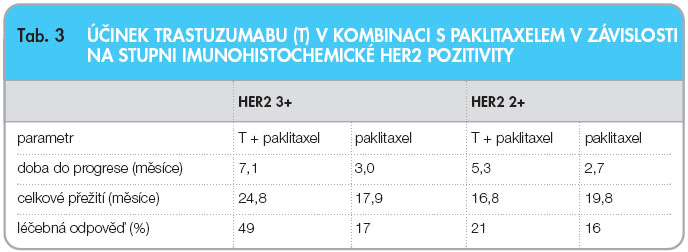 dosažených léčebných odpovědí – 50 % vs. 32 % (p = 0,0001). Další subanalýza podskupin HER2 2+ a 3+ ještě potvrdila tento rozdíl v efektivitě. U pacientek s IHC pozitivitou HER2 3+ se rozdíly v dosažení doby do progrese onemocnění, celkové léčebné odpovědi a celkového přežití ještě zvýraznily, viz tab. 3 [19].
dosažených léčebných odpovědí – 50 % vs. 32 % (p = 0,0001). Další subanalýza podskupin HER2 2+ a 3+ ještě potvrdila tento rozdíl v efektivitě. U pacientek s IHC pozitivitou HER2 3+ se rozdíly v dosažení doby do progrese onemocnění, celkové léčebné odpovědi a celkového přežití ještě zvýraznily, viz tab. 3 [19].
Studie H0649 zkoumala efektivitu trastuzumabu v monoterapii u HER2 pozitivních pacientek ve druhé a třetí linii léčby. Do studie bylo zařazeno 222 pacientek předléčených paliativní chemoterapií pro metastatické onemocnění. Dosaženo bylo 16 % léčebných odpovědí; medián trvání léčebné odpovědi byl 9 měsíců (v rozmezí 1,6–26). Také v této studii byla subanalýzou prokázána daleko výraznější efektivita u pacientek ve skupině HER2 3+ [20].
Další významnou studií byla studie M77001, která srovnávala monoterapii docetaxelem s kombinací docetaxel a trastuzumab. Od předchozích studií se lišila výběrem pacientek – zařazeny byly pouze nemocné s IHC HER2 pozitivitou 3+ nebo ty, u nichž byla prokázána HER2 amplifikace FISH metodou. Také v této studii bylo dosaženo lepších výsledků v kombinaci docetaxel plus trastuzumab – dvojnásobného počtu léčebných odpovědí, dvojnásobné doby do progrese onemocnění a signifikantního prodloužení přežití pacientek (31,2 vs. 22,7 měsíce). Další slibná data v rámci výsledků této studie byla publikována v roce 2006 po 36 měsících sledování, kdy 22 % pacientek léčených trastuzumabem přežívalo déle než 4 roky [21].
Tyto přesvědčivé výsledky klinických studií vedly k zavedení trastuzumabu do léčby metastatického HER2 pozitivního karcinomu prsu, viz tab. 4 [20–24]. I po deseti letech terapie trastuzumabem nebylo zcela zřejmé, co nabídnout HER2 pozitivním pacientkám, u kterých došlo k progresi onemocnění při podávání trastuzumabu. V roce 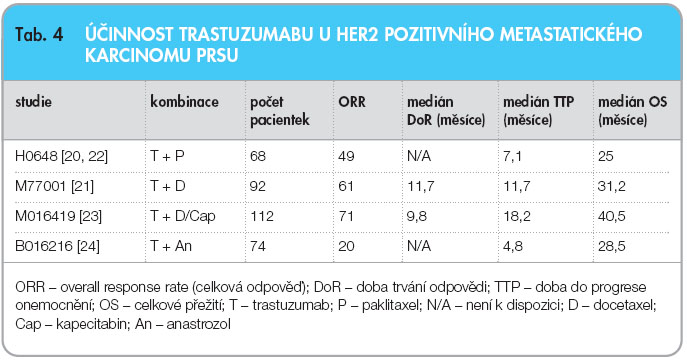 2008 byly prezentovány výsledky klinické studie fáze III GBG-26 u pacientek, které již byly předléčeny trastuzumabem. Zařazeno bylo 156 pacientek s HER2 pozitivním karcinomem prsu s předchozí terapií trastuzumabem. Při progresi během léčby trastuzumabem byly nemocné randomizovány do dvou ramen – v jednom byly léčeny kombinací trastuzumab a kapecitabin, ve druhém rameni byly dále léčeny pouze monoterapií trastuzumabem. Bylo dosaženo téměř dvojnásobného množství celkových léčebných odpovědí (48 % vs. 27 %), prodloužení času do progrese onemocnění (8,2 vs. 5,6 měsíce, HR 0,69, p = 0,034) a zlepšení celkové doby přežití (25,5 vs. 20,4 měsíce, HR 0,76; p = 0,26) ve prospěch ramene s kombinovanou léčbou [25].
2008 byly prezentovány výsledky klinické studie fáze III GBG-26 u pacientek, které již byly předléčeny trastuzumabem. Zařazeno bylo 156 pacientek s HER2 pozitivním karcinomem prsu s předchozí terapií trastuzumabem. Při progresi během léčby trastuzumabem byly nemocné randomizovány do dvou ramen – v jednom byly léčeny kombinací trastuzumab a kapecitabin, ve druhém rameni byly dále léčeny pouze monoterapií trastuzumabem. Bylo dosaženo téměř dvojnásobného množství celkových léčebných odpovědí (48 % vs. 27 %), prodloužení času do progrese onemocnění (8,2 vs. 5,6 měsíce, HR 0,69, p = 0,034) a zlepšení celkové doby přežití (25,5 vs. 20,4 měsíce, HR 0,76; p = 0,26) ve prospěch ramene s kombinovanou léčbou [25].
Další z možností je kombinace cílené biologické terapie směřované na HER2 receptor. Jednou z prvních klinických studií fáze III je studie EGF 104900, kombinující trastuzumab a lapatinib u pacientek s metastatickým karcinomem prsu, které byly předléčeny chemoterapií a trastuzumabem. Obě tyto látky mají za cíl HER2 receptor, ale trastuzumab se váže na jeho extracelulární doménu, zatímco lapatinib se váže na intracelulární část receptorů HER1 a HER2 a blokuje kinázovou aktivitu receptoru. Tyto pacientky byly léčeny buď kombinací lapatinib plus trastuzumab, nebo pouze monoterapií lapatinibem. Léčebná kombinace vedla ke zlepšení doby do progrese onemocnění (8,1 vs. 12,0 týdne, HR 0,73, p = 0,008) a k nesignifikantnímu prodloužení přežití o 1 měsíc (2,8 vs. 1,9 měsíce, p = 0,008). V parametru celkové odpovědi nebylo dosaženo signifikantního rozdílu (10,3 % při podávání kombinace vs. 6,9 % při monoterapii, p = 0,46). Rozdíl v hodnocení klinického přínosu (CBR) byl signifikantní (24,7 % u kombinace vs. 12,4 % u monoterapie, p = 0,01). Výsledky léčby se mohou zdát nevýrazné, nicméně jednalo se o pacientky předléčené minimálně 3 liniemi paliativní terapie. Opakovaně tak bylo prokázáno, že pokračování v léčbě trastuzumabem a pouze změna v kombinaci je pro pacientky větším přínosem než pouhá záměna samotného léku [26].
Kromě kombinace s chemoterapií lze trastuzumab podávat i s hormonální léčbou. V klinické studii fáze III TAnDEM byly postmenopauzální HER2 pozitivní pacientky léčeny buď jednak samotnou hormonální terapií anastrozolem, nebo kombinací anastrozol a trastuzumab. V kombinačním rameni bylo prokázáno prodloužení doby do progrese z 2,4 na 4,8 měsíce (p = 0,0007) oproti monoterapii anastrozolem. Také v počtu celkových odpovědí bylo dosaženo lepšího výsledku v kombinovaném rameni (6,8 % vs. 20,3 %, p = 0,018).
Do studie eLEcTRA byly zařazovány pacientky s expresí steroidních receptorů (SR), část pacientek i HER2 pozitivních. Celkem 58 pacientek HER2 pozitivních a SR pozitivních bylo randomizováno do ramene s letrozolem samotným, nebo byly léčeny kombinací trastuzumab a letrozol. Dalších 35 pacientek HER2 negativních a SR pozitivních bylo léčeno pouze monoterapií letrozolem. Terapie byla podávána v 1. linii léčby metastatického karcinomu prsu. Výsledky byly prezentovány na sympoziu v San Antoniu v roce 2009. Medián doby do progrese onemocnění (TTP) byl při monoterapii letrozolem (skupina A) 3,3 měsíce, při léčbě kombinací letrozol plus trastuzumab (skupina B) 14,1 měsíce (HR 0,67; p = 0,23) a 15,2 měsíce u pacientek SR pozitivních a HER2 negativních (skupina C), které byly léčeny samotným letrozolem (HR 0,71; p = 0,03). Ve skupině A bylo dosaženo celkové odpovědi 13 %, ve skupině B 27 % a ve skupině C 11 %. Kombinovaná terapie letrozolem s trastuzumabem je u pacientek s HER2 pozitivním a SR pozitivním karcinomem prsu v 1. linii metastatického onemocnění efektivnější než monoterapie letrozolem.
Adjuvantní terapie karcinomu prsu
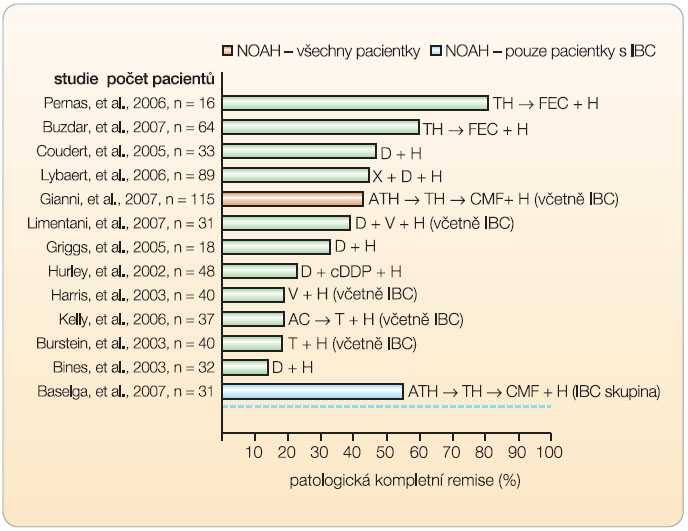
Adjuvantní terapie doplňuje nebo zvyšuje účinnost jiné základní léčebné metody. Cílem adjuvantní terapie je eliminace reziduální choroby, a tím zajištění vyléčení pacientky nebo alespoň prodloužení doby přežití. Trastuzumab prokázal účinek v klinických studiích u metastatického  karcinomu prsu a dalším krokem bylo jeho zavedení do adjuvantní léčby. Čtyři velké randomizované klinické studie a několik menších prokázaly přínos trastuzumabu i v rámci adjuvantní terapie (obr. 4). Data z několika randomizovaných klinických studií prokazují, že přidání trastuzumabu k chemoterapii přináší u HER2 pozitivních pacientek s karcinomem prsu snížení počtu rekurencí onemocnění a prodloužení celkového přežití. Nejčastěji je trastuzumab podáván po dobu jednoho roku, a to sekvenčně po terapii antracykliny z důvodu redukce možné kardiotoxicity.
karcinomu prsu a dalším krokem bylo jeho zavedení do adjuvantní léčby. Čtyři velké randomizované klinické studie a několik menších prokázaly přínos trastuzumabu i v rámci adjuvantní terapie (obr. 4). Data z několika randomizovaných klinických studií prokazují, že přidání trastuzumabu k chemoterapii přináší u HER2 pozitivních pacientek s karcinomem prsu snížení počtu rekurencí onemocnění a prodloužení celkového přežití. Nejčastěji je trastuzumab podáván po dobu jednoho roku, a to sekvenčně po terapii antracykliny z důvodu redukce možné kardiotoxicity.
Severoamerické studie
Obě americké studie měly podobný design. Ve studii NSABP B-31 bylo léčeno 1736 pacientek s HER2 pozitivním karcinomem prsu s postižením axilárních uzlin. Tyto ženy byly léčeny čtyřmi cykly chemoterapie režimem AC (doxorubicin + cyklofosfamid) v intervalu 21 dní s následným podáním 4 cyklů paklitaxelu v intervalu 21 dní. K léčbě paklitaxelem byl či nebyl přidán trastuzumab v nasycovací dávce 4 mg/kg a dále v udržovací dávce 2 mg/kg po dobu jednoho roku. Studie N-9831 navíc ještě testovala přidání trastuzumabu sekvenčně k chemoterapii. Do studie bylo zařazeno 1615 žen s HER2 pozitivním karcinomem prsu s metastatickým postižením axilárních uzlin, ale také byly zařazeny ženy s negativními uzlinami a s vysokým rizikem rekurence onemocnění. Všechny pacientky byly v úvodu léčeny 4 cykly chemoterapie režimem AC, následně v jednom rameni pouze monoterapií paklitaxelem v týdenním podání po 12 cyklů, ve druhém rameni dostávaly pacientky po 12 cyklů vždy 1krát týdně taktéž paklitaxel, na který navázalo podávání trastuzumabu po dobu 52 týdnů, ve třetím rameni byly pacientky léčeny kombinací paklitaxel plus trastuzumab 1krát týdně po dobu 12 týdnů, následovala monoterapie trastuzumabem do celkové doby 52 týdnů. Do obou studií byly zařazeny pouze pacientky s HER2 IHC 3+ nebo FISH pozitivní. Výsledky byly hodnoceny společnou analýzou. Přidáním trastuzumabu k chemoterapii došlo k signifikantní redukci rizika rekurence přibližně o polovinu (HR 0,48, p < 0,0001) a k redukci rizika smrti o 33 % (HR 0,67; p = 0,015) [27].
Studie HERA
Podobný výsledek přinesla i průběžná analýza dat velké multicentrické mezinárodní studie, do které bylo zařazeno 5090 žen s HER2 pozitivním karcinomem prsu po ukončení standardní adjuvantní chemoterapie. Podmínkou vstupu do studie byla ukončená lokoregionální terapie a podání minimálně 4 cyklů adjuvantní chemoterapie. Zařazovány byly pacientky s pozitivními axilárními uzlinami, popř. pacientky s nádorem větším než 1 cm s negativními axilárními uzlinami. Téměř u 95 % pacientek byly podány antracykliny, ale pouze u čtvrtiny z nich kombinace antracyklinu a taxanu; třetina nemocných měla negativní axilární uzliny. Publikovaná analýza hodnotila pouze jednoroční podání trastuzumabu u 1703 pacientek, kde došlo k 36% redukci rizika rekurence onemocnění (HR 0,64) a také k signifikantnímu zlepšení celkového přežití (HR 0,66) [28].
Studie BCIRG 006
Tato studie zahrnovala kromě 2 ramen s antracyklinem i rameno, v němž byly pacientky léčeny kombinací docetaxel, karboplatina plus trastuzumab. Ve dvou ramenech byly pacientky léčeny kombinací AC po 4 cykly, další 4 cykly dostávaly docetaxel (T), který byl v jednom rameni podáván spolu s trastuzumabem (H). Po ukončení podávání docetaxelu byl pacientkám dále aplikován trastuzumab (do celkové doby jednoho roku). Do této studie bylo zařazeno 3222 pacientek s HER2 pozitivním karcinomem prsu s metastatickým postižením axilárních uzlin nebo pacientek vysoce rizikových ve stadiu N0. Průběžná analýza proběhla za 23, 36 a 65 měsíců. Po 23 měsících bylo bezpříznakové období (DFS) statisticky významně lepší v obou ramenech s trastuzumabem ve srovnání s chemoterapií samotnou (HR pro DFS 0,49 a 0,61 pro AC/TH a TCH). Nebyl nalezen signifikantní rozdíl mezi dvěma rameny obsahujícími trastuzumab; rozdíl ve 4letém DFS byl u režimu AC/TH ve srovnání s TCH režimem 4 % (84 % vs. 80 %). Přidání trastuzumabu k adjuvantní chemoterapii s antracykliny zlepšuje DFS o 51 % a snižuje riziko úmrtí o 41 %. V rameni s neantracyklinovým režimem (režim TCH) bylo dosaženo zlepšení DFS o 39 % a zlepšení přežití o 34 %. Po 65 měsících byl znovu potvrzen signifikantní rozdíl v obou parametrech – v bezpříznakovém období (HR 0,64 při srovnání režimu AC/TH s ACT, p < 0,0001, a HR 0,75 při srovnání TCH a ACT, p = 0,04) a v celkovém přežití (HR 0,63 při srovnání AC/TH a ACT, p < 0,001, a HR 0,77 při srovnání TCH a ACT, p = 0,038). Tento signifikantní prospěch byl prokázán u obou skupin – u pacientek s nízkým i vysokým rizikem. Nebyl prokázán signifikantní rozdíl v efektivitě antracyklinového a neantracyklinového režimu [29].
Ve všech předchozích studiích byl trastuzumab podáván minimálně po dobu 12 měsíců. Ve finské studii FinHer byl trastuzumab podáván pouze 9 týdnů spolu s chemoterapií. Zařazeno bylo 1010 pacientek, 778 HER2 negativních a 232 HER2 pozitivních. Randomizovány byly do ramen léčených třemi cykly docetaxelu nebo vinorelbinu, následovaly 3 cykly režimu FEC. U pacientek HER2 pozitivních buď byl, nebo nebyl přidán k chemoterapii trastuzumab na dobu 9 týdnů. Pacientky léčené docetaxelem dosáhly lepšího DDFS (období bez příznaků vzdálených metastáz) než pacientky ve skupině léčené vinorelbinem (HR = 0,66; 95% CI 0,49–0,91; p = 0,010). V podskupině HER2 pozitivních žen měly pacientky léčené trastuzumabem tendenci k lepšímu DDFS oproti skupině léčené pouze chemoterapií (HR = 0,65; 95% CI 0,38–1,12; p = 0,12). Adjuvantní terapií s docetaxelem bylo dosaženo lepšího DDFS ve srovnání s adjuvantní terapií s vinorelbinem. Této studii je ale vytýkán malý počet pacientů, celkově bylo zařazeno 1010 žen, ale dle designu studie bylo trastuzumabem léčeno pouze 232 nemocných. U žádné pacientky léčené 9týdenním cyklem trastuzumabu nedošlo k poklesu ejekční frakce levé komory (EF LK) ani k symptomatickému srdečnímu selhání, jak bylo popisováno v předchozích studiích [30].
Zatím ještě nejsou k dispozici definitivní data z klinických studií s trastuzumabem v adjuvanci a stále ještě zůstává nezodpovězeno několik otázek – jaká je optimální doba podávání, zda by nepřineslo dostatečný prospěch pouze podávání trastuzumabu v monoterapii, popř. v kombinaci s hormonální terapií. Doufejme, že odpovědi na některé otázky budeme mít již brzy k dispozici. Zdá se, že na otázku, zda je efektivnější současné, nebo sekvenční podávání léčby, už odpověď známe. V San Antoniu byly v roce 2009 prezentovány výsledky amerických studií s mediánem sledování 5,3 roku, kdy bylo dosaženo bezpříznakového období u 84,2 % pacientek léčených současně a u 79,8% pacientek léčených sekvenčně. Rozdíl nedosáhl statistické významnosti, ale riziko rekurence nebo smrti se v rameni se současným podáváním chemoterapie a trastuzumabu snížilo o 25 % ve srovnání se sekvenčním podáváním.
Neoadjuvantní podání
 Neoadjuvantní chemoterapie se podává před operací především s cílem zlepšit operační možnosti, získat časné informace o biologických vlastnostech nádoru a jeho senzitivitě na danou léčbu. Dosažení patologické kompletní remise je prognostickým markerem. Pacientky, které dosáhnou kompletní patologické remise po neoadjuvantní chemoterapii, mají delší bezpříznakové období a delší přežití. V neoadjuvatní terapii se používají stejné látky jako v adjuvantním podání. Efektivita podání trastuzumabu u metastatického karcinomu prsu a efektivita podání v adjuvanci vedla ke snaze zařadit trastuzumab do neoadjuvantní léčby. Problematické bylo zvolit vhodný léčebný režim. Zásadním cytostatikem v léčbě karcinomu prsu zůstávají antracykliny, ale z předchozích studií byla jednoznačně prokázána větší kardiotoxicita při léčbě kombinací antracyklin plus trastuzumab. Byla publikována celá řada klinických studií fáze II, které kombinovaly trastuzumab s různými chemoterapeutickými režimy (tab. 2). Ve většině studií byly antracykliny podány v neoadjuvanci sekvenčně nebo současně s trastuzumabem. Dosažení patologické kompletní remise (pCR) se pohybovalo v rozmezí 15–80 % dle zvoleného režimu a zřejmě i dle počtu pacientek zařazených do studie (obr. 5).
Neoadjuvantní chemoterapie se podává před operací především s cílem zlepšit operační možnosti, získat časné informace o biologických vlastnostech nádoru a jeho senzitivitě na danou léčbu. Dosažení patologické kompletní remise je prognostickým markerem. Pacientky, které dosáhnou kompletní patologické remise po neoadjuvantní chemoterapii, mají delší bezpříznakové období a delší přežití. V neoadjuvatní terapii se používají stejné látky jako v adjuvantním podání. Efektivita podání trastuzumabu u metastatického karcinomu prsu a efektivita podání v adjuvanci vedla ke snaze zařadit trastuzumab do neoadjuvantní léčby. Problematické bylo zvolit vhodný léčebný režim. Zásadním cytostatikem v léčbě karcinomu prsu zůstávají antracykliny, ale z předchozích studií byla jednoznačně prokázána větší kardiotoxicita při léčbě kombinací antracyklin plus trastuzumab. Byla publikována celá řada klinických studií fáze II, které kombinovaly trastuzumab s různými chemoterapeutickými režimy (tab. 2). Ve většině studií byly antracykliny podány v neoadjuvanci sekvenčně nebo současně s trastuzumabem. Dosažení patologické kompletní remise (pCR) se pohybovalo v rozmezí 15–80 % dle zvoleného režimu a zřejmě i dle počtu pacientek zařazených do studie (obr. 5).
![Obr. 6 Design klinické studie fáze III s neoadjuvantním podáním trastuzumabu u HER2+ pacientek; podle [31] – Buzdar, et al., 2005.](https://www.remedia.cz/photo-a-27826---.jpg) V současné době jsou k dispozici výsledky dvou klinických studií fáze III s neoadjuvantním podáním trastuzumabu. První studie zařazovala pacientky s karcinomem prsu klinického stadia II a IIIA; v plánu bylo zařadit 168 pacientek, které měly být randomizovány do dvou ramen. Pacientky byly léčeny 4 cykly paklitaxelu (T) v dávce 225 mg/m2 ve 24hodinové infuzi, následovaly 4 cykly léčby režimem FEC (5-fluorouracil, cyklofosfamid, epirubicin), nebo stejným režimem s přidáním trastuzumabu (H), který byl podáván 24 týdnů současně s chemoterapií (obr. 6). Rameno se samotnou chemoterapií bylo uzavřeno předčasně po zařazení celkem 42 pacientek, vzhledem k výraznému rozdílu v efektivitě terapie ve prospěch kombinačního ramene s trastuzumabem. Dále bylo do ramene s trastuzumabem zařazeno ještě 22 pacientek. Dle posledních publikovaných výsledků v mediánu sledování 36,1 měsíce dosáhly pacientky v rameni s trastuzumabem signifikantně vyššího procenta pCR (T»FEC 26,3 %, T + H»FEC + H randomizované pacientky 65,2 %, T + H»FEC + H nerandomizované pacientky 54,5 %) a delšího bezpříznakového období. I přes paralelní podávání trastuzumabu s antracykliny nebyla prokázána vyšší kardiotoxicita kombinované léčby chemoterapií a trastuzumabem [31].
V současné době jsou k dispozici výsledky dvou klinických studií fáze III s neoadjuvantním podáním trastuzumabu. První studie zařazovala pacientky s karcinomem prsu klinického stadia II a IIIA; v plánu bylo zařadit 168 pacientek, které měly být randomizovány do dvou ramen. Pacientky byly léčeny 4 cykly paklitaxelu (T) v dávce 225 mg/m2 ve 24hodinové infuzi, následovaly 4 cykly léčby režimem FEC (5-fluorouracil, cyklofosfamid, epirubicin), nebo stejným režimem s přidáním trastuzumabu (H), který byl podáván 24 týdnů současně s chemoterapií (obr. 6). Rameno se samotnou chemoterapií bylo uzavřeno předčasně po zařazení celkem 42 pacientek, vzhledem k výraznému rozdílu v efektivitě terapie ve prospěch kombinačního ramene s trastuzumabem. Dále bylo do ramene s trastuzumabem zařazeno ještě 22 pacientek. Dle posledních publikovaných výsledků v mediánu sledování 36,1 měsíce dosáhly pacientky v rameni s trastuzumabem signifikantně vyššího procenta pCR (T»FEC 26,3 %, T + H»FEC + H randomizované pacientky 65,2 %, T + H»FEC + H nerandomizované pacientky 54,5 %) a delšího bezpříznakového období. I přes paralelní podávání trastuzumabu s antracykliny nebyla prokázána vyšší kardiotoxicita kombinované léčby chemoterapií a trastuzumabem [31].
Druhou neoadjuvantní studií fáze III byla studie NOAH, jejíž data byla prezentována v roce 2007. Zařazeno bylo 327 pacientek s lokálně pokročilým karcinomem prsu. Pacientky byly randomizovány do tří ramen. V prvních dvou ramenech byly HER2 pozitivní pacientky léčeny režimem paklitaxel plus doxorubicin (3 cykly), dále paklitaxelem (4 cykly) a režimem CMF (cyklofosfamid, methotrexát, 5-fluorouracil, 3 cykly) s konkomitantním podáním trastuzumabu, nebo bez něj. Do třetího ramene byly zařazovány HER2 negativní pacientky léčené stejným chemoterapeutickým schématem bez trastuzumabu. V analýze bylo hodnoceno 228 HER2 pozitivních pacientek a 99 pacientek HER2 negativních. Přidání trastuzumabu do kombinace signifikantně zvýšilo procento dosažených pCR (43 % vs. 23 %, p = 0,002). Třicet procent zařazených pacientek mělo inflamatorní karcinom prsu; rozdíl v počtu dosažených pCR byl výraznější u pacientek HER2 pozitivních (19 % vs. 55 %).
Očekávají se výsledky dalších klinických studií fáze III, jako jsou studie GeparQuattro, GeparQuinto, kde je antracyklin podáván současně s trastuzumabem, a výsledky studie NeoALTTO, kde je předoperačně zařazen pouze trastuzumab, paklitaxel nebo lapatinib a antracykliny jsou podávány až po operaci. Zajímavé bude srovnat nejenom jejich efektivitu, ale i jejich kardiotoxicitu.
Metastazující adenokarcinom žaludku
Trastuzumab byl hodnocen v randomizované, otevřené multicentrické studii fáze III ToGA (BO18255), do které byli zahrnuti pacienti s HER2 pozitivním karcinomem žaludku v pokročilém inoperabilním stadiu (recidivující a/nebo metastatický). Přibližně 3800 pacientů bylo testováno na přítomnost receptorů HER2; 594 z nich mělo prokazatelně HER2 pozitivní karcinom, a byli tedy zaregistrováni do studie [32]. Pacienti byli randomizováni do dvou ramen a léčeni v první linii trastuzumabem (6 mg/kg v třítýdenním intervalu) v kombinaci s fluoropyrimidinem (kapecitabin nebo 5-fluorouracil) a cisplatinou vs. samotnou chemoterapií. Kapecitabin byl podáván perorálně v dávce 1000 mg/m2 2krát denně po dobu 14 dní každé 3 týdny, 6 cyklů. 5-fluorouracil byl podáván v dávce 800 mg/m2/den v kontinuální i.v. infuzi po dobu 5 dní každé 3 týdny, 6 cyklů. Každý z nich byl podáván společně s cisplatinou v dávce 80 mg/m2 každé 3 týdny, 6 cyklů, den 1 každého cyklu.
Primárním cílem bylo stanovení doby celkového přežití, která byla definována jako doba od randomizace do úmrtí z jakékoli příčiny. V době analýzy zemřelo celkem 349 randomizovaných pacientů: 182 (62,8 %) pacientů v kontrolním rameni a 167 (56,8 %) pacientů v léčebném rameni. Většina úmrtí byla důsledkem příhody související s nádorovým onemocněním. Medián celkového přežití pacientů ve skupině léčené trastuzumabem činil 13,5 měsíce vs. 11,1 měsíce u pacientů léčených samotnou chemoterapií (HR 0,74; CI 0,60, 0,91; p = 0,0046). Medián celkového přežití ve skupině s vysokou expresí HER2 byl v rameni se samotnou chemoterapií 11,8 měsíce a v rameni s trastuzumabem 16 měsíců (HR 0,65; CI 0,51–0,83). Medián přežití bez progrese činil 5,5 vs. 7,6 měsíce (HR 0,64; CI 0,51–0,79).
Zařazení do současné palety léčiv
Od objevení HER2 onkogenu na zvířecím modelu do zavedení trastuzumabu do klinické praxe v roce 1998 uplynulo dlouhých takřka patnáct let. Trastuzumab byl prvním cíleným biologickým lékem v terapii karcinomu prsu. Jeho podání samostatně nebo v kombinaci s chemoterapií prodlužuje přežití jak u pacientek s metastatickým karcinomem prsu, tak i u žen s časným klinickým stadiem nádoru prsu. Tyto výsledky jsou výrazným krokem vpřed v léčbě specifické (HER2 pozitivní) skupiny pacientek s karcinomem prsu. Trastuzumab rovněž představuje první cílenou biologickou léčbu, u níž bylo prokázáno prodloužení délky života u pacientů s karcinomem žaludku v pokročilém stadiu.
Indikace
Metastatický HER2 pozitivní karcinom prsu
V současné době je možno indikovat trastuzumab v terapii HER2 pozitivního karcinomu prsu:
-
v 1. linii metastatického onemocnění v kombinaci s paklitaxelem,
-
v 1. linii metastatického onemocnění v kombinaci s docetaxelem,
-
v 1. linii pro metastatické onemocnění v kombinaci s inhibitorem aromatáz u postmenopauzálních pacientek s expresí steroidních receptorů,
-
v monoterapii u pacientek, které jsou předléčeny 2 liniemi paliativní chemoterapie; předchozí chemoterapie musí zahrnovat antracyklin a taxan s výjimkou pacientek, které jsou pro tuto terapii nevhodné [13].
Časný HER2 pozitivní karcinom prsu
V adjuvantním podání je možno indikovat trastuzumab u pacientek po chirurgickém zákroku, po chemoterapii (adjuvantní nebo neoadjuvantní) a po radioterapii. Doposud není možno standardně indikovat trastuzumab v neoadjuvantním podání [13].
Metastazující adenokarcinom žaludku
V kombinaci s kapecitabinem nebo s 5-fluorouracilem a cisplatinou je trastuzumab indikován k léčbě nemocných s HER2 pozitivním metastazujícím adenokarcinomem žaludku nebo gastroezofageálního spojení.
Kontraindikace
Jedinou kontraindikací je hypersenzitivita na léčivou látku nebo na kteroukoliv pomocnou látku tohoto přípravku, kardiální selhávání či významně snížená hodnota EF LK.
Nežádoucí účinky
Údaje o nežádoucích účincích vycházejí z klinických studií a ze zkušeností po uvedení přípravku do praxe, při doporučeném dávkovacím režimu v monoterapii nebo v kombinaci s paklitaxelem. U pacientek léčených trastuzumabem jsou nejčastějšími nežádoucími účinky horečka, bolesti břicha, nevolnost, zvracení, infuzní reakce, průjem, infekce, kašel, bolest hlavy, únava, dušnost, exantém, neutropenie, anémie, artralgie, myalgie. U nežádoucích účinků, jako jsou srdeční selhání, signifikantní pokles EF LK, závažná infuzní reakce a plicní toxicita, by mělo dojít minimálně k přerušení, eventuálně k ukončení terapie trastuzumabem [13].
Nejčastějšími nežádoucími účinky u pacientů s adenokarcinomem žaludku ve studii ToGa (tj. příhodami, jejichž frekvence byla v rameni s trastuzumabem o 5 % vyšší než ve srovnávacím rameni) byly zánět nosohltanu, anémie, trombocytopenie, porucha vnímání chuti, průjem, zánět ústní sliznice, bolest břicha, únava, teplota, zánět sliznic, třesavka a pokles hmotnosti. Z nich anémie, trombocytopenie, průjem, teplota a zánět sliznic byly hlášeny rovněž jako závažné nežádoucí příhody.
Kardiotoxicita
Kardiotoxicita trastuzumabu se v prvních studiích neočekávala, a byla překvapením. Výskyt srdečního selhání se objevil až u 27 % žen léčených kombinací trastuzumab a antracyklin. Mechanismus kardiotoxicity souvisí s HER2 receptorem. Experimentální práce prokázaly, že HER2 receptor v myocytech má ochrannou funkci – pozitivně ovlivňuje adaptaci myocytu na stres. Trastuzumab navázáním na HER2 receptor zablokuje reparativní buněčný proces a uvolní cestu apoptóze. V situaci již existujícího problému myocytu může akcelerovat buněčnou smrt nebo zabrání obnovení normální buněčné funkce zablokováním reparativního procesu. Po přerušení terapie trastuzumabem došlo u většiny pacientek k normalizaci EF LK, což podporuje hypotézu reparace buněk, které se znovu aktivují po uvolnění HER2 receptoru. Z bioptických dat z myokardu pacientek, u kterých došlo k poklesu EF LK při terapii trastuzumabem, nebyly nalezeny evidentní buněčné změny ve světelném mikroskopu. V elektronovém mikroskopu byly zaznamenány změny, jež odpovídají změnám popisovaným při reverzibilní kardiomyopatii. Doposud nebyla nalezena trvalá buněčná strukturální léze v souvislosti s léčbou trastuzumabem.
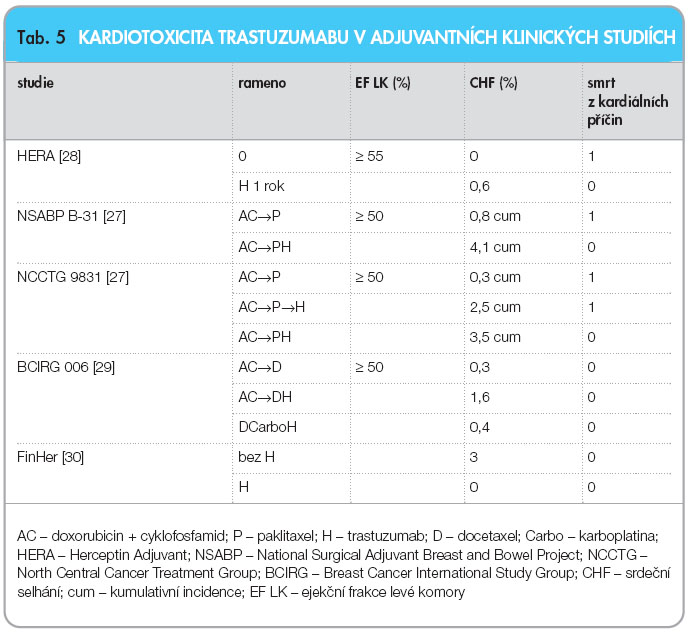 Řada klinických studií prokázala kardiotoxicitu trastuzumabu při nebo po terapii antracykliny (tab. 5). Projevem kardiotoxicity je poškození funkce levé komory srdeční s dalším vývojem srdečního selhání. Může dojít pouze k asymptomatickému poklesu EF LK nebo i ke klinickým projevům srdečního selhání. Možnou kardiotoxicitu je nutno při terapii trastuzumabem pravidelně monitorovat pomocí echokardiografie – monitorace EF LK, popř. je možno k diagnostice využít kardiomarkerů, jako jsou pro-BNP nebo troponiny. Na základě klinických studií se doporučuje pravidelná monitorace EF LK každé 3 měsíce. V případě, že se objeví kardiotoxicita, je nutno terapii trastuzumabem přerušit, zahájit příslušnou medikaci a v případě normalizace EF LK je možno zvážit návrat k terapii trastuzumabem. Při zvažování návratu k terapii je vždy nutno posoudit poměr riziko/přínos terapie pro pacientku.
Řada klinických studií prokázala kardiotoxicitu trastuzumabu při nebo po terapii antracykliny (tab. 5). Projevem kardiotoxicity je poškození funkce levé komory srdeční s dalším vývojem srdečního selhání. Může dojít pouze k asymptomatickému poklesu EF LK nebo i ke klinickým projevům srdečního selhání. Možnou kardiotoxicitu je nutno při terapii trastuzumabem pravidelně monitorovat pomocí echokardiografie – monitorace EF LK, popř. je možno k diagnostice využít kardiomarkerů, jako jsou pro-BNP nebo troponiny. Na základě klinických studií se doporučuje pravidelná monitorace EF LK každé 3 měsíce. V případě, že se objeví kardiotoxicita, je nutno terapii trastuzumabem přerušit, zahájit příslušnou medikaci a v případě normalizace EF LK je možno zvážit návrat k terapii trastuzumabem. Při zvažování návratu k terapii je vždy nutno posoudit poměr riziko/přínos terapie pro pacientku.
U pacientů s adenokarcinomem žaludku ve studii ToGA byla většina případů poklesu EF LK asymptomatická, s výjimkou jednoho pacienta v rameni s trastuzumabem, u něhož pokles EF LK koincidoval se srdečním selháváním.
Alergická reakce
V případě mírné alergické reakce se může objevit horečka, třesavka, bolesti hlavy, závratě, hypotenze, zarudnutí. Při závažné alergické reakci se vyskytuje bronchospasmus, angioedém, anafylaxe, hypoxie a závažná hypotenze; nejčastěji vzniká během prvního podání nebo bezprostředně po ukončení úvodní infuze. Dojde-li k alergické reakci, je potřeba terapii ihned přerušit, zavést příslušnou medikaci a monitorovat pacienta do doby, než symptomy zcela odezní. Je-li reakce závažná, je potřeba zvážit ukončení terapie trastuzumabem.
Plicní toxicita
Terapie trastuzumabem může vést k závažné až fatální plicní toxicitě. Zahrnuje dušnost, intersticiální pneumonitidu, plicní infiltráty, pleurální výpotek, nekardiální plicní edém, plicní insuficienci a hypoxii, plicní fibrózu.
Lékové interakce
Nebyly provedeny žádné studie, které by se zaměřovaly na interakce trastuzumabu. Riziko vzniku interakcí se současně užívanými léky nelze vyloučit.
Těhotenství
Trastuzumab podávaný v graviditě může způsobit poškození plodu. K dispozici jsou pouze kazuistiky pacientek, u kterých byl preparát během gravidity podáván. Při podávání trastuzumabu v graviditě je popisováno zvýšené riziko výskytu oligohydramniomu během druhého a třetího trimestru. Oligohydramniom byl popsán u gravidních pacientek léčených trastuzumabem v monoterapii i v kombinaci s chemoterapií. U poloviny pacientek došlo po přerušení terapie trastuzumabem ke zvýšení objemu amniální tekutiny. U opic, u kterých byly prováděny reprodukční studie, byl pozorován transplacentární přestup trastuzumabu během časné (20.–50. den) a pozdní fáze (120.–150. den) vývoje plodu [13].
Studie prováděné u kojících opic (makak jávský) prokázaly vylučování trastuzumabu do mateřského mléka. Není známo, zda je trastuzumab vylučován do mateřského mléka u lidí, nicméně lidský IgG je vylučován do mateřského mléka. Publikovaná data uvádějí, že protilátky se do cirkulace novorozence a kojence dostávají pouze v omezené míře [13].
Dávkování
Při současné terapii s paklitaxelem, docetaxelem je trastuzumab podáván v úvodní dávce 4 mg/kg v 90minutové infuzi, následně terapie pokračuje udržovací dávkou 2 mg/kg v 30minutové infuzi jedenkrát týdně. Po ukončení týdenní aplikace je dále trastuzumab podáván v dávce 6 mg/kg v 30–90minutové infuzi jedenkrát každé 3 týdny. Pokud pacient dostává docetaxel, je možné, vzhledem k prokázané větší efektivitě 3týdenního podávání, zahájit léčbu úvodní dávkou 8 mg/kg a potom pokračovat po třech týdnech v podávání dávky 6 mg/kg.
V monoterapii je zahájeno podávání trastuzumabu až po ukončení adjuvantní chemoterapie s antracykliny. Terapie je zahájena nasycovací dávkou 8 mg/kg v 90minutové infuzi, dále se pokračuje udržovací dávkou 6 mg/kg v 30–90minutové infuzi každé 3 týdny po dobu 52 týdnů. Pokud pacient vynechá dávku a od vynechané dávky uplyne týden nebo méně, je možno podat obvyklou udržovací dávku 6 mg/kg. Jestliže pacientka vynechá dávku trastuzumabu a od vynechané dávky uplyne doba delší než jeden týden, měla by být podána znovu nasycovací dávka trastuzumabu 8 mg/kg v 90minutové infuzi a dále by terapie pokračovala dávkou udržovací, tj. 6 mg/kg v 30minutové infuzi [13].
Doporučená doba podávání trastuzumabu je 52 týdnů – toto platí ale pouze u adjuvantního podání, nikoli u metastazujícího karcinomu prsu, kdy je doba podávání závislá na trvajícím protinádorovém efektu či na případných nežádoucích účincích. Pacienti s metastazujícím adenokarcinomem žaludku byli v klinických studiích léčeni trastuzumabem do progrese onemocnění.
Balení
Jedna injekční lahvička o objemu 15 ml z čirého skla typu I se zátkou z butylové pryže potažené ochranným filmem obsahuje 150 mg trastuzumabu v podobě prášku pro přípravu koncentrátu určeného pro přípravu infuzního roztoku [13].
Seznam použité literatury
- [1] Yarden Y, Sliwkowski MX. Untangling the ErbB signaling network. Nat Rev Mol Cell Biol 2001; 2: 127–137. Review.
- [2] Codony-Servat J, Albanell J, Lopez-Talavera JC, et al. Cleavage of the HER 2 ectodomain is a pervanadate-activable process that is inhibited by the tissue inhibitor of metalloproteases-1 in breast cancer cells. Cancer Res 1999; 59: 1196–1201.
- [3] Slamon DJ, Clark GM, Wong SG, et al. Human Breast cancer: Correlation of relapse and survival with amplifications of the HER 2 oncogene. Science 1987; 235:177–182.
- [4] Lazar GA, Dang W, Karki S, et al. Engineered antibody Fc variants with enhanced effector function. Proc Natl Acad Sci USA 2006; 103; 4005–4010.
- [5] Arnould L, Gelly M, Penault-Llorca F, et al. Trastuzumab-based treatment of HER2-positive breast cancer: An antibody-dependent cellular cytotoxicity mechanism? Br J Cancer 2006; 94; 259–267.
- [6] Gennari R, Medard S, Fagnoni F, et al. Pilot study of the mechanism of action of preoperative trastuzumab in patiens with primary operable breast tumors overexpressing HER2. Clin Cancer Res 2004; 10; 5650–5655.
- [7] Carney WP, Neumann R, Lipton A, et al. Monitoring the circulating levels of the HER2/Neu oncoprotein in breast cancer. Clin Brest Cancer 2004; 5; 105–116.
- [8] Fornier MN, Seidman AD, Schwarz MK, et al. Serum HER2 extracellular domain in metastatic breast cancer patiens treated with weekly trastuzumab and paclitaxel: Association with HER2 status by immunohistochemistry and fluorescence in situ hybridization and with response rate. Ann Oncol 2005; 16; 234–239.
- [9] Köstler WJ, Steger GG, Soleiman A, et al. Monitoring of serum HER2/Neu predicts histopathological response to neoadjuvant trastuzumab-based therapy for breast cancer. Anticancer Res 2004; 24; 1127–1130.
- [10] Molina MA, Codony-Servat J, Albanell J, et al. Trastuzumab, a humanized anti-HER2 receptor monoclonal antibody, inhibits basal and activated HER 2 ectodomain cleavage in Brest cancer cells. Cancer Res 2001; 61; 4744–4749.
- [11] Spector NL, Blackwell KL. Understanding the mechanism behind trastuzumab therapy for human epidermal growth factor receptor 2-positive breast cancer. J Clin Oncol 2009; 27; 5838–5847.
- [12] McKeage K, Perry CM. Trastuzumab: a review of its use in the treatment of metastatic breast cancer overexpressing HER2. Drugs 2002; 62: 209–243.
- [13] Herceptin – souhrnné údaje o přípravku 3/2010. http://www.ema.europa.eu/humandocs/Humans/EPAR/herceptin/herceptin.htm
- [14] Fabián P, Nenutil R, et al. Incidence HER 2 amplifikace u karcinomu prsu a její korelace s klinicko-patologickými parametry. Sestava 500 konsekutivních karcinomů prsu MOÚ. Abstrakt 098,XXX.BOD, Brno, 2006; 153.
- [15] Baselga J, Carbonell X, Castaneda-Soto NJ, et al. Phase II study of efficacy, safety and pharmacokinetics of trastuzumab monotherapy administered on a 3-weekly schedule. J Clin Oncol 2005; 23: 2162–2171.
- [16] Vogel CL, Cobleigh MA, Tripathy D, et al. Efficacy and safety of trastuzumab as a single agent in first-line treatment of HER2-overexpressing metastatic breast cancer. J Clin Oncol 2002; 20: 719–726.
- [17] Baselga J, Tripathy D, Mendelsohn J, et al. Phase II study of weekly itravenous trastuzumab in patiens with HER2/neu-overexpressing metastatic Brest cancer. Semin Oncol 1999; 24 suppl. 12): 78–83.
- [18] Cobleigh MA, Vogel CL, Tripathy D, et al. Multinational study of the efficacy and safety of humanized anti-HER2 monoclonal antibody in women who have HER2-overexpressing metastatic breast cancer that has progressed after chemotherapy for metastatic disease. J Clin Oncol 1999;17: 2639–2648.
- [19] Eiermann W. International Herceptin Study Group. Trastuzumab combined with chemotherapy for the treatment of HER2-positive metastatic breast cancer: pivotal trial data. Ann Oncol 2001; 12 (Suppl. 1): S57–62.
- [20] Slamon DJ, Leyland-Jones B, Shak S, et al. Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2. N Engl J Med 2001; 344: 783–792.
- [21] Marty M, Cognetti F, Maraninchi D, et al. Randomized phase II trial of the efficacy and safety of trastuzumab combined with docetaxel in patients with HER2 positive metastatic breast cancer administered as first-line treatment: the M77001 study group. J Clin Oncol 2005; 23: 4265–4274.
- [22] Smith IE. Efficacy and safety of Herceptin in women with metastatic breast cancer: results from pivotal clinical studies. Anticancer Drugs 2001; 12 Suppl 4: S3–10.
- [23] Wardley, et al. Breast Cancer Res Treat 2006; 100 (S68): abstract 2063.
- [24] Kaufman B, Mackey JR, Clemens MR, et al. Trastuzumab plus anastrozole versus anastrozole alone for the treatment of postmenopausal women with human epidermal growth factor receptor 2-positive, hormone receptor-positive metastatic breast cancer: results from the randomized phase III TAnDEM study. J Clin Oncol 2009; 27: 5529–5537.
- [25] Minckwitz von G, Zielinski C, Maartense E, et al. Capecitabine versus capecitabine plus trastuzumab in patiens with HER2 positive metastatic breast cancer progressing during trastuzumab treatment – the TBP phase III study (GBD-26/BIG 3-05). J Clin Oncol 2008; 26 (Suppl. 1): abstract 1025.
- [26] Blackwell KL, Burnstein H, O’Shaughnessy J, et al. Randomized Study of lapatinib alone or in combination with trastuzumab in women with ErbB2-positive trastuzumab-refractory metastatic breast cancer. J Clin Oncol 2010; 28: 1124–1130.
- [27] Perez EA, Suman VJ, Davidson N, et al. NCCTG N 9831, May 2005 update. Presented at the 45th Annual meeting on the American Society of Clinical Oncology, Orlando, Fl, May 2005.
- [28] Smith I, Procter M, Gerber RD, et al. 2-Year follow up of trastuzumab after adjuvant chemotherapy in HER2 positive breast cancer: a randomized controlled trial. Lancet 2007; 369: 29–36.
- [29] Slamon D, Eiermann W, Robert N, et al. BCIRG 006: 3nd interim analysis phase III randomized trial comparing doxorubicin and cyclophosphamide followed by docetaxel (ACT) with doxorubicin and cyclophosphamide followed by docetaxel and trastuzumab (ACTH) with docetaxel, carboplatin and trastuzumab (TCH) in HER2 neu positive early Breast cancer patients. In: proceeding of the 32th Annual San Antonion Breast Cancer symposium, San Antonio, TX, December 9–13, 2009, abstract 62.
- [30] Joensuu H, Bono P, Kataja V, et al. Fluorouracil, Epirubicin and Cyclophosphamide With Either Docetaxel or Vinorelbine, With or Without Trastuzumab, As Adjuvant Treatments of Breast Cancer: Final Results of the FinHer Trial. J Clin Oncol 2009; 27: 5685–5692.
- [31] Buzdar A, Valero V, Ibrahim NK, et al. Neoadjuvant therapy with paclitaxel followed by 5-fluorouracil, epirubicin and cyclophosphamid chemotehrapy and concurrent trastuzumab in human epidermal growth factor receptor 2-positive operable breast cancer: An update of the initial randomized study population and data of additional patiens with the same regimen. Clin Cancer Res 2007; 13: 228–233.
- [32] Van Cutsem E, Kang Y, Chung H, et al. Efficacy results from the ToGA trial: A phase III study of trastuzumab added to standard chemotherapy (CT) in first-line human epidermal growth factor receptor 2 (HER2)-positive advanced gastric cancer (GC). J Clin Oncol 2009; 27: 18 s. (suppl; abstr LBA4509).