Vaccinum pneumococcale saccharidicum conjugatum
První v České republice registrovanou konjugovanou pneumokokovou vakcínou je 7valentní vakcína konjugovaná s difterickým proteinem CRM197. Je schopna navodit dostatečnou imunitní odpověď i u dětí od 2 měsíců věku do 2 let. Bezpečnost vakcíny byla hodnocena v různých kontrolovaných klinických studiích se zdravými kojenci a také s předtím neočkovanými staršími dětmi. K nejběžnějším nežádoucím účinkům patřila reakce v místě vpichu a horečka. V průběhu základního očkování ani přeočkování nebyly pozorovány žádné pravidelně se vyskytující celkové či lokální reakce, s výjimkou vyššího výskytu přechodné bolestivosti. Základní indikací je aktivní imunizace proti invazivním onemocněním vyvolaným Streptococcus pneumoniae sérotypů 4, 6B, 9V, 14, 18C, 19F a 23F u kojenců a malých dětí ve věku od 2 měsíců do 2 let a u dosud neočkovaných dětí ve věku od 2 do 5 let (vysoce rizikoví pacienti). Doplňkovou indikací jsou akutní otitidy, konjugovaná vakcína ovlivňuje i nazofaryngeální nosičství.
Farmakologická skupina
Vakcíny, purifikované polysacharidové antigeny konjugované, ATC kód J07AL02.
Chemické a fyzikální vlastnosti
Sedmivalentní vakcína konjugovaná s difterickým proteinem CRM197.
Jedna 0,5ml dávka obsahuje:
Pneumococcale polysaccharidum
sérotypus 4* (2 mg)
Pneumococcale polysaccharidum
sérotypus 6B* (4 mg )
Pneumococcale polysaccharidum
sérotypus 9V* (2 mg )
Pneumococcale polysaccharidum
sérotypus 14* (2 mg )
Pneumococcale oligosaccharidum
sérotypus 18C* (2 mg )
Pneumococcale polysaccharidum
sérotypus 19F* (2 mg )
Pneumococcale polysaccharidum
sérotypus 23F* (2 mg )
*Konjugován s nosným proteinem CRM197 (20 mg) a adsorbován na fosforečnan hlinitý (0,5 mg).
Pomocné látky tvoří chlorid sodný, voda na injekci.
Jedná se o suspenzi. Po uskladnění se vytvoří bílý depozit a čirý supernatant. Vakcína se uchovává při teplotě 2–8 °C.
Vakcína má být před použitím dobře protřepána až do vzniku bílé homogenní suspenze a má být vizuálně zkontrolována eventuální přítomnost cizích částic a/nebo případnou změnu fyzikálních vlastností. Nepodávejte vakcínu, pokud obsah balení vypadá jinak [3, 4].
Mechanismus účinku
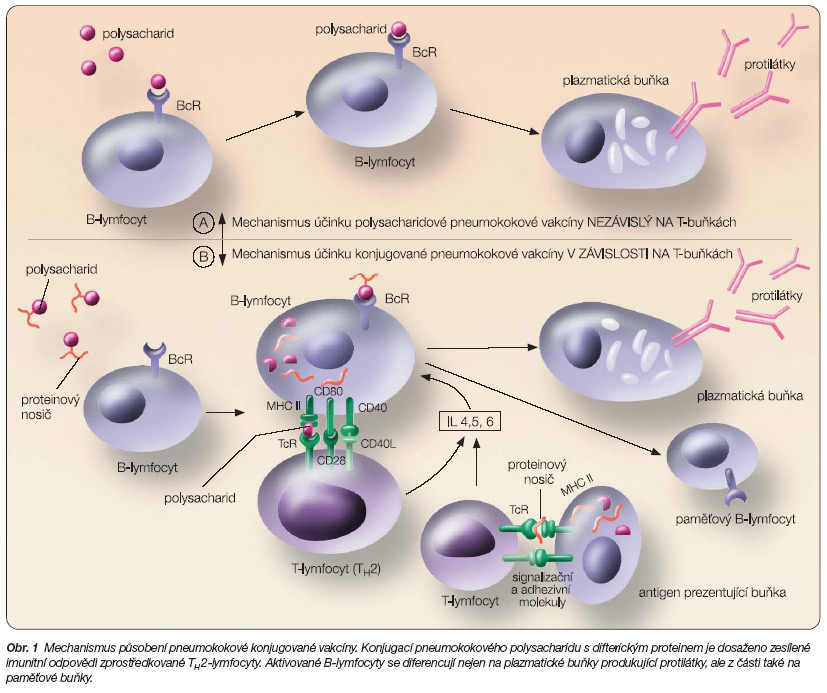
Imunogenita stávajících polysacharidových vakcín u kojenců a malých dětí je velmi chudá. Vakcíny nejsou proto doporučovány u věkové kohorty pod dva roky věku a zároveň neposkytují významnou ochranu proti slizničním pneumokokovým infekcím nebo proti šíření rezistentních pneumokokových kmenů z člověka na člověka. Tato slabá imunogenita polysacharidových vakcín u malých dětí se vztahuje k podstatě polysacharidové molekuly, která se chová jako nezávislá na T-buňkách. Dalším důležitým faktorem je neschopnost indukovat imunologickou odpověď – nevytváří se paměťová buňka. Kovalentní navázání polysacharidového antigenu na proteinový nosič mění antigen na dependentní na T-buňkách (obr. 1). Antigen prezentující buňky jsou schopny protein zpracovat a prezentovat peptidy pomocným T-lymfocytům za pomoci HLA II. To stimuluje B-buňky k vyzrání do podoby plazmatických buněk nebo paměťových buněk [5, 11].
Farmakodynamické vlastnosti
Aby bylo možno vyhnout se časově a finančně náročným studiím účinnosti, hledá se možnost, jak předpovědět klinickou účinnost prostřednictvím jednoho či více jasně definovaných laboratorních testů. Bohužel koreláty séroprotekce nebyly zatím stanoveny, ale na základě zkušeností s konjugovanými hemofilovými vakcínami se ukazuje, že imunologická paměť může být rozhodujícím faktorem. Klasické cesty sledování velikosti protilátkové odpovědi, perzistence protilátek, avidity a funkční kapacity protilátek jsou postupně doplňovány a někdy nahrazovány novými metodami testujícími aviditu a opsono-fagocytární aktivitu vakcínou indukovaných pneumokokových protilátek různých izotypů a podtříd. Imunogenita viz Klinické zkušenosti [6, 8, 10, 11].
Farmakokinetické vlastnosti
Hodnocení farmakokinetických vlastností u vakcín není dostupné.
Klinické zkušenosti
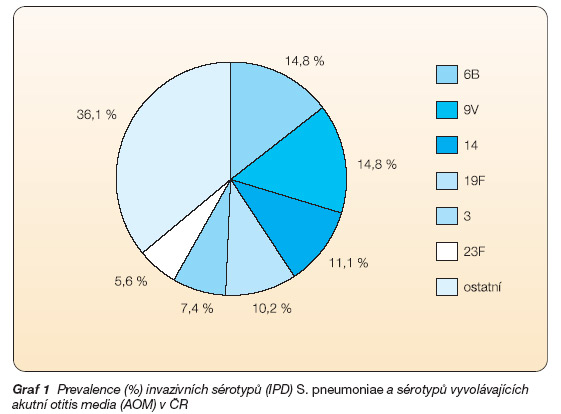
Výsledky hodnocení účinnosti vakcíny proti invazivním onemocněním byly získány na populaci USA, kde vakcína pokrývala 89–93 % séroskupin. Epidemiologické údaje z let 1988–2003 svědčí o tom, že v Evropě je pokrytí nižší a liší se v jednotlivých zemích. V severní části Evropy je pokrytí stanovené u dětí pod 2 roky věku nižší, v jižní části Evropy je pokrytí vyšší. V důsledku toho bude Prevenar pokrývat 71 % až 86 % kmenů izolovaných z invazivních pneumokokových onemocnění (IPD) u evropských dětí ve věku pod 2 roky (v ČR 62 % na výběrovém souboru, viz graf 1) [4, 5, 8, 13, 14, 16, 24].
Sérotypy obsažené ve vakcíně pokrývají více než 80 % rezistentních kmenů. U evropských dětí ve věku 2–5 let by měl Prevenar pokrývat 50–75 % izolovaných kmenů odpovědných za invazivní pneumokoková onemocnění. Snížení incidence IPD pozorované u starších dětí může být částečně důsledkem přirozeně získané imunity.
Účinnost
Účinnost proti invazivním onemocněním byla hodnocena v rozsáhlé randomizované dvojitě zaslepené klinické studii na multietnické populaci v severní Kalifornii (studie Kaiser Permanente). 37 816 kojenců ve věku 2, 4,
Ve studii Kaiser Permanente u pneumonií s bakteriémií vyvolanou kmeny sérotypů S. pneumoniae obsaženými ve vakcíně byla účinnost 87% (95% CI: 7–99). Byla také hodnocena účinnost vakcíny proti pneumonii (nebylo prováděno mikrobiologické potvrzení diagnózy). Ve skupině určené k léčení došlo ke snížení rizika u klinicky diagnostikované pneumonie s RTG nálezem o 33 % (95% CI: 6–52) a u klinicky diagnostikované pneumonie s vyhojením o 73 % (95 % CI: 36–90) [6–10, 18].
Doplňující klinické údaje
Výsledky klinických studií potvrzují hypotézy o účinnosti Prevenaru i proti otitis media vyvolané sérotypy obsaženými ve vakcíně, ale účinnost byla nižší než u invazivních onemocnění.
Účinnost Prevenaru proti akutní otitis media (AOM) byla hodnocena jako primární hodnocený ukazatel v randomizované dvojitě zaslepené klinické studii na 1662 finských kojencích a jako sekundární hodnocený ukazatel ve studii v severní Kalifornii. Hodnocená účinnost vakcíny proti vakcinačním sérotypům zjištěným u kmenů izolovaných u akutní otitis media ve finské studii byla 57 % (95% CI: 44–67). U populace určené k léčení byla účinnost vakcíny 54 % (95% CI: 41–64). U imunizovaných subjektů bylo pozorováno zvýšení výskytu zánětu středního ucha o 34 %, které bylo vyvoláno kmeny séroskupin neobsaženými ve vakcíně. Avšak celkovým přínosem bylo statisticky významné snížení incidence (o 34 %) všech pneumokokových zánětů středního ucha. Při sledování opakujících se zánětů středního ucha (= 3 případy v průběhu 6 měsíců nebo 4 případy za 12 měsíců) bylo ve finské studii důsledkem vakcinace statisticky nevýznamné snížení incidence o 16 % (95% CI: -6–35). Ve studii v severní Kalifornii bylo výsledkem vakcinace statisticky významné snížení incidence o 9,5 % (95% CI: 3–15). V severní Kalifornii byl také u vakcinovaných jedinců snížen počet operací ušní trubice o 20 % (95% CI: 2–35). Ve finské studii bylo v důsledku podání vakcíny statisticky nevýznamně sníženo celkové množství případů otitis media bez rozlišení etiologických agens o 6 % (95% CI: -4–16), zatímco ve studii v severní Kalifornii bylo vlivem vakcíny zjištěno statisticky významné snížení o 7 % (95% CI: 4–10). Vakcína sice výrazně ovlivňuje nazofaryngeální nosičství, negativním jevem však je, že dochází k nahrazování jinými kmeny – tzv. replacementu. Patogenní a rezistentní kmeny pneumokoků jsou však při něm naštěstí nahrazovány kmeny vnímavějšími, s nižší patogenitou oproti kmenům původním [6, 12, 19, 23].
Imunogenita
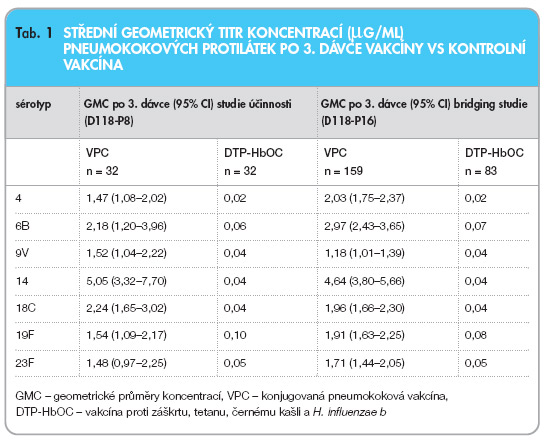
Vakcínou indukované protilátky proti kapsulárnímu polysacharidu specifickému pro každý sérotyp jsou považovány za protektivní proti invazivním onemocněním. Minimální koncentrace ochranných protilátek proti invazivním onemocněním nebyla pro žádný sérotyp určena. Po třech a čtyřech dávkách byla pozorována signifikantní protilátková odpověď u všech sérotypů obsažených ve vakcíně u dětí, které dostaly vakcínu, i když geometrický průměr koncentrací se u jednotlivých sérotypů lišil. U všech sérotypů byla pozorována maximální odpověď v základním očkování po 3 dávkách s následujícím přeočkováním čtvrtou dávkou. Konjugovaná vakcína vyvolala vznik účinných protilátek proti všem sérotypům, jak bylo změřeno opsonofagocytózou následně po základním očkování. Dlouhodobé přetrvávání protilátek po dokončení očkování nebylo vyšetřováno u kojenců a starších dětí (opožděná imunizace). Jednoduchý imunologický test s polysacharidovými antigeny vakcinačních sérotypů 13 měsíců po základním očkování prokázal anamnesticky významnou protilátkovou odpověď u všech 7 sérotypů obsažených ve vakcíně, což svědčí o kvalitě vakcíny.
Po jedné dávce podané dětem ve věku 2–5 let byla pozorována signifikantní protilátková odpověď u všech sérotypů vakcíny. Očkování dětí ve věku 2–5 let jednou dávkou vedlo k podobné imunitní odpovědi, jaká byla pozorována po primární očkovací sérii u kojenců a batolat mladších než 2 roky, na nichž byla demonstrována klinická účinnost (ochrana). Klinické studie účinnosti na populaci ve věku 2–5 let nebyly provedeny. Z otevřené nekontrolované klinické studie provedené ve Švédsku u 83 dětí jsou k dispozici údaje o imunogenitě vakcíny podané ve
Zařazení do současné palety léčiv
Epidemiologie S. pneumonie
S. pneumoniae
byl objeven v roce 1881. Jedná se o grampozitivní bakterii, která se vyskytuje v párech jako diplokok buď samostatně, nebo v krátkých řetízcích. Pneumokoky jsou fakultativně anaerobní a většina je kryta povrchovým polysacharidem. Právě ten umožňuje jejich typizaci. Dnes je popsáno na 40 skupin a identifikováno přes 90 různých sérotypů pneumokoků. Pouhých 6 skupin z nich odpovídá za 70 % všech invazivních onemocnění. V České republice se u invazivních onemocnění nejčastěji uplatňují sérotypy 6B, 9V, 14,
V přenosu onemocnění se uplatňuje zejména nosičství pneumokoků v nosohltanu, jeho význam s věkem ale postupně klesá. Tento fenomén potvrzují výrazně vyšší hodnoty nosičství u dospělých v rodinách s dětmi ve srovnání s bezdětnými rodinami. Jakmile dojde k narušení slizniční bariéry, dochází k výskytu otitid či sinusitid, v případě průniku do krevního řečiště dojde k vývoji již zmíněných nepříliš častých, o to však závažnějších invazivních forem onemocnění.
Streptococcus pneumoniae způsobuje v dětském věku pestrou škálu různých onemocnění od nejzávažnějších invazivních onemocnění, jako jsou meningitidy, septikémie (bakteriémie) a pneumonie, až po život zpravidla neohrožující, avšak o to četnější akutní otitidy a sinusitidy. Incidence invazivních pneumokokových onemocnění je v evropských zemích různá. Nejvyšší výskyt je u dětí pod 2 roky věku v regionech Španělska, s hodnotou 174/100 000. Následuje Belgie 104/100 000, Finsko 40/100 000, Dánsko 35/100 000, Německo 19/100 000. Meningitida se vyskytuje přibližně v 0,5 až 2,0 případech na 100 000 dětí v Evropě i USA s mortalitou kolem 23 %. Výskyt pneumokokové bakteriémie kolísá v závislosti na sezoně s maximem v zimních měsících. I když neexistují reprezentativní evropská data o incidenci, na základě studií v Anglii, Švédsku a Dánsku je možno odhadovat ji mezi 10 až 20 případy na 100 000 dětí mladších 5 let s mortalitou přibližně 20 %. Incidence pneumonií je ještě vyšší. Finská data hovoří o 5,7 na 1000 dětí ženského pohlaví pod 5 let věku, respektive 11,2 u mužského pohlaví. Nad 5 let věku klesá na hodnoty kolem 5,4 na 1000 bez rozdílu pohlaví. Naopak akutní otitida je jedním z nejčastějších dětských onemocnění. Existují práce, které udávají výskyt až u 100 % dětí do 2 let věku, jiní autoři hovoří o 30–60 %. My jsme takto vysoké hodnoty v podmínkách ČR na souboru 5000 dětí nepotvrdili, avšak i naše hodnota prokazující výskyt klinicky závažných otitid, které vedly k návštěvě pediatra či otorinolaryngologa u 20 % dětí, představuje enormní medicínské a zejména ekonomické břemeno.
Pozice vakcíny v paletě léčiv
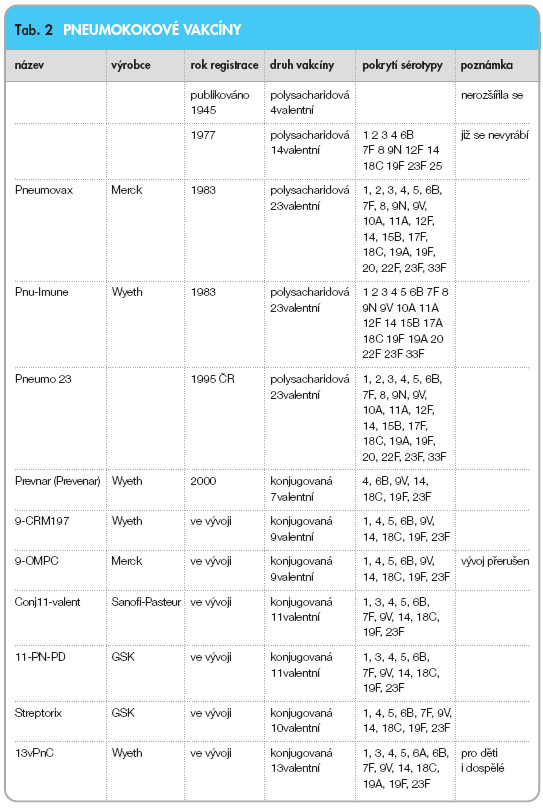
Jedná se o první licencovanou vakcínu (tab. 2), která je schopna navodit dostatečnou imunitní odpověď i u dětí od 2 měsíců věku do 2 let. Vakcína byla poprvé registrována v USA v únoru 2000, následovalo Švýcarsko od března
Jak v České i Slovenské republice, tak i na světě jde o první pneumokokovou vakcínu na bázi polysacharidu konjugovaného na protein a umožňujícího také stimulaci paměťových buněk a tedy aplikovatelnost u dětí pod 2 roky věku. Vakcína průlomovým způsobem vedla ke snížení incidence invazivních pneumokokových onemocnění, k poklesu výskytu akutního zánětu středního ucha s výraznou ekonomickou úsporou. Výrazný dopad konjugované pneumokokové vakcíny prokázala i studie v rozvojové Gambii publikovaná v časopisu Lancet 2005 [9]. Pro rozvojový svět je však cena vakcíny příliš vysoká. Cena vychází ze dvou aspektů, jednak je objektivně technologie výroby vakcíny velmi náročná, protože se vlastně opakuje pro každý antigen zvlášť, a druhým faktorem, již ne tak objektivním, je fakt, že neexistuje konkurence. Zatím nebyla jiná konjugovaná pneumokoková vakcína nikde ve světě registrována [6, 8, 9].
Výroba sestává z přípravy proteinu CRM197 rozfázovanou do etapy růstu, ultrafiltrace a purifikace a podobně i přípravu 7 pneumokokových polysacharidů, kdy každý je připravován odděleně (proces se 7x opakuje, následně dochází k chemické aktivaci a konjugaci různě podle sérotypu). V závěrečné fázi dojde ke kombinaci do jedné vakcíny. Technologická náročnost výroby se promítá i do extrémně dlouhé doby výroby, která dosahuje 12 měsíců.
Indikace
Aktivní imunizace proti invazivním onemocněním (zahrnujícím sepse, meningitidy, pneumonie s bakteriémií, bakteriémie) vyvolaným Streptococcus pneumoniae sérotypů 4, 6B, 9V, 14,
– ‑u kojenců a malých dětí ve věku od 2 měsíců do 2 let;
– ‑u dosud neočkovaných dětí ve věku od 2 do 5 let (vysoce rizikoví pacienti).
Počet dávek, které mají být podány různým věkovým skupinám, viz Dávkování.
O použití přípravku Prevenar se má rozhodnout na podkladě oficiálního doporučení, které bere v úvahu epidemiologickou rozmanitost sérotypů v různých zeměpisných oblastech, jakož i dopady invazivního onemocnění v různých věkových skupinách.
Řada prací se zabývá možností indikace pneumokokové konjugované vakcíny u akutních otitid, konjugovaná vakcína ovlivňuje i nazofaryngeální nosičství [1–5, 11].
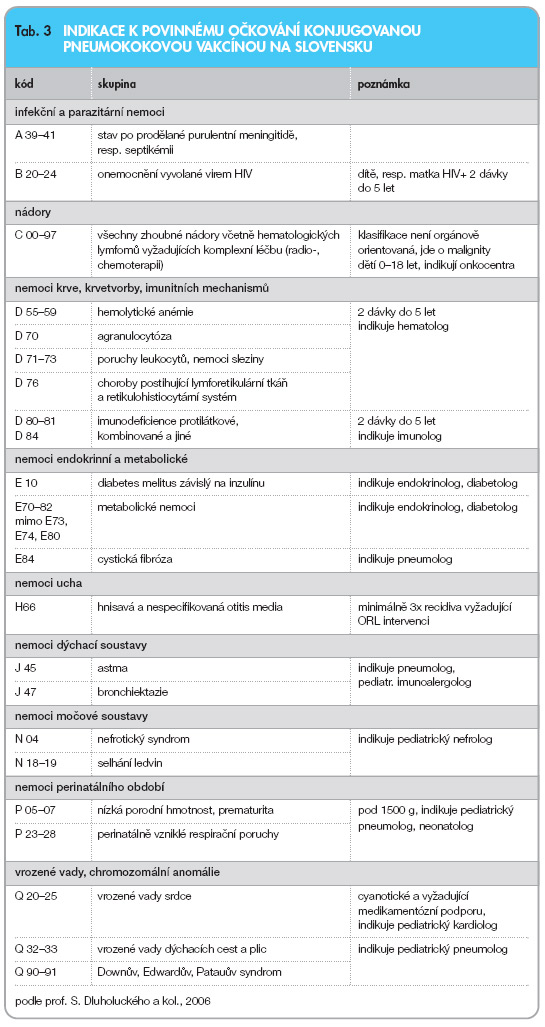
Čeští experti všech dotčených odborností však kromě výše uvedených základních indikací formulovali kritéria pro zařazení do rizikových skupin, kde by vakcína měla být hrazena.
Očkování konjugovanou vakcínou proti nákazám vyvolaným S. pneumoniae se provede v souladu se schválenými informacemi pro předepisování u dětí splňujících alespoň jedno z níže uvedených indikačních kritérií:
a) ‑primární defekty imunity s klinickým projevem poruchy tvorby imunoglobulinů, T-lymfocytů, fagocytózy a komplementu;
b) ‑závažné sekundární imunodeficity (hematoonkologická a onkologická onemocnění po CHT, transplantace orgánů, HIV);
c) ‑asplenie funkční i anatomické (děti mladší 2 let);
d) ‑transplantace kmenových hemopoetických buněk;
e) ‑chronická plicní onemocnění (vrozené vady a porucha respiračního traktu, bronchopulmonální dysplazie);
f)‑recidivující (pneumokokové) otitidy (4 ataky a více/rok);
g) ‑aplikace kochleárního implantátu a přítomnost likvorey.
Konsenzus slovenských expertů uvádí tab. 3.
Kontraindikace
Základní kontraindikací je přecitlivělost na léčivou látku nebo na kteroukoli pomocnou látku nebo na difterický toxoid.
Zvláštní varování a zvláštní opatření pro použití
Tak jako u jiných vakcín má být podávání odloženo u osob s mírným nebo závažným akutním horečnatým onemocněním.
Tak jako u všech injekčních vakcín má být vždy k dispozici dohled lékaře a má být připravena vhodná medikace pro případ vzácné anafylaktické reakce po podání vakcín.
Vakcína nechrání proti těm sérotypům Streptococcus pneumoniae, které vakcína neobsahuje, ani proti jiným mikroorganismům, které způsobují stejná invazivní onemocnění nebo zánět středního ucha. Tato vakcína nemá být podávána kojencům nebo dětem s trombocytopenií nebo s jinými poruchami hemokoagulace, které jsou kontraindikací pro intramuskulární aplikaci, pokud ovšem potenciální přínos jasně nepřevažuje nad rizikem podání. Přestože může dojít k jisté protilátkové odpovědi na difterický toxoid, očkování touto vakcínou nenahrazuje běžné očkování proti difterii.
U dětí starších než 24 měsíců byl pozorován vyšší výskyt lokálních reakcí než u kojenců. Děti s poruchou imunity, ať už v důsledku podávání imunosupresivní terapie, genetické poruchy, infekce HIV nebo z jiných příčin, mohou mít po aktivní imunizaci nižší protilátkovou odpověď. Údaje o bezpečnosti a imunogenitě vakcíny u dětí se srpkovitou anémií jsou omezené; tyto údaje nejsou zatím k dispozici ani pro jiné specifické vysoce rizikové skupiny dětí vzhledem k invazivnímu pneumokokovému onemocnění (děti s kongenitální a získanou dysfunkcí sleziny, infekcí HIV, maligním onemocněním, nefrotickým syndromem). Očkování vysoce rizikových skupin má být posuzováno individuálně. Děti mladší než 2 roky (včetně vysoce rizikových) mají dostat očkovací sérii odpovídající jejich aktuálnímu věku. Použití konjugované pneumokokové vakcíny nenahrazuje podání 23valentní pneumokokové polysacharidové vakcíny u dětí nad 24 měsíců věku za podmínek (jako srpkovitá anémie, asplenie, infekce HIV, chronická onemocnění nebo osoby s ohroženou imunitou), které je řadí do vyššího rizika vůči invazivním onemocněním vyvolaným S. pneumoniae. Děti ve věku nad 24 měsíců s vysokým rizikem dříve očkované konjugovanou pneumokokovou vakcínu mají dostat 23valentní pneumokokovou polysacharidovou vakcínu, kdykoli je doporučena. Na základě omezeného množství údajů nemá být interval mezi podáním pneumokokové konjugované vakcíny a podáním 23valentní pneumokokové polysacharidové vakcíny kratší než 8 týdnů. Pouze omezené údaje jsou dostupné k informaci o použití smíšených očkovacích schémat s pneumokokovými konjugovanými vakcínami a 23valentní pneumokokovou polysacharidovou vakcínou u předtím neočkovaných vysoce rizikových dětí ve věku 2–5 let. O použití těchto schémat je možno uvažovat na individuálním základě, přičemž je třeba vzít v úvahu platná národní doporučení.
Při souběžném podávání konjugované pneumokokové vakcíny s hexavalentními vakcínami (DTaP/Hib(PRPT)/ IPV/HepB) musí mít lékař na paměti, že údaje z klinických studií svědčí o vyšší četnosti výskytu febrilních reakcí než po podávání samotných hexavalentních vakcín. Tyto reakce byly většinou mírné (do
Profylaktická antipyretická terapie se doporučuje
– ‑u všech dětí, které dostávají konjugovanou pneumokokovou vakcínu současně s vakcínami obsahujícími celobuněčnou složku pertuse, kvůli vyššímu podílu febrilních reakcí;
– ‑u dětí, které mají křeče nebo febrilní křeče v anamnéze.
Nepodávat intravenózně [1–4].
Nežádoucí účinky
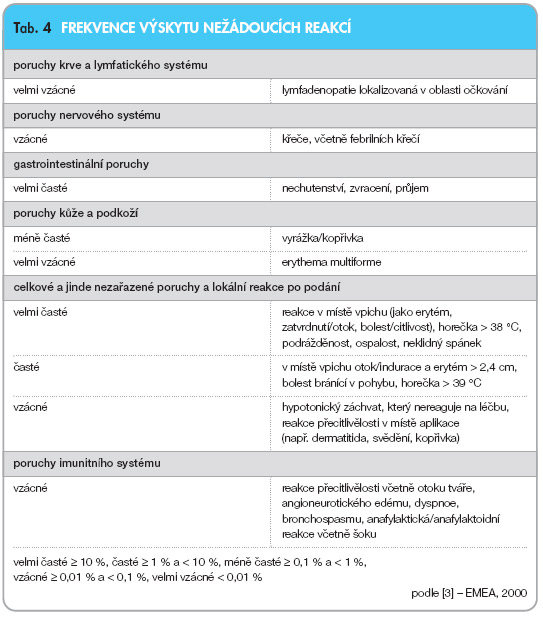
Bezpečnost vakcíny byla hodnocena v různých kontrolovaných klinických studiích, do nichž bylo zařazeno více než 18 000 zdravých kojenců (6 týdnů–18 měsíců). Většina zkušeností s bezpečností podání vakcíny byla získána ze studie účinnosti, do níž bylo zahrnuto 17 066 kojenců, kteří dostali 55 352 dávek vakcíny. Byla hodnocena také bezpečnost podání u předtím neočkovaných starších dětí. Ve všech studiích byla vakcína podávána souběžně s pravidelným dětským očkováním. Mezi nejběžnější hlášené nežádoucí účinky patřila reakce v místě vpichu a horečka. V průběhu základního očkování ani přeočkování nebyly pozorovány žádné pravidelně se vyskytující celkové či lokální reakce po opakovaných dávkách, s výjimkou vyššího výskytu přechodné bolestivosti (36,5 % případů) a bolestivosti, která bránila pohybu končetin (18,5 % případů), pozorovaných po přeočkování. U starších dětí očkovaných jednou dávkou vakcíny byl pozorován vyšší výskyt lokálních reakcí, než jaký byl předtím popsán u kojenců. Tyto reakce byly převážně přechodného charakteru. V poregistrační studii zahrnující 115 dětí ve věku 2–5 let byla hlášena bolestivost u 39,1 % dětí; u 15,7 % dětí bolestivost zabraňovala pohybu končetinou. U 40 % dětí bylo hlášeno zarudnutí a u 32,2 % dětí byla hlášena indurace. Zarudnutí a indurace o průměru
Nežádoucí účinky hlášené v klinických studiích nebo v poregistračním sledování jsou seřazeny v tab. 4 podle orgánů lidského těla a frekvence pro všechny věkové skupiny.
Předávkování
Byly hlášeny případy předávkování včetně podání vyšších než doporučených dávek a případy podání následných dávek v kratším intervalu, než se doporučuje. Ve většině případů nebyly pozorovány nežádoucí účinky. Obecně byly nežádoucí účinky pozorované po předávkování stejné jako ty, které byly hlášeny po aplikaci jednotlivých dávek podle doporučení [3, 4].
Lékové interakce
Konjugovaná pneumokoková vakcína může být podávána současně s jinými dětskými vakcínami podle doporučených očkovacích schémat. Různé injekční vakcíny musí být vždy podány každá do jiného místa vpichu.
V sedmi kontrolovaných klinických studiích byla hodnocena imunitní odpověď po souběžném podání běžných dětských vakcín současně s konjugovanou pneumokokovou vakcínou do odlišných míst vpichu. Protilátková odpověď na vakcínu Hib konjugovanou s tetanovým proteinem PRPT a na vakcínu proti tetanu a hepatitidě B (HepB) byla podobná jako u kontrolní skupiny. U vakcíny Hib konjugované s CRM byla v kojenecké skupině pozorována zvýšená protilátková odpověď na Hib a difterii. Při přeočkování byl pozorován určitý pokles hladiny protilátek proti Hib, ale všechny děti měly dostatečnou ochrannou hladinu. Bylo pozorováno nepředpokládané snížení odpovědi na antigeny pertuse a na inaktivovanou polio vakcínu (IPV). Klinická významnost těchto interakcí není známa. Omezené výsledky z otevřených studií ukázaly přijatelnou odpověď na MMR a varicellu. Údaje ze souběžného podávání přípravků Prevenar (konjugovaná pneumokoková vakcína) a Infanrix Hexa (DTaP/ Hib(PRPT)/ IPV/HepB vakcína) neprokázaly klinicky významné vzájemné ovlivnění protilátkové odpovědi u žádného antigenu po aplikaci 3 dávek základního očkování. Zatím nejsou k dispozici dostatečné údaje o vzájemném ovlivňování při souběžném podávání s dalšími hexavalentními vakcínami. Údaje ze souběžného podávání s konjugovanou vakcínou proti meningokokům skupiny C nejsou zatím k dispozici, ale údaje z pokusného kombinovaného podávání vakcíny obsahující 7 konjugovaných antigenů pneumokokových sérotypů a vakcíny obsahující stejné konjugované antigeny proti meningokokům skupiny C neprokázaly klinicky významné vzájemné ovlivnění protilátkové odpovědi u žádného z antigenů. Svědčí to o tom, že souběžné podávání konjugované pneumokokové vakcíny a konjugované CRM vakcíny proti meningokokům skupiny C by nemělo vést ke vzájemnému imunologickému ovlivnění po podání 3 dávek základního očkování v 1. roce života [3, 4, 22].
Upozornění
Studie toxicity opakovaných dávek pneumokokové konjugované vakcíny podané králíkům neprokázaly významné lokální ani celkové toxické účinky. Bezpečnost a imunogenita jiných cest podání (např. subkutánní) nebyly testovány.
Vakcína nebyla testována s ohledem na jakýkoliv kancerogenní nebo mutagenní potenciál nebo ovlivnění fertility. Nebyly prováděny ani animální reprodukční studie. Není známo, zda má vakcína negativní účinek na fetus, pokud je aplikována gravidní ženě, či zda může ovlivnit reprodukční kapacitu. Těhotným ženám se proto aplikace vakcíny nedoporučuje [3, 4].
Dávkování a způsob podání
Vakcína se má podávat formou intramuskulární injekce. Děti ve věku 2–6 měsíců: tři dávky po 0,5 ml, s přestávkami nejméně 1 měsíc mezi dávkami. První dávka se obvykle podává ve věku 2 až 3 měsíců. Čtvrtou dávku se doporučuje podat ve druhém roce života.
Dříve neočkovaní starší kojenci a děti: kojenci ve věku 7–11 měsíců: 2 dávky po 0,5 ml, s přestávkou nejméně 1 měsíc mezi nimi. Třetí dávku se doporučuje podat ve druhém roce života.
Děti ve věku 12–23 měsíců: 2 dávky po 0,5 ml s přestávkou nejméně 2 měsíce mezi nimi.
Děti ve věku 24 měsíců–5 let: 1 samostatná dávka.
Potřeba přeočkování nebyla stanovena, i když se diskutuje o případném boosteru. V kohortě nad 24 měsíců věku se doporučuje pouze 1 dávka.
Očkovací schémata
Zařazení očkovacího schématu konjugované pneumokokové vakcíny mezi doporučená očkování závisí na oficiálním doporučení. Existují limitované či nedostatečné údaje o bezpečnosti a imunogenitě vakcíny proti invazivním pneumokokovým onemocněním pro specifické rizikové skupiny (např. osoby se srpkovitou anémií, asplenií, HIV pozitivní). Vakcína není zamýšlena pro použití u dospělých ani není substitucí za polysacharidovou vakcínu pro důchodce [3, 4].
Monitorování léčiva
U vakcín se neprovádí monitorování v tělních tekutinách, smysluplné je pouze měřit s adekvátním odstupem hladinu protilátek v séru (viz imunogenita) nebo měření buněčné imunity.
Balení
Balení obsahuje skleněnou lékovku s šedou kaučukovou zátkou chráněnou hliníkovým krytem, případně stříkačku a přenosovou, resp. aplikační jehlu. Léčivé přípravky obsahující konjugovanou pneumokokovou vakcínu registrované Státním ústavem pro kontrolu léčiv (podobně jako slovenský ŠÚKL) jsou uvedeny v tab. 5.
Stabilita
Vakcínu je nutno skladovat při standardní teplotě 2–8 °C. Vakcína nesmí zmrznout, a proto ji není vhodné skladovat ani v těsné blízkosti mrazicího boxu. V těchto podmínkách je možno vakcínu skladovat 3 roky [3, 4].
Pokud byla vakcína exponována vyšší teplotě v důsledku výpadku elektrického proudu po dobu kratší než 72 hodin, je možno ji použít po dobu následujících 6 měsíců, pokud je původní exspirační doba shodná či delší.
Kompatibilita
Studie kompatibility nejsou k dispozici, a proto tento léčivý přípravek nesmí být mísen s žádnými dalšími léčivými přípravky.
Vakcínu je možno aplikovat pouze intramuskulárně samostatnou injekcí. I když je dovolena simultánní aplikace, která se s výhodou využívá při aplikacích v souladu s dětským očkovacím kalendářem, nesmí se vakcína mísit v jedné stříkačce s ostatními vakcínami (např. Infanrix Hexa nebo parenterální polio). Vakcíny je možno simultánně aplikovat, ale do různých míst (v sestupném pořadí podle priority levý m. deltoideus, pravý m. deltoideus, anterolaterální kvadrant stehna (L + P), naprosto výjimečně, pouze z důvodů hodných zřetele, m. gluteus – tato dětská predilekční místa aplikace se mění s vyšším věkem. Kolem dvou až tří měsíců preferujeme zpravidla anterolaterální kvadrant stehna a neaplikujeme do deltového svalu. Ve vyšším věku naopak upřednostníme deltový sval, nepříliš vhodný obecně je gluteální sval.
Seznam použité literatury
- [1] CDC, Advisory Committee on Immunization Practices (ACIP). Prevention of pneumococcal disease: Recommendations of the Advisory Committee on Immunization Practices (ACIP). 1997, MMWR 46 (RR-08): 1–24.
- [2] CDC, Advisory Committee on Immunization Practices (ACIP). Preventing pneumococcal disease among infants and young children. Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR 2000; 49 (RR-09): 1–34.
- [3] EMEA. Opinion of the committee for proprietary medicinal products on the granting of a marketing authorisation for Prevnar. EMEA/H/C/ 2000; 323: 1–38.
- [4] Pneumococcal 7-valent Conjugate Vaccine (Diphtheria CRM197 Protein). Package Insert 2000; 1–23.
- [5] WHO: Pneumococcal vaccines. Weekly Epidemiological Record 1999; 74: 177–184.
- [6] Black S, Shinefield H, Baxter, R, et al. Postlicensure Surveillance for Pneumococcal Invasive Diseases after Use of Heptavalent Pneumococcal Conjugate Vaccine in Northern California Kaiser Permanente. Pediatr Infect Dis J 2004; 23: 485–489.
- [7] Black S, Shinefield H, Fireman B, et al. Efficacy, safety and immunogenicity of heptavalent pneumococcal conjugate vaccine in children. Pediatr Infect Dis J 2000; 19: 187–195.
- [8] Black S, Shinefield H, Ling S, et al. Effectiveness of heptavalent pneumococcal conjugate vaccine in children younger than five years of age for prevention of pneumonia. Pediatr Infect Dis J 2002; 21: 810–815.
- [9] Cutts FT, Zaman SM, Enwere G, et al. Efficacy of nine-valent pneumococcal conjugate vaccine against pneumonia and invasive pneumococcal disease in The Gambia: randomised, double blind, placebo-controlled trial. Lancet. 2005; 365: 1139–1146.
- [10] Eskola J, Kilpi T, Palmu A, et al. Efficacy of a pneumococcal conjugate vaccine against acute otitis media. NEJM 2001; 344: 403–409.
- [11] Eskola J, Merja A. Pneumococcal conjugate vaccines. Pediatr Infect Dis J 1999; 18: 543–551.
- [12] Fireman B, Black S, Shinefield H, et al. Impact of the pneumococcal conjugate vaccine on otitis media. 2003; 22: 10–16.
- [13] Ghaffar F, Barton T, Lozano J, et al. Effect of the 7-valent pneumococcal conjugate vaccine on nasopharyngeal colonization by Streptococcus pneumoniae in the first 2 years of life. CID 2004; 39: 930–938.
- [14] Hausdorff WP. Invasive pneumococcal disease in children: geographic and temporal variations in incidence and serotype distribution. Eur J Ped 2002; 161 (Suppl. 2): S135–S139.
- [15] Choo S, Seymour L, Rhonwen M, et al. Immunogenicity and reactogenicity of a pneumococcal conjugate vaccine administered combined with influenzae type b conjugate vaccine in United Kingdom infants. Pediatr Infect Dis 2000; 19: 854–862.
- [16] Kaplan S, Mason OE, Barson JW, et al. Three-year multicenter surveillance of systemic pneumococcal infections in children. Pediatrics 1998; 102: 538–545.
- [17] O´Brien KL, Swift AJ, Winkelstein JA, et al. Safety and immunogenicity of heptavalent pneumococcal vaccine conjugated to CRM 197 among infants with sickle cell disease. Pediatrics 2000; 106: 965–972.
- [18] Poehling KA, Lafleur BJ, Szilagyi PG, et al. Population based impact of pneumococcal conjugate vaccine in young children. Pediatrics 2004; 114: 755–761.
- [19] Revai K, McCormick DP, Patel J, et al. Pneumococcal conjugate vaccine increased nasopharyngeal bacterial colonization in children with acu te otitis media. J Invest Med 2005; 53 (Suppl 258): S298–S298.
- [20] Robinson KA, Baughman W, Rothrock G, et al. Epidemiology of invasive Streptococcus pneumoniae infections in the United States, 1995–1998. Opportunities for prevention in the conjugate vaccine era. JAMA 2001; 285: 1929–1935.
- [21] Shinefield H, Black S, Ray P. Safety and immunogenicity of heptavalent pneumococcal CRM 197 conjugate vaccine in infants and toddlers. Pediatr Infect Dis J 1999; 18: 757–763.
- [22] Schmitt HJ, Faber J, Lorenz I, Schmoele-Thoma B, Ahlers N. The safety, reactogenicity and immunogenicity of 7-valent pneumococcal conjugate vaccine (7VPnC) concurrently administered with a combination DTaP-IPV-Hib vaccine. 2003, 21: 3653–3662.
- [23] Veenhoven RH, Bogaert D, Schilder AGM, Rijkers GT, Uiterwaal CSPM, Kiezebrink HH, van Kempen MJP, Dhooge IJ, Bruin J, Ijzerman EPF, de Groot R, Kuis W, Hermans PWM, Sanders EAM. Nasopharyngeal pneumococcal carriage after combined pneumococcal conjugate and polysaccharide vaccination in children with a history of recurrent acute otitis media. Clin Infect Dis 2004 ; 39: 911–919.
- [24] Zangwill KM, Vadheim CM, Vannier AM, et al. Epidemiology of invasive pneumococcal disease in Southern California: implications for the design and conduct of a pneumococcal conjugate vaccine efficacy trial. J Infect Dis 1996; 174: 752–759.