Časné použití erenumabu vs. preventivní antimigrenózní medikace – studie APPRAISE
Pacienti s migrénou často podstupují několik nespecifických preventivních terapií z důvodu intolerance nebo nedostatečné účinnosti této léčby. To nezřídka vede k nízké adherenci k léčbě a zvýšené zátěži onemocněním. Studie APPRAISE porovnávala efektivitu, snášenlivost a adherenci při léčbě erenumabem a nespecifickými perorálními léky na prevenci migrény u pacientů s epizodickou migrénou, u nichž selhaly jedna nebo dvě preventivní terapie. Výsledky klinického sledování prokázaly, že časné použití erenumabu u těchto pacientů poskytuje dlouhodobou účinnost, bezpečnost a adherenci k léčbě oproti kontinuálně podávané perorální preventivní medikaci [1].
Úvod
Perorální preventivní antimigrenózní terapie (oral migraine preventive medication, OMPM) zahrnující betablokátory, blokátory kalciových kanálů, antiepileptika a antidepresiva se používá již dlouho jako standard péče pro prevenci migrény. Nicméně OMPM nebyla původně vyvinuta pro léčbu migrény a většina z těchto léků má nedostatečné nebo omezené důkazy o účinnosti a bezpečnosti [2]. Monoklonální protilátky zacílené na CGRP (calcitonin gene related peptide) byly specificky vyvinuty jako antimigrenózní terapie a jsou americkým Úřadem pro kontrolu potravin a léčiv (FDA) i Evropskou lékovou agenturou (EMA) schváleny pro preventivní léčbu migrény. První schválenou monoklonální protilátkou byl inhibitor receptoru CGRP erenumab [3–11]. Nespecifická OMPM zůstává ve většině zemí standardní péčí, anti‑CGRP terapie je podle doporučení American Headache Society (AHS) a European Headache Federation (EHF) určena pouze pro pacienty s předchozím selháním preventivní léčby [12–16].
Studie prokázaly, že setrvání na OMPM je u pacientů s migrénou nedostatečné, především z důvodu špatné snášenlivosti a/nebo neúčinnosti [1,17–21]. To zvýrazňuje potřebu efektivnější, lépe tolerované cílené léčby a její časné implementace v rámci léčebného paradigmatu.
Účinnost a bezpečnost erenumabu byly potvrzeny v několika placebem kontrolovaných studiích u pacientů s epizodickou i chronickou migrénou, u nichž selhaly 2–4 předchozí profylaktické terapie [3,4,22–24], a nadále jsou dokládány výsledky studií v reálném světě [25–29]. HER‑MES byla první přímou studií, která prokázala vyšší účinnost a snášenlivost erenumabu oproti topiramátu [30].
Ve 12měsíční prospektivní, intervenční, globální, multicentrické, aktivně kontrolované, randomizované klinické studii APPRAISE byl porovnáván trvalý přínos dvou léčebných paradigmat (erenumab podávaný jednou měsíčně vs. perorální profylaktika) u dospělých pacientů s epizodickou migrénou. Cílem bylo zjistit, zda časné zahájení léčby erenumabem u pacientů, u nichž selhaly jeden nebo dva předchozí perorální profylaktické přípravky, by mohlo znamenat dlouhodobý trvalý prospěch ve srovnání s běžně předepisovanými OMPM.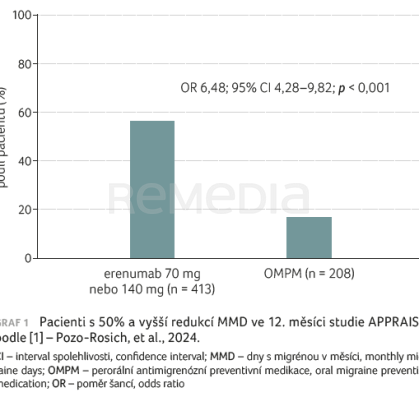
Uspořádání studie a charakteristika pacientů
Předchozí preventivní léčba ve studii APPRAISE zahrnovala tricyklická antidepresiva, valproát, topiramát, flunarizin, betablokátory ad. Klinické sledování probíhalo od 15. května 2019 (první zařazený pacient) do 1. října 2021 (poslední pacient dokončil poslední návštěvu v roce základní fáze). Zařazení pacienti byli z 84 center v 17 zemích. Základní fáze zahrnovala období screeningu (až dva týdny), počáteční období (čtyři týdny) a období otevřené léčby (52 týdnů). Pacienti byli randomizováni v poměru 2 : 1 k podávání erenumabu v dávce 70 mg nebo 140 mg subkutánně nebo k podávání schválené OMPM [1].
Do studie byli zařazeni pacienti ve věku 18 let a starší s dokumentovanou historií migrény (s aurou nebo bez ní) po dobu 12 měsíců nebo déle před screeningem podle ICHD‑III (International Classification of Headache Disorders, 3rd Edition) [31], s příznaky migrény čtyři a více dnů v měsíci a méně než 15 dní v měsíci průměrně během tří měsíců před screeningem, s dokumentovaným selháním 1–2 preventivních terapií v posledních šesti měsících z důvodu nedostatečné účinnosti nebo špatné snášenlivosti. Klíčová vylučovací kritéria zahrnovala věk 50 let a více při nástupu migrény, clusterovou bolest hlavy nebo hemiplegickou migrénu v anamnéze, selhání dvou nebo více schválených preventivních antimigrenózních terapií, použití anti‑CGRP monoklonálních protilátek v průběhu tří měsíců počátečního období studie, používání přístrojů nebo invazivních intervencí v průběhu dvou měsíců počátečního období, užívání ergotaminu nebo triptanů (≥ 10 dní v měsíci), nadměrné užívání jednoduchých analgetik (≥ 15 dní v měsíci) nebo užívání analgetik obsahujících opioid nebo butalbital čtyři nebo více dní v měsíci v průběhu dvou měsíců počátečního období.
Složeným primárním cílovým ukazatelem byl podíl pacientů, kteří dokončili jeden rok randomizované léčby, a zároveň dosažení 50% nebo většího poklesu počtu dnů s migrénou v měsíci (monthly migraine days, MMD) v měsíci 12 oproti výchozí hodnotě. Sekundární cílové ukazatele zahrnovaly podíl pacientů, kteří dokončili léčebné období ve 12. měsíci, kumulativní průměrnou změnu MMD v průběhu léčebného období oproti výchozí hodnotě a podíl respondérů ve 12. měsíci – měřeno podle škály Patient’s Global Impression of Change (PGIC) [32]. Rovněž byly provedeny subanalýzy u pacientů, u nichž došlo ke změně léčby.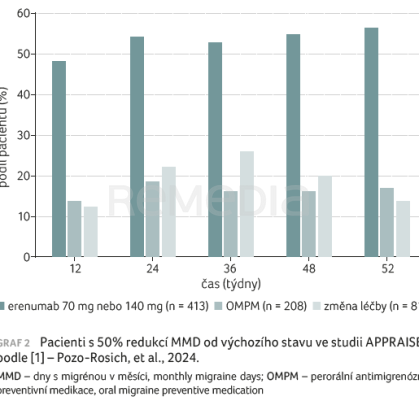
Výsledky
Účinnost
Z celkem 621 pacientů (průměrný věk 41,3 roku; 545 žen; 76 mužů) bylo 413 randomizováno k podávání erenumabu a 208 k podávání OMPM. Dvanáctiměsíční léčbu dokončilo 523 pacientů (377 ve skupině s erenumabem, 146 ve skupině s OMPM) a 98 pacientů studii ukončilo. Hlavními důvody pro přerušení léčby byly rozhodnutí pacienta (16, resp. 40 osob), nežádoucí účinky (9, resp. 5 osob) a rozhodnutí lékaře (2, resp. 8 osob). V rameni s OMPM byly většině pacientů podávány betablokátory (65 osob), topiramát (46 osob) a tricyklická antidepresiva (33 osob) [1].
Ve 12. měsíci signifikantně více pacientů přiřazených k podávání erenumabu (232 ze 413) dosáhlo primárního cílového ukazatele oproti pacientům původně přiřazeným k OMPM (35 z 208) – poměr šancí (OR) 6,48; 95% interval spolehlivosti (CI) 4,28–9,82; p < 0,001 (graf 1) [1]. Z pacientů v rameni s OMPM 13 pokračovalo v užívání betablokátorů, 12 v užívání topiramátu a osm v užívání tricyklických antidepresiv.
Výrazně větší podíl pacientů v rameni s erenumabem (359 ze 413) dokončil studii s původně přidělenou léčbou oproti rameni s OMPM (78 z 208) – OR 11,27; 95% CI 7,53–16,87; p < 0,001. Jako hlavní důvody změny léčby byly uváděny nedostatečná účinnost a intolerance léčby (která se týkala pouze jednoho pacienta léčeného erenumabem). Větší podíl pacientů, kteří zahájili léčbu erenumabem a pokračovali v ní do 12. měsíce, dosáhl 50% nebo většího poklesu MMD ve srovnání s pacienty, u nichž došlo ke změně léčby mezi týdny 12 a 52 (graf 2) [1]. Průměrná změna od výchozí hodnoty v kumulativním parametru MMD byla významně vyšší v rameni s erenumabem oproti rameni s OMPM v době od prvního do 12. měsíce (graf 3) [1]. Ve 12. měsíci byla změna oproti výchozímu stavu v adjustovaném průměru MMD –4,32 dne (erenumab) a –2,65 dne (OMPM). Významný průměrný léčebný rozdíl byl ve 12. měsíci pozorován také u pacientů, kteří byli přiděleni k léčbě erenumabem a pokračovali v ní, ve srovnání s pacienty, kteří léčbu změnili (–2,80 dne; p < 0,001). Podíl pacientů, kteří dokončili 12měsíční původně přidělenou léčbu a byli identifikováni jako respondéři na škále PGIC (≥ 5 ve 12. měsíci), byl 76,0 % (314 ze 413) v rameni s erenumabem oproti 18,8 % (39 z 208) v rameni s OMPM (OR 13,75; 95% CI 9,08–20,83; p < 0,001). Z pacientů, kteří změnili léčbu, bylo identifikováno 24,7 % (20 z 81) jako respondéři ve 12. měsíci.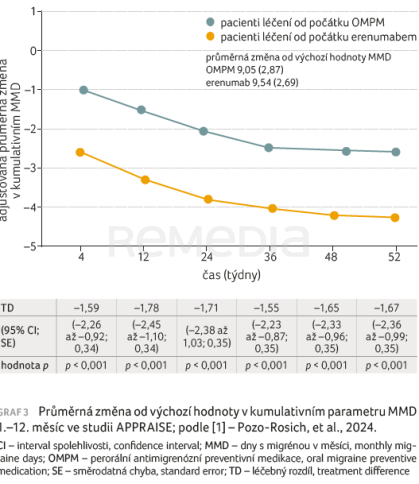
Bezpečnost
Výskyt nežádoucích účinků souvisejících s léčbou (treatment‑emergent adverse events, TEAEs) byl mezi léčebnými rameny podobný – v případě erenumabu v 74,8 %, v případě OMPM v 76,2 %. Nejběžnějšími nežádoucími účinky, u nichž bylo podezření, že souvisejí s léčbou erenumabem, byly zácpa (12,3 %) a bolest v místě vpichu (4,7 %), u OMPM to byly únava (14,1 %) a zvýšení hmotnosti (9,7 %). Výskyt závažných nežádoucích účinků (serious adverse events, SAEs) byl rovněž v obou skupinách srovnatelný (erenumab 3,7 %, OMPM 3,9 %). Jeden pacient v rameni s erenumabem uvedl anafylaktický stav střední závažnosti, u nějž bylo vysloveno podezření na souvislost s léčbou. Ve studii nedošlo k žádnému úmrtí. Výskyt nežádoucích účinků vedoucích k přerušení léčby byl přibližně osmkrát nižší u pacientů léčených erenumabem (2,9 %) vs. OMPM (23,3 %, včetně devíti pacientů převedených z ramene s erenumabem). Nejčastějšími nežádoucími účinky vedoucími k přerušení léčby erenumabem byly abdominální bolest, astenie a zvýšení hmotnosti (0,5 % pro každý), k přerušení podávání OMPM vedly únava (4,4 %) a potíže s pozorností (2,9 %). Výskyt nežádoucích účinků vedoucích k úpravě dávkování byl zhruba 15krát nižší v rameni s erenumabem (1,0 %) vs. OMPM (15,5 %). Zácpa se vyskytla u 13 % pacientů léčených erenumabem oproti 1,0 % ve skupině s OMPM. Většina příhod byla mírné nebo střední závažnosti, pouze jeden pacient ve skupině s erenumabem hlásil těžkou zácpu. Výskyt hypertenze byl mezi skupinami podobný. Nebyly hlášeny žádné klinicky významné trendy a abnormality v laboratorních parametrech, vitálních funkcích nebo v rámci vyšetření EKG [1].
Diskuse
Pouze několik pacientů (2,2 %) ve skupině s erenumabem přešlo z původně přidělené medikace k jiné léčbě v porovnání s 34,6 % v rameni s OMPM, což značí lepší adherenci k terapii. Výhodou podávání erenumabu je také to, že nevyžaduje titraci dávky a má delší biologický poločas, umožňuje tedy měsíční podávání, které oproti každodennímu užívání léků může rovněž přispívat ke zlepšení adherence. Změna od výchozí hodnoty v parametru MMD se postupně zlepšovala v obou léčebných ramenech po dobu 12 měsíců, nicméně tento efekt byl větší v rameni s erenumabem oproti OMPM počínaje čtvrtým týdnem sledování. Ve studii APPRAISE měli pacienti léčení erenumabem 13krát vyšší pravděpodobnost dosažení relevantního klinického zlepšení ve 12. měsíci hodnoceného pomocí PGIC ve srovnání s pacienty, kteří dostávali OMPM [1]. Tato zjištění korelují s údaji o klinické odpovědi a dokládají větší spokojenost pacientů s léčbou erenumabem.
Shrnutí
Randomizovaná klinická studie APPRAISE přinesla klinicky významné důkazy o tom, že včasné zahájení preventivní léčby migrény erenumabem je prospěšné z hlediska lepší tolerance terapie, její bezpečnosti a účinnosti v porovnání s OMPM. Dřívější zahájení léčby erenumabem může v reálné klinické praxi vést k tomu, že méně pacientů přeruší terapii nebo ji změní. Navíc tato zjištění mohou pomoci redukovat finanční náklady na péči, snížit invaliditu a zvýšit kvalitu života pacientů. Výsledky studie rovněž podporují recentní aktualizaci doporučených postupů EHF, podle nichž jsou anti‑CGRP monoklonální protilátky považovány za možnost terapie první volby pro pacienty s migrénou, kteří vyžadují preventivní léčbu.
Pro vydání Remedia 5/2024 připravujeme komentář odborníka ke studii APPRAISE.
Literatura
[1] Pozo‑Rosich P, Dolezil D, Paemeleire K, et al. Early Use of Erenumab vs Nonspecific Oral Migraine Preventives. The APPRAISE Randomized Clinical Trial. JAMA Neurol 2024; 81: 461–470.
[2] Hepp Z, Dodick DW, Varon SF, et al. Adherence to oral migraine‑preventive medications among patients with chronic migraine. Cephalalgia 2015; 35: 478–488.
[3] Goadsby PJ, Reuter U, Hallstrom Y, et al. A controlled trial of erenumab for episodic migraine. N Engl J Med 2017; 377: 2123–2132.
[4] Tepper S, Ashina M, Reuter U, et al. Safety and efficacy of erenumab for preventive treatment of chronic migraine: a randomised, double‑blind, placebo‑controlled phase 2 trial. Lancet Neurol 2017; 16: 425–434.
[5] Stauffer VL, Dodick DW, Zhang Q, et al. Evaluation of Galcanezumab for the Prevention of Episodic Migraine: the EVOLVE‑1 randomized clinical trial. JAMA Neurol 2018; 75: 1080–1088.
[6] Skljarevski V, Matharu M, Millen BA, et al. Efficacy and safety of galcanezumab for the prevention of episodic migraine: results of the EVOLVE‑2 Phase 3 randomized controlled clinical trial. Cephalalgia 2018; 38: 1442–1454.
[7] Detke HC, Goadsby PJ, Wang S, et al. Galcanezumab in chronic migraine: the randomized, double‑blind, placebo‑controlled REGAIN study. Neurology 2018; 91: e2211–e2221.
[8] Dodick DW, Silberstein SD, Bigal ME, et al. Effect of fremanezumab compared with placebo for prevention of episodic migraine: a randomized clinical trial. JAMA 2018; 319: 1999–2008.
[9] Silberstein SD, Dodick DW, Bigal ME, et al. Fremanezumab for the preventive treatment of chronic migraine. N Engl J Med 2017; 377: 2113–2122.
[10] Ashina M, Saper J, Cady R, et al. Eptinezumab in episodic migraine: a randomized, double‑blind, placebo‑controlled study (PROMISE‑1). Cephalalgia 2020; 40: 241–254.
[11] Lipton RB, Goadsby PJ, Smith J, et al. Efficacy and safety of eptinezumab in patients with chronic migraine: PROMISE‑2. Neurology 2020; 94: e1365–e1377.
[12] Sacco S, Amin FM, Ashina M, et al. European Headache Federation guideline on the use of monoclonal antibodies targeting the calcitonin gene related peptide pathway for migraine prevention: 2022 update. J Headache Pain 2022; 23: 67.
[13] American Headache Society. The American Headache Society position statement on integrating new migraine treatments into clinical practice. Headache 2019; 59: 1–18.
[14] Italian Medicines Agency. Attivazione web e pubblicazione schede di monitoraggio – registro AIMOVIG [navštíveno 20. 2. 2024]. Dostupné na: https://www.aifa.gov.it/en/‑/attivazione‑web‑epubblicazione‑schede‑di‑monitoraggio‑registroaimovig
[15] National Institute for Health and Care Excellence. Erenumab for preventing migraine [navštíveno 20. 2. 2024]. Dostupné na: https://www.nice.org.uk/guidance/ta682/chapter/1‑Recommendations
[16] DGN. DGN Guidelines home page [navštíveno 20. 2. 2024]. Dostupné na: https://dgn.org/leitlinien/
[17] Hepp Z, Bloudek LM, Varon SF. Systematic review of migraine prophylaxis adherence and persistence. J Manag Care Pharm 2014; 20: 22–33.
[18] Hepp Z, Dodick DW, Varon SF, et al. Persistence and switching patterns of oral migraine prophylactic medications among patients with chronic migraine: a retrospective claims analysis. Cephalalgia 2017; 37: 470–485.
[19] Ford JH, Schroeder K, Nyhuis AW, et al. Cycling through migraine preventive treatments: implications for all‑cause total direct costs and disease‑specific costs. J Manag Care Spec Pharm 2019; 25: 46–59.
[20] Blumenfeld AM, Bloudek LM, BeckerWJ, et al. Patterns of use and reasons for discontinuation of prophylactic medications for episodic migraine and chronic migraine: results from the second international burden of migraine study (IBMS‑II). Headache 2013; 53: 644–655.
[21] Kawata AK, Shah N, Poon JL, et al. Understanding the migraine treatment landscape prior to the introduction of calcitonin gene‑related peptide inhibitors: results from the Assessment of Tolerability and Effectiveness in Migraine Patients using Preventive Treatment (ATTAIN) study. Headache 2021; 61: 438–454.
[22] Ashina M, Goadsby PJ, Reuter U, et al. Long‑term efficacy and safety of erenumab in migraine prevention: results from a 5‑year, open‑label treatment phase of a randomized clinical trial. Eur J Neurol 2021; 28: 1716–1725.
[23] Dodick DW, Ashina M, Brandes JL, et al. ARISE: a phase 3 randomized trial of erenumab for episodic migraine. Cephalalgia 2018; 38: 1026–1037.
[24] Reuter U, Goadsby PJ, Lanteri‑Minet M, et al. Efficacy and tolerability of erenumab in patients with episodic migraine in whom 2‑to‑4 previous preventive treatments were unsuccessful: a randomised, double‑blind, placebo‑controlled, phase 3b study. Lancet 2018; 392: 2280–2287.
[25] Barbanti P, Aurilia C, Egeo G, et al. Erenumab in the prevention of high‑frequency episodic and chronic migraine: Erenumab in Real Life in Italy (EARLY), the first Italian multicenter, prospective real‑life study. Headache 2021; 61: 363–372.
[26] Torres‑Ferrus M, Gallardo VJ, Alpuente A, et al. The impact of anti‑CGRP monoclonal antibodies in resistant migraine patients: a real‑world evidence observational study. J Neurol 2021; 268: 3789–3798.
[27] Ornello R, Casalena A, Frattale I, et al. Conversion from chronic to episodic migraine in patients treated with erenumab: real‑life data from an Italian region. J Headache Pain 2020; 21: 102.
[28] Scheffler A, Messel O,Wurthmann S, et al. Erenumab in highly therapy‑refractory migraine patients: first German real‑world evidence. J Headache Pain 2020; 21: 84.
[29] Alex A, Vaughn C, Rayhill M. Safety and tolerability of 3 CGRP monoclonal antibodies in practice: a retrospective cohort study. Headache 2020; 60: 2454–2462.
[30] Reuter U, Ehrlich M, Gendolla A, et al. Erenumab versus topiramate for the prevention of migraine – a randomised, double‑blind, active‑controlled phase 4 trial. Cephalalgia 2022; 42: 108–118.
[31] Headache Classification Committee of the International Headache Society (IHS). The International Classification of Headache Disorders 3rd edition. Cephalalgia 2018; 38: 1–211.
[32] Fischer D, Stewart AL, Bloch DA, et al. Capturing the patient’s view of change as a clinical outcome measure. JAMA 1999; 282: 1157–1162.