Profylaxe migrény anti CGRP protilátkami
V rámci 36. českého a slovenského neurologického sjezdu se konalo sympozium společnosti Teva s názvem „Léčba migrény: Jaké přínosy má léčba anti‑CGRP v praxi“. V následujícím textu se podrobněji věnujeme přednáškám MUDr. Petry Migaľové z Fakultní nemocnice v Ostravě, která se zaměřila na efektivnost anti‑CGRP terapie u pacientů s chronickou migrénou a nadužíváním medikace, a MUDr. Dany Čtrnácté z Ústřední vojenské nemocnice v Praze, která informovala o zkušenostech s kvartálním podáváním fremanezumabu u frekventní epizodické migrény.
Migréna představuje nejčastější primární bolest hlavy s prevalencí v populaci okolo 12 %. Jedná se o třetí nejčastější neurologické onemocnění a zároveň druhou nejvíce handicapující diagnózu celosvětově dle studie Global Burden of Disease [1]; tím se řadí mezi ekonomicky nejvíce zatěžující onemocnění současnosti.
Typickým projevem migrény je jednostranná pulzující bolest hlavy střední nebo silné intenzity. Bolest však může být bodavá a je lokalizována také do oka, do čela nebo spánků oboustranně nebo v záhlaví. Obvykle je doprovázena nepříjemnými vegetativními příznaky – nauzeou, zvracením, foto‑ nebo fonofobií nebo osmofobií. Bolest se zhoršuje fyzickou aktivitou, nemocný preferuje klid na lůžku. Jednotlivý neléčený (nebo neúspěšně léčený) záchvat trvá 4–72 hodin. Mezi záchvaty je pacient bez potíží. Nejčastěji se vyskytuje epizodická migréna, která je definována počtem záchvatů nižším než 15 dní v měsíci. Asi 30 % pacientů má bolesti hlavy více než 1× za týden a celých 8 % potom častěji než 10‒14× do měsíce. K progresi do chronické formy každoročně dospěje asi u 2,5 % nemocných [2].
Chronická migréna je podle Mezinárodní klasifikace bolestí hlavy, 3. vydání, (International Classification of Headache Disorders 3rd Edition, ICHD‑3) z roku 2018 samostatnou jednotkou definovanou jako bolest hlavy vyskytující se alespoň 15 dní v měsíci po dobu minimálně tří měsíců po sobě jdoucích, přičemž nejméně osm dní musí splňovat kritéria migrény bez aury nebo s aurou [3]. Postihuje 1‒3 % pacientů. Tento typ bolesti je často kombinován s nadužíváním akutní medikace a s rozvojem bolesti hlavy z nadužívání medikace (medication overuse headache, MOH).
Akutní a profylaktická léčba migrény
Základem úspěchu akutní terapie je podat lék co nejdříve od vzniku obtíží a v dostatečné dávce. K léčbě migrenózní ataky se používají podle intenzity bolesti a tolerance jednoduchá analgetika (kyselina acetylsalicylová, paracetamol, metamizol), nesteroidní antiflogistika (ibuprofen, naproxen, diklofenak, nimesulid, indometacin) a specifická protimigrenózní analgetika – triptany. Opioidní analgetika ani námelové alkaloidy se nedoporučují.
Cílem profylaktické léčby je snížení vysoké frekvence, intenzity a doby trvání záchvatů migrény. Profylaktikum by mělo být podáváno v dostatečné dávce (dle tolerance pacienta) a po dostatečně dlouhou dobu (alespoň tři měsíce). Profylaktická léčba je indikována u pacientů trpících tři a více dní v měsíci středně těžkou a těžkou migrénou; u nemocných s bolestí hlavy trvající nejméně 6–8 dní v měsíci, kde je akutní léčba neúčinná; při kontraindikaci akutní terapie; u pacientů s těžkými neurologickými příznaky i u méně frekventních atak; u nemocných s migrénou, která navzdory důslednému dodržování režimu, vyloučení spouštěcích faktorů i akutní léčbě významně ovlivňuje kvalitu života. Profylaktická léčba je indikována také u pacientů s vysokým rizikem MOH. Jedná se o sekundární poruchu způsobenou nadměrným užíváním akutních léků, kdy s narůstajícím počtem migrenózních záchvatů potřebuje pacient další a další analgetika, která postupem času ztrácejí účinnost. Pacient musí zvyšovat dávku svého léku nebo užít kombinaci léčiv a dostává se do začarovaného kruhu – pokud neužije lék, rozbolí ho hlava [2].
Bolest hlavy z nadužívání analgetické medikace
Bolest hlavy z nadužívání medikace - MOH (dříve transformovaná migréna) – je od roku 1988 samostatnou jednotkou v ICHD. Jde o poměrně komplikovanou diagnózu definovanou jako bolest migrenózního, tenzního nebo smíšeného typu vyskytující se 15 a více dní v měsíci a nadužívání musí trvat minimálně tři měsíce. Jestliže nemocný užívá jednosložková analgetika (paracetamol, metamizol) nebo nesteroidní antirevmatika, o nadužívání se hovoří, užívá‑li léky 15 a více dní v měsíci. Užívá‑li kombinovaná analgetika, triptany, opioidy či přípravky s ergotaminem, jedná se o nadužívání v případě jejich užití 10 a více dní v měsíci (2‒3 dny v týdnu) [4].
MOH má různé fenotypy, bolest se rozvíjí s novými charakteristikami, jako je například změna její kvality, změna v temporálním vzorci bolesti nebo proměna v přidružených příznacích. Pacienti dále mohou trpět zvyšující se frekvencí atak a tyto ataky mohou být těžší. Nejčastěji se MOH sdružuje s chronickou migrénou (60–80 % pacientů), dále s chronickým tenzním typem bolesti hlavy a posttraumatickou bolestí hlavy. Prevalence MOH v populaci se odhaduje na 0,5–2,6 %, její výskyt je 2–5krát častější u žen, s nejvyšší frekvencí výskytu ve věku mezi 30–50 lety [5,6]. Větší riziko MOH představuje pozitivní rodinná anamnéza. Nezřídka se s MOH pojí psychiatrické choroby, jako jsou deprese, úzkost a poruchy spánku [6]. Patofyziologie MOH je neznámá, zvažuje se uplatnění mnoha faktorů, především genetického, dále regulace exprese a senzitizace receptorů na buněčné úrovni [7], strukturální a funkční změny v hipokampu [8,9] a změny ve zpracování bolesti, sítích tvorby závislosti a hustotě receptorů.
Ohledně strategie léčby MOH dosud nepanuje jednoznačná shoda. Hlavním záměrem je ale vždy přerušení nadužívání léčiv s cílem zastavit MOH, zlepšit responzivitu pacienta na akutní a profylaktickou léčbu a nastolit nový, účelný režim užívání analgetik [10]. Nehledě na detailní rozdíly v užívaných postupech lze jednotlivé fáze léčby definovat jako: 1. edukace pacienta, 2. náhlé nebo postupné ukončení léčby, 3. profylaktická léčba a 4. prevence relapsu. Benefit vyplývající z úspěšné léčby je vysoký – individuální pro pacienta a sociálně‑ekonomický pro společnost.
Mechanismus vzniku migrény
Podstatou bolesti hlavy je stimulace nociceptivních trigeminových vláken, která patří k tzv. trigeminovaskulárnímu systému. Při stimulaci se z perivaskulárních nervových zakončení uvolňují neurotransmitery, především calcitonin gene‑related peptide (CGRP), v menší míře pak substance P a neurokinin A. Uvedeným způsobem dochází k vazodilataci meningeálních cév a vzniká sterilní perivaskulární zánět. Stimulace, vazodilatace a zánět jsou odpovědné za bolest hlavy u migrény.
![OBR. 1 Terapeutické účinky monoklonálních protilátek určuje vazba na cílové struktury; podle [11] – Pellesi, et al., 2017. OBR. 1 Terapeutické účinky monoklonálních protilátek určuje vazba na cílové struktury; podle [11] – Pellesi, et al., 2017.](https://www.remedia.cz/photo-pg-1300---.jpg) Klíčovým vazoaktivním neuropeptidem v patogenezi migrény je CGRP. Účastní se vazodilatace meningeálních cév a rozvoje sterilního perivaskulárního zánětu. Jeho koncentrace v krvi se během neléčeného migrenózního záchvatu zvyšuje a je inhibován triptany. Bylo prokázáno, že intravenózní podání CGRP provokuje záchvat migrény. Selektivní antagonisté CGRP tak efektivně působí proti jeho účinkům. Na základě těchto poznatků byly vyvinuty nové specifické léky zasahující cíleně do patogeneze migrény. Patří k nim dva typy protilátek, z nichž první jsou proti receptoru pro CGRP (erenumab) a druhé proti CGRP ligandu (galkanezumab, fremanezumab, eptinezumab) [11], obrázek 1. První výsledky klinického hodnocení s antagonistou receptorů pro CGRP byly zveřejněny v roce 2004. Účinnost a dobrá snášenlivost anti‑CGRP monoklonálních protilátek v profylaktické léčbě chronické i epizodické migrény byly opakovaně potvrzeny dalšími klinickými hodnoceními.
Klíčovým vazoaktivním neuropeptidem v patogenezi migrény je CGRP. Účastní se vazodilatace meningeálních cév a rozvoje sterilního perivaskulárního zánětu. Jeho koncentrace v krvi se během neléčeného migrenózního záchvatu zvyšuje a je inhibován triptany. Bylo prokázáno, že intravenózní podání CGRP provokuje záchvat migrény. Selektivní antagonisté CGRP tak efektivně působí proti jeho účinkům. Na základě těchto poznatků byly vyvinuty nové specifické léky zasahující cíleně do patogeneze migrény. Patří k nim dva typy protilátek, z nichž první jsou proti receptoru pro CGRP (erenumab) a druhé proti CGRP ligandu (galkanezumab, fremanezumab, eptinezumab) [11], obrázek 1. První výsledky klinického hodnocení s antagonistou receptorů pro CGRP byly zveřejněny v roce 2004. Účinnost a dobrá snášenlivost anti‑CGRP monoklonálních protilátek v profylaktické léčbě chronické i epizodické migrény byly opakovaně potvrzeny dalšími klinickými hodnoceními.
Monoklonální protilátky v terapii migrény
Do příchodu specifických CGRP monoklonálních protilátek se v profylaktické léčbě migrény využívaly pouze nespecifické léky, které tvoří nesourodou skupinu, řada z nich je určena primárně k terapii jiných onemocnění. Monoklonální protilátky stojí v centru zájmu biologické léčby, neboť jsou namířeny proti konkrétnímu receptoru a lze využít jejich jak neutralizačního, tak blokačního efektu.
Jedná se o velké molekuly s vysokou molekulovou hmotností, takže téměř neprocházejí hematoencefalickou bariérou (periferní působení). Mají výraznou cílovou specifitu, čímž se minimalizují nežádoucí účinky v jiných místech působení a zároveň se tím zlepšuje i jejich tolerabilita. Mají dlouhý biologický poločas (například fremanezumab 45 dní), proto se s výhodou užívají jako profylaktická léčba, kterou lze podávat jednou měsíčně anebo i v delších intervalech. Nemají lékové interakce, nejsou totiž metabolizovány v játrech, ale jsou pozvolna štěpeny na jednotlivé aminokyseliny pomocí retikuloendotelového systému. Ačkoliv se mohou vyskytnout nečetné lokální komplikace při subkutánním podání, celkově jsou monoklonální protilátky dobře tolerovány a mají minimální imunogenní potenciál. Velice dobrá účinnost těchto látek byla prokázána v klinických studiích a od roku 2020, kdy jsou přípravky v České republice registrovány, nadále potvrzována v praxi, a to jak u epizodické a chronické migrény, tak u MOH.
Použití biologické léčby v klinické praxi
Kazuistika 1: Biologická profylaxe přináší výraznou úlevu od letitých bolestí
Pacientka narozená 1971, od menarche (11 let) trpící migrénami, které byly zpočátku vázány na menses, po porodech došlo k jejich zhoršení. Od roku 2011 stav progredoval do chronicity (migréna 12–18× v měsíci) a od roku 2020 měla pacientka denní bolesti hlavy. Medikace byla buď neefektivní (cinarizin, venlafaxin, metoprolol), nebo ji pacientka netolerovala (topiramát, valproát). V roce 2021 užívala prakticky denně analgetika (všechna v kombinaci) a v témže roce byla u nemocné stanovena diagnóza asthma bronchiale (inhalační salbutamol a levocetirizin sezonně). Biologická profylaxe fremanezumabem byla zahájena v dubnu 2021 a během tří měsíců přinesla snížení počtu atak migrény na polovinu (z 13 na 6). Tento stav dlouhodobé kompenzace přetrvává.
Kazuistika 2: Před zahájením biologické léčby není nutné nadužívanou medikaci vysazovat
Pacientka narozená 1952, migrény bez aury má od 12 let. Dlouhodobě léčena v Německu, kdy vyzkoušela různé profylaxe i alternativní metody. V centru pro diagnostiku a léčbu bolesti hlavy je dispenzarizována od roku 2015 s diagnózou chronická migréna (denní bolesti hlavy), přičemž triptany jsou již bez efektu. V roce 2020 začala pro silné a frekventní ataky zvyšovat analgetickou medikaci až na 30–60 tablet/měsíc. V prosinci téhož roku byla zahájena biologická profylaxe fremanezumabem, při které došlo během tří měsíců léčby k poklesu počtu atak migrény na polovinu (z 8 na 4), dále je frekvence atak stabilní (3× měsíčně). Nadužívanou medikaci nebylo třeba před zahájením biologické profylaxe zcela vysazovat.
Kazuistika 3: Komfortní kvartální dávkování fremanezumabu
Pacientka bez bolestí hlavy v rodinné anamnéze, pro asthma bronchiale dispenzarizována na pneumologii, dlouhodobě užívala hormonální antikoncepci, kterou vysadila v roce 2020. Bolesti hlavy začaly s nástupem puberty (1988), s vazbou na větší fyzickou námahu, úleva se dostavila po odpočinku. Výrazné zhoršení nastalo po prvním porodu (2001). Ze záchranné medikace pacientka užívala ibuprofen, nimesulid, metamizol, triptany. Jako profylaktickou léčbu vyzkoušela mnoho přípravků z mnoha lékových skupin, vysazení hormonální antikoncepce bylo bez výraznějšího efektu na frekvenci migrén. V lednu 2022 proběhlo první vyšetření v poradně bolestí hlavy, o měsíc později byla zahájena biologická léčba fremanezumabem pro diagnózu frekventní epizodické migrény bez aury (11-12-20 dní s migrénou v měsíci, MMD), po selhání konvenční profylaktické léčby valproátem, venlafaxinem a cinarizinem a při intoleranci topiramátu. Při léčbě fremanezumabem došlo k výraznému poklesu počtu MMD i ve skóre dle dotazníku HIT‑6 (Headache Impact Test). Pacientka je s léčbou velmi spokojena, dosud pokračuje v kvartálním dávkovacím schématu, které je pro ni velmi komfortní. Aplikace probíhá v ordinaci, čímž odpadá zodpovědnost za léky jako takové (převoz, skladování, likvidace pera) a umožňuje pacientce žít plnohodnotnější život.
Fremanezumab
Fremanezumab je plně humanizovaná monoklonální protilátka IgG2, která se selektivně váže na ligand CGRP a blokuje jeho vazbu na receptor. Jedná se o jediný anti‑CGRP přípravek s možností flexibilního podávání: subkutánní aplikace v dávce 225 mg jednou měsíčně nebo 675 mg kvartálně. Aplikuje se pomocí předplněné injekční stříkačky nebo předplněného pera, jehož obsluha je velmi jednoduchá. Nežádoucí účinky léčby fremanezumabem jsou minimální (lokální reakce v místě vpichu – erytém, pruritus; další nežádoucí účinky jako zácpa, průjem nebo nazofaryngitida se vyskytují s četností srovnatelnou s placebem). Lékové interakce zatím nebyly zaznamenány. Fremanezumab má nízkou imunogenicitu a minimální „wearing off“ efekt, tj. klinicky významné snížení účinnosti léčby na konci dávkovacího intervalu.
Fremanezumab prokázal účinnost a bezpečnost v registračních studiích fáze III: studie HALO CM u chronické migrény a studie HALO EM u epizodické migrény. Údaje o účinnosti a bezpečnosti fremanezumabu z reálné klinické praxe dále shromažďuje klinické hodnocení fáze IV PEARL (Pan‑European Real Life), které probíhá v 87 centrech v 11 zemích Evropy u zhruba 1 100 pacientů s chronickou nebo epizodickou migrénou. Jedná se tak o doposud nejrozsáhlejší studii běžné praxe hodnotící fremanezumab.
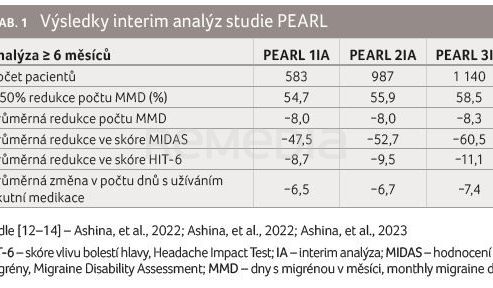 Klinické hodnocení PEARL dosud probíhá, předpokládá se, že poslední pacient dokončí studii během prvního čtvrtletí roku 2024. K dispozici jsou aktuálně výsledky interim analýz (tab. 1) [12−14].
Klinické hodnocení PEARL dosud probíhá, předpokládá se, že poslední pacient dokončí studii během prvního čtvrtletí roku 2024. K dispozici jsou aktuálně výsledky interim analýz (tab. 1) [12−14].
První interim analýza studie PEARL
Výsledky byly hodnoceny po šesti měsících léčby. Celkem 54,7 % všech pacientů dosáhlo více než 50% redukce počtu MMD. Mezi všemi pacienty došlo ke snížení počtu MMD od počáteční hodnoty o 8 dnů. Zlepšení bylo zaznamenáno rovněž ve skóre MIDAS (Migraine Disability Assessment; celkem 55,8 %) a ve skóre HIT‑6 (celkem 56,1 %). Při léčbě fremanezumabem byl doložen pokles potřeby akutní medikace – v šestém měsíci terapie ji pacienti použili v průměru o 6,5 dne méně.
Druhá interim analýza
Výsledky po 12 měsících léčby dokládají setrvalou účinnost fremanezumabu v redukci počtu MMD. Během šestiměsíční léčby fremanezumabem došlo u 55,9 % pacientů s epizodickou nebo chronickou migrénou ke snížení počtu MMD o 50 % nebo více. Průměrná změna počtu MMD byla v šestém měsíci −8, v devátém měsíci −8,5 a ve 12. měsíci −8,3. Data byla v souladu s výsledky první interim analýzy, což podpořilo průkaz účinnosti a bezpečnosti fremanezumabu pro preventivní léčbu migrény.
Třetí interim analýza
Analýza hodnotila účinnost fremanezumabu u pacientů, kteří přešli (switch) na tuto léčbu z jiné anti‑CGRP monoklonální protilátky, adherenci a perzistenci pacientů při léčbě fremanezumabem a setrvalý účinek fremanezumabu při poklesu počtu MMD. Během prvních šesti měsíců léčby fremanezumabem dosáhlo 32,3 % pacientů po switchi ≥ 50% poklesu počtu MMD, přičemž u pacientů s epizodickou a chronickou migrénou byl podíl podobný. Za klinicky významnou lze považovat skutečnost, že 60,9 % pacientů s chronickou migrénou dosáhlo ≥ 30% poklesu počtu MMD. Výsledky naznačují, že fremanezumab může nabídnout výhodnou možnost léčby u pacientů, u nichž jiné monoklonální protilátky selhaly z důvodu nedostatečné odpovědi nebo z důvodu nesnášenlivosti.
Závěr
Monoklonální protilátky CGRP jsou specifickou profylaxí založenou na znalostech patofyziologie migrény. Ve studiích i v praxi byla prokázána jejich velmi dobrá účinnost u epizodické migrény, chronické migrény a MOH. Nespornou výhodou je frekvence aplikace monoklonálních protilátek jednou měsíčně nebo čtvrtletně. Nemají interakce s jinými terapeutiky. Nebyly popsány závažné nežádoucí účinky a dlouhodobá tolerance je také dobrá. Podle současných znalostí nevedou k tvorbě autoprotilátek a ani jinak neovlivňují imunitní systém.
Jedním ze schválených léčivých přípravků z této skupiny je Ajovy (fremanezumab). Fremanezumab je vhodný pro nemocné s epizodickou nebo chronickou (≥ 15 MMD) migrénou, kteří splňují platná kritéria. Léčba je výhodná u nemocných s MOH. Jako jediný přípravek ze skupiny monoklonálních protilátek nabízí možnost flexibilního dávkování, a to buď jednou měsíčně, nebo kvartálně. Toto podávání výrazně zvyšuje compliance pacientů s profylaktickou terapií migrény. Tolerabilita protilátky je velmi dobrá, vyskytuje se jen malý podíl převážně lokálních nežádoucích účinků. Fremanezumab neprochází hepatálním nebo renálním metabolismem, a je tak možné jeho podávání u interních komorbidit. Kardiovaskulární riziko nebylo prokázáno. Potenciální pozitivní psychotropní efekt je dále studován.
Redakčně zpracovala MUDr. Vlasta Raušová
Literatura
[1] https://www.healthdata.org/research‑analysis/gbd
[2] Kotas R. Bolesti hlavy v klinické praxi. Praha: Maxdorf, 2015.
[3] Classification and diagnostic criteria for headache disorders, cranial neuralgias and facial pain. Headache Classification Committee of the International Headache Society. Cephalalgia 1988; 8(Suppl 7): 1−96.
[4] Nežádal T. CGRP monoklonální protilátky v profylaktické léčbě migrény. Neurol praxi 2019; 20: 356−360.
[5] Řehulka P. Migréna – moderní diagnostika a léčba. Praha: Maxdorf, 2023.
[6] Fischer MA, Jan A. Medication‑Overuse Headache. Last update August 22, 2023. Dostupné na: https://www.ncbi.nlm.nih.gov/books/NBK538150/
[7] Woolf CJ. Central sensitization: implications for the diagnosis and treatment of pain. Pain 2011; 152(3 Suppl): S2−S15.
[8] Schwedt TJ, Chong CD. Medication Overuse Headache: Pathophysiological Insights from Structural and Functional Brain MRI Research. Headache 2017; 57: 1173−1178.
[9] Lai TH, Wang SJ. Neuroimaging Findings in Patients with Medication Overuse Headache. Curr Pain Headache Rep 2018; 22: 1.
[10] Tassorelli C, Jensen R, Allena M, et al., the COMOESTAS Consortium. A consensus protocol for the management of medication‑overuse headache: Evaluation in a multicentric, multinational study. Cephalalgia 2014; 34: 645−655.
[11] Pellesi L, Guerzoni S, Pini LA. Spotlight on Anti‑CGRP Monoclonal Antibodies in Migraine: The Clinical Evidence to Date. Clin Pharmacol Drug Dev 2017; 6: 534−547.
[12] Ashina M, Mitsikostas D, Amin F, et al. Effectiveness of fremanezumab for preventive treatment of migraine: the observational PEARL study. EAN 2022; Abstract EPR‑035.
[13] Ashina M, et al. Effectiveness of Fremanezumab for the Preventive Treatment of Migraine: Second Interim Analysis of the Observational PEARL Study. Migraine Trust International Symposium (MTIS) 2022; Abstract MTIS‑PO‑054.
[14] Ashina M, Mitsikostas D, Amin F, et al. Real‑world effectiveness & safety of fremanezumab in migraine: 3rd interim analysis of the pan‑European PEARL study. EAN 2023; Abstract EPR‑045.