Studie NOAH-AFNET 6
Souhrn
Ludka O. Studie NOAH‑AFNET 6. Remedia 2024; 34: 131–135.
Epizody rychlé frekvence síní (atrial high‑rate episodes, AHRE) jsou síňové arytmie detekované implantovanými srdečními zařízeními. Dosud nebylo známo, zda nás výskyt AHRE u pacientů bez fibrilace síní opravňuje k zahájení antikoagulační léčby. Událostmi řízená dvojitě zaslepená, randomizovaná klinická studie NOAH‑AFNET 6 zahrnula pacienty ve věku 65 let nebo starší, kteří měli AHRE trvající alespoň šest minut a alespoň jeden další rizikový faktor pro vznik cévní mozkové příhody (CMP). Pacienti byli randomizováni v poměru 1 : 1 k podávání edoxabanu nebo placeba. Primární cílový ukazatel účinnosti byl složen z kardiovaskulárního úmrtí, CMP nebo systémové embolie a hodnocen v analýze doby do události. Bezpečnostní cílový ukazatel zahrnoval úmrtí z jakékoliv příčiny nebo velké krvácení. U pacientů s AHRE detekovanými implantabilními zařízeními antikoagulace edoxabanem ve srovnání s placebem významně nesnížila incidenci kardiovaskulárního úmrtí, CMP nebo systémové embolie, ale vedla k vyššímu výskytu úmrtí nebo velkého krvácení. Výskyt CMP byl v obou skupinách nízký.
Klíčová slova: studie NOAH‑AFNET 6 – epizody rychlé frekvence síní – antikoagulace − edoxaban – cévní mozková příhoda – kardiovaskulární úmrtí – systémová embolie.
Summary
Ludka O. NOAH‑AFNET 6 trial. Remedia 2024; 34: 131–135.
AHRE (atrial high‑rate episodes) may be detected by implantable cardiac devices. So far, it is not clear whether AHRE unaccompanied by atrial fibrillation mandates the initiation of anticoagulation therapy. In the event‑driven, double blind, randomized clinical trial NOAH‑AFNET 6, patients aged 65 or older with a history of AHRE lasting at least 6 minutes and at least one more risk factor for stroke were investigated. They were randomized 1:1 to edoxaban or placebo. The composite primary endpoint consisted of cardiovascular death, stroke and systemic embolization – time to event was analyzed. All‑cause death and major bleeding represented the safety endpoint. In patients with AHRE detected by implantable cardiac devices, anticoagulation with edoxaban did not ensure significant decrease in the incidence of cardiovascular death, stroke and systemic embolization while it was associated with higher incidence of all‑cause death and major bleeding (compared to placebo). The stroke rate was low in both groups.
Key words: NOAH‑AFNET 6 trial – atrial high‑rate episodes – anticoagulation – edoxaban – stroke – cardiovascular death – systemic embolization.
Úvod
Perorální antikoagulace snižuje riziko vzniku ischemické cévní mozkové příhody (CMP) u pacientů s fibrilací síní [1,2]. Systematické monitorování rytmu může umožnit včasnější detekci fibrilace síní, a tím i včasnější zahájení antikoagulační léčby [3,4]. Implantované srdeční přístroje (kardiostimulátor, srdeční resynchronizační terapie, implantabilní kardioverter‑defibrilátor, implantabilní záznamníky) mohou zaznamenávat také krátké epizody síňových arytmií. Arytmie detekované tímto typem kontinuálního monitorování se označují jako subklinická fibrilace síní nebo epizody rychlé frekvence síní (atrial high‑rate episodes, AHRE). Vzhledem k tomu, že se srdeční elektrická aktivita zaznamenaná během AHRE podobá aktivitě zaznamenané během fibrilace síní, někteří lékaři zahajují perorální antikoagulační léčbu u pacientů s AHRE, zejména u těch, kteří mají další rizikové faktory pro CMP, nebo u těch, kteří mají AHRE trvající déle než 24 hodin [5]. Vzhledem ke své vzácnosti a epizodické povaze zůstávají AHRE obvykle nediagnostikovány u pacientů, kteří nepodstupují dlouhodobé monitorování rytmu [6].
Subanalýza studie MOST se 312 pacienty hodnotila klinický význam AHRE definované jako frekvence síní > 220/min v trvání více než pět minut. Po 27 měsících mělo alespoň jednu epizodu AHRE 51 % pacientů. Přítomnost AHRE byla nezávisle asociována se zvýšeným rizikem výskytu úmrtí nebo CMP. Téměř jedna pětina pacientů s AHRE byla asymptomatická [7]. Ve studii ASSERT u 2 580 pacientů ve věku ≥ 65 let s hypertenzí a bez předchozí diagnózy fibrilace síní byly AHRE definovány jako epizody síňové frekvence > 190/min trvající více než šest minut. Po 2,5letém sledování byla přítomnost AHRE spojena s 2,5násobným zvýšením rizika výskytu ischemické CMP nebo systémové embolie [8].
Při absenci fibrilace síní nebyla však perorální antikoagulace obecně účinná v prevenci CMP u pacientů, kteří prodělali embolickou CMP neznámého původu, nebo u pacientů se srdečním selháním [9-12]. Z těchto důvodů byla provedena studie NOAH‑AFNET 6 (Non‑Vitamin K Antagonist Oral Anticoagulants in Patients with High Rate Episodes). Cílem studie bylo porovnat účinnost a bezpečnost perorální antikoagulační léčby edoxabanem s účinností a bezpečností péče bez antikoagulace u pacientů s AHRE, kteří měli klinické rizikové faktory pro vznik CMP [13].
Metodika
Tato dvojitě zaslepená, randomizovaná, událostmi řízená studie iniciovaná zkoušejícími se uskutečnila na 206 pracovištích v 18 evropských zemích a byli do ní zařazováni pacienti ve věku ≥ 65 let s AHRE detekovanými implantovanými zařízeními bez anamnézy fibrilace síní. Pacienti museli mít AHRE alespoň dva měsíce po implantaci zařízení. Kvalifikační AHRE musela zahrnovat síňovou frekvenci alespoň 170 tepů za minutu a musela trvat šest nebo více minut. Pacienti rovněž museli mít jeden nebo více z následujících rizikových faktorů pro vznik CMP: srdeční selhání, hypertenzi, diabetes mellitus, předchozí CMP nebo tranzitorní ischemickou ataku, cévní onemocnění (předchozí infarkt myokardu, aortální plak nebo onemocnění periferních tepen, karotid nebo mozkových tepen) nebo věk > 75 let. Kritérii pro vyřazení byly fibrilace síní dokumentovaná pomocí elektrokardiografie (EKG), akutní koronární syndrom, perkutánní koronární intervence nebo koronární bypass do 30 dnů před zařazením do studie, očekávaná délka života kratší než 12 měsíců, kontraindikace perorální antikoagulace, indikace pro duální protidestičkovou léčbu či jiná indikace pro perorální antikoagulaci.
Kontrolní návštěvy se u zařazených pacientů uskutečnily každých šest měsíců a zahrnovaly klinické vyšetření, zachycení AHRE z implantabilních zařízení, EKG, posouzení kritérií pro snížení dávky edoxabanu a indikaci kyseliny acetylsalicylové (ASA), výdej dávek edoxabanu nebo placeba [14].
Velikost populace byla původně odhadnuta na 3 400 pacientů a následně byla snížena na 2 538 pacientů na základě průběžné analýzy, která byla provedena po 1 000 pacientorocích. Celkový počet pacientů, u kterých byl proveden screening, není bohužel znám.
Vhodní pacienti byli náhodně randomizováni v poměru 1 : 1 k podávání edoxabanu v dávce 60 mg nebo placeba. Randomizace byla stratifikována podle indikace k léčbě ASA. Kritéria pro snížení dávky edoxabanu na 30 mg jednou denně (tělesná hmotnost ≤ 60 kg, clearance kreatininu 15-50 ml/min nebo současné užívání silných inhibitorů P‑glykoproteinu) byla hodnocena při každé návštěvě, s ev. provedením vhodné úpravy. Skupina s placebem dostávala tabletu, která buď neobsahovala žádnou účinnou látku, nebo obsahovala ASA v dávce 100 mg denně. Tableta, kterou pacient dostal, byla určena na základě indikací pro použití ASA, jež zahrnovaly onemocnění periferních nebo koronárních tepen, předchozí infarkt myokardu nebo předchozí CMP. Indikaci k léčbě ASA určil zkoušející lékař při vstupní návštěvě a pokaždé, když byl vydán zkušební lék.
Primárním cílovým ukazatelem účinnosti byl první výskyt složený z kardiovaskulárního úmrtí, CMP nebo systémové embolie hodnocený v analýze doby do události. Bezpečnostní cílový ukazatel byl složen z úmrtí z jakékoliv příčiny nebo velkého krvácení [15]. Klíčovými sekundárními ukazateli byly jednotlivé složky primárního cílového ukazatele účinnosti a bezpečnosti, dále ukazatel složený z CMP nebo systémové embolie, kognitivní funkce, kvalita života, spokojenost a symptomy pacienta a funkční stav.
Výsledky
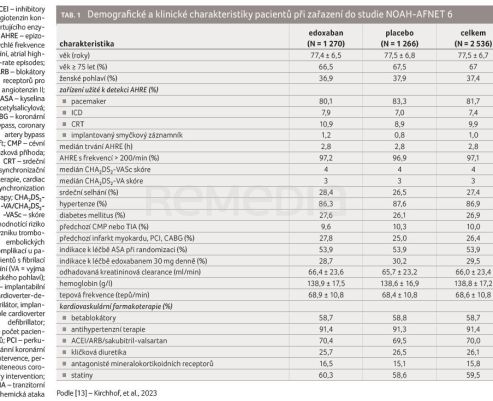 Od 24. června 2016 do 6. září 2022 bylo v rámci studie randomizováno 2 608 pacientů s AHRE. Hodnoceno bylo nakonec 2 536 pacientů (1 270 pacientů ve skupině s edoxabanem a 1 266 pacientů ve skupině s placebem). Průměrný věk pacientů činil 78 let. Medián trvání AHRE byl 2,8 hodiny a AHRE obecně vykazovaly síňové frekvence vyšší než 200 tepů za minutu (tab. 1) [13]. Medián počtu AHRE byl 2,8 v každé skupině, medián CHA2DS2‑VASc skóre hodnotícího riziko vzniku tromboembolických komplikací u pacientů s fibrilací síní byl 4. Demografické a klinické charakteristiky pacientů na počátku studie byly v obou skupinách podobné (tab. 1) [13]. Etnická skupina a rasa nebyly systematicky zaznamenávány, pacienty byli především běloši.
Od 24. června 2016 do 6. září 2022 bylo v rámci studie randomizováno 2 608 pacientů s AHRE. Hodnoceno bylo nakonec 2 536 pacientů (1 270 pacientů ve skupině s edoxabanem a 1 266 pacientů ve skupině s placebem). Průměrný věk pacientů činil 78 let. Medián trvání AHRE byl 2,8 hodiny a AHRE obecně vykazovaly síňové frekvence vyšší než 200 tepů za minutu (tab. 1) [13]. Medián počtu AHRE byl 2,8 v každé skupině, medián CHA2DS2‑VASc skóre hodnotícího riziko vzniku tromboembolických komplikací u pacientů s fibrilací síní byl 4. Demografické a klinické charakteristiky pacientů na počátku studie byly v obou skupinách podobné (tab. 1) [13]. Etnická skupina a rasa nebyly systematicky zaznamenávány, pacienty byli především běloši.
 Z 1 270 pacientů, kteří dostávali edoxaban, 365 (28,7 %) splnilo kritéria pro snížení dávky na 30 mg jednou denně na začátku studie. K vysazení edoxabanu došlo po mediánu 16,8 měsíce (rozmezí 6,1-30,0). Celkem 134 pacientů ve skupině s edoxabanem svůj souhlas stáhlo a fibrilace síní se vyvinula u 232 osob (8,7 %/pacientorok). Z 1 266 pacientů ve skupině s placebem dostalo 683 (53,9 %) pacientů ASA. K vysazení placeba došlo po mediánu 16,7 měsíce (rozmezí 6,2-31,4). Celkem 134 pacientů ve skupině s placebem svůj souhlas stáhlo a fibrilace síní se rozvinula u 230 osob (8,8 % pacientorok).
Z 1 270 pacientů, kteří dostávali edoxaban, 365 (28,7 %) splnilo kritéria pro snížení dávky na 30 mg jednou denně na začátku studie. K vysazení edoxabanu došlo po mediánu 16,8 měsíce (rozmezí 6,1-30,0). Celkem 134 pacientů ve skupině s edoxabanem svůj souhlas stáhlo a fibrilace síní se vyvinula u 232 osob (8,7 %/pacientorok). Z 1 266 pacientů ve skupině s placebem dostalo 683 (53,9 %) pacientů ASA. K vysazení placeba došlo po mediánu 16,7 měsíce (rozmezí 6,2-31,4). Celkem 134 pacientů ve skupině s placebem svůj souhlas stáhlo a fibrilace síní se rozvinula u 230 osob (8,8 % pacientorok).
Primární cílové ukazatele
Studie byla předčasně ukončena, se střední dobou sledování 21 měsíců, na základě obav o bezpečnost a na základě výsledků nezávislého hodnocení marnosti podávání edoxabanu. V době ukončení byl plánovaný nábor již ukončen a 184 z 220 plánovaných primárních ukazatelů účinnosti se vyskytlo v průběhu střední doby sledování 21 měsíců v obou skupinách.
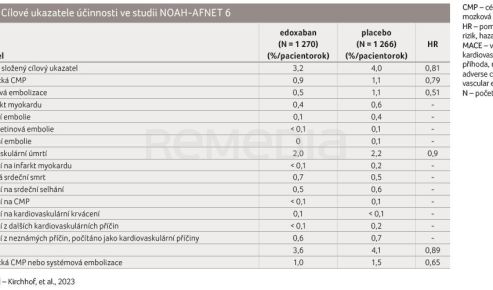
![GRAF 1A, B Primární cílový ukazatel účinnosti a bezpečnosti ve studii NOAH-AFNET 6; podle [13] – Kirchhof, et al., 2023. GRAF 1A, B Primární cílový ukazatel účinnosti a bezpečnosti ve studii NOAH-AFNET 6; podle [13] – Kirchhof, et al., 2023.](https://www.remedia.cz/photo-pg-1364---.jpg) Primární cílový ukazatel účinnosti se vyskytl u 83 pacientů (3,2 %/pacientorok) ve skupině s edoxabanem a u 101 pacientů (4,0 %/pacientorok) ve skupině s placebem (poměr rizik [HR] 0,81; 95% interval spolehlivosti [CI] 0,60-1,08; p = 0,15), tabulka 2, graf 1A [13]. Incidence CMP byla přibližně 1 %/pa-
Primární cílový ukazatel účinnosti se vyskytl u 83 pacientů (3,2 %/pacientorok) ve skupině s edoxabanem a u 101 pacientů (4,0 %/pacientorok) ve skupině s placebem (poměr rizik [HR] 0,81; 95% interval spolehlivosti [CI] 0,60-1,08; p = 0,15), tabulka 2, graf 1A [13]. Incidence CMP byla přibližně 1 %/pa-
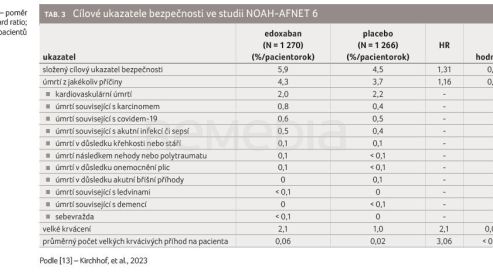
cientorok v obou skupinách. Bezpečnostní cílový ukazatel byl zaznamenán u 149 pacientů (5,9 %/pacientorok) ve skupině s edoxabanem a u 114 pacientů (4,5 %/pacientorok) ve skupině s placebem (HR 1,31; 95% CI 1,02-1,67; p = 0,03), tabulka 3, graf 1B [13]. Fibrilace síní diagnostikovaná pomocí EKG se vyvinula u 462 z 2 536 pacientů (18,2 % celkem, 8,7 %/pa-
cientorok).
Sekundární cílové ukazatele
 Cévní mozková příhoda se vyskytla u 22 pacientů (0,9 %/pacientorok) ve skupině s edoxabanem a u 27 pacientů (1,1 %/pacientorok) ve skupině s placebem (tab. 2) [13]. Systémová embolie se vyskytla u 14 pacientů (0,5 %/pacientorok) ve skupině s edoxabanem a u 28 pacientů (1,1 %/pacientorok) ve skupině s placebem. Kombinace CMP nebo systémové embolie se vyskytla u 25 pacientů (1,0 %/pacientorok) ve skupině s edoxabanem a u 38 pacientů (1,5 %/pacientorok) ve skupině s placebem (HR 0,65; 95% CI 0,39-1,07). Ke kardiovaskulárnímu úmrtí došlo u 52 pacientů (2,0 %/pacientorok) ve skupině s edoxabanem a u 57 pacientů (2,2 %/pa-
Cévní mozková příhoda se vyskytla u 22 pacientů (0,9 %/pacientorok) ve skupině s edoxabanem a u 27 pacientů (1,1 %/pacientorok) ve skupině s placebem (tab. 2) [13]. Systémová embolie se vyskytla u 14 pacientů (0,5 %/pacientorok) ve skupině s edoxabanem a u 28 pacientů (1,1 %/pacientorok) ve skupině s placebem. Kombinace CMP nebo systémové embolie se vyskytla u 25 pacientů (1,0 %/pacientorok) ve skupině s edoxabanem a u 38 pacientů (1,5 %/pacientorok) ve skupině s placebem (HR 0,65; 95% CI 0,39-1,07). Ke kardiovaskulárnímu úmrtí došlo u 52 pacientů (2,0 %/pacientorok) ve skupině s edoxabanem a u 57 pacientů (2,2 %/pa-
cientorok) ve skupině s placebem (tab. 2) [13]. Velké krvácení bylo hlášeno u 53 pacientů ve skupině s edoxabanem a u 25 pacientů ve skupině s placebem (HR 2,10; 95% CI 1,30-3,38). K úmrtí z jakékoliv příčiny došlo u 111 pacientů ve skupině s edoxabanem a u 94 pacientů ve skupině s placebem (HR 1,16; 95% CI 0,88-1,53), tabulka 3 [13]. Průměrné skóre na vizuální analogové stupnici EQ‑5D‑5L (EuroQol 5‑Dimension 5‑Level) se v průběhu času zhoršovalo bez podstatného rozdílu mezi zkušebními skupinami. Ostatní výsledky hlášené pacienty, kognitivní funkce a funkční stav se v průběhu času výrazně nezměnily a byly podobné v obou skupinách.
Diskuse
Ve dvojitě zaslepené, randomizované studii NOAH‑AFNET 6 nevedla perorální antikoagulace edoxabanem podávaná v dávkách schválených pro léčbu fibrilace síní k nižší incidenci kombinovaného cílového ukazatele zahrnujícího kardiovaskulární úmrtí, CMP nebo systémovou embolii oproti žádné antikoagulaci u pacientů s AHRE. Edoxaban ale vedl k vyššímu výskytu složeného cílového ukazatele zahrnujícího úmrtí z jakékoliv příčiny nebo velké krvácení. Incidence příhod byla obecně v očekávaných rozmezích, s výjimkou nízkého výskytu CMP v obou skupinách [13].
Klinické charakteristiky populace ve studii NOAH‑AFNET 6, včetně věku a rizikových faktorů pro CMP, jsou v souladu s charakteristikami pacientů s fibrilací síní, kteří mají vysoké riziko vzniku CMP a nejsou léčeni antikoagulancii. Navzdory zařazení vysoce rizikové populace byla pozorovaná incidence CMP u pacientů, kteří nebyli léčeni perorálními antikoagulancii, nižší, než se očekávalo. Výskyt CMP pozorovaný ve studii NOAH‑AFNET 6 byl podstatně nižší než výskyt hlášený v kohortové studii zahrnující švédské pacienty s fibrilací síní a skóre CHA2DS2‑VASc 4, kteří nebyli léčeni perorálními antikoagulancii [16]. Incidence CMP bez antikoagulace ve studii NOAH‑AFNET 6 byla také nižší než u pacientů s fibrilací síní, jimž byla přiřazena léčba ASA ve studii AVERROES [17], u pacientů, kteří byli bez antikoagulace ve studii ELDERCARE‑AF [18], a u pacientů bez antikoagulace (ASA) ve studiích s antagonisty vitaminu K [19]. Kromě toho byl výskyt CMP u pacientů, kteří ve studii NOAH‑AFNET 6 nedostávali perorální antikoagulaci, nižší než u pacientů s fibrilací síní, kteří dostávali edoxaban ve studii ENGAGE AF‑TIMI 48 [20]. Vyšší výskyt velkého krvácení u pacientů ve skupině s edoxabanem byl očekávaným nežádoucím účinkem antikoagulační léčby. Tyto pozorované výskyty velkého krvácení jsou rovněž v souladu s výskytem velkého krvácení u pacientů, kteří dostávali edoxaban ve studii ENGAGE AF‑TIMI 48, ve studii ELDERCARE‑AF a v klinické praxi [21].
Nízký výskyt CMP, který nebyl dále snížen léčbou edoxabanem, může vést k tomu, že je vhodné přerušit antikoagulační léčbu u pacientů s AHRE [22]. Zdá se, že hlavním rozdílem mezi populací studovanou ve studii NOAH‑AFNET 6 a pacienty s fibrilací síní je tzv. nízká zátěž arytmií. Publikované zprávy ukazují, že nízká zátěž arytmií přispívá k nízkému výskytu CMP i u pacientů s fibrilací síní: paroxysmální fibrilace síní je spojena s nižším výskytem CMP oproti perzistující nebo permanentní fibrilaci síní [23,24]. Včasná kontrola rytmu snižuje riziko vzniku kardiovaskulárních příhod, včetně CMP [25], a tento efekt je zprostředkován dosažením sinusového rytmu, který odráží sníženou zátěž arytmií [26]. Tyto výsledky mohou podpořit závěr ze studie NOAH‑AFNET 6, že u pacientů s AHRE bez EKG dokumentované fibrilace síní jsou AHRE lépe zvládnutelné bez antikoagulace.
Limitace studie
Vzhledem k předčasnému ukončení studie po nahromadění 184 z 220 původně plánovaných primárních ukazatelů účinnosti nemá NOAH‑AFNET 6 dostatečnou sílu pro detekci nebo vyloučení malého příznivého účinku perorální antikoagulace na prevenci CMP. Nálezy s edoxabanem také nelze zobecnit na jiná přímá perorální antikoagulancia (direct oral anticoagulants, DOAC). Probíhající studie byly navrženy tak, aby určily účinnost a bezpečnost terapie DOAC po úspěšné léčbě (kontrola rytmu) a zhodnotily bezpečnost a účinnost apixabanu u pacientů s AHRE [27,28]. Podobné studie mohou být oprávněné k hodnocení účinnosti a bezpečnosti perorální antikoagulace u pacientů, kteří mají vzácné síňové arytmie detekované implantovanými srdečními zařízeními, ale nemají fibrilaci síní dokumentovanou na EKG [29]. Studie NOAH‑AFNET 6 zahrnovala převážně bělochy v Evropě. Výsledky se tedy mohou u jiných rasových a etnických skupin lišit. Nízký výskyt CMP, který byl pozorován v této studii a ve studii LOOP [6], naznačuje, že kromě predikce klinického rizika pro CMP jsou potřebné i další metody ke zlepšení odhadu rizika vzniku CMP u pacientů s občasnými síňovými arytmiemi zjištěnými dlouhodobým sledováním při rozhodování o použití antikoagulace.
Závěr
Ve studii zahrnující pacienty, kteří měli AHRE bez fibrilace síní a kteří byli ve věku 65 let nebo starší a měli jiné rizikové faktory pro CMP, nebyla incidence kombinované kardiovaskulární smrti, CMP nebo systémové embolie s edoxabanem významně odlišná od placeba, avšak léčba edoxabanem vedla k vyššímu výskytu složeného cílového ukazatele úmrtí nebo velkého krvácení.
Prof. MUDr. Ondřej Ludka, Ph.D., FESC
Všeobecná interní klinika LF MU a FN Brno
Jihlavská 20, 625 00 Brno
e-mail: ludka.ondrej@fnbrno.cz
Literatura
[1] Hart RG, Pearce LA, Aguilar MI. Metaanalysis: antithrombotic therapy to prevent stroke in patients who have nonvalvular atrial fibrillation. Ann Intern Med 2007; 146: 857−867.
[2] Ruff CT, Giugliano RP, Braunwald E, et al. Comparison of the efficacy and safety of new oral anticoagulants with warfarin in patients with atrial fibrillation: a meta‑analysis of randomised trials. Lancet 2014; 383: 955−962.
[3] Schnabel RB, Marinelli EA, Arbelo E, et al. Early diagnosis and better rhythm management to improve outcomes in patients with atrial fibrillation: the 8th AFNET/EHRA consensus conference. Europace 2023; 25: 6−27.
[4] Freedman B, Camm J, Calkins H, et al. Screening for atrial fibrillation: a report of the AF‑SCREEN international collaboration. Circulation 2017; 135: 1851−1867.
[5] Toennis T, Bertaglia E, Brandes A, et al. The influence of atrial high‑rate episodes on stroke and cardiovascular death: an update. Europace 2023; 25: euad166.
[6] Svendsen JH, Diederichsen SZ, Hojberg S, et al. Implantable loop recorder detection of atrial fibrillation to prevent stroke (the LOOP study): a randomised controlled trial. Lancet 2021; 398: 1507−1516.
[7] Glotzer TV, Hellkamp AS, Zimmerman J, et al. Atrial high rate episodes detected by pacemaker diagnostics predict death and stroke: report of the Atrial Diagnostics Ancillary Study of the MOde Selection Trial (MOST). Circulation 2003; 107: 1614−1619.
[8] Healey JS, Connolly SJ, Gold MR, et al. Subclinical atrial fibrillation and the risk of stroke. N Engl J Med 2012; 366: 120−129.
[9] Hart RG, Sharma M, Mundl H, et al. Rivaroxaban for stroke prevention after embolic stroke of undetermined source. N Engl J Med 2018; 378: 2191−2201.
[10] Diener H‑C, Sacco RL, Easton JD, et al. Dabigatran for prevention of stroke after embolic stroke of undetermined source. N Engl J Med 2019; 380: 1906−1917.
[11] Zannad F, Anker SD, Byra WM, et al. Rivaroxaban in patients with heart failure, sinus rhythm, and coronary disease. N Engl J Med 2018; 379: 1332−1342.
[12] Homma S, Thompson JLP, Pullicino PM, et al. Warfarin and aspirin in patients with heart failure and sinus rhythm. N Engl J Med 2012; 366: 1859−1869.
[13] Kirchhof P, Toennis T, Goette A, et al. Anticoagulation with Edoxaban in Patients with Atrial High‑Rate Episodes. N Engl J Med 2023; 389: 1167−1179.
[14] Kirchhof P, Blank BF, Calvert M, et al. Probing oral anticoagulation in patients with atrial high rate episodes: rationale and design of the non‑vitamin K antagonist oral anticoagulants in patients with atrial high rate episodes (NOAH‑AFNET 6) trial. Am Heart J 2017; 190: 1218.
[15] Schulman S, Kearon C, Subcommittee on Control of anticoagulation of the Scientific and Standardization Committee of the International Society on Thrombosis and Haemostasis. Definition of major bleeding in clinical investigations of antihemostatic medicinal products in nonsurgical patients. J Thromb Haemost 2005; 3: 692−694.
[16] Friberg L, Rosenqvist M, Lip GYH. Evaluation of risk stratification schemes for ischaemic stroke and bleeding in 182,678 patients with atrial fibrillation: the Swedish atrial fibrillation cohort study. Eur Heart J 2012; 33: 1500−1510.
[17] Connolly SJ, Eikelboom J, Joyner C, et al. Apixaban in patients with atrial fibrillation. N Engl J Med 2011; 364: 806−817.
[18] Okumura K, Akao M, Yoshida T, et al. Low‑dose edoxaban in very elderly patients with atrial fibrillation. N Engl J Med 2020; 383: 1735−1745.
[19] Mant J, Hobbs FDR, Fletcher K, et al. Warfarin versus aspirin for stroke prevention in an elderly community population with atrial fibrillation (the Birmingham atrial fibrillation treatment of the aged study, BAFTA): a randomised controlled trial. Lancet 2007; 370: 493−503.
[20] Giugliano RP, Ruff CT, Braunwald E, et al. Edoxaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2013; 369: 2093−2104.
[21] Kirchhof P, Pecen L, Bakhai A, et al. Edoxaban for stroke prevention in atrial fibrillation and age‑adjusted predictors of clinical outcomes in routine clinical care. Eur Heart J Cardiovasc Pharmacother 2022; 9: 47−57.
[22] Sanna T, Diener H‑C, Passman RS, et al. Cryptogenic stroke and underlying atrial fibrillation. N Engl J Med 2014; 370: 2478−2486.
[23] Vanassche T, Lauw MN, Eikelboom JW, et al. Risk of ischaemic stroke according to pattern of atrial fibrillation: analysis of 6563 aspirin‑treated patients in ACTIVE‑A and AVERROES. Eur Heart J 2015; 36: 281a−287a.
[24] Link MS, Giugliano RP, Ruff CT, et al. Stroke and mortality risk in patients with various patterns of atrial fibrillation: results from the ENGAGE AF‑TIMI 48 trial (effective anticoagulation with factor Xa next generation in atrial fibrillation thrombolysis in myocardial infarction 48). Circ Arrhythm Electrophysiol 2017; 10: e004267.
[25] Kirchhof P, Camm AJ, Goette A, et al. Early rhythm‑control therapy in patients with atrial fibrillation. N Engl J Med 2020; 383: 1305−1316.
[26] Eckardt L, Sehner S, Suling A, et al. Attaining sinus rhythm mediates improved outcome with early rhythm control therapy of atrial fibrillation: the EAST‑AFNET 4 trial. Eur Heart J 2022; 43: 4127−4144.
[27] Verma A, Ha ACT, Kirchhof P, et al. The optimal anti‑coagulation for enhancedrisk patients post‑catheter ablation for atrial fibrillation (OCEAN) trial. Am Heart J 2018; 197: 124−132.
[28] Lopes RD, Alings M, Connolly SJ, et al. Rationale and design of the apixaban for the reduction of thrombo‑embolism in patients with device‑detected sub‑clinical atrial fibrillation (ARTESIA) trial. Am Heart J 2017; 189: 137−145.
[29] U.S. Preventive Services Task Force. Screening for atrial fibrillation: US Preventive Services Task Force recommendation statement. JAMA 2022; 327: 360−367.