Tofacitinib z perspektivy odborníků
Sympozia společnosti Pfizer na letošním kongresu Evropské aliance revmatologických společností (EULAR 2024), který se konal 12.–15. června 2024 ve Vídni, měla v hledáčku tofacitinib a jeho využití v léčbě pacientů napříč specializacemi.
Tofacitinib v léčbě ankylozující spondylitidy a ulcerózní kolitidy
První sympozium se zaměřilo na ankylozující spondylitidu (AS) a ulcerózní kolitidu (UC). O aktuálních otázkách léčby diskutovali revmatoložka profesorka Janet Pope (University of Western Ontario, Kanada), farmakolog profesor Frank Behrens (Frauenhofer Institute for Translational Medicine and Pharmacology, Frankfurt, Německo) a gastroenterolog profesor Charlie Lees (University of Edinburgh, Spojené království).
Spondyloartritida (SpA) a zánětlivá onemocnění střev (IBD) jsou chronická imunologicky podmíněná onemocnění kloubů a střeva, která se často vyskytují současně u stejného pacienta, zvyšují u každého jednotlivého zátěž onemocněním, zhoršují kvalitu života pacientů a ovlivňují terapeutické strategie.
Přítomní odborníci si dali za cíl sdílet zkušenosti, diskutovat praktické otázky a identifikovat komplexní strategie v managementu péče o pacienta trpícího AS a extramuskuloskeletálními manifestacemi. Žádoucí je aplikovat poznatky z klinických hodnocení AS a UC se záměrem optimalizovat léčebné strategie a zároveň prozkoumat dostupná bezpečnostní data v celé šíři napříč indikacemi.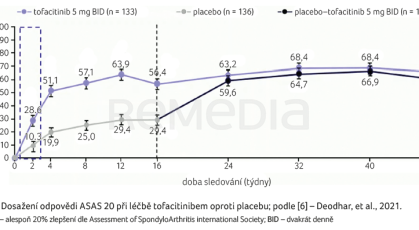
Sympozium provází příběh mladého pacienta. Mathew, 29 let, který je v péči revmatologa pro diagnózu AS, je léčen několik let inhibitory tumor nekrotizujícího faktoru (TNF). Nyní došlo ke zhoršení stavu, má křeče v břiše, zvýšenou frekvenci defekace, pozoruje krev ve stolici, vnímá zhoršenou kvalitu života (únava, nechuť k aktivitám s kamarády). Přítomní odborníci se zamýšlejí nad možnou diagnózou a vzhledem k věku a příznakům je napadá IBD. Proč?
Zhruba 4–12 % pacientů s axiální SpA má klinicky zjevné a diagnostikované IBD. Zároveň se odhaduje, že 40–50 % nemocných může mít subklinický mikroskopický zánět střev [1]. Diskutující odborníci se shodli na potřebě správné a časné diagnózy. Snahou gastroenterologů i revmatologů by mělo být koexistenci těchto stavů odhalit a v péči o pacienta spolupracovat. IBD a SpA považují spíše za asociovaná onemocnění než za komorbidity. Tedy že mezi diagnózami je přímé spojení (sdílená patofyziologie) a onemocnění se vzájemně ovlivňují. Incidence SpA se s trváním IBD zvyšuje a obdobnou závislost je možné zaznamenat obráceně [2,3].
Jaká je tedy společná patofyziologie či překryv? Na osu střevo‑kloub je třeba pohlížet systémově, profesorka Janet Pope ji přirovnala ke spojitosti psoriázy a psoriatické artritidy (PsA). Na rozvoji kloubního i střevního zánětu se podílejí genetická predispozice, environmentální spouštěče, vlastnosti mikrobiomu i transport imunitních buněk a specifické cytokiny.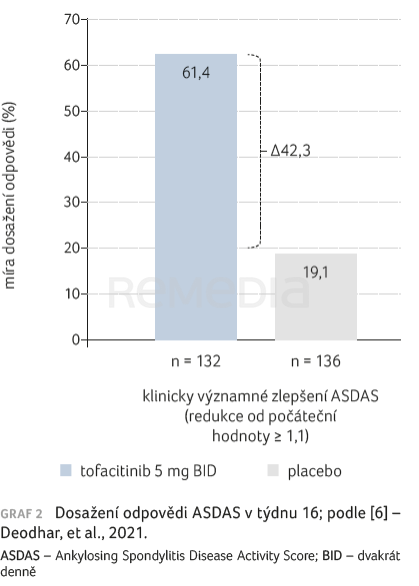
Většina molekulárně cílených biologických terapií vyvinutých během posledních dvou desetiletí byla založena na důkazech, že na těchto imunitních onemocněních se podílejí specifické cytokinové dráhy, které jsou různým způsobem zapojeny do poškozujícího zánětu [4]. Podobnosti i rozdíly v patogenetických mechanismech je pak možné využít v léčebných strategiích a při konkrétním cílení terapie. Porozumění patofyziologii onemocnění je proto zásadní pro cílenou léčbu, kterou pak můžeme mířit na hlavní patofyziologickou dráhu, v případě výskytu obou diagnóz sdílenou. Ke změně střevní permeability přispívá řada faktorů (střevní dysbióza, kouření, infekce, stres, znečištěné prostředí, dieta aj.), což ve svém důsledku vede k aktivaci produkce cytokinů a imunitních buněk a k migraci leukocytů ze střeva do kloubů [5]. Na základě znalosti vazeb mezi axiální SpA, PsA a IBD je racionální zaměřit se v léčbě na klíčové signální dráhy. Mezi ně patří dráha TNF, interleukinu (IL) 23/IL‑17 a dráha JAK‑STAT (Janus kináza/signal transducer and activator of transcription).
Přednášející se vrátili zpět k prezentovanému pacientovi a zamysleli se nad výběrem terapie z perspektivy SpA a IBD. Mathew byl referován ke gastroenterologovi, který na základě endoskopického vyšetření a biopsie tlustého střeva potvrdil diagnózu ulcerózní kolitidy (UC). Pacient se již dříve potýkal s depresí a nyní se jeho psychický stav s pracovní neschopností zhoršil a vnímá potřebu vrátit se co nejdříve do práce a „fungovat“.
Jako iniciální terapie byly indikovány čípky s kyselinou 5‑aminosalicylovou s plánem zhodnocení odpovědi na léčbu po čtyřech týdnech. Přednášející si spolu s auditoriem položili otázku, jak tohoto pacienta dále léčit. Které léčebné možnosti připadají pro Mathewa v úvahu? Switch na jiný inhibitor TNF, inhibitor IL‑23, inhibitor IL‑17, inhibitor JAK, či setrvat na stávající léčbě? Většina přítomných hlasovala pro indikaci inhibitoru JAK. Profesorka Pope upřesnila, že inhibitor IL‑17 není vhodnou volbou, protože není dostatečně účinný u IBD, inhibitor IL‑23 zase u axiálního onemocnění.
Co víme o účinnosti tofacitinibu u pacientů s AS a UC? Jeho účinnost a bezpečnost v terapii pacientů s aktivní AS doložil klinický program hodnocení, který vedl k jeho schválení v této indikaci. Tofacitinib poskytuje u AS v porovnání s placebem rychlou a klinicky významnou úlevu od symptomů a výrazně více pacientů dosahuje nízké aktivity onemocnění [6] a klinické remise [7]. Jak demonstruje graf 1, u pacientů původně randomizovaných k podávání placeba došlo k rychlému zlepšení po převedení na aktivní léčbu. Stejně rychlý klinický efekt byl zaznamenán v případě dalších sledovaných parametrů – bolesti zad, trvání ranní ztuhlosti, v laboratorním i celkovém hodnocení aktivity onemocnění dle skóre ASDAS (Ankylosing Spondylitis Disease Activity Score), graf 2 [6].
V terapii UC prověřoval účinnost tofacitinibu klinický program OCTAVE, a to v léčbě indukční (OCTAVE Induction 1 a 2) [7] i udržovací (OCTAVE Sustain) [8]. Primárním cílovým ukazatelem OCTAVE Induction bylo dosažení remise v týdnu 8 (graf 3A, B), u OCTAVE Sustain remise v týdnu 52 (graf 3C). Jak zhodnotili přítomní odborníci, také u UC demonstroval tofacitinib velmi rychlý nástup účinku a signifikantní redukci symptomů (frekvence vyprazdňování, krev ve stolici) hlášených pacienty – již v průběhu tří dnů [9]. Do té doby byla taková účinnost léčby nevídaná.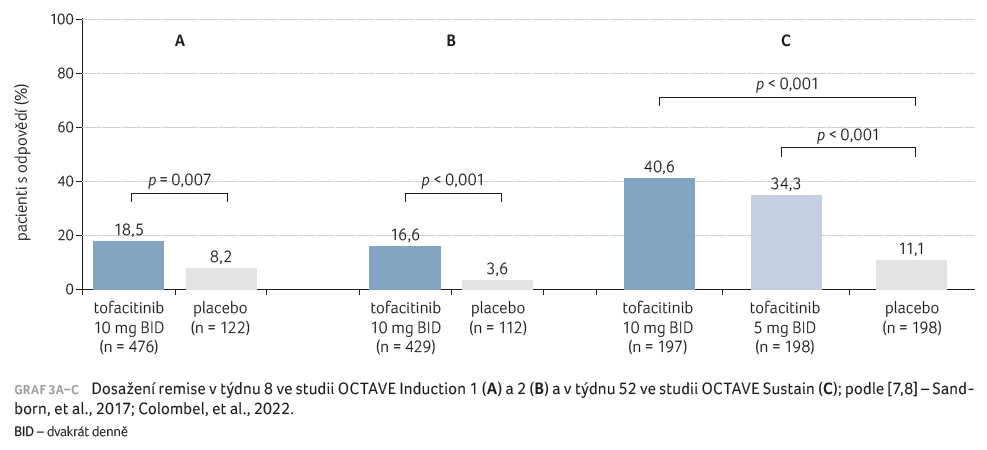
U prezentovaného pacienta Mathewa došlo ke zhoršení stavu, diskutující se shodli, že stav nelze považovat za ztrátu odpovědi na léčbu inhibitorem TNF, ale za rozvoj dalšího, asociovaného onemocnění. Nicméně zabývali se doklady o efektu následné linie léčby dle předléčenosti pacienta. V klinických hodnoceních u AS [10] i UC [7] potvrdila terapie tofacitinibem v porovnání s placebem signifikantní účinnost bez ohledu na předchozí léčbu inhibitory TNF, i když výraznější efekt byl zaznamenán u biologicky tzv. naivních pacientů.
Přítomní odborníci dále poukázali na efekt léčby na kvalitu života pacientů. I v této oblasti přináší léčba tofacitinibem výrazné zlepšení [6,7,11]. Sledovali také redukci míry zánětu dle zobrazovacích metod. Tofacitinib prokázal ve srovnání s placebem u pacientů s AS výraznější potlačení zánětu páteře na magnetické rezonanci [12] a vyšší míru dosažení endoskopické remise u pacientů s UC v týdnu 8 i 52 [13].
V poslední části prezentace se diskutující zaměřili na bezpečnost léčby tofacitinibem. Nežádoucí události zvláštního zájmu byly u tofacitinibu sledovány napříč indikacemi (revmatoidní artritida [RA], PsA, AS a UC). Zaznamenáno bylo zvýšené riziko výskytu herpes zoster, které považují přítomní za řešitelné prostřednictvím vakcinace před zahájením terapie. Dále připomněli studii ORAL Surveillance, která na podkladě obav z kardiovaskulární (KV) bezpečnosti léčby inhibitory JAK záměrně sledovala populaci pacientů „obohacenou“ o rizikové faktory. Do studie porovnávající inhibitor JAK tofacitinib s anti‑TNF terapií mohli být zařazeni pacienti s aktivní RA navzdory léčbě metotrexátem ve věku 50 let nebo starší a s alespoň s jedním dalším KV rizikovým faktorem (současný kuřák cigaret, hypertenze, sérová koncentrace HDL cholesterolu < 40 mg/dl, diabetes mellitus, předčasná ischemická choroba srdeční v rodinné anamnéze, mimokloubní RA, onemocnění koronárních tepen v anamnéze). Výsledky nesplnily kritéria non‑inferiority, riziko velkých kardiovaskulárních příhod (MACE) a malignit bylo zaznamenáno vyšší u tofacitinibu ve srovnání s anti‑TNF přípravkem. Na základě post hoc analýzy pak byly identifikovány subpopulace pacientů, u nichž bylo zaznamenáno odlišné riziko výskytu MACE a malignit oproti inhibitorům TNF. Jako rizikové faktory byly zjištěny věk ≥ 65 let a kouření [14], a u takových pacientů je tedy léčba ke zvážení. Profesor Behrens zdůraznil, že populaci pacientů s AS tvoří často mladí pacienti a tento aspekt léčby zde vyvstává s daleko menší naléhavostí. Navíc doporučené postupy pro léčbu předkládají jasná pravidla pro použití jednotlivých lékových skupin. Pacienti trpící UC mají obecně vyšší KV riziko, nicméně analýza Schreibera a kol. ve shodě s předešlým prokázala potenciální souvislosti mezi výchozím KV rizikem a MACE u pacientů s UC, což naznačuje, že KV riziko by mělo být v klinické praxi vždy posuzováno individuálně [15].
Výběr pacienta s revmatoidní artritidou pro léčbu tofacitinibem
Druhé sympozium společnosti Pfizer se zaměřilo na RA a dalo si za cíl zdůraznit množství údajů z klinických studií i dat z reálného prostředí pro tofacitinib a jejich hodnotu pro jejich použití jako pomoc při výběru vhodného pacienta. Jako diskutující se sešli revmatoložka Francesca Spinelli (Sapienza University of Roma, Itálie), nám již známá profesorka Janet Pope (University of Western Ontario, Kanada) a profesor James Galloway (Centre for Rheumatic Diseases King᾿s College, Londýn, Spojené království).
Prezentovány byly dvě modelové pacientky. První byla 36letá Elizabeth, která má malého syna. Dosud nestonala, nekouří, nemá žádné rizikové faktory. Diagnóza RA u ní byla stanovena před čtyřmi lety. Léčena byla doposud metotrexátem, nyní došlo ke zhoršení bolestí a k několika vzplanutím nemoci. Pacientka vede aktivní život, v léčbě by upřednostila perorální lékovou formu, která by ji neomezovala. Druhou pacientkou byla Ines, 62 let, diagnóza RA u ní byla stanovena před 12 lety. Za tu dobu vystřídala řadu léčebných modalit, ale dosud se nepodařilo najít takovou, která by u ní dobře působila. Nekouří, má index tělesné hmotnosti (BMI) 29 kg/m2, léčí se s astmatem. Také u ní došlo recentně ke zhoršení stavu.
Profesor Galloway zdůraznil, že prevalence RA v populaci roste a neléčené onemocnění má významné důsledky na mortalitu i morbiditu pacientů, zkracuje délku života i zhoršuje jeho kvalitu. Připomněl klinická hodnocení s tofacitinibem u RA. Monoterapie tofacitinibem (studie ORAL Solo) vedla u pacientů s aktivní RA a nedostatečnou odpovědí na antirevmatické léky modifikující onemocnění (DMARDs) ke snížení výskytu známek a symptomů RA a zlepšení fyzických funkcí s rychlým nástupem účinku již ve druhém týdnu [16]. Dlouhodobá data z extenzí klinických studií dokládají udržení efektu léčby po dobu až osmi let [17]. Signifikantní podíl dosažení remise byl zaznamenán při léčbě tofacitinibem v měsíci 3, a to i u pacientů s neadekvátní odpovědí na inhibitory TNF [18].
Data z reálného klinického prostředí (RWE) doplňují doklady o účinnosti a bezpečnosti z randomizovaných klinických studií (RCT), jež poskytují kvalitnější obraz díky porovnání obdobných skupin pacientů ve sledovaných parametrech, ale rozdílně léčených, nicméně tzv. real‑world data poskytnou obraz o léčbě u celého širokého spektra pacientů. RCT zůstávají zlatým standardem pro získání kvalitních, ale krátkodobých dat o účinnosti a bezpečnosti léčby, RWE pak dokreslují tento obraz o dlouhodobá data u skutečné populace pacientů. Jednou z takových prací je post hoc analýza studie, která extrahovala data u pacientů léčených tofacitinibem nebo biologickými DMARDs (bDMARDs) z australského registru OPAL‑QUMI. Dosažení míry remise bylo mezi skupinami srovnatelné, ať už se jednalo o monoterapii, nebo o kombinační léčbu [19]. Další pohled na léčbu tofacitinibem v reálném prostředí přináší práce Finckha [20] porovnávající tuto léčbu s inhibitory TNF a bDMARDs s jiným mechanismem účinku. Pravděpodobnost setrvání na léčbě až po dobu tří let byla u pacientů léčených tofacitinibem oproti dalším skupinám signifikantně vyšší.
Na doklady o bezpečnosti léčby tofacitinibem se zaměřila doktorka Spinelli. Zmínila konzistentní bezpečnostní profil doložený napříč indikacemi [21,22] i výše zmíněnou studii ORAL Surveillance [14]. Na základě jejích výsledků Evropská léková agentura po doporučení výboru PRAC schválila bezpečnostní opatření týkající se celé skupiny inhibitorů JAK ohledně jejich použití u rizikových skupin pacientů (věk ≥ 65 let, dlouhodobé aktivní kouření nebo dlouhodobé kuřáctví v anamnéze, anamnéza aterosklerotického KV onemocnění, KV rizikové faktory nebo rizikové faktory pro malignity). Tito pacienti by měli být léčeni inhibitory JAK pouze při nevhodnosti jiné léčebné modality. Nicméně u pacientů mladších 65 let, kteří nikdy nekouřili, nebylo zvýšené riziko příhod (MACE ani malignit) detekováno (graf 4A–C) [14]. A je třeba zmínit, že pacienti s anamnézou aterosklerotického KV onemocnění mají obecně vyšší relativní riziko MACE v dalších 10 letech.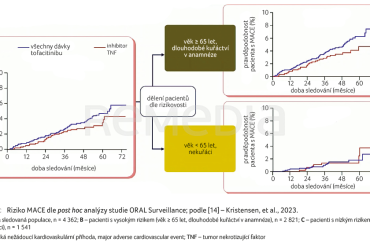
Bezpečnostní signály, které vzešly ze studie ORAL Surveillance, byly zkoumány následně také v reálném prostředí. Studie STAR‑RA nenašla důkazy o zvýšeném riziku malignit u sledovaných pacientů ve věku ≥ 18 let léčených tofacitinibem v reálných podmínkách [23]. Co se týče KV příhod, bylo zaznamenáno numericky vyšší, ovšem statisticky nevýznamné riziko KV příhod u starších (≥ 50 let) pacientů s RA s alespoň jedním KV rizikovým faktorem [24].
Diskutující odborníci se zamysleli nad pacientkami prezentovanými v úvodu. U Elizabeth není žádná překážka k indikaci inhibitoru JAK, Ines je starší, trpí nadváhou, ale další KV rizikový faktor nemá. Došlo u ní k selhání vícero předchozích léčebných modalit. Nabízí se tedy odlišný, nový mechanismus účinku pro léčbu. Přednášející zdůraznili, že vždy musí jít o rozhodnutí sdílené s pacientem (způsob podání, rychlost účinku, zvážení rizik), jakési vybalancování přínosů a rizik při aktuálně již širokých léčebných možnostech. Každá terapie přináší určitá rizika, která je třeba s pacientem probrat a zvážit jejich klinickou relevanci.
Literatura
[1] Evans J, Sapsford M, McDonald S, et al. Prevalence of axial spondyloarthritis in patients with inflammatory bowel disease using cross‑sectional imaging: a systematic literature review. Ther Adv Musculoskelet Dis 2021;13:1759720X21996973.
[2] Shrestha S, Brand JS, Järås J, et al. Association Between Inflammatory Bowel Disease and Spondyloarthritis: Findings from a Nationwide Study in Sweden. J Crohns Colitis 2022; 16: 1540–1550.
[3] Stolwijk C, van Tubergen A, Castillo‑Ortiz JD, Boonen A. Prevalence of extra‑articular manifestations in patients with ankylosing spondylitis: a systematic review and meta‑analysis. Ann Rheum Dis 2015; 74: 65–73.
[4] Felice C, Dal Buono A, Gabbiadini R. Cytokines in Spondyloarthritis and Inflammatory Bowel Diseases: From Pathogenesis to Therapeutic Implications. Int J Mol Sci 2023; 24: 3957.
[5] Fragoulis GE, Liava C, Daoussis D, et al. Inflammatory bowel diseases and spondyloarthropathies: From pathogenesis to treatment. World J Gastroenterol 2019; 25: 2162–2176.
[6] Deodhar A, Sliwinska‑Stanczyk P, Xu H, et al. Tofacitinib for the treatment of ankylosing spondylitis: a phase III, randomised, double‑blind, placebo‑controlled study. Ann Rheum Dis 2021; 80: 1004–1013.
[7] Sandborn WJ, Su C, Sands BE, et al. Tofacitinib as Induction and Maintenance Therapy for Ulcerative Colitis. N Engl J Med 2017; 376: 1723–1736.
[8] Colombel JF, Osterman MT, Thorpe AJ, et al. Maintenance of Remission With Tofacitinib Therapy in Patients With Ulcerative Colitis. Clin Gastroenterol Hepatol 2022; 20: 116–125.e5.
[9] Hanauer S, Panaccione R, Danese S, et al. Tofacitinib Induction Therapy Reduces Symptoms Within 3 Days for Patients With Ulcerative Colitis. Clin Gastroenterol Hepatol 2019; 17: 139–147.
[10] Deodhar A, Marzo‑Ortega H, Wu J, et al. Tofacitinib Efficacy and Safety in Patients With Ankylosing Spondylitis by Prior Biologic Disease‑Modifying Antirheumatic Drug Use: A Post Hoc Analysis. ACR Open Rheumatol 2023; 5: 632–643.
[11] Navarro‑Compán V, Wei JC, van den Bosch F, et al. Effect of tofacitinib on pain, fatigue, health‑related quality of life and work productivity in patients with active ankylosing spondylitis: results from a phase III, randomised, double‑blind, placebo‑controlled trial. RMD Open 2022; 8: e002253.
[12] Østergaard M, Wu J, Fallon L, et al. Tofacitinib Reduces Spinal Inflammation in Vertebral Bodies and Posterolateral Elements in Ankylosing Spondylitis: Results from a Phase 2 Trial. Rheumatol Ther 2023; 10: 1001–1020.
[13] Feagan BG, Khanna R, Sandborn WJ, et al. Agreement between local and central reading of endoscopic disease activity in ulcerative colitis: results from the tofacitinib OCTAVE trials. Aliment Pharmacol Ther 2021; 54: 1442–1453.
[14] Kristensen LE, Danese S, Yndestad A, et al. Identification of two tofacitinib subpopulations with different relative risk versus TNF inhibitors: an analysis of the open label, randomised controlled study ORAL Surveillance. Ann Rheum Dis 2023; 82: 901–910.
[15] Schreiber S, Rubin DT, Siew CN, et al. Major Adverse Cardiovascular Events by Baseline Cardiovascular Risk in Patients with Ulcerative Colitis Treated with Tofacitinib: Data from the OCTAVE Clinical Programme. J Crohns Colitis 2023; 17: 1761–1770.
[16] Fleischmann R, Kremer J, Cush J, et al. Placebo‑controlled trial of tofacitinib monotherapy in rheumatoid arthritis. N Engl J Med 2012; 367: 495–507.
[17] Wollenhaupt J, Lee EB, Curtis JR, et al. Safety and efficacy of tofacitinib for up to 9.5 years in the treatment of rheumatoid arthritis: final results of a global, open‑label, long‑term extension study. Arthritis Res Ther 2019; 21: 89.
[18] Smolen JS, Aletaha D, Gruben D, et al. Brief Report: Remission Rates With Tofacitinib Treatment in Rheumatoid Arthritis: A Comparison of Various Remission Criteria. Arthritis Rheumatol 2017; 69: 728–734.
[19] Bird P, Littlejohn G, Butcher B, et al. Real‑world evaluation of effectiveness, persistence, and usage patterns of monotherapy and combination therapy tofacitinib in treatment of rheumatoid arthritis in Australia. Clin Rheumatol 2022; 41: 53–62.
[20] Finckh A, Tellenbach C, Herzog L, et al. Comparative effectiveness of antitumour necrosis factor agents, biologics with an alternative mode of action and tofacitinib in an observational cohort of patients with rheumatoid arthritis in Switzerland. RMD Open 2020; 6: e001174.
[21] Burmester GR, Nash P, Sands BE, et al. Adverse events of special interest in clinical trials of rheumatoid arthritis, psoriatic arthritis, ulcerative colitis and psoriasis with 37 066 patient‑years of tofacitinib exposure. RMD Open 2021; 7: e001595.
[22] Mease P, Charles‑Schoeman C, Cohen S, et al. Incidence of venous and arterial thromboembolic events reported in the tofacitinib rheumatoid arthritis, psoriasis and psoriatic arthritis development programmes and from real‑world data. Ann Rheum Dis 2020; 79: 1400–1413.
[23] Khosrow‑Khavar F, Desai RJ, Lee H, et al. Tofacitinib and Risk of Malignancy: Results From the Safety of Tofacitinib in Routine Care Patients With Rheumatoid Arthritis (STAR‑RA) Study. Arthritis Rheumatol 2022; 74: 1648–1659.
[24] Khosrow‑Khavar F, Kim SC, Lee H, et al. Tofacitinib and risk of cardiovascular outcomes: results from the Safety of TofAcitinib in Routine care patients with Rheumatoid Arthritis (STAR‑RA) study. Ann Rheum Dis 2022; 81: 798–804.