Setrvalá účinnost a bezpečnost asciminibu po téměř čtyřech letech sledování ve studii ASCEMBL
Následující text přináší data prezentovaná na loňském 65. výročním sjezdu Americké hematologické společnosti (ASH). Klinická studie fáze III ASCEMBL hodnotila účinnost a bezpečnost asciminibu oproti bosutinibu u pacientů s chronickou myeloidní leukemií v chronické fázi po předchozí léčbě tyrozinkinázovými inhibitory.
Onemocnění chronickou myeloidní leukemií (CML) vyžaduje dlouhodobou terapii s důrazem na léčivé přípravky, které se vyznačují vysokou a trvalou účinností a nízkou zátěží nežádoucími účinky (adverse events, AEs). Asciminib, první inhibitor BCR::ABL1 (dle mechanismu účinku tzv. STAMP – Specifically Targeting the ABL Myristoyl Pocket), prokázal v klinické studii fáze III ASCEMBL významně větší účinnost a bezpečnost ve srovnání s bosutinibem u pacientů v chronické fázi CML (CML‑CP), kteří byli dříve léčeni dvěma nebo více tyrozinkinázovými inhibitory (TKI). Míra tzv. velké molekulární odpovědi (major molecular response, MMR) byla 25,5 % v rameni s asciminibem ve srovnání s 13,2 % v rameni s bosutinibem ve 24. týdnu sledování, bylo tedy dosaženo primárního cílového ukazatele [1]. V 96. týdnu bylo dosaženo klíčového sekundárního cílového ukazatele – MMR pro asciminib 37,6 % vs. pro bosutinib 15,8 % [2]. Navzdory delšímu trvání expozice asciminibu zůstala bezpečnost/snášenlivost léčby konzistentně lepší u asciminibu oproti bosutinibu, přičemž bylo pozorováno méně AEs všech stupňů a stupně ≥ 3 a AEs vedoucích k přerušení podávání studijní medikace.
Po střední době sledování 3,7 roku jsou uvedeny aktualizované výsledky z konce studie ASCEMBL (end of study treatment, EOS Tx; mezní termín [cut‑off] 22. března 2023). Zároveň jsou prezentována také první dostupná data od pacientů, u nichž došlo k selhání při léčbě bosutinibem a přešli k terapii asciminibem [3].
Metody
Dospělí (ve věku ≥ 18 let) s CML‑CP po předchozí léčbě dvěma nebo více TKI, s intolerancí nebo nedostatečnou účinností této léčby podle doporučení European LeukemiaNet (ELN) z roku 2013, byli randomizováni v poměru 2 : 1 k podávání asciminibu v dávce 40 mg dvakrát denně, nebo bosutinibu v dávce 500 mg jednou denně. Pacienti, kteří splnili kritéria pro selhání studijní medikace podle ELN 2013 při léčbě bosutinibem, mohli přejít k terapii asciminibem a byli analyzováni samostatně. Pacienti, kteří přerušili léčbu bosutinibem kvůli intoleranci, nemohli přejít k terapii asciminibem. Konec studie je stanoven pět let od okamžiku, kdy poslední zařazený pacient obdržel první dávku studijní medikace.
Výsledky
Celkem 233 pacientů bylo randomizováno k podávání asciminibu (n = 157) nebo bosutinibu (n = 76). Nejčastějším důvodem přerušení léčby byla nedostatečná účinnost – u 40 (25,5 %) pacientů léčených asciminibem a u 28 (36,8 %) pacientů léčených bosutinibem. V době cut‑off EOS Tx probíhala studijní léčba asciminibem a bosutinibem u 77 (49,4 %), resp. 8 (10,5 %) pacientů. Nemocní, u nichž byl zaznamenán prospěch ze studijní medikace v průběhu EOS Tx, měli podle hodnocení investigátora přístup ke studijní léčbě i po skončení studie.
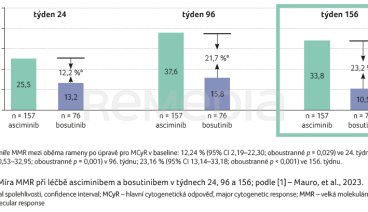 Míra MMR ve 156. týdnu byla nadále vyšší u asciminibu (33,8 %) oproti bosutinibu (10,5 %), graf 1 [3]. Rozdíl po úpravě pro hlavní cytogenetickou odpověď (major cytogenetic response, MCyR) při výchozím stavu (baseline) byl 23,2 % (95% interval spolehlivosti [CI] 13,1–33,2 %; oboustranné p < 0,001). Míra BCR::ABL1IS ≤ 1 % ve 156. týdnu u pacientů bez této úrovně odpovědi v baseline byla také nadále vyšší u asciminibu (43,0 %) v porovnání s bosutinibem (11,1 %).
Míra MMR ve 156. týdnu byla nadále vyšší u asciminibu (33,8 %) oproti bosutinibu (10,5 %), graf 1 [3]. Rozdíl po úpravě pro hlavní cytogenetickou odpověď (major cytogenetic response, MCyR) při výchozím stavu (baseline) byl 23,2 % (95% interval spolehlivosti [CI] 13,1–33,2 %; oboustranné p < 0,001). Míra BCR::ABL1IS ≤ 1 % ve 156. týdnu u pacientů bez této úrovně odpovědi v baseline byla také nadále vyšší u asciminibu (43,0 %) v porovnání s bosutinibem (11,1 %).
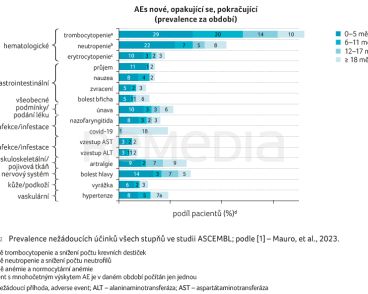 Navzdory delšímu mediánu trvání (rozsahu) expozice asciminibu (156,0 [0,1–256,3] týdne) vs. bosutinibu (30,5 [1,0–239,3] týdne) byla bezpečnost/snášenlivost asciminibu nadále lepší ve srovnání s bosutinibem a výsledky byly konzistentní s předchozími analýzami. U dvou nových pacientů se vyskytly AEs, které vedly k přerušení podávání studijní medikace od 96. týdne cut‑off (u jedné pacientky léčené asciminibem bylo hlášeno těhotenství; jeden pacient léčený bosutinibem hlásil průjem), a četnost AEs zůstala nižší ve skupině s asciminibem oproti bosutinibu (8,3 % vs. 27,6 %). Nejčastějšími (≥ 10 %) AEs stupně ≥ 3 při léčbě asciminibem vs. bosutinibem byly trombocytopenie (22,4 % vs. 9,2 %), neutropenie (18,6 % vs. 14,5 %), průjem (0 % vs 10,5 %) a zvýšená hodnota alaninaminotransferázy (0,6 % vs. 14,5 %). Většina AEs se objevila během prvních šesti měsíců (graf 2) [3]. Míra výskytu arteriálních okluzí upravená s ohledem na expozici u pacientů léčených asciminibem se snížila od 96. týdne cut‑off z 3,0 na 2,2/100 pacientoroků a ve skupině s asciminibem se neobjevily žádné nové arteriální okluze, což naznačuje, že riziko jejich vzniku se v průběhu času nezvyšovalo. Mezi pacienty, kteří přerušili studijní medikaci z důvodu nedostatečné účinnosti léčby nebo progrese onemocnění, se od 96. týdne cut‑off neobjevily žádné nové mutace.
Navzdory delšímu mediánu trvání (rozsahu) expozice asciminibu (156,0 [0,1–256,3] týdne) vs. bosutinibu (30,5 [1,0–239,3] týdne) byla bezpečnost/snášenlivost asciminibu nadále lepší ve srovnání s bosutinibem a výsledky byly konzistentní s předchozími analýzami. U dvou nových pacientů se vyskytly AEs, které vedly k přerušení podávání studijní medikace od 96. týdne cut‑off (u jedné pacientky léčené asciminibem bylo hlášeno těhotenství; jeden pacient léčený bosutinibem hlásil průjem), a četnost AEs zůstala nižší ve skupině s asciminibem oproti bosutinibu (8,3 % vs. 27,6 %). Nejčastějšími (≥ 10 %) AEs stupně ≥ 3 při léčbě asciminibem vs. bosutinibem byly trombocytopenie (22,4 % vs. 9,2 %), neutropenie (18,6 % vs. 14,5 %), průjem (0 % vs 10,5 %) a zvýšená hodnota alaninaminotransferázy (0,6 % vs. 14,5 %). Většina AEs se objevila během prvních šesti měsíců (graf 2) [3]. Míra výskytu arteriálních okluzí upravená s ohledem na expozici u pacientů léčených asciminibem se snížila od 96. týdne cut‑off z 3,0 na 2,2/100 pacientoroků a ve skupině s asciminibem se neobjevily žádné nové arteriální okluze, což naznačuje, že riziko jejich vzniku se v průběhu času nezvyšovalo. Mezi pacienty, kteří přerušili studijní medikaci z důvodu nedostatečné účinnosti léčby nebo progrese onemocnění, se od 96. týdne cut‑off neobjevily žádné nové mutace.
Z 28 pacientů, kteří přerušili léčbu bosutinibem z důvodu nedostatečné účinnosti, jich 25 přešlo k terapii asciminibem. Téměř všichni pacienti, kteří přešli na léčbu asciminibem (96 %), měli před switchem v baseline BCR::ABL1IS > 10 %. Žádný z pacientů se switchem nedosáhl MMR do 48. týdne nebo ve 48. týdnu po přechodu. Ve 48. týdnu však 24 % pacientů dosáhlo BCR::ABL1IS ≤ 10 % a 8 % pacientů BCR::ABL1IS ≤ 1 %. Bezpečnostní profil asciminibu u pacientů se switchem byl konzistentní s profilem u pacientů, kteří dostávali asciminib od randomizace. Nejčastějšími AEs (≥ 10 %) stupně ≥ 3 byly neutropenie (32,0 %) a trombocytopenie (24,0 %). AEs vedoucí k přerušení podávání studijní medikace se vyskytly u 8,0 % pacientů, kteří přešli k terapii asciminibem.
Závěr
V téměř čtyřletém klinickém sledování ASCEMBL asciminib nadále vykazoval vyšší účinnost a lepší bezpečnost/snášenlivost ve srovnání s bosutinibem u pacientů s CML‑CP po předchozí léčbě dvěma nebo více TKI. Dobrý bezpečnostní profil asciminibu prokázaly všechny analýzy studie ASCEMBL (24. týden, 96. týden a EOS Tx), což potvrzuje, že u pacientů léčených asciminibem může být zachována vysoká úroveň odpovědi a mohou pokračovat v této léčbě, aniž by prodělali pozdě se objevující AEs. Data z populace pacientů se switchem potvrzují význam strategie časného zahájení léčby asciminibem. Výsledky analýzy ASCEMBL EOS Tx nadále silně podporují asciminib [4] jako terapii volby pro pacienty se suboptimální odpovědí na léčbu předchozími dvěma či více TKI a/nebo s její intolerancí.
Literatura
[1] Réa D, Mauro MJ, Boquimpani C, et al. A phase 3, open‑label, randomized study of asciminib, a STAMP inhibitor, vs bosutinib in CML after 2 or more prior TKIs. Blood 2021; 138: 2031–2041.
[2] Hochhuas A, Réa D, Boquimoani C, et al. Asciminib vs bosutinib in chronic‑phase chronic myeloid leukemia previously treated with at least two tyrosine kinase inhibitors: longer‑term follow‑up of ASCEMBL. Leukemia 2023; 37: 617–626.
[3] Mauro M, Minami Y, Hochhaus A, et al. Sustained Efficacy and Safety with Asciminib (ASC) after Almost 4 Years of Median Follow‑up from Ascembl, a Phase 3 Study of ASC Vs Bosutinib (BOS) in Patients (Pts) with Chronic Myeloid Leukemia in Chronic Phase (CML‑CP) after ≥2 Prior Tyrosine Kinase Inhibitors (TKIs): An End of Study Treatment (EOS Tx) Update, Including Results from Switch Population. 65th ASH Annual Meeting and Exposition, December 9–12, 2023, San Diego, California. Poster Number 4536.
[4] Souhrn údajů o přípravku Scemblix. 2023. Dostupné na: https://www.sukl.cz