Úspěšná léčba závažné psoriázy sekukinumabem u pacienta s roztroušenou sklerózou
Souhrn:
Nečas M. Úspěšná léčba závažné psoriázy sekukinumabem u pacienta s roztroušenou sklerózou. Remedia 2022; 32: 38–42.
Psoriáza může být asociována s řadou dalších onemocnění včetně roztroušené sklerózy (RS). Léčba psoriázy u pacientů s RS a naopak léčba RS u psoriatiků s sebou může přinášet určitá úskalí, která je dobré znát. Kazuistika popisuje případ pacienta s psoriázou, u něhož se manifestovala RS v průběhu léčby etanerceptem a bylo poměrně náročné sladit zde léčbu tak, aby působila příznivě na obě onemocnění. To se nakonec podařilo díky sekukinumabu.
Summary:
Necas M. Successful treatment of severe psoriasis with secukinumab in a patient with multiple sclerosis. Remedia 2022; 32: 38–42.
Psoriasis can be associated with several other diseases, including multiple sclerosis (MS). Treatment of psoriasis in patients with MS and, conversely, treating MS in psoriatic patients can encounter certain pitfalls that are good to know. The case report describes a patient with psoriasis who developed multiple sclerosis during treatment with etanercept. It was relatively difficult to harmonise the treatment to be beneficial in both diseases, achieved thanks to secukinumab.
Key words: psoriasis, multiple sclerosis, secukinumab
Úvod
Psoriáza bývá spojena s řadou komorbidit, jako jsou psoriatická artritida, idiopatická zánětlivá onemocnění střev, ankylozující spondylitida, autoimunitní uveitida či episkleritida a onemocnění spojená s metabolickým syndromem. U psoriatiků také častěji vídáme roztroušenou sklerózu (RS), i když dosud není zcela jasné, zda je možné ji považovat přímo za komorbiditu, nebo spíše jen za asociované onemocnění. V každém případě se ale RS vyskytuje častěji u psoriatiků než v běžné populaci, zatímco pacienti s RS mívají častěji psoriázu oproti běžné populaci. U takovýchto pacientů je dobré vědět, že některé léky používané k léčbě jednoho onemocnění mohou vyprovokovat či zhoršit onemocnění druhé (např. anti TNF přípravky v léčbě psoriázy mohou vyprovokovat RS a naopak interferon beta či biologika natalizumab, rituximab nebo okrelizumab, používaná v léčbě RS, mohou vyvolat či zhoršit lupénku). Kazuistika popisuje případ pacienta s psoriázou, u kterého se manifestovala RS v průběhu léčby etanerceptem a bylo poměrně náročné sladit zde léčbu tak, aby působila příznivě na obě onemocnění. To se nakonec podařilo díky sekukinumabu.
Popis případu
Jedná se o 47letého muže, který trpí psoriázou s kloubním postižením již od svých 18 let. Z dalších onemocnění se pacient léčí pro lumboischialgický syndrom, má lehkou hepatopatii a opakovaně hyperglykemii k došetření. V rodinné anamnéze je zajímavý údaj, že otec pacienta zemřel v 61 letech na nádor na mozku (blíže neví), matka má zřejmě psoriázu ve kštici, ale nikde se neléčí.
V době převzetí do naší péče pacient užíval pouze občas analgetika na bolesti páteře, vitaminy skupiny B a také Wobenzym. Alergie neguje, nekouří asi od roku 2012, alkohol ani kávu již nepije vůbec. Měří 182 cm a váží kolem 88 kg. Je v plném invalidním důchodu a žije sám.
Vzhledem k progresi kožního onemocnění u něj byla v roce 2013 na jiném dermatologickém pracovišti zahájena biologická léčba namířená proti tumor nekrotizujícímu faktoru alfa (anti TNFα) – pacientovi začal být podáván etanercept v kombinaci s metotrexátem. Tato terapie vedla k úplnému vyhojení psoriatických ložisek – tedy k dosažení plné remise kožního onemocnění. Nicméně koncem roku 2016 byla u pacienta diagnostikována RS, a proto byla léčba etanerceptem i metotrexátem ukončena. K léčbě RS byl neurology zvolen natalizumab, rekombinantní humanizovaná protilátka proti α4 podjednotce α4β1 integrinu (Tysabri). Ten sice zmírnil symptomy RS, ale do půl roku došlo k relapsu psoriázy s progresí až do generalizace.
Proto byl pacient v říjnu 2017
hospitalizován na naší klinice, kde byla zavedena intenzivní
lokální terapie, která však měla pouze částečný efekt
se skóre PASI (Psoriasis Area and Severity Index) kolem 12
(obr. 1A–C). Další léčebné možnosti tedy byly
konzultovány s ošetřujícím neurologem, který nedoporučil
návrat k terapii metotrexátem. Proti léčbě apremilastem
(perorální inhibitor fosfodiestrázy 4) naopak neurolog neměl
námitky, a proto byla 18. října 2017 zahájena léčba
tímto přípravkem (Otezla) v běžném dávkovacím schématu.
Po čtyřech měsících léčby (únor 2018) bylo patrné mírné
zlepšení kožního nálezu (PASI 6,5; index BSA [Body Surface Area]
12 %). Neurologové ukončili léčbu natalizumabem pro
nedostatečný efekt, což jsme uvítali, protože je známo, že
natalizumab může zhoršovat psoriázu. Z neurologického
hlediska byla zvažována léčba RS alemtuzumabem spíše než
fumaráty či fingolimodem, které by dle neurologů u pacienta
zřejmě neměly dostatečný účinek. Léčba alemtuzumabem však
bohužel nebyla schválena revizním lékařem a do medikace
byl v červenci 2018 opět navrácen natalizumab. To vedlo
pochopitelně ke zhoršení psoriázy s nárůstem skóre
PASI na 14,8 a BSA na 15 % i přes pokračující
léčbu apremilastem. V únoru 2019 byla léčba natalizumabem
ukončena pro nález vysokého titru protilátek proti JCV (John
Cunningham virus), který může vyvolat progresivní multifokální
leukoencefalopatii. Po konzultaci s klinickým farmakologem
neurologové rozhodli o léčbě fingolimodem (Gilenya). K té
však nakonec nebylo přistoupeno pro kardiologický nález (srdeční
arytmie). Co se týče lupénky, ta se sice po ukončení léčby
natalizumabem zmírnila (PASI kolem 9, BSA kolem 15 %), ale
rozhodně se nejednalo o uspokojivý stav.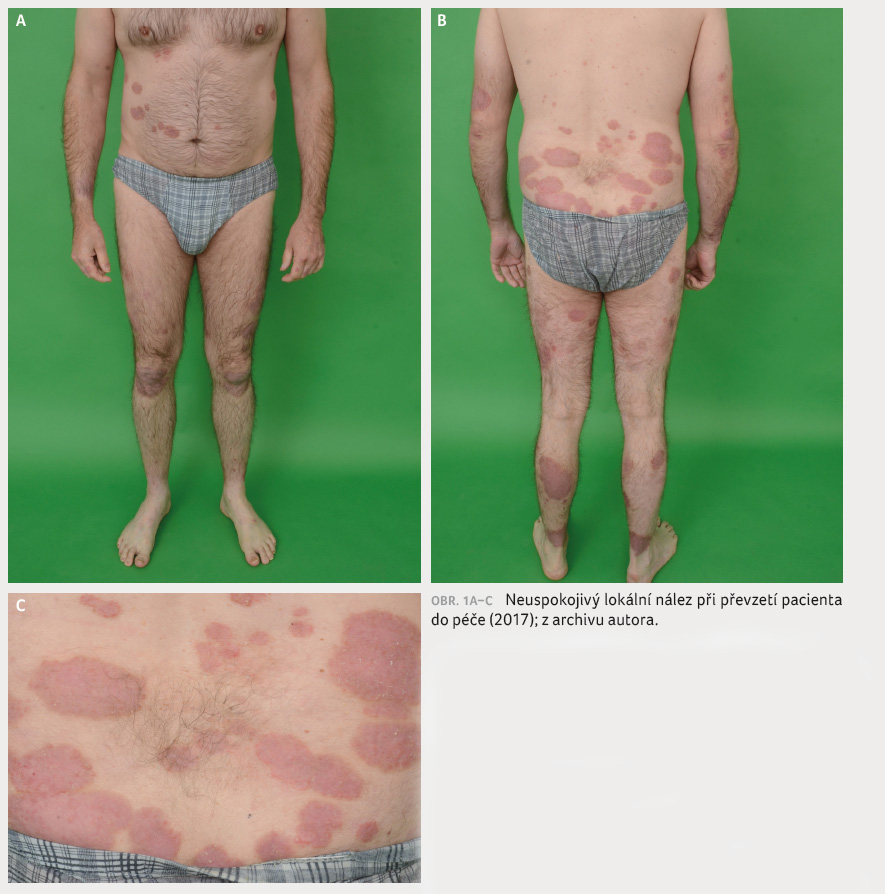
Začátkem října 2019 byla navíc neurology zahájena léčba monoklonální protilátkou proti znaku CD20 okrelizumabem (Ocrevus), z čehož jsme nebyli příliš nadšeni. Existují totiž literární údaje o možném negativním vlivu na psoriázu, což se také u našeho pacienta stalo (nárůst skóre PASI v průběhu první poloviny roku 2020 na hodnoty kolem 12), navíc se zhoršily pacientovy bolesti kloubů, zejména kotníků a kolen, a také se přidružily otoky kotníků. Bylo jasné, že bude potřeba zvolit nějakou razantnější terapii psoriázy, než je apremilast, ale zároveň takovou, která nebude mít negativní dopad na pacientovo neurologické onemocnění.
Nakonec jsme se rozhodli pro
sekukinumab a 7. října 2020 jsme zahájili léčbu tímto
přípravkem (Cosentyx) ve standardním dávkovacím schématu
(před zahájením léčby sekukinumabem dosahovalo PASI 15 a BSA
20 %). Efekt léčby se dostavil velmi rychle. O dva měsíce
později již bylo skóre PASI pouze 3,2 a BSA 5 % (obr. 2A–C), došlo také k výraznému ústupu bolestivosti
kloubů. Dávkovací schéma sekukinumabu jsme mírně modifikovali
s ohledem na souběžnou léčbu okrelizumabem, a to
tak, že pacient vždy po infuzi okrelizumabu (2× ročně)
vynechává jednu aplikaci sekukinumabu. Při poslední kontrole
16. listopadu 2021 byl kožní nález velmi dobrý, zbytkové
projevy byly pouze na lýtkách (PASI 0,8, BSA 2 %). Klouby
pacienta bolí jen minimálně, pouze bederní páteř.
Z neurologického hlediska pokračuje léčba okrelizumabem.
Po podání infuze v červnu 2021 byla další aplikace
okrelizumabu naplánována na 14. prosince 2021.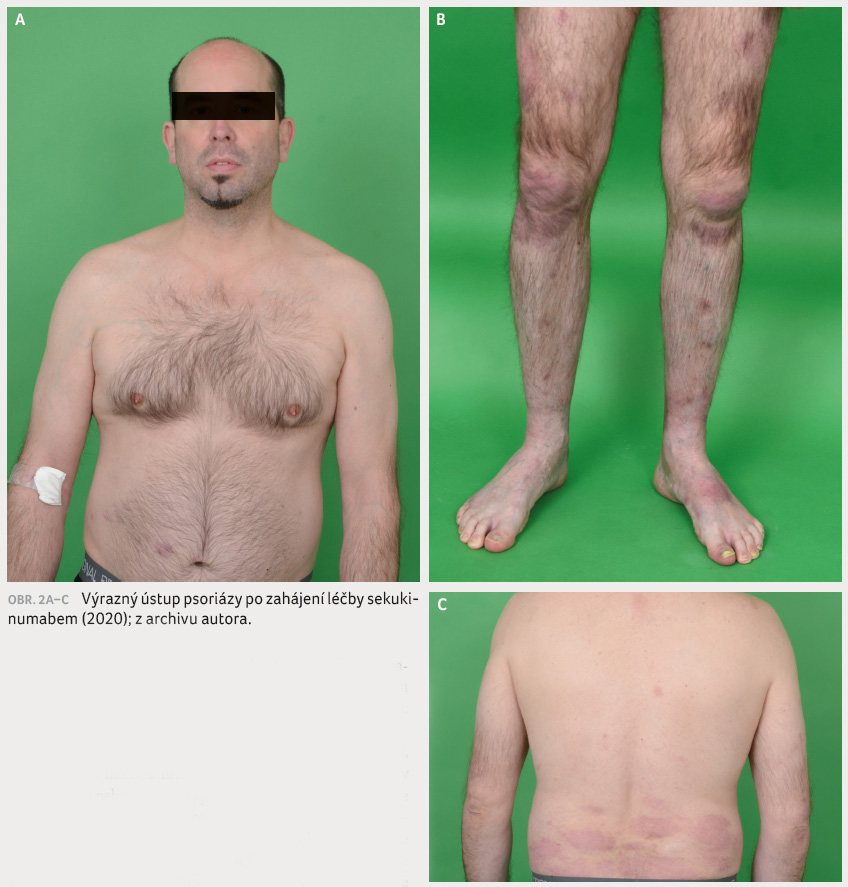
Diskuse
Psoriáza i RS mají určité společné rysy jako například podobné genetické pozadí, autoimunitní podklad nebo obdobné spouštěče. Existuje proto řada léků, které mohou být účinné u obou onemocnění. Jedná se především o deriváty kyseliny fumarové – fumaráty, které se používají již poměrně dlouho v léčbě psoriázy v německy mluvících zemích a ve Skandinávii a nově jsou k dispozici v této indikaci také v České republice [1]. U našeho pacienta byla tato léčba zvažována, ale nakonec neurology zamítnuta pro předpokládaný nedostatečný efekt na RS. Rovněž inhibitory receptorů pro sfingosin fosfát by kromě RS mohly zmírňovat i projevy psoriázy. Jedním z těchto inhibitorů je fingolimod. Jedná se o imunomodulačně působící lék, jehož aktivní metabolit fingolimod 1 fosfát působí jako funkční antagonista receptorů pro sfingosin 1 fosfát (S1P) a vede k zablokování centrálních paměťových T lymfocytů a B lymfocytů v lymfatických uzlinách [2]. Že by fingolimod mohl pozitivně působit i u psoriázy, naznačuje například práce Ji a kolektivu [3]. Léčba fingolimodem byla u našeho pacienta plánována, ale nebylo k ní nakonec přistoupeno pro nález srdeční arytmie.
Další možností, jak účinně postihnout obě onemocnění, by mohly být některé inhibitory fosfodiesterázy (PDE). Ty blokují jeden nebo více podtypů PDE, enzymu, který aktivuje intracelulární cyklický adenosinmonofosfát (cAMP) a cyklický guanosinmonofosfát (cGMP). Dermatologům je dobře znám apremilast, který je schválen k léčbě středně závažné až závažné chronické ložiskové psoriázy [4]. V našem případě však apremilast neprokázal dostatečnou účinnost ani na pacientovu psoriázu, ani na projevy RS.
Velmi zajímavou, ale i potenciálně rizikovou možností léčby obou onemocnění je alemtuzumab, humanizovaná monoklonální protilátka selektivně zaměřená proti povrchovému znaku CD52, který je hojně přítomen na povrchu T a B lymfocytů, monocytů, makrofágů a dendritických buněk [5]. V případě našeho pacienta byla tato možnost také zvažována, ale nebyla nakonec schválena revizním lékařem. Recentně navíc Evropská léková agentura (EMA) přezkoumávala léčivý přípravek Lemtrada (alemtuzumab) a omezila jeho použití v léčbě RS v souvislosti s nově hlášenými případy závažné neutropenie, autoimunitních reakcí (autoimunitní hepatitida) a také případy vzniku hemofagocytární lymfohistiocytózy a kardiovaskulárních komplikací (krvácení do plic, srdeční infarkt, mozková mrtvice a cervikocefalická arteriální disekce) spojených s léčbou tímto přípravkem, a to včetně fatálních případů.
Dalším přípravkem, který je již několik let schválen pro léčbu psoriázy a mohl by být současně účinný u RS, je biologikum sekukinumab, humánní monoklonální protilátka proti IL 17A. Tento interleukin byl totiž identifikován jako potenciální terapeutický cíl i při RS. Analýza vzorků mozkové tkáně pacientů s RS ukázala významně vyšší imunoreaktivitu IL 17 jak u aktivních, tak u chronických forem RS lézí ve srovnání s normální mozkovou tkání [6]. Th17 lymfocyty zaměřené proti myelinu infiltrují centrální nervový systém a uvolňují IL 17A, který působí na astrocyty a prostřednictvím IL 6 zahajuje zánětlivou kaskádu vedoucí k demyelinizaci [7]. Bylo zjištěno, že selektivní inhibice IL 17A snižuje produkci IL 6 a dalších prozánětlivých cytokinů astrocyty [8]. V šestiměsíční placebem kontrolované studii „proof of concept“ u 73 pacientů s relabující remitující formou RS snížila léčba sekukinumabem (10 mg/kg i.v. v týdnech 2, 4, 8, 12, 16 a 20) ve srovnání s placebem významně četnost nových lézí značených gadoliniem (Gd+), což je marker aktivity nemoci, a vedla ke snížené míře relapsů [9]. Extenze této studie a další studie fáze II byly bohužel ukončeny předčasně, nikoliv však kvůli neúčinnosti léčby či z bezpečnostních důvodů [10]. V roce 2016 byla provedena další studie, jejímž cílem bylo zhodnotit vliv léčby sekukinumabem na počet nových aktivních mozkových lézí (prokázaných zobrazením na magnetické rezonanci) u pacientů s relabující remitující formou RS. Pacienti byli randomizováni v poměru 1 : 1 k léčbě sekukinumabem 10 mg/kg nebo k podávání placeba. Ve srovnání s placebem došlo ve skupině pacientů léčených sekukinumabem ke snížení počtu nových Gd+ ložisek RS o 67 %. Autoři uzavírají, že blokáda IL 17A může vést k redukci rozvoje nových mozkových lézí v rámci RS [11]. Recentně Assefa a spolupracovníci popsali případ 42letého muže s nově diagnostikovanou RS a 23letou anamnézou psoriázy (PASI 16,9). Při pulzní kortikoterapii došlo ke zmírnění projevů RS a k poklesu skóre PASI o 75 %, ale po nasazení interferonu nastal relaps psoriázy a objevily se bolesti kloubů. Přes zahájení systémové léčby takrolimem nedošlo ke zmírnění psoriázy ani kloubních potíží v rámci RS. Proto byla tato léčba ukončena a byl nasazen ustekinumab, který uvedl psoriázu do remise, nicméně kloubní potíže se zhoršovaly. Pacient byl tedy převeden z ustekinumabu na sekukinumab. To vedlo k poklesu skóre PASI na 0 a také k poklesu bolestivosti kloubů, navíc se nezhoršilo skóre EDSS (Expanded Disability Status Scale) vyjadřující míru disability u pacientů s RS. Autoři uzavírají, že sekukinumab uvedl psoriázu do remise, zmírnil bolestivost kloubů a zastavil progresi RS [12].
Bohužel přes všechny tyto slibné výsledky nebyl nakonec sekukinumab zařazen do léčebného portfolia RS, protože jeho účinnost byla zhruba na úrovni prvoliniové léčby RS a byly již k dispozici ještě účinnější přípravky jako např. okrelizumab a další. U našeho pacienta však sekukinumab osvědčil výborný efekt na psoriázu a v kombinaci s okrelizumabem vedl také k podstatnému zlepšení stavu pacienta s RS. Vzhledem ke kombinaci s okrelizumabem jsme mírně modifikovali dávkovací schéma sekukinumabu (vynechání vždy jedné dávky po aplikaci okrelizumabu), abychom snížili potenciální imunosupresi. Laboratorně ani klinicky se naštěstí žádné komplikace této kombinované léčby nevyskytly.
Závěr
U pacientů se současnou psoriázou a RS musíme být velmi opatrní při volbě terapie, protože řada přípravků určených k léčbě psoriázy může zhoršit RS (např. anti TNF přípravky) a naopak některé léky účinné u RS mohou zhoršit psoriázu (např. interferon beta či natalizumab). U popisovaného případu se nakonec jako optimální ukázala kombinace biologik sekukinumabu a okrelizumabu.
Seznam použité literatury
- [1] Meluzínová E. Dimethyl‑fumarát v léčbě relabující‑remitující formy roztroušené sklerózy. Neurol praxi 2014; 15: 192–96.
- [2] Singer BA. Fingolimod for the treatment of relapsing multiple sclerosis. Expert Rev Neurother 2013; 13: 589– 602.
- [3] Ji M, Xue N, Lai F, et al. Validating a Selective S1P1 Receptor Modulator Syl930 for Psoriasis Treatment. Biol Pharm Bull 2018; 41: 592–596.
- [4] Schafer PH, Parton A, Capone L, et al. Apremilast is a selective PDE4 inhibitor with regulatory effects on innate immunity. Cell Signal 2014; 26: 2016–2029.
- [5] Brown JW, Coles AJ. Alemtuzumab: evidence for its potential in relapsing‑remitting multiple sclerosis. Drug Des Devel Ther 2013; 7: 131–138.
- [6] Tzartos JS, Friese MA, Craner MJ, et al. Interleukin‑17 production in central nervous system‑infiltrating T cells and glial cells is associated with active disease in multiple sclerosis. Am J Pathol 2008; 172: 146–155.
- [7] Jadidi‑Niaragh F, Mirshafiey A. Th17 cell, the new player of neuroinflammatory process in multiple sclerosis. Scand J Immunol 2011; 74: 1–13.
- [8] Elain G, Jeanneau K, Rutkowska A, et al. The selective anti‑IL17A monoclonal antibody secukinumab (AIN457) attenuates IL17A‑induced levels of IL6 in human astrocytes. Glia 2014; 62: 725–735.
- [9] Havrdova E, Belova A, Goloborodko A. Sensitivity analysis of a phase IIa study of secukinumab in relapsing remitting multiple sclerosis. [abstract]. 29th Congress of ECTRIMS Copenhagen, Denmark Mult Scler: 2013.
- [10] NCT01874340. Efficacy and Safety of AIN457 (Secukinumab) in Patients With Relapsing Multiple Sclerosis. Dostupné na: https://clinicaltrials.gov/ct2/show/NCT01874340.
- [11] Havrdová E, Belova A, Goloborodko A, et al. Activity of secukinumab, an anti‑IL‑17A antibody, on brain lesions in RRMS: results from a randomized, proof‑of‑concept study. J Neurol 2016; 263: 1287–1295.
- [12] Assefa GT, Kaneko S, Oguro H, Morita E. Treatment of psoriasis and psoriatic arthritis with secukinumab after unsatisfactory response to ustekinumab in multiple sclerosis patient. J Dermatol 2019; 46: e112–e113.