Budeme měnit strategii antikoagulační léčby?
Souhrn:
Bultas J. Budeme měnit strategii antikoagulační léčby? Remedia 2022; 32: 274–279.
Dosud užívaná antikoagulancia (inhibitory faktoru Xa, inhibitory trombinu či antivitaminy K) tlumí dominantně společnou cestu koagulace. Vzhledem k tomu, že k nejčastějším indikacím podávání antikoagulancií patří stagnace krve a aktivace reparačně zánětlivých pochodů (při fibrilaci síní či tromboembolické nemoci), se nabízí působit selektivně na tuto vnitřní větev koagulační kaskády a zachovat tak hemostázu iniciovanou poškozením cévní stěny. Nejperspektivnější cestou s nejvíce doklady o účinnosti a bezpečnosti je inhibice faktoru XI. Prověřována je strategie blokády na bázi monoklonálních protilátek (abelacimab a osocimab) či klasickými malými molekulami (asundexian a milvexian) či blokáda syntézy faktoru XI inhibujícími oligonukleotidy typu ASO. V posledních letech tato oblast dospěla do pokročilých fází klinického hodnocení a jsou k dispozici nová zajímavá data.
Summary:
Bultas J. Will we change the strategy of anticoagulation therapy? Remedia 2022; 32: 274–279.
Currently used anticoagulation agents (factor Xa inhibitors, thrombin inhibitors and antivitamin K) dominantly block the common coagulation pathway. The most frequent anticoagulant indication is blood stagnation and activation of reparatory and inflammatory processes (atrial fibrillation or thromboembolic disease). Therefore, a selective influence on the intrinsic pathway of the coagulation cascade is an option so that the hemostasis initiated by blood vessel wall disruption is preserved. The most promising way supported by evidence of efficacy and safety is factor XI inhibition. Other strategies are being investigated – blockade with monoclonal antibodies (abelacimab and osocimab) or classic small molecules (asundexian and milvexian) and factor XI synthesis blockade with inhibitory oligonucleotides called antisense oligonucleotides. In recent years, this area of expertise has reached advanced phases of clinical evaluation, and new exciting data have emerged.
Key words: inhibition of intrinsic coagulation pathway, factor XI inhibitors, factor XII inhibitors, abelacimab, osocimab, asundexian, milvexian
Hemostáza je velmi sofistikovaný
reparační mechanismus primárně sloužící k zástavě
krvácení při poškození cévní stěny. Současně je nutno
omezit rozsah koagula a trvání procesu, tj. v mezích
možností zachovat cirkulaci a perfuzi tkání. Fylogeneticky
je hemostáza velmi starým mechanismem, nepřekvapí proto těsný
vztah k ostatním reparačně zánětlivým pochodům.
Zejména z didaktických důvodů je hemostáza dělena do tří složek – na hemostázu primární – destičkovou, zprostředkovanou aktivací trombocytů s vytvořením destičkového trombu, na hemokoagulaci, tedy koagulační kaskádu, kdy soustava proteáz postupně aktivuje polymerizaci fibrinogenu na fibrinovou síť, a na fibrinolýzu, kdy je soustavou proteáz aktivován plazmin a fibrinová síť je posléze degradována. Funkčně nutno přiřadit k mechanismům stavění krvácení ještě vazokonstrikci, která podpoří zástavu krvácení zejména při krvácení z drobných cév či zpomalením perfuze vytvoří podmínky pro rozvinutí hemostatického procesu.
Destičková hemostáza zprostředkuje rychlou reparaci defektu za podmínek, kdy krevní proud nedovolí účinnou aktivaci koagulační kaskády. Tato primární hemostáza je spouštěna kontaktem trombocytů se subendoteliálními strukturami, zejména s kolagenem. Vazba na kolagen je zprostředkována bivalentními proteiny, zejména von Willebrandovým faktorem. Aktivace trombocytu cirkulujícími působky (adenosin difosfátem, tromboxanem A2, trombinem aj.) či vlastní vazbou na trombogenní povrch vede k vzájemné vazbě trombocytů receptory IIb/IIIa a k expresi fosfolipidů na povrchu destiček, které váží koagulační faktory a o několik řádů zrychlují koagulační kaskádu. Tím je zajištěno, že definitivní fibrinová zátka vzniká preferenčně v místě defektu krytého méně stabilním primárním trombem.
Zatímco destičková hemostáza je spouštěna odhalením subendoteliálních struktur a vazba na ně probíhá i při nepřerušeném krevním proudu, vlastní koagulace se může plně rozvinout pouze při oblenění průtoku, tj. v situaci, kdy dostatečná koncentrace proteáz v koagulační kaskádě umožní amplifikaci celého procesu s vytvořením účinné koncentrace trombinu. Při kontaktu hemostatických faktorů s povrchem nepokrytým endoteliemi, při stagnaci krve či uvolněním tkáňového faktoru nebo kininů při traumatu cévy aktivují vnitřní či vnější cestu koagulace s vytvořením menšího množství trombinu. Tato stále nedostatečná koncentrace ještě nespustí polymerizaci fibrinogenu, ale trombin nejprve aktivuje koagulační faktory ve vyšších etážích, vytvoří se dostatečné množství protrombinového komplexu, dostatečné množství trombinu a celý proces může akcelerovat. Závěrečně jsou působením faktoru XIIIa vlákna fibrinu vzájemně propojena ve fibrinovou síť a trombus je stabilizován.
Na příkladu faktoru XIII je možno demonstrovat zmíněné propojení hemostázy s ostatními defenzivními a reparačními mechanismy. Faktor XIIIa nejen přispívá ke stabilizaci trombu vzájemným propojením fibrinových vláken, ale současně dochází k vazbě fibrinu k tkáním povrchu rány či k povrchovým proteinům stěny bakterie s jejich imobilizací a eliminací. V rámci reparace tak fibrinová síť slouží jako matrix pro proliferaci leukocytů, fibroblastů a dalších buněk do vlastní rány, což usnadňuje hojení např. bércových vředů či vytvoření jizvy po infarktu tkáně. Podobně je aktivní faktor XIIIa podmínkou angiogeneze a reparace tkání. Z této zdaleka ne vyčerpávající ukázky vynikne, jak delikátní jsou zásahy do hemostázy. Neinhibujeme pouze koagulaci, ale často se objeví nečekaný efekt na zcela jiný systém, s nímž nepočítáme. Nepřekvapí, že v preklinických studiích vedla inhibice faktoru XIIIa k vytvoření méněcenné jizvy např. po infarktu myokardu [1]. Tato skutečnost byla důvodem ukončení vývoje inhibitorů faktoru XIIIa jako další možné antikoagulační strategie.
Souhra koagulačních faktorů vede zpravidla k vytvoření trombu a dočasnému zacelení defektu. Další aktivace hemostázy je nežádoucí jak pro riziko trombotických komplikací, tak pro riziko krvácení při vyčerpání proteinů koagulační kaskády, zejména fibrinogenu. Plně rozvinutá koagulační kaskáda, konkrétně aktivace fibrinogenu a tvorba trombinu, je utlumena dvojím mechanismem. Prvním je vazba trombinu s povrchovým receptorem – trombomodulinem. Trombin v komplexu trombin/trombomodulin ztrácí schopnost polymerizovat fibrinogen na vlákna fibrinu. Druhým mechanismem, opět závislým na tomto komplexu, je aktivace proteinů C a S, které ve vzájemné vazbě inaktivují faktory Va a VIIIa a již probíhající koagulaci utlumí. Tím je dosaženo cíle – zástavy krvácení lokálním trombem –, nedojde však k diseminaci procesu mimo poškozenou oblast.
Třetí složka – fibrinolýza – pak slouží k degradaci fibrinové sítě a obnovení průtoku. Rovnováha mezi hemokoagulací a fibrinolýzou rozhoduje o včasném zprůchodnění cévy a snížení rizika rozvoje tkáňového infarktu.
Proč hledat nové cesty antikoagulace?
V současné době antikoagulační léčbu zaměřujeme na tři strategie: inhibici trombinu, inhibici faktoru Xa a inhibici více faktorů současně. Inhibitory trombinu reprezentují heparin (aktivující antitrombin) a dva přímé inhibitory: perorálně působící gatrany (dabigatran) a parenterální hirudiny. Inhibitory faktoru Xa jsou pentasacharidy – fondaparinux (aktivující antitrombin) – a xabany (apixaban, betrixaban, edoxaban a rivaroxaban). Nízkomolekulární hepariny (low molecular weight heparins, LMWH) zprostředkovaně, tj. aktivací antitrombinu, inhibují více faktor Xa, méně trombin. Antivitaminy K (v ČR warfarin) blokují syntézu více faktorů, jimž je společná nutnost karboxylace faktorů vitamin K dependentní karboxylázou (trombin, koagulační faktory VII, IX, X a protein C a S). Tyto dosud užívané antikoagulační strategie s sebou přinášejí i nevýhody. U všech zavedených antikoagulancií dominuje inhibice společné cesty koagulace. To znamená, že potlačujeme hemostázu aktivovanou oběma cestami koagulační kaskády – vnější i vnitřní. Tlumit vnější cestu, aktivovanou uvolněním tkáňového faktoru při poškození cévní stěny, nemusí být vždy výhodné. Setkáváme se s větším rizikem významného krvácení. Pokud bychom selektivně blokovali jen vnitřní cestu, aktivovanou kontaktem s trombogenním povrchem či zpomalením průtoku krve, je předpoklad snížení rizika těchto hemoragických komplikací. Zajištěn by však měl být efekt při stagnaci krve u fibrilace síní či při žilní insuficienci nebo inaktivitě.
Hledání nových cest antikoagulační strategie má i další důvody. Vedle zásahu do hemostázy s sebou nesou některá antikoagulancia i specifické nežádoucí účinky. Příkladem jsou antivitaminy K, které blokují nejen karboxylaci faktorů hemostázy, ale též karboxylaci desítky vitamin K dependentních biologicky velmi aktivních proteinů. Výsledkem je např. porucha osteogeneze a osifikace, porucha tvorby vaziva (s dopadem na periodontální systém či na vlasový folikul), které vídáme například při aplikaci warfarinu [2]. Podobné „extrakoagulační“ působení vidíme u heparinů, kdy non antikoagulačně působící část glykosaminoglykanového řetězce ovlivňuje též metabolismus kostí a pojiva s rizikem osteopenie či alopecie [3]. Jak bylo řečeno, koagulační faktory mají mnohočetnou funkci, např. trombin a faktor VIII a X se účastní embryogeneze. V experimentu na geneticky upravených zvířatech s vyřazením těchto faktorů byla pozorována porucha vývoje některých orgánů [4]. Otázkou je, zda též inhibitory trombinu či faktoru Xa nebudou negativně ovlivňovat embryogenezi. Popsána je porucha angiogeneze u některých xabanů či LMWH [5]. Podobně, opět v experimentu, inhibice trombinu negativně ovlivnila vývoj pojivové tkáně [6]. I když problém možného extrakoagulačního působení byl jen nastíněn, teprve příští léta určí, do jaké míry je klinicky významný. Obezřetnost však je při masovém užívání léčiv této skupiny jistě namístě. Velmi často se nežádoucí účinky léčiv zaregistrují až po desítkách let užívání. Též z tohoto aspektu musíme přistupovat jak ke starým, tak i k novým strategiím.
Jaké nové strategie v antikoagulační
léčbě se nabízejí?
V posledních letech byla zaznamenána celá řada nově vyvíjených antikoagulancií. Uveďme jen nový antivitamin K (tecarfarin) s výhodnějšími farmakokinetickými vlastnostmi, nové xabany či nové sulfatované polysacharidy podobné heparinu. Jejich další vývoj a přechod do klinických fází hodnocení stagnuje či byl ukončen. Pouze ve dvou skupinách, tj. ve skupině inhibitorů faktoru XIa či inhibitorů faktoru XIIa, je patrný další vývoj. Obě skupiny, na rozdíl od dosud užívaných antikoagulancií, inhibují vnitřní cestu koagulace.
Důvod, proč je inhibice této vnitřní
cesty aktivace koagulace pokládána za perspektivní, je dán
vlastnostmi této větve kaskády (obr. 1). Je spouštěna
řadou patologických stavů: aktivací inflamazomové zánětlivé
kaskády s uvolněním řady cytokinů (tumor nekrotizující
faktor alfa, TNFα; interleukin 6, IL 6; kalikreiny aj.),
aktivací neutrofilů s tvorbou silně trombogenní sítě
z rozvlákněné DNA čili NET (neutrophil extracellular
traps – neutrofilní extracelulární pasti),
aktivovanými trombocyty či kontaktem s negativně nabitým
povrchem (např. s fosfolipidy na povrchu aktivovaných
trombocytů, s vlákny nukleových kyselin, s polyfosfáty
uvolněnými z granul aktivovaných destiček či bakterií).
Iniciální fáze má charakter vazby faktoru XII na trombogenní
povrch (zpravidla povrch s negativním elektrostatickým
nábojem). Kontakt vyvolá konformační změny s následnou
autoaktivací faktoru XII na XIIa. Tento aktivovaný faktor XIIa
spustí na jedné straně vnitřní cestu koagulace (katalýzou
faktoru XI na XIa), na straně druhé aktivuje
kalikrein kininový systém, čímž ovlivní reparačně
zánětlivý proces [7].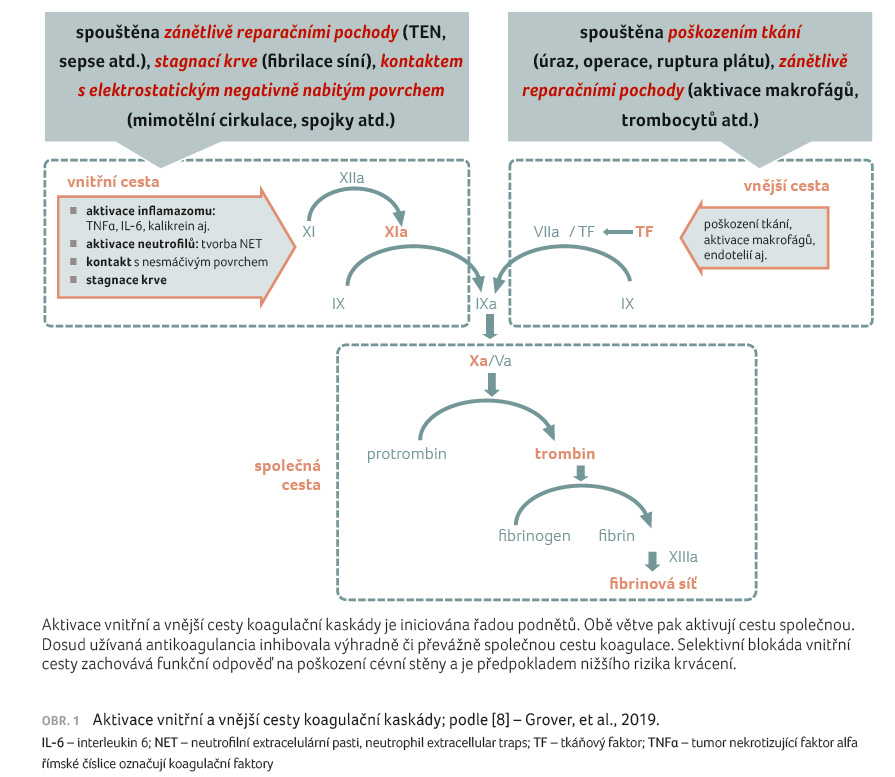
Podmínkou aktivace koagulační kaskády, zejména vnitřní cesty, je stagnace krve, která dovolí dosažení dostatečné koncentrace koagulačních faktorů [8]. V praxi to jsou zejména ty stavy, kdy antikoagulační léčbu užíváme. Nejčastější indikací je stagnace krve (u fibrilace síní, žilní insuficience nebo při imobilitě končetiny). Dalšími indikacemi jsou zánětlivě reparační pochody (těžší infekce, zejména covid 19, sepse apod.), nebo kontakt krve s elektrostaticky negativně nabitým povrchem (mimotělní cirkulace, cévní spojky aj.). Naopak funkce vnější cesty spouštěné poškozením cévní stěny (s uvolněním tkáňového faktoru a aktivací makrofágů, trombocytů i endotelií) je zachována. V klinice se s těmito stavy setkáváme při poškození cévy úrazy či např. při operaci. Tedy reparační mechanismus zabraňující krvácení při poškození cévy zůstává plně funkční.
Shrneme li, pak cílená inhibice vnitřní cesty by měla být dostatečně účinná v nejčastějších indikacích (při fibrilaci síní či léčbě a profylaxi tromboembolické nemoci), naopak by měla být zachována hemostáza při krvácení na podkladě poškození cévní stěny. Ve srovnání s inhibicí společné cesty koagulační kaskády je předpoklad větší bezpečnosti při zachované účinnosti.
Jak vnitřní cestu koagulace
inhibovat?
Jak bylo řečeno, prověřována je strategie cílená na faktor XI a faktor XII. První přístup, tedy blokáda aktivace faktoru XIa, je ve vývoji dále – probíhají poslední fáze klinického hodnocení hned u několika léčiv. Na rozdíl od dosud užívaných antikoagulancií, která mají charakter malomolekulárních látek (warfarin, xabany a gatrany) či jsou odvozena od heparinu či hirudinu, nová antikoagulancia odrážejí pokrok ve farmakologii. Objevují se zde léčiva na bázi interferujících oligonukleotidů jak typu siRNA (small interfering RNA) čili siranů, tak ASO (antisense oligonukleotidů). Tedy strategie blokující syntézu koagulačních faktorů. Paralelně je vyvíjen přístup cílený na blokádu funkce: přichází řada inhibitorů faktoru XI charakteru monoklonálních protilátek či jejich fragmentů, proteinových inhibitorů (typu RBD, receptor binding domain) nebo jsou vyvíjena klasická malomolekulární léčiva [8].
Stejně jako u LMWH či přímých antikoagulancií byl nejprve prověřován efekt v indikaci prevence tromboembolických příhod provázejících zákroky na velkých nosných kloubech. Profylaxe je zde krátkodobá, omezená na několik týdnů, incidence trombotických komplikací je vysoká, dostačuje zařadit menší počet probandů. To je předpokladem rychlého získání validních výsledků o účinnosti a bezpečnosti léčby. Dále jsou tato data důležitá z pohledu určení optimální dávky. Výsledky klinických hodnocení v této indikaci jsou již k dispozici. Naopak v indikacích ostatních, tj. v profylaxi tromboembolických iktů při fibrilaci síní a v léčbě tromboembolické nemoci (TEN), při mimotělním oběhu či sepsi, data ještě nemáme, studie však probíhají. Je tak prověřován efekt zejména inhibitorů faktoru XI u stavů, kdy je hemostáza aktivována stagnací krve, kontaktem s povrchem či zánětem. Tedy ve většině relevantních indikací.
Jaké jsou výhody a jaké jsou
možnosti inhibice faktoru XI?
Z klinického pohledu jsou perspektivnější inhibitory faktoru XI. Jejich vývoj pokročil nejdále. Jedním z důvodů volby této strategie je skutečnost, že máme k dispozici model snížené aktivity faktoru XIa. Klinickým korelátem inhibice faktoru XI je hemofilie C, tedy vrozený deficit faktoru XI. Průběh choroby je charakterizován nízkým rizikem krvácení při významném snížení incidence aterotrombotických a tromboembolických příhod [9]. Dále máme k dispozici data z klinických studií fáze II či časné fáze III již u několika léčiv. Výhodou je i dostupnost sledování efektu stanovením běžně dostupného testu aktivovaného parciálního tromboplastinového času (aPTT). Účinná hodnota aPTT se pohybuje kolem dvojnásobného prodloužení. Alternativně je možno užít i trombinový čas. V případě potřeby ukončení účinku je možno užít čerstvou mraženou plazmu jako antidotum, tedy způsob dostupný a ekonomicky únosný.
Inhibitory faktoru XI typu monoklonálních protilátek
Nejvíce dat je k dispozici u inhibitorů faktoru XI typu monoklonálních protilátek. U abelacimabu a osocimabu proběhla fáze II hodnocení v profylaxi TEN po ortopedických operacích a probíhá fáze III v indikaci prevence tromboembolizace u nemocných s fibrilací síní, resp. v profylaxi TEN u výkonů ortopedických. U xisomabu probíhá studie fáze II antikoagulační léčby během hemodialýzy.
Abelacimab a osocimab jsou plně humánní monoklonální protilátky vázající se selektivně na katalytickou doménu faktoru XIa. Aplikují se každých 30 dnů podkožně, při testovaných dávkách v rozmezí 30–180 mg je nástupu účinku dosaženo do jedné hodiny, eliminační poločas se pohybuje kolem 30 dnů, resp. délka trvání efektu kolem 30 dnů u abelacimabu, 60 dnů u osocimabu, jedná se tedy o rychlý a dlouhodobý účinek bez rizika lékových interakcí. Charakter plně humánních protilátek zaručuje minimální riziko vzniku inaktivujících protilátek i při dlouhodobém podávání.
Účinnost a bezpečnost
abelacimabu v profylaxi symptomatických či asymptomatických
tromboembolických příhod byla prověřována formou otevřené
studie u 412 pacientů indikovaných k náhradě kolenního
kloubu [10]. Abelacimab byl jednorázově postoperačně aplikován
ve třech různých dávkách (30 mg, 75 mg a 150 mg),
jako komparátor byl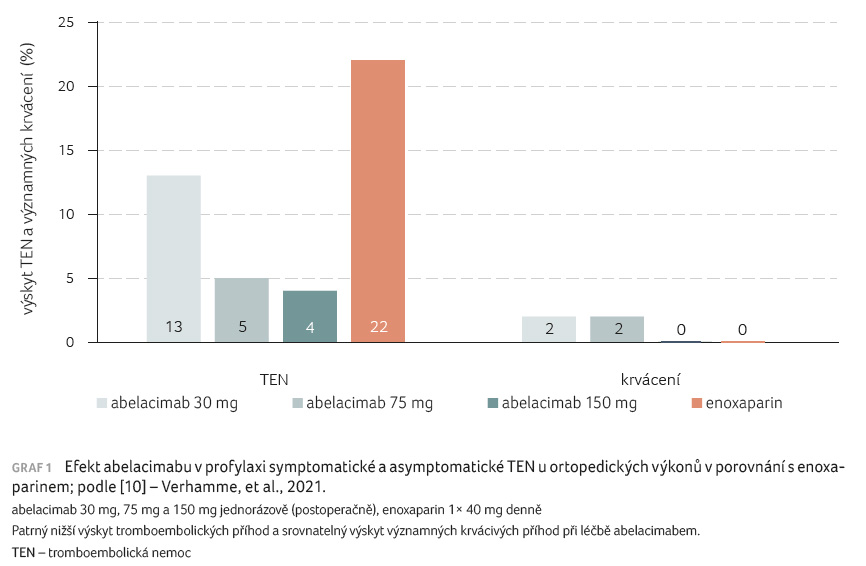 standardně volen enoxaparin podávaný v jedné
denní dávce 40 mg podkožně do kontrolní venografie.
Z výsledků je patrno, že abelacimab při aplikaci obou
vyšších dávek byl významně účinnější pro pokles výskytu
převážně asymptomatických trombotických příhod, ale výskyt
krvácení byl srovnatelný (graf 1). Efekt je však ovlivněn
skutečností, že se jednalo o menší počet pacientů v této
studii typu „dose finding“ (hledání rozsahu dávek).
standardně volen enoxaparin podávaný v jedné
denní dávce 40 mg podkožně do kontrolní venografie.
Z výsledků je patrno, že abelacimab při aplikaci obou
vyšších dávek byl významně účinnější pro pokles výskytu
převážně asymptomatických trombotických příhod, ale výskyt
krvácení byl srovnatelný (graf 1). Efekt je však ovlivněn
skutečností, že se jednalo o menší počet pacientů v této
studii typu „dose finding“ (hledání rozsahu dávek).
Sledování účinnosti a bezpečnosti abelacimabu v indikaci profylaxe tromboembolických příhod u nemocných s fibrilací síní v porovnání s rivaroxabanem probíhá již druhým rokem, ukončení studie (AZALEA TIMI 71) se očekává v roce 2023. I tato studie má charakter tzv. dose finding.
Efekt osocimabu byl prověřován
ve studii FOXTROT [11]. Charakter studie byl obdobný (otevřená,
typ dose finding), indikací byla opět profylaxe symptomatických
i asymptomatických příhod u náhrady kolenních kloubů.
Vedle aplikace monoklonální protilátky po výkonu
(0,3–1,8 mg/kg) byly stejné tři dávky podávány jiné skupině
předoperačně. K porovnání byl užit enoxaparin (40 mg
denně) či apixaban 2,5 mg podávaný dvakrát denně po dobu
nejméně 10 dnů, resp. do kontrolní venografie. Je patrný
nižší výskyt TEN, opět dominantně asymptomatických příhod,
v obou větvích s léčbou osocimabem v porovnání
s enoxaparinem, resp. srovnatelný efekt vůči apixabanu (graf 2). Riziko významných hemoragických příhod bylo u všech
antikoagulancií stejné.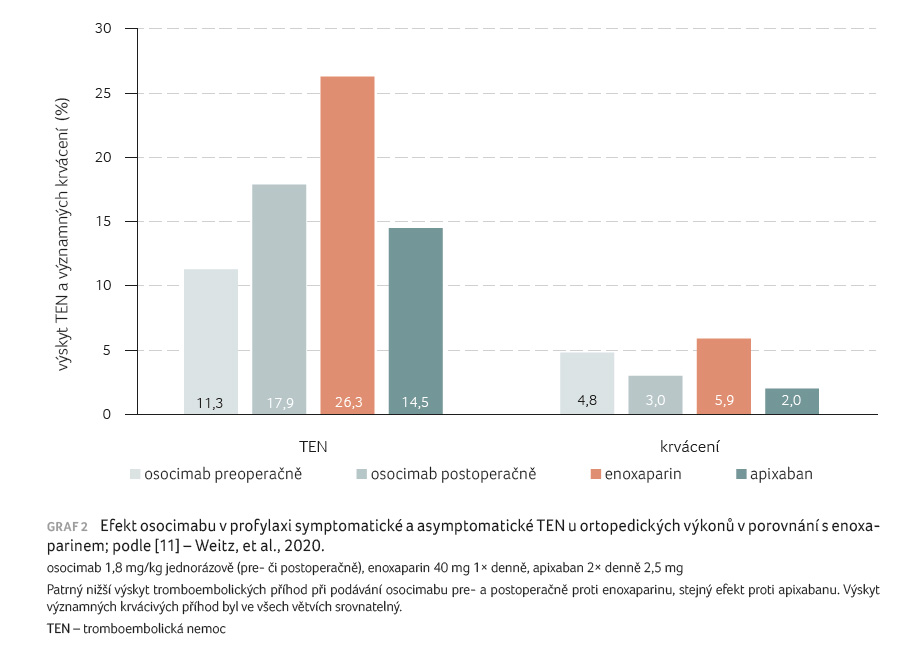
Shrneme li, pak inhibice faktoru XI pomocí monoklonálních protilátek je nadějná, nicméně zatím se zdá být stejná či větší účinnost při srovnatelné bezpečnosti. Definitivní efekt v profylaxi TEN u ortopedických pacientů je ověřován ve fázi III klinického hodnocení. Stejně je prověřován účinek v léčbě TEN a v profylaxi tromboembolických iktů u fibrilace síní.
Inhibitory faktoru XIa na bázi malomolekulárních léčiv – xianů
Řada inhibitorů aktivovaného faktoru XIa je ve vývoji. Úspěšně ukončenou fázi II klinického hodnocení s přechodem do třetí fáze v základních indikacích mají asundexian a milvexian. Název pro skupinu – xiany – je odvozen od inhibice faktoru XIa, stejně jako xabany od faktoru Xa.
Asundexian je přímým selektivním inhibitorem aktivovaného faktoru XIa. Poločas plazmatické eliminace 16–18 hodin umožňuje aplikaci jedenkrát denně, dobrá absorpce umožňuje perorální podání. Nástup účinku se projevuje do jedné hodiny, maximální koncentrace je dosaženo za 2–4 hodiny. Biodegradace a eliminace probíhají dominantně játry [12].
V současné době máme výsledky hodnocení fáze II, studii typu dose finding v profylaxi tromboembolického iktu u nemocných s fibrilací síní. Obdobná studie v sekundární prevenci po koronární či cerebrovaskulární příhodě ještě probíhá.
U nemocných s fibrilací síní byl porovnáván efekt dvou dávek asundexianu s referenčním apixabanem [13]. Obě dávky (20 mg a 50 mg) dostatečně (z více než 90 %) inhibovaly aktivitu faktoru XIa jak v době vrcholové, tak minimální koncentrace. Primárním cílovým ukazatelem byla bezpečnost, tedy výskyt velkých a významných krvácení. Oproti apixabanu byla léčba asundexianem (v případě obou dávek) zatížena krvácením o polovinu méně při porovnání s komparátorem. Výskyt všech nežádoucích příhod byl ve všech třech ramenech stejný. K určení účinnosti byla studie malá.
Milvexian je opět malomolekulární selektivní inhibitor katalytické domény faktoru XIa. Poločas plazmatické eliminace je o něco kratší (8–14 hodin), prověřována proto byla perorální aplikace jak v jedné, tak ve dvou denních dávkách. Nástup účinku se projevil asi za jednu hodinu, maximální koncentrace je dosaženo za 2–4 hodiny. Biodegradace a eliminace dominantně probíhají játry [14]. Srovnáme li, pak až na kratší dobu účinku milvexianu se oba xiany navzájem mnoho neliší. U obou léčiv byl antikoagulační efekt (sledovaný aPTT) lineárně závislý na dávce. Méně než 20% podíl ledvin na eliminaci nevede ke kumulaci při renální insuficienci.
U milvexianu máme k dispozici výsledky studie fáze II v indikaci prevence TEN při ortopedických výkonech na nosných kloubech [15]. V řadě větví byla sledována bezpečnost (velká a významná krvácení) i účinnost (symptomatická a asymptomatická TEN) při různých dávkách milvexianu (50–200 mg v jedné či dvou denních dávkách postoperačně) proti enoxaparinu v dávce 40 mg denně. Výskyt tromboembolických komplikací byl numericky méně častý při léčbě milvexianem (souhrnná analýza), výskyt krvácení byl srovnatelný.
S omezením vyplývajícím z analýzy dat fáze II hodnocení můžeme též pro inhibici aktivovaného faktoru XIa na bázi xianů konstatovat slibné výsledky. Ani zde, stejně jako u inhibice faktoru XI monoklonálními protilátkami, nebyla pozorována předpokládaná větší bezpečnost léčby, tedy nízké riziko krvácení. Nicméně s definitivními závěry bude nutno počkat do výsledků hodnocení fáze III v jednotlivých indikacích.
Inhibice syntézy faktoru XI inhibujícími oligonukleotidy typu ASO
Snížení aktivity faktoru XIa je možno dosáhnout buď omezením katalytické aktivity této proteázy (monoklonálními protilátkami či xiany), nebo inhibicí syntézy faktoru XI. Ze dvou inhibičních strategií – typu siRNA či ASO – je nejdál typ ASO. Příkladem je léčivo vyvíjené pod kódovým označením ISIS 416858. ASO, tedy krátké řetězce RNA o 20–25 nukleotidech, jsou komplementární k příslušné mediátorové ribonukleové kyselině (mRNA) pro syntézu konkrétního proteinu. Vazbou na mRNA je zabráněno zabudování do ribozomu a zastavena je syntéza proteinu, v našem případě faktoru XI. K terapeutickým účelům jsou ASO modifikovány, což vede k prodloužení efektu, vazba s N acetylgalaktosaminem umožní průnik do buňky a aplikace ve formě lipozomu chrání řetězec před RNázou. Antikoagulační efekt plně přetrvává nejméně tři měsíce po jedné dávce, k obnově vnitřní cesty srážlivosti (měřené aktivitou faktoru XIa či prodloužením aPTT) nedošlo dříve než za šest měsíců. Vzhledem k pomalejšímu nástupu účinku inhibice syntézy faktoru XI je antitrombotického efektu dosaženo po několika týdnech, proto byl přípravek ISIS 416858 podáván pět týdnů před testováním vlastního účinku [16]. Toto velké prodlení mezi dávkou a nástupem efektu je jistě určitou nevýhodou. Z tohoto důvodu – i při slibných výsledcích studie fáze II s profylaxí TEN u ortopedických zákroků – nejsou od roku 2015 zprávy o další klinické studii v základních indikacích. Prověřována byla pouze možnost dlouhodobého útlumu vnitřní cesty koagulace touto strategií u pacientů v hemodialyzační léčbě. Po pěti letech od ukončení studie nelze nalézt publikaci výsledků. Je tak pravděpodobné, že další vývoj této cesty byl pozastaven či ukončen.
Co vypovídají dosavadní fakta
o perspektivě inhibice vnitřní cesty koagulace v profylaxi
a v léčbě trombotických stavů?
Předně je nutno konstatovat, že
jednoznačně dominuje strategie cílená na inhibici aktivity
faktoru XI. Konkrétní pozice pro optimální využití inhibice
faktoru XII se stále hledá. V indikaci antitrombotické zatím
studie nepokročily do fáze klinického hodnocení. Uvažuje se
i o jiných indikacích, například v rámci prevence
a léčby hereditárního angioedému.
klinického hodnocení. Uvažuje se
i o jiných indikacích, například v rámci prevence
a léčby hereditárního angioedému.
Naopak inhibice faktoru XI jak na bázi plně humánních monoklonálních protilátek, tak na bázi malomolekulárních klasických léčiv (xianů) v posledních letech výrazně zrychlila a pokročila do třetí fáze hodnocení (tab. 1). Dosavadní studie fáze II svědčí pro dobrý efekt v prevenci trombotických komplikací ortopedických operací – zpravidla větší v porovnání s enoxaparinem či srovnatelný s apixabanem. Nebyl však potvrzen předpokládaný nižší výskyt krvácení. Zatím máme k dispozici pouze výsledky studií zabývajících se optimálním dávkováním (ve smyslu velikosti dávky, podání před operací, či po ní), a tak nelze konečné využití této léčby ještě zhodnotit. Obdobně je prověřován efekt v léčbě TEN v profylaxi tromboembolizace u nemocných s fibrilací síní, v sekundární prevenci po koronárních či cerebrovaskulárních příhodách či při mimotělní cirkulaci.
Seznam použité literatury
- [1] Dickneite G, Herwald H, Korte W, et al. Coagulation factor XIII: a multifunctional transglutaminase with clinical potential in a range of conditions. Thromb Haemost 2015; 113: 686697.
- [2] Kidd PM. Vitamins D and K as pleiotropic nutrients: clinical importance to the skeletal and cardiovascular systems and preliminary evidence for synergy. Altern Med Rev 2010; 15: 199–222.
- [3] Vitiello A, Ferrara F. Low Molecular Weight Heparin, Anti‑inflammatory/Immunoregulatory and Antiviral Effects. Cardiovasc Drugs Ther 2021: 1–5.
- [4] Aronovich A, Tchorsh D, Shezen E, et al. A Novel Role for Factor VIII and Other Coagulation Factors in Organ Size Control. Blood 2008; 112: 592.
- [5] Yavuz C, Caliskan A, Karahan O, et al. Investigation of the antiangiogenic behaviors of rivaroxaban and low molecular weight heparins. Blood Coagul Fibrinolysis 2014; 25: 303308.
- [6] Kaplan N, Karaarslan N, Yilmaz I, et al. Are Intervertebral Disc Tissue Cells Damaged When Attempting to Prevent Thrombus Formation Using Dabigatran, A New Oral Anticoagulant? Turk Neurosurg 2019; 29: 470–477.
- [7] Naudin C, Burillo E, Blankenberg S, et al. Factor XII Contact Activation. Semin Thromb Hemost 2017; 43: 814–826.
- [8] Grover SP, Mackman N. Intrinsic Pathway of Coagulation and Thrombosis Insights From Animal Models. Arterioscler Thromb Vasc Biol 2019; 39: 331–338.
- [9] Preis M, Hirsch J, Kotler A, et al. Factor XI deficiency is associated with lower risk for cardiovascular and venous thromboembolism events. Blood 2017; 129: 1210–1215.
- [10] Verhamme P, Yi A, Segers A, et al. Abelacimab for Prevention of Venous Thromboembolism. N Engl J Med 2021; 385: 609–617.
- [11] Weitz JI, Bauersachs R, Becker B, et al. Effect of Osocimab in Preventing Venous Thromboembolism Among Patients Undergoing Knee Arthroplasty. JAMA 2020; 323: 130–139.
- [12] Kubitza D, Heckmann M, Distler J, et al. Pharmacokinetics, pharmacodynamics and safety of BAY 2433334, a novel activated factor XI inhibitor, in healthy volunteers: A randomized phase 1 multiple‑dose study. Br J Clin Pharmacol 2022 Jan 10; doi: 10.1111/bcp.15230. Online ahead of print.
- [13] Piccini JP, Caso V, Connolly SJ, et al. Safety of the oral factor XIa inhibitor asundexian compared with apixaban in patients with atrial fibrillation (PACIFIC‑AF): a multicentre, randomised, double‑blind, double‑dummy, dose‑finding phase 2 study. Lancet 2022; 399: 1383–1390.
- [14] Perera V, Wang Z, Luettgen J, et al. First‑in‑human study of milvexian, an oral, direct, small molecule factor XIa inhibitor. Clin Transl Sci 2022; 15: 330–342.
- [15] Weitz JI, Strony J, Ageno W, et al. Milvexian for the Prevention of Venous Thromboembolism. N Engl J Med 2021; 385: 2161–2172.
- [16] Büller HR, Bethune C, Bhanot S, et al. Factor XI Antisense Oligonucleotide for Prevention of Venous Thrombosis. N Engl J Med 2015; 372: 232–240.