Léčba CAR-T lymfocyty – aktuální stav, nové indikace a přípravky, zkušenosti z praxe
Souhrn
Vydra J. Léčba CAR‑T lymfocyty – aktuální stav, nové indikace a přípravky, zkušenosti z praxe. Remedia 2024; 34: 331–334.
Článek shrnuje aktuální problematiku léčby CAR‑T lymfocyty. CAR‑T lymfocyty jsou geneticky modifikované autologní T lymfocyty pacienta, které exprimují syntetický, umělý receptor, jenž umožňuje rozpoznat cílový povrchový antigen. Po rozpoznání antigenu se CAR‑T lymfocyty aktivují a proliferují a díky přímé cytotoxicitě likvidují cílovou tkáň. Celosvětově jsou registrovány přípravky proti antigenům CD19 (exprimován na nehodgkinských lymfomech a akutní lymfoblastické leukemii) a BCMA (mnohočetný myelom). V České republice již bylo více než 200 pacientů léčeno anti‑CD19 CAR‑T terapií. Článek přehledně shrnuje vlastnosti a indikace registrovaných CAR‑T přípravků a hlavní komplikace této léčby.
Klíčová slova: imunoterapie – nehodgkinské lymfomy – akutní lymfoblastická leukemie – chimérický antigenní receptor – CAR‑T léčba.
Summary
Vydra J. CAR‑T therapy – current state, new indications and agents, practical experience. Remedia 2024; 34: 331–334.
The article summarizes the current state of CAR‑T therapy. CAR‑T lymphocytes are genetically modified autologous T lymphocytes, which express a synthetic, artificial receptor that enables the recognition of a target surface antigen. Upon antigen recognition, CAR‑T lymphocytes become activated, proliferate, and destroy the target tissue through direct cytotoxicity. Products targeting CD19 antigens (expressed on non‑Hodgkin lymphomas and acute lymphoblastic leukemia) and BCMA (multiple myeloma) have been registered in EU. In the Czech Republic, more than 200 patients have already been treated with anti‑CD19 CAR‑T therapy. The article provides an overview of the characteristics and indications of registered CAR‑T products and the main complications associated with this treatment.
Key words: immunotherapy – non‑Hodgkin lymphoma – acute lymphoblastic leukemia – chimeric antigenic receptor – CAR‑T therapy.
Úvod
T lymfocyty jsou základní složkou adaptivní buněčné imunity. Hrají podstatnou roli v obraně proti intracelulárním patogenům a v protinádorové imunitě. Počátek snahy využít imunitní systém k terapii nádorových onemocnění – imunoterapii – sahá do první poloviny 20. století. Pro imunoterapii jsou využívány protilátky, cytokiny, interleukiny, interferony, checkpoint inhibitory a autologní nebo alogenní leukocyty. Asi nejpokročilejší technologií v imunoterapii je použití geneticky modifikovaných T lymfocytů, které exprimují syntetické receptory proti cílovým strukturám – léčba CAR‑T lymfocyty.
Chimérický antigenní receptor (chimeric antigen receptor, CAR) je umělý genový konstrukt, který je složen z vazebné části (obvykle variabilní doména imunoglobulinu), transmembránové části, signalizační domény a kostimulační domény. Oproti přirozenému T buněčnému receptoru (T‑cell receptor, TCR), který rozpoznává krátké peptidy vložené do žlábku molekul lidského leukocytárního antigenu (human leukocyte antigen, HLA), rozpoznává CAR přímo cílový antigen na povrchu buněk – nevidí tedy případné intracelulární antigeny, na druhou stranu ale není aktivita CAR limitována nutností rozpoznání HLA molekuly. Právě extrémní variabilita HLA molekul způsobuje, že TCR nejsou k imunoterapii příliš vhodné – rozpoznávají vždy komplex cílového antigenu s konkrétní HLA molekulou, a nelze tedy vytvořit „univerzální“ TCR, který by bylo možné použít u všech pacientů.
CAR‑T lymfocyty jsou geneticky modifikované T lymfocyty, které exprimují kromě svého přirozeného TCR i CAR. V současnosti klinicky používané CAR‑T lymfocyty jsou autologní ex vivo geneticky modifikované a ex vivo expandované produkty – pro každého pacienta jsou tedy vyráběny zvlášť z výchozího materiálu – autologních lymfocytů, které jsou získávány leukocytaferézou.
Cílový antigen pro imunoterapii – pokud má být imunoterapie účinná a bezpečná – musí být buď specifický pro nádorové onemocnění a nesmí se vyskytovat na zdravé tkáni, nebo musí být cílová tkáň postradatelná. Dosud registrované přípravky cílí na antigeny CD19 (B nehodgkinské lymfomy, akutní lymfoblastická leukemie) a BCMA (mnohočetný myelom). Antigen CD19 je exprimován na B lymfocytech a jde o koreceptor B buněčného receptoru, zatímco BCMA (B buněčný maturační antigen) je exprimován na zralých B lymfocytech a plazmatických buňkách a je receptorem pro cytokiny (BAFF a APRIL), jeho signalizace reguluje přežití, diferenciaci a funkci zralých B lymfocytů a plazmatických buněk. CD19 CAR‑T a BCMA CAR‑T navozují depleci B lymfocytů a plazmatických buněk.
Přípravky CAR‑T terapie a jejich dostupnost v ČR
Léčba CAR‑T lymfocyty je dostupná v centrech hematologické péče na základě individuálního schválení zdravotní pojišťovnou. Seznam registrovaných přípravků, jejich indikace a dostupnost v České republice jsou shrnuty v tabulce 1. V ČR již bylo CAR‑T lymfocyty léčeno více než 200 pacientů. 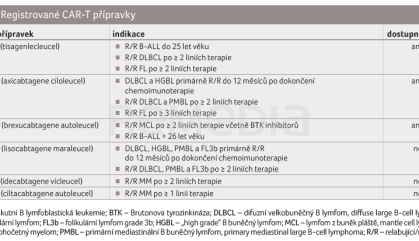
Tisagenlecleucel
Tisagenlecleucel je CAR‑T 2. generace složený z jednořetězcového fragmentu myší protilátky FMC63 proti CD19, transmembránové domény CD8 a z intracelulární kostimulační domény 4‑1BB (CD137) a CD3ζ [1]. Je indikován k léčbě pediatrických a mladých dospělých pacientů s akutní B lymfoblastickou leukemií (B‑ALL) ve věku do 25 let včetně, pokud je onemocnění refrakterní, v relapsu po transplantaci nebo ve druhém či dalším relapsu a k léčbě dospělých pacientů s relabujícím/refrakterním difuzním velkobuněčným B lymfomem (R/R DLBCL) nebo folikulárním lymfomem (FL) po dvou a více liniích systémové léčby [2].
Účinnost u B‑ALL dětí a mladých dospělých byla dokumentována ve studii fáze II s jedním ramenem u 79 pacientů s R/R B‑ALL. Kompletní remise (complete remission, CR) bylo dosaženo u 82 % pacientů (95% interval spolehlivosti [CI] 72–90), 98 % z těchto remisí bylo MRN (minimální reziduální nemoc) negativních. Pravděpodobnost přežití bez relapsu (relapse‑free survival, RFS) po 18 měsících byla 66 %. Celkové přežití (overall survival, OS) po dvou letech bylo 66 % [3].
V případě R/R DLBCL ve třetí a vyšších liniích léčby byla účinnost potvrzena v jednoramenné studii fáze II u 115 pacientů. Celková odpověď (míra objektivní odpovědi = kompletní remise + parciální remise, ORR = CR + PR) byla 53 % (95% CI 44–66); RFS po 36 měsících bylo 60 % a medián OS 11 měsíců, OS po třech letech 36 % [4].
Skupina pacientů s primárně refrakterním agresivním velkobuněčným B lymfomem nebo progresí do 12 let po ukončení léčby byla předmětem randomizované studie fáze III srovnávající léčbu tisagenlecleucelem oproti standardní péči (BELINDA). Celkem bylo v této studii randomizováno 322 pacientů. Medián času od odběru T lymfocytů do podání přípravku byl 52 dnů. Přežití bez události (event‑free survival, EFS) bylo v obou skupinách tři měsíce, ORR 46,3 % po studijní léčbě a 42,5 % po standardní léčbě. Nepodařilo se tedy prokázat superioritu tisagenlecleucelu oproti standardní terapii druhé linie u pacientů s primárně refrakterním a časně relabujícím DLBCL a „high grade“ B buněčným lymfomem (HGBL). Z toho důvodu tisagenlecleucel není indikován ve druhé linii léčby agresivních velkobuněčných lymfomů [5].
U pacientů s R/R FL po dvou a více liniích léčby bylo ve studii s 97 nemocnými dosaženo celkové odpovědi u 86 % z nich, CR u 68 % (95% CI 59–78). Odpověď přetrvávala po dvou letech u 66 % pacientů [6].
Axicabtagene ciloleucel
Axicabtegene ciloleucel je CAR‑T 2. generace složený z fragmentu myší protilátky FMC63 proti CD19, kostimulační domény CD28 a z řetězce CD3ζ. Vlastní vazebná část je shodná s tisagenlecleucelem, přípravky se ale liší v kostimulační a transmembránové doméně [7]. Axicabtegene ciloleucel je indikován k léčbě druhé linie u dospělých pacientů s primárně refrakterním nebo časně relabujícím DLBCL a HGBL a pro léčbu R/R DLBCL a primárně mediastinálního B buněčného lymfomu (PMBCL) po dvou či více liniích systémové léčby. V případě R/R FL je axicabtagene ciloleucel indikován po třech či více liniích systémové léčby [8].
Axicabtagene ciloleucel v druhé linii léčby pacientů s primárně refrakterními a časně (do 12 měsíců) relabujícími velkobuněčnými B lymfomy byl hodnocen v randomizované studii fáze III ZUMA‑7 s 359 pacienty. Celkem 180 pacientů bylo léčeno axicabtagene ciloleucelem, 179 dostalo standardní léčbu. Medián času od odběru T lymfocytů do podání přípravku byl 18 dnů. Celkem 83 % pacientů léčených axicabtagene ciloleucelem dosáhlo léčebné odpovědi, zatímco ve skupině standardní léčby to bylo 50 %. Kompletní remise bylo dosaženo u 65 %, resp. 32 % pacientů. Celkové přežití po čtyřech letech bylo 55 % ve skupině s axicabtagene ciloleucelem a 46 % v kontrolní skupině [9,10].
Ve třetí linii léčby velkobuněčných lymfomů byl axicabtagene ciloleucel zkoumán ve studii fáze II s jedním ramenem (ZUMA‑1). Léčeno bylo 101 pacientů, 58 % dosáhlo CR, 25 % PR. Celkové přežití po pěti letech bylo 42,6 %, přežití bez progrese (progression‑free survival, PFS) 31,8 % [11].
V případě FL a lymfomu marginální zóny (MZL) ve třetí a další linii léčby šlo opět o jednoramennou studii fáze II se 146 pacienty (ZUMA‑5). Celková odpověď byla pozorována u 92 % pacientů, u 76 % byla zaznamenána CR. Medián PFS byl 39,6 měsíce [12,13].
Brexucabtagene autoleucel
Brexucabtagene autoleucel využívá stejný CAR jako axicabtagene ciloleucel. Rozdíl je ve výrobě produktu, během níž je navíc zařazen krok pozitivní selekce T lymfocytů, který zajistí, že CAR‑T lymfocyty nejsou předčasně vystaveny nádorovým buňkám v průběhu výrobního procesu, což by mohlo vést k jejich předčasné aktivaci a exhausci.
Brexucabtagene autoleucel je indikován k léčbě dospělých pacientů s R/R lymfomem z plášťových buněk (MCL) po dvou či více liniích systémové léčby, které zahrnovaly terapii inhibitorem Brutonovy tyrozinkinázy (BTK). Dále je indikován k léčbě dospělých pacientů ve věku 26 let a starších s relabující nebo refrakterní akutní lymfoblastickou leukemií (ALL) z prekurzorů B lymfocytů.
Ve studii fáze II ZUMA‑3 bylo zařazeno 71 pacientů s B‑ALL, pro 65 z nich byl vyroben brexucabtagene autoleucel a 55 nemocným (77 %) byl podán. CR bylo dosaženo u 65 % pacientů; 46 % z léčených pacientů žilo po třech letech od podání terapie [14].
Ve studii fáze II ZUMA‑2 bylo zařazeno 74 pacientů s MCL, brexucabtagene autoleucel byl podán 68 z nich. U 93 % pacientů byla zaznamenána ORR, u 68 % CR. Celkové přežití po třech letech činilo 62 % [14,15].
Lisocabtagene maraleucel
Lisocabtagene maraleucel je opět CAR‑T 2. generace složený z jednořetězcového fragmentu myší protilátky FMC63 proti CD19 spojené s transmembránovou doménou CD28, intracelulární kostimulační doménou 4‑1BB (CD137) a CD3ζ [16].
Tento přípravek zatím nebyl v ČR dostupný, v EU je indikován k léčbě dospělých s DLBCL, HGBL, PMBL a FL3b (folikulárního lymfomu grade 3b), u nichž došlo k relapsu onemocnění v průběhu 12 měsíců od ukončení chemoimunoterapie první linie nebo kteří jsou na tuto léčbu refrakterní. Lisocabtagene maraleucel je také indikován k léčbě dospělých pacientů s R/R DLBCL, PMBCL a FL3b po dvou nebo více liniích systémové terapie [17].
Výsledky léčby lisocabtagene maraleucelem ve druhé linii oproti standardní léčbě hodnotila randomizovaná studie TRANSFORM. Celkem 74 % pacientů léčených lisocabtagene maraleucelem dosáhlo CR oproti 21 % pacientů ve standardní skupině. EFS po 18 měsících byl 52,6 % (95% CI 42,3–62,9) oproti 20,8 % (95% CI 12,2–29,5) [16].
Ve třetí linii léčby (studie TRANSCEND NHL 001) bylo léčeno 270 pacientů (z 345, kteří podstoupili aferézu), odhadované dvouleté trvání odpovědi (duration of response, DOR), PFS a OS byly 49,5 %, 40,6 % a 50,5 % [18].
Idecabtagene vicleucel
Idecabtagene vicleucel je CAR‑T složený z fragmentu protilátky proti BCMA, intracelulární kostimulační domény 4‑1BB (CD137) a CD3ζ [19].
Idecabtagene vicleucel je indikován od třetí linie léčby mnohočetného myelomu; předchozí léčba musela zahrnovat imunomodulátor, inhibitor proteazomu a protilátku anti‑CD38 [20]. Ve studii KARMMA bylo zařazeno 140 pacientů, 128 z nich dostalo idecabtagene vicleucel po mediánu 32 dnů od leukaferézy. U 98 % pacientů byla zaznamenána ORR, u 33 % bylo dosaženo CR, u 26 % MRN negativní CR. Medián PFS byl 8,8 měsíce [20].
Ciltacabtagene autoleucel
Ciltacabtagene autoleucel obsahuje dva těžké řetězce protilátky proti BCMA, intracelulární kostimulační doménu 4‑1BB (CD137) a signalizační řetězec CD3ζ [21].
Indikací k léčbě ciltacabtagene autoleucelem je mnohočetný myelom u pacientů, kteří podstoupili alespoň jednu předchozí linii léčby zahrnující imunomodulátor a inhibitor proteazomu [22].
Ve studii CARTITUDE‑4 bylo randomizováno 419 pacientů, 208 bylo léčeno ciltacabtagene autoleucelem, 211 dostalo standardní léčbu. PFS po jednom roce činil 76 % ve skupině s ciltacabtagene autoleucelem a 50 % ve skupině pacientů se standardní léčbou; mediánu PFS nebylo ve skupině se studijní léčbou dosaženo, zatímco ve standardní skupině byl 12 měsíců. Celková odpověď byla 85 %, u 74 % pacientů bylo dosaženo CR.
Komplikace CAR‑T léčby
Léčba CAR‑T lymfocyty je spojena se skupinou specifických komplikací:
- syndrom z uvolnění cytokinů (cytokine release syndrome, CRS),
- neurotoxicita spojená s léčbou imunoefektorovými buňkami (immune‑effector cell associated neurotoxicity syndrome, ICANS),
- hematotoxicita (immune‑effector cell associated hematotoxicity, ICAHT),
- sekundární hemofagocytární syndrom (immune‑effector cell associated hemophagocyti lymphohistiocytosis, ICAHL).
Incidence těchto komplikací dle registračních studií je shrnuta v tabulce 2 [2,8,17,22,23].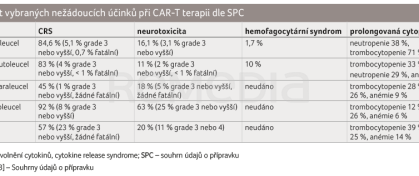
Syndrom z uvolnění cytokinů je nejčastější komplikací léčby CAR‑T lymfocyty. CRS je v podstatě přirozeným důsledkem aktivace imunitního systému. Nepotvrdila se hypotéza, že by výskyt CRS koreloval zásadním způsobem s léčebnou odpovědí – v multicentrické studii s 352 pacienty v osmi centrech ve Spojených státech amerických bylo dosaženo CR nebo PR u 66 % pacientů s CRS a u 52 % pacientů bez CRS (p = 0,81). Vývoj CRS neměl významný dopad na PFS ani na OS. Maximální koncentrace feritinu více než 5 000 μg/l během 28 dnů po infuzi CAR‑T buněk byla spojena s významně horším PFS a OS s poměrem rizik (HR) 2,61 (95% CI 1,71–3,98; p < 0,001) a 2,38 (95% CI 1,50–3,76; p < 0,001) v daném pořadí. Zvýšená koncentrace laktátdehydrogenázy před zahájením lymfodepleční chemoterapie byla spojena s horším PFS a OS, s HR 2,11 (95% CI 1,49–2,98; p < 0,001) a 2,34 (95% CI 1,55–3,53; p < 0,001). Podávání kortikosteroidů během léčby nemělo významný dopad na PFS ani na OS [24].
Poté, co byly rozptýleny prvotní obavy z negativního ovlivnění účinku CAR‑T terapie při použití kortikosteroidů a proticytokinové léčby, přistupuje řada pracovišť k použití tocilizumabu a dexametazonu dříve, než tomu bylo zprvu zvykem, a to zejména u rizikových pacientů s komorbiditami. Jsou publikovány práce hodnotící použití tocilizumabu, anakinry a/nebo kortikosteroidů v prevenci CRS [25,26].
Neurotoxicita spojená s léčbou imunoefektorovými buňkami je asi nejzáhadnější komplikací léčby CAR‑T lymfocyty. Patofyziologie ICANS není zatím uspokojivě objasněna, její incidence a závažnost se mezi jednotlivými přípravky mírně liší, vyskytuje se jak u anti‑CD19, tak i u anti‑BCMA léčiv. Příznaky mohou zahrnovat například zmatenost, třes, dysartrii, apraxii, křeče, libovolné fokální příznaky, v těžkých případech se rozvíjí porucha vědomí, mozkový edém a ICANS může vést k úmrtí pacienta. ICANS obvykle přichází o něco později než CRS. V patogenezi hraje opět roli nadměrná aktivace a proliferace CAR‑T lymfocytů, které produkují prozánětlivé cytokiny, jež vedou k abnormální aktivaci endotelu s disrupcí hematoencefalické bariéry a k rozvoji koagulopatie s hypofibrinogenemií. Léčba ICANS je podobná léčbě CRS a je zaměřena na ovlivnění produkce cytokinů a aktivace T lymfocytů – vysokodávkované kortikosteroidy, anakinra, siltuximab.
Budoucnost CAR‑T terapie a závěr
CAR‑T lymfocyty představují revoluční technologii léčby nádorových onemocnění. Využití buněk imunitního systému k léčbě je provázeno rizikem unikátních komplikací, které nejsou triviální a jsou částečně spřaženy s vlastním mechanismem účinku. Nutnost přípravy autologních přípravků pro každého pacienta s sebou nese značné logistické a výrobní náklady. Limitace rozpoznání jednoho antigenu omezuje spektrum cílových tkání.
Řada farmaceutických společností a akademických pracovišť investuje do vývoje CAR technologie s cílem eliminovat omezení, která v současnosti tato léčba má. Lze očekávat, že se tato technologie bude dramaticky rozvíjet podobně, jako tomu bylo u jiných převratných technologií, a že se uplatní v řadě dalších indikací – zejména v léčbě autoimunit a v terapii solidních nádorů.
MUDr. Jan Vydra, Ph.D.
Ústav hematologie a krevní transfuze
U Nemocnice 2094/1, 120 00 Praha 2
e-mail: jan.vydra@uhkt.cz
Literatura
[1] Vairy S, Garcia JL, Teira P, Bittencourt H. CTL019 (tisagenlecleucel): CAR‑T therapy for relapsed and refractory B‑cell acute lymphoblastic leukemia. Drug Des Devel Ther 2018; 12: 3885–3898.
[2] SPC Kymriah. Dostupné na: https://www.ema.europa.eu/cs/documents/product‑information/kymriah‑epar‑product‑information_cs.pdf
[3] Maude SL, Laetsch TW, Buechner J, et al. Tisagenlecleucel in Children and Young Adults with B‑Cell Lymphoblastic Leukemia. N Engl J Med 2018; 378: 439–448.
[4] Schuster SJ, Tam CS, Borchmann P, et al. Long‑term clinical outcomes of tisagenlecleucel in patients with relapsed or refractory aggressive B‑cell lymphomas (JULIET): a multicentre, open‑label, single‑arm, phase 2 study. Lancet Oncol 2021; 22: 1403–1415.
[5] Bishop MR, Dickinson M, Purtill D, et al. Second‑Line Tisagenlecleucel or Standard Care in Aggressive B‑Cell Lymphoma. N Engl J Med 2022; 386: 629–639.
[6] Fowler NH, Dickinson M, Dreyling M, et al. Tisagenlecleucel in adult relapsed or refractory follicular lymphoma: the phase 2 ELARA trial. Nat Med 2021; 28: 325–332.
[7] Kochenderfer JN, Feldman SA, Zhao Y, et al. Construction and Pre‑clinical Evaluation of an Anti‑CD19 Chimeric Antigen Receptor. J Immunother 2009; 32: 689–702.
[8] SPC Yescarta. Dostupné na: https://www.ema.europa.eu/cs/documents/product‑information/yescarta‑epar‑product‑information_cs.pdf
[9] Locke FL, Miklos DB, Jacobson CA, et al. Axicabtagene Ciloleucel as Second‑Line Therapy for Large B‑Cell Lymphoma. N Engl J Med 2022; 386: 640–654.
[10] Westin JR, Oluwole OO, Kersten MJ, et al. Survival with Axicabtagene Ciloleucel in Large B‑Cell Lymphoma. N Engl J Med 2023; 389: 148–157.
[11] Neelapu SS, Jacobson CA, Ghobadi A, et al. Five‑year follow‑up of ZUMA‑1 supports the curative potential of axicabtagene ciloleucel in refractory large B‑cell lymphoma. Blood 2023; 141: 2307–2315.
[12] Jacobson CA, Chavez JC, Sehgal AR, et al. Axicabtagene ciloleucel in relapsed or refractory indolent non‑Hodgkin lymphoma (ZUMA‑5): a single‑arm, multicentre, phase 2 trial. Lancet Oncol 2022; 23: 91–103.
[13] Mohty R, Kharfan‑Dabaja MA, Chavez JC. Axicabtagene Ciloleucel in the Management of Follicular Lymphoma: Current Perspectives on Clinical Utility, Patient Selection and Reported Outcomes. Cancer Manag Res 2023; 15: 367–375.
[14] Shah BD, Ghobadi A, Oluwole OO, et al. KTE‑X19 for relapsed or refractory adult B‑cell acute lymphoblastic leukaemia: phase 2 results of the single‑arm, open‑label, multicentre ZUMA‑3 study. Lancet 2021; 398: 491–502.
[15] Wang M, Munoz J, Goy A, et al. Three‑Year Follow‑Up of KTE‑X19 in Patients With Relapsed/Refractory Mantle Cell Lymphoma, Including High‑Risk Subgroups, in the ZUMA‑2 Study. J Clin Oncol 2023; 41: 555–567.
[16] Abramson JS, Solomon SR, Arnason J, et al. Lisocabtagene maraleucel as second‑line therapy for large B‑cell lymphoma: primary analysis of the phase 3 TRANSFORM study. Blood 2023; 141: 1675–1684.
[17] SPC Breyanzi. Dostupné na: https://www.ema.europa.eu/cs/documents/product‑information/breyanzi‑epar‑product‑information_cs.pdf
[18] Abramson JS, Palomba ML, Gordon LI, et al. Two‑year follow‑up of lisocabtagene maraleucel in relapsed or refractory large B‑cell lymphoma in TRANSCEND NHL 001. Blood 2024; 143: 404–416.
[19] Oriol A, Abril L, Torrent A, et al. The role of idecabtagene vicleucel in patients with heavily pretreated refractory multiple myeloma. Ther Adv Hematol 2021; 12: 20406207211019622.
[20] Munshi NC, Anderson LD, Shah N, et al. Idecabtagene Vicleucel in Relapsed and Refractory Multiple Myeloma. N Engl J Med 2021; 384: 705–716.
[21] Chekol Abebe E, Yibeltal Shiferaw M, Tadele Admasu F, Asmamaw Dejenie T. Ciltacabtagene autoleucel: The second anti‑BCMA CAR T‑cell therapeutic armamentarium of relapsed or refractory multiple myeloma. Front Immunol 2022; 13: 991092.
[22] SPC Carvykti. Dostupné na: https://www.ema.europa.eu/cs/documents/product‑information/carvykti‑epar‑product‑information_cs.pdf
[23] SPC Abecma. Dostupné na: https://www.ema.europa.eu/cs/documents/product‑information/abecma‑epar‑product‑information_cs.pdf
[24] Bhaskar ST, Patel VG, Porter DL, et al. Chimeric antigen receptor T‑cell therapy yields similar outcomes in patients with and without cytokine release syndrome. Blood Adv 2023; 7: 4765–4772.
[25] Ahmed N, Caimi P, Reese JS, et al. Prophylactic Tocilizumab in Patients with Relapsed Refractory Lymphoma Treated with Anti CD19 Chimeric Antigen Receptor T‑Cell Therapy. Biol Blood Marr Transplant 2020; 26: S275–S276.
[26] Caimi PF, Pacheco Sanchez G, Sharma A, et al. Prophylactic Tocilizumab Prior to Anti‑CD19 CAR‑T Cell Therapy for Non‑Hodgkin Lymphoma. Front Immunol 2021; 12: 745320.