Iptakopan – blokátor alternativní dráhy komplementu v léčbě paroxysmální noční hemoglobinurie
Souhrn
Červinek L. Iptakopan – blokátor alternativní dráhy komplementu v léčbě paroxysmální noční hemoglobinurie. Remedia 2024; 34: 168–172.
Paroxysmální noční hemoglobinurie je potenciálně závažné onemocnění krvetvorby s jasnou patofyziologií vzniku. Inhibitory C5 složky komplementu se staly globální první volbou léčby onemocnění. Pro pacienty s extravaskulární hemolýzou je v rámci léčby indikováno podání pegcetakoplanu. Další možností je nový blokátor alternativní dráhy komplementu iptakopan. Iptakopan prokázal v klinických studiích fáze III APPLY‑PNH a APPOINT‑PNH splnění primárních cílů studie, a to zvýšení hodnoty hemoglobinu minimálně o 20 g/l oproti výchozímu stavu a zvýšení koncentrace hemoglobinu alespoň na 120 g/l. Bezpečnostní profil iptakopanu je příznivý.
Klíčová slova: paroxysmální noční hemoglobinurie – ekulizumab – ravulizumab – pegcetakoplan – iptakopan.
Summary
Cervinek L. Iptacopan – inhibitor of the alternative complement pathway in the treatment of paroxysmal nocturnal hemoglobinuria. Remedia 2024; 34: 168–172.
Paroxysmal nocturnal hemoglobinuria is a potentially serious hematopoietic disease with a clear pathophysiology. Inhibitors of the complement component 5 have become the global first choice for the treatment of the disease. For patients with extravascular haemolysis, pegcetacoplan is indicated as part of treatment. Another option is a new alternative complement pathway inhibitor iptacopan. It was shown that iptacopan, in the phase III clinical trials APPLY‑PNH and APPOINT‑PNH, guaranteed the achievement of the primary objectives consisting of increase in haemoglobin levels by 20 g/l and to levels above 120 g/l. The safety profile of iptacopan is favorable.
Key words: paroxysmal nocturnal hemoglobinuria – eculizumab – ravulizumab – pegcetacoplan – iptacopan.
Paroxysmální noční hemoglobinurie
Paroxysmální noční hemoglobinurie (PNH) je velmi vzácné získané onemocnění krvetvorby. U nemocných pacientů dochází k postižení všech krevních elementů, tj. červených krvinek, bílých krvinek a krevních destiček. Příčinou onemocnění je získaný genetický defekt (mutace genu), jenž má za následek chybění některých látek, které za normálních okolností chrání krevní elementy před jejich zánikem působením tzv. komplementu – souboru bílkovin, jež hrají důležitou roli ve spouštění imunitních reakcí spojených s ochranou organismu zejména proti infekci.
Onemocnění se obvykle manifestuje chudokrevností (anémií) s doprovodnými příznaky, jako jsou dušnost nebo nevýkonnost. Výraznou únavou je postiženo přibližně 75–89 % pacientů s PNH.
Příčina anémie je často multifaktoriální, nejčastěji je způsobena intravaskulárním rozpadem červených krvinek (hemolýzou) zapříčiněnou aktivovaným komplementem. Další příčinou může být primární selhání kostní dřeně, kam řadíme například pacienty s aplastickou anémií s přítomností PNH klonu. Jinou příčinou anémie může být nedostatek zásobního železa při opakovaných ztrátách močí při hematurii. V neposlední řadě nacházíme pacienty s nefrogenní anémií při chronické renální insuficienci. Jiní pacienti mohou mít iniciální příznak nemoci závažnější, bývá to často nečekaná krevní sraženina (trombóza) v arteriálním či venózním řečišti, nezřídka v oblasti jaterních či slezinných žil, v mozkových splavech, tj. v klinicky atypických lokalizacích trombózy. Zhruba 29–44 % pacientů s PNH prodělá během svého života více než jednu trombózu. Příčinou trombotických komplikací je aktivace systému intravaskulární hemolýzy (IVH) s následným velmi vysokým trombotickým potenciálem. Riziko trombózy je u těchto nemocných výrazně zvýšeno a není zcela odstraněno ani účinnou antikoagulační léčbou, pokud není stabilizováno základní onemocnění. Další klinické potíže u pacientů s PNH mohou zahrnovat dysfagii při poruše motility a křečích jícnu, dále dušnost při chronické plicní hypertenzi a u mužů i erektilní dysfunkci. Vidíme tedy, že s pacienty s PNH se primárně může setkat i lékař jiných specializací než jen hematolog či internista.
Možnosti léčby
Historická podpůrná léčba onemocnění spočívá v dodávání chybějících červených krvinek transfuzemi a v prevenci trombotických komplikací podáváním látek zmírňujících srážení krve.
Nemocní s opakovaným masivním rozpadem červených krvinek, tj. s výraznou závislostí na podávání transfuzí, jsou ohroženi několika riziky. Opakované transfuze vedou často k přetížení organismu železem s rizikem jeho ukládání do svaloviny srdce a do jater.
Dalším rizikem je rozvoj alogenních protilátek s následnými komplikacemi po transfuzích.
Pacienti s aplastickou anémií a s PNH klonem, u nichž převažuje postižení kostní dřeně, jsou léčeni v rámci specializovaných hematologických center podáním velmi silné imunosuprese nebo jsou směrováni k provedení transplantace krvetvorných buněk.
V posledním desetiletí se v oblasti terapie PNH objevily monoklonální protilátky, které zcela změnily léčbu onemocnění. Léčba inhibitory komplementu výrazně snížila trombotické riziko nemoci a zmírnila klinické potíže pacientů.
Historicky prvním přípravkem schváleným pro léčbu pacientů s PNH byl ekulizumab. Ekulizumab je monoklonální protilátka, jejíž účinek je cílen na zastavení rozpadu krevních elementů cestou blokády C5 složky komplementu. Léčba pacientů spočívá v pravidelném 14denním parenterálním podávání 900 mg ekulizumabu. Před podáním léčby je povinnost všechny pacienty očkovat proti meningokokové infekci.
Před několika lety se do klinické praxe dostala i druhá generace inhibitoru komplementu, a to ravulizumab. Ravulizumab je upravený inhibitor komplementu, jenž poskytuje rychlou, kompletní a setrvalou inhibici C5 složky komplementu. Tato upravená molekula umožňuje parenterální podání s intervalem osm týdnů a je vhodná pro stabilní pacienty bez výrazné průlomové nebo extravaskulární hemolýzy (EVH).
Cílem efektivní léčby PNH je kontrola IVH a vymizení klinických potíží pacienta. Nyní dostupné inhibitory C5 složky komplementu ekulizumab a ravulizumab zvýšily míru přežití pacientů s PNH a zmírnily projevy onemocnění kontrolou IVH, což se odráží v koncentraci laktátdehydrogenázy [1–3]. I přes velmi účinnou léčbu inhibitory C5 složky komplementu asi 82 % pacientů nedosahuje normalizace hodnoty hemoglobinu. Z těchto pacientů má 10–29 % reziduální IVH a 25–50 % EVH [4–7]. Příčinou tohoto stavu může být zvýšení aktivity EVH na podkladě akumulace C3b složky komplementu a následně C3 mediované opsonizace erytrocytů, jež ústí v extravaskulární fagocytózu. V léčbě těchto pacientů se nyní uplatňují blokátory alternativní dráhy komplementu, jako je například pegcetakoplan [8].
Iptakopan
 V posledních letech bylo v rámci klinických studií intenzivně zkoumáno několik perorálních molekul inhibujících alternativní dráhu komplementu – jedná se o inhibitory faktoru B a D [9]. Jedním z těchto léků je iptakopan (obr. 1).
V posledních letech bylo v rámci klinických studií intenzivně zkoumáno několik perorálních molekul inhibujících alternativní dráhu komplementu – jedná se o inhibitory faktoru B a D [9]. Jedním z těchto léků je iptakopan (obr. 1).
Iptakopan je perorální selektivní inhibitor faktoru B. Faktor B představuje klíčovou serinovou proteázu v alternativní cestě komplementového systému (obr. 2)
[10].
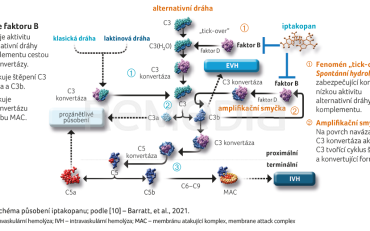 Před několika lety byly publikovány výsledky klinické studie fáze II X2204 (NCT03896152) s iptakopanem (LNP023) v léčbě PNH. Výsledky ukázaly, že u pacientů s PNH, kteří dosud nedostali inhibitor C5, monoterapie iptakopanem po dobu 12 týdnů významně zmírnila IVH a EVH a většina pacientů dosáhla rychlého a dlouhodobého zlepšení bez krevní transfuze. V této studii byl iptakopan dobře snášen a neobjevily se žádné neočekávané bezpečnostní signály [11]. Výsledky další otevřené studie fáze II X2201 (NCT03439839) ukázaly, že u pacientů s PNH s aktivní hemolýzou po standardní léčbě inhibitorem C5 složky komplementu může přidání iptakopanu k této terapii významně zlepšit kontrolu onemocnění. V rámci studie někteří pacienti ukončili léčbu inhibitorem C5 a dále pokračovali v léčbě iptakopanem [11]. Zásadní poznatky ohledně účinnosti iptakopanu u pacientů s PNH přinesly klinické studie fáze III – APPOINT‑PNH a APPLY‑PNH [12,13].
Před několika lety byly publikovány výsledky klinické studie fáze II X2204 (NCT03896152) s iptakopanem (LNP023) v léčbě PNH. Výsledky ukázaly, že u pacientů s PNH, kteří dosud nedostali inhibitor C5, monoterapie iptakopanem po dobu 12 týdnů významně zmírnila IVH a EVH a většina pacientů dosáhla rychlého a dlouhodobého zlepšení bez krevní transfuze. V této studii byl iptakopan dobře snášen a neobjevily se žádné neočekávané bezpečnostní signály [11]. Výsledky další otevřené studie fáze II X2201 (NCT03439839) ukázaly, že u pacientů s PNH s aktivní hemolýzou po standardní léčbě inhibitorem C5 složky komplementu může přidání iptakopanu k této terapii významně zlepšit kontrolu onemocnění. V rámci studie někteří pacienti ukončili léčbu inhibitorem C5 a dále pokračovali v léčbě iptakopanem [11]. Zásadní poznatky ohledně účinnosti iptakopanu u pacientů s PNH přinesly klinické studie fáze III – APPOINT‑PNH a APPLY‑PNH [12,13].
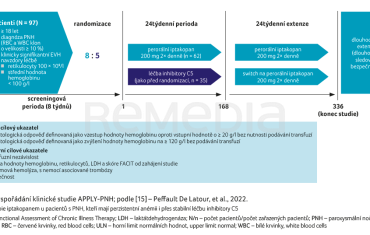
Klinická studie fáze III APPOINT‑PNH byla zaměřena na pacienty s PNH s hemolýzou a anémií, kteří dosud nebyli léčeni inhibitory komplementu. Uspořádání studie znázorňuje obrázek 3 [14].
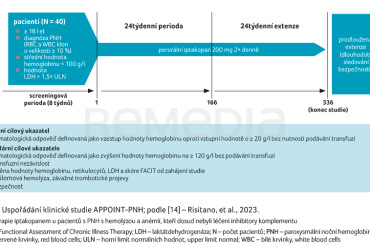
Primárním cílovým ukazatelem studie APPOINT‑PNH bylo dosažení hematologické odpovědi definované jako zvýšení hodnoty hemoglobinu minimálně o 20 g/l oproti výchozímu stavu bez nutnosti podávání transfuzí. Sekundárními cílovými ukazateli pak byly bezpečnost, průlomová hemolýza a transfuzní nezávislost. Studie byla koncipována jako 24týdenní léčba s následnou 24týdenní extenzí a s bezpečnostním sledováním. V rámci klinického sledování bylo dosaženo primárního cíle zvýšení hodnoty hemoglobinu o 20 g/l u 31 z 33 pacientů (92 %), graf 1A [14,15]. Adjustovaná změna střední hodnoty hemoglobinu od výchozího stavu do 126. a 168. dne sledování činila +42,8 g/l (graf 2A) [14,15].
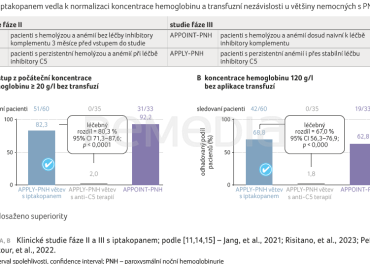 Sesterskou klinickou studií fáze III zaměřenou na pacienty s PNH léčené inhibitory C5, kteří však vykazují perzistentní anémii, byla APPLY‑PNH. Její uspořádání ukazuje obrázek 4 [15]. Primárním cílovým ukazatelem studie bylo zvýšení hodnoty hemoglobinu minimálně o 20 g/l oproti výchozímu stavu bez podání transfuzí a zvýšení hodnoty hemoglobinu na 120 g/l. V rámci sekundárních cílových ukazatelů byly zkoumány bezpečnost, průlomová hemolýza a transfuzní nezávislost. V klinickém sledování bylo dosaženo primárního cíle superiority iptakopanu v obou primárních parametrech oproti inhibitoru C5 složky komplementu. Primárního cílového ukazatele vzestupu hodnoty hemoglobinu o 20 g/l bylo dosaženo u 51 z 60 pacientů, tj. u 82,3 %, ve srovnání se 2 % pacientů léčených inhibitorem C5; zvýšení hodnoty hemoglobinu na 120 g/l bylo dosaženo u 42 z 60 pacientů (graf 1A, B) [14,15]. Adjustovaná změna střední hodnoty hemoglobinu od výchozího stavu do 126. a 168. dne sledování činila +36,3 g/l v rameni s iptakopanem (graf 2B) [14,15].
Sesterskou klinickou studií fáze III zaměřenou na pacienty s PNH léčené inhibitory C5, kteří však vykazují perzistentní anémii, byla APPLY‑PNH. Její uspořádání ukazuje obrázek 4 [15]. Primárním cílovým ukazatelem studie bylo zvýšení hodnoty hemoglobinu minimálně o 20 g/l oproti výchozímu stavu bez podání transfuzí a zvýšení hodnoty hemoglobinu na 120 g/l. V rámci sekundárních cílových ukazatelů byly zkoumány bezpečnost, průlomová hemolýza a transfuzní nezávislost. V klinickém sledování bylo dosaženo primárního cíle superiority iptakopanu v obou primárních parametrech oproti inhibitoru C5 složky komplementu. Primárního cílového ukazatele vzestupu hodnoty hemoglobinu o 20 g/l bylo dosaženo u 51 z 60 pacientů, tj. u 82,3 %, ve srovnání se 2 % pacientů léčených inhibitorem C5; zvýšení hodnoty hemoglobinu na 120 g/l bylo dosaženo u 42 z 60 pacientů (graf 1A, B) [14,15]. Adjustovaná změna střední hodnoty hemoglobinu od výchozího stavu do 126. a 168. dne sledování činila +36,3 g/l v rameni s iptakopanem (graf 2B) [14,15].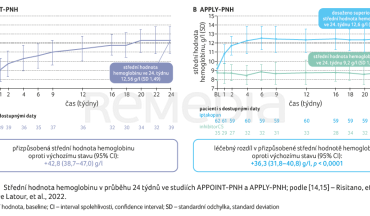
Dva pacienti ve studii APPLY‑PNH měli klinicky vyjádřenou průlomovou hemolýzu, naproti tomu u pacientů léčených inhibitorem C5 to bylo šest nemocných. Ve studii APPOINT‑PNH nebyla průlomová hemolýza zachycena.
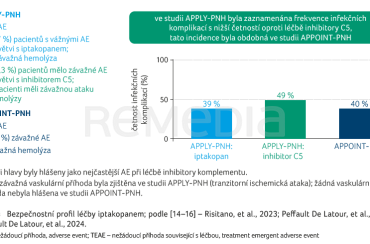
 Bezpečnostní profil přípravku shrnuje graf 3 [14–16]. Ve studii APPLY‑PNH bylo hlášeno šest závažných nežádoucích příhod bez závažné hemolýzy, obdobně čtyři závažné nežádoucí příhody ve studii APPOINT‑PNH. Jedna vaskulární příhoda, a to tranzitorní ischemická ataka, byla hlášena ve studii APPLY‑PNH. Nejčastějšími nežádoucími účinky byly bolest hlavy (16 %), průjem (15 %) a infekce horních cest dýchacích (11 %). Celkový bezpečností profil iptakopanu se jeví jako příznivý.
Bezpečnostní profil přípravku shrnuje graf 3 [14–16]. Ve studii APPLY‑PNH bylo hlášeno šest závažných nežádoucích příhod bez závažné hemolýzy, obdobně čtyři závažné nežádoucí příhody ve studii APPOINT‑PNH. Jedna vaskulární příhoda, a to tranzitorní ischemická ataka, byla hlášena ve studii APPLY‑PNH. Nejčastějšími nežádoucími účinky byly bolest hlavy (16 %), průjem (15 %) a infekce horních cest dýchacích (11 %). Celkový bezpečností profil iptakopanu se jeví jako příznivý.
Závěr
 Paroxysmální noční hemoglobinurie jako příklad vzácného, avšak potenciálně velmi nebezpečného onemocnění dokumentuje výrazný medicínský pokrok v léčbě.
Paroxysmální noční hemoglobinurie jako příklad vzácného, avšak potenciálně velmi nebezpečného onemocnění dokumentuje výrazný medicínský pokrok v léčbě.
Prvotní substitučně symptomatický postup byl nahrazen cílenou léčbou monoklonálními protilátkami blokujícími C5 složku komplementu. Další pokrok vedl k účinné blokádě alternativní dráhy komplementu pegcetakoplanem. Aktuálně prezentovaná malá perorální molekula iptakopanu jako blokátoru alternativní dráhy komplementu přináší další možnost účinné léčby pacientů s paroxysmální noční hemoglobinurií.
MUDr. Libor Červinek, Ph.D.
Interní hematologická a onkologická klinika FN Brno
Jihlavská 20, 625 00 Brno
e-mail: cervinek.libor@fnbrno.cz
Literatura
[1] Lee JW, Sicre de Fontbrune F, Wong Lee Lee L, et al. Ravulizumab (ALXN1210) vs eculizumab in adult patients with PNH naive to complement inhibitors: the 301 study. Blood 2019; 133: 530–539.
[2] Kulasekararaj AG, Hill A, Rottinghaus ST, et al. Ravulizumab (ALXN1210) vs eculizumab in C5‑inhibitor‑experienced adult patients with PNH: the 302 study. Blood 2019; 133: 540–549.
[3] Brodsky RA, Peffault De Latour R, Rottinghaus ST, et al. A Prospective Analysis of Breakthrough Hemolysis in 2 Phase 3 Randomized Studies of Ravulizumab (ALXN1210) Versus Eculizumab in Adults with Paroxysmal Nocturnal Hemoglobinuria. Blood 2018; 132(Suppl 1): 2330.
[4] Risitano AM, Marotta S, Ricci P, et al. Anti‑complement Treatment for Paroxysmal Nocturnal Hemoglobinuria: Time for Proximal Complement Inhibition? A Position Paper From the SAAWP of the EBMT. Front Immunol 2019; 10: 1157.
[5] Risitano AM, Peffault de Latour R. How we(’ll) treat paroxysmal nocturnal haemoglobinuria: diving into the future. Br J Haematol 2022; 196: 288‑303.
[6] Debureaux PE, Kulasekararaj AG, Cacace F, et al. Categorizing hematological response to eculizumab in paroxysmal nocturnal hemoglobinuria: a multicenter real‑life study. Bone Marrow Transplant 2021; 56: 2600‑2602.
[7] Versmold K, Alashkar F, Raiser C, et al. Long‑term outcomes of patients with paroxysmal nocturnal hemoglobinuria treated with eculizumab in a real‑world setting. Eur J Hematol 2023; 111: 84‑95.
[8] Bhak RH, Mody‑Patel N, Baver SB, et al. Comparative effectiveness of pegcetacoplan versus ravulizumab in patients with paroxysmal nocturnal hemoglobinuria previously treated with eculizumab: a matching‑adjusted indirect comparison. Curr Med Res Opin 2021; 37: 1913–1923.
[9] Schubart A, Flohr S, Junt T, Eder J. Low‑molecular weight inhibitors of the alternative complement pathway. Immunol Rev 2023; 313: 339–357.
[10] Barratt J, Weitz I. Complement Factor D as a Strategic Target for Regulating the Alternative Complement Pathway. Front Immunol 2021; 12: 71257.
[11] Jang JH, Wong LL, Ko B‑S, et al. 12‑Month Analysis of a Phase 2 Study of Iptacopan (LNP023) Monotherapy for Paroxysmal Nocturnal Hemoglobinuria. Blood 2021; 138(Suppl 1): 2173.
[12] Peffault De Latour R, Kulasekararaj AG, Scheinberg P, et al. Clinical Breakthrough Hemolysis during Monotherapy wit oral Factor B inhibitor Iptacopan Is Generally Not Severe and Managed without Treatment Discontinuation: 48 Week Data from the Phase III APPLY‑PNH and APPOINT‑PNH Trials in Paroxysmal Nocturnal Hemoglobinuria. Blood 2023; 142(Suppl 1): 1338.
[13] Risitano AM, Kulasekararaj AG, Roeth A, et al. Factor B inhibition with Oral Iptacopan Monotherapy Demonstrates Sustained Long‑Term Efficacy and Safety in anti‑C5‑Treated Patients with Paroxysmal Nocturnal Hemoglobinuria and Persistant anemia: Final 48‑Week Results from Multicenter, Phase III APPLY‑PNH Trial. Blood 2023; 142(Suppl 1): 571.
[14] Risitano AM, Han B, Ueda Y, et al. Oral Complement Factor B Inhibitor Iptacopan Monotherapy Improves Hemoglobin to Normal/Near‑Normal Levels in Paroxysmal Nocturnal Hemoglobinuria Patients Naïve to Complement Inhibitors: Phase III APPOINT‑PNH Trial. 49th Annual Meeting of the European Society for Blood and Marrow Transplantation (EBMT); April 23–36, 2023; Paris, France. Abstract OS12‑06.
[15] Peffault de Latour R, Röth A, Kulasekararaj A, et al. Oral Monotherapy with Iptacopan, a Proximal Complement Inhibitor of Factor B, Has Superior Efficacy to Intravenous Terminal Complement Inhibition with Standard of Care Eculizumab or Ravulizumab and Favorable Safety in Patients with Paroxysmal Nocturnal Hemoglobinuria and Residual Anemia: Results from the Randomized, Active‑Comparator‑Controlled, Open‑Label, Multicenter, Phase III APPLY‑PNH Study. 64th American Society of Hematology Annual Meeting & Exposition (ASH); December 10–13, 2022; New Orleans, LA. Abstract LBA‑2.
[16] Peffault De Latour R, Risitano AM. Oral Iptacopan Monotherapy in Paroxysmal Nocturnal Hemoglobinuria. N Engl J Med 2024; 390: 994–1008.