Lapatinib v léčbě karcinomu prsu
Lapatinib je aktivní malá molekula účinkující jako duální inhibitor tyrozinkinázy vyvinutá k perorálnímu podání. Mechanismus účinku předurčuje tuto látku k použití v léčbě řady tumorů exprimujících ve zvýšené míře ErbB-1 a/nebo ErbB-2. Bylo prokázáno, že neexistuje zkřížená rezistence mezi trastuzumabem a lapatinibem. Jde o velmi slibnou látku, jejíž účinek byl potvrzen u pokročilého karcinomu prsu předléčeného kombinací cytostatik a trastuzumabu. Nyní probíhá řada multicentrických mezinárodních studií, ve kterých je lapatinib použit v první linii léčby pokročilého nebo metastazujícího karcinomu prsu. V současné době zkoumají četné studie účinek lapatinibu v adjuvantní léčbě nepokročilého karcinomu prsu. Předpokládá se možnost prostupnosti lapatinibu hematoencefalickou bariérou, a proto se zkouší efekt této látky u mozkových metastáz. Lapatinib se nyní nachází v časné fázi klinického výzkumu u dalších solidních nádorů se zvýšenou tvorbou ErbB-1 a ErbB-2, a to zejména u pokročilého renálního karcinomu a pokročilého karcinomu hlavy a krku.
Úvod
Karcinom prsu představuje problém nejen medicínský, ale i celospolečenský. Je nejhlavnější příčinou úmrtí žen způsobených rakovinou. Ročně zemře na celém světě na 400 000 žen na tuto chorobu. V Evropě činil v roce 2004 nově diagnostikovaný karcinom prsu 27 % ze všech diagnostikovaných zhoubných nádorů a týž rok bylo zaznamenáno 130 000 úmrtí způsobených rakovinou prsu. V ČR se v roce 2004 nově diagnostikovalo na 7600 nových případů tohoto onemocnění a v témže roce podlehlo uvedené chorobě takřka 2000 žen [1].
Karcinom prsu a HER2/neu
Z četných mnohatisícových mezinárodních studií vyplývá, že riziko rekurencí u karcinomu prsu trvá, a to i u nepokročilého onemocnění, ještě po třiceti letech od stanovení diagnózy. U metastazujícího onemocnění činí průměrná doba celkového přežití 18–30 měsíců. Ženy, jejichž nádor exprimuje ve zvýšené míře receptor pro epidermální růstový faktor typu 2 ErbB-2 (HER2, též HER2/neu), jsou v nebezpečí zvýšeného rizika progrese onemocnění a smrti. Předpokládá se, že v populaci žen s karcinomem prsu je 15–20 % nemocných s nádorem, u něhož je patrná over-exprese HER2/neu [2, 3]. Na podkladě řady kontrolovaných multicentrických studií se vyvinuly terapeutické strategie s cílem blokovat signální cestu HER2, a tím zlepšit léčebné výsledky u uvedené skupiny nemocných žen. Trastuzumab – rekombinantní humanizovaná monoklonální protilátka, která blokuje extracelulární doménu proteinu HER2, je klíčovou součástí léčebných schémat pokročilého metastazují-cího i nepokročilého karcinomu prsu se zjištěnou pozitivitou HER2/neu [4].
Problémem je však rezistence karcinomu prsu vůči dostupné léčbě, která již nedokáže naplnit očekávání žádaného léčebného efektu u postižené skupiny nemocných. Trastuzumab se tedy stal (jak již řečeno) standardní součástí adjuvantní léčby spolu s chemoterapií. Přesto je řada nemocných, která žije s prokázanou over-expresí HER2/neu a adjuvanci trastuzumabem nepodstoupila, protože tato léčba v době stanovení jejich diagnózy nebyla ještě schválena. Naproti tomu existují již dnes na světě (nikoliv u nás) tisíce nemocných žen, které adjuvantní léčbu trastuzumabem prodělaly. Obě tyto skupiny pa-cientek jsou přesto ohroženy zvýšeným rizikem relapsu. Nejsou však k dispozici žádná data, která by nás opravňovala k přídatnému použití trastuzumabu u těch pa-cientek, které se léčily adjuvantně standardními chemickými režimy, jejich léčba skončila před více než sedmi týdny, jsou bez relapsu a dosud adjuvanci trastuzumabem nedostaly. U těch nemocných, které se adjuvanci trastuzumabem podrobily a nyní podlehly relapsu, není známo, zda by opětné podání téhož preparátu po více než sedmi týdnech od ukončení adjuvance bylo eventuálně efektivní.
Při léčbě trastuzumabem se u pokročilého karcinomu někdy vyvine rezistence na tento preparát a v adjuvanci dojde někdy ze stejných příčin k progresi [5, 6].
Mechanismus účinku lapatinibu
Z výše uvedených důvodů se hledají alternativy k blokaci HER2. Tato alternativa se zřejmě našla v jiné látce, kterou představuje malá molekula lapatinib. Z preklinických studií vyplývá, že zde není zkřížená rezistence mezi trastuzumabem a lapatinibem [7, 8].
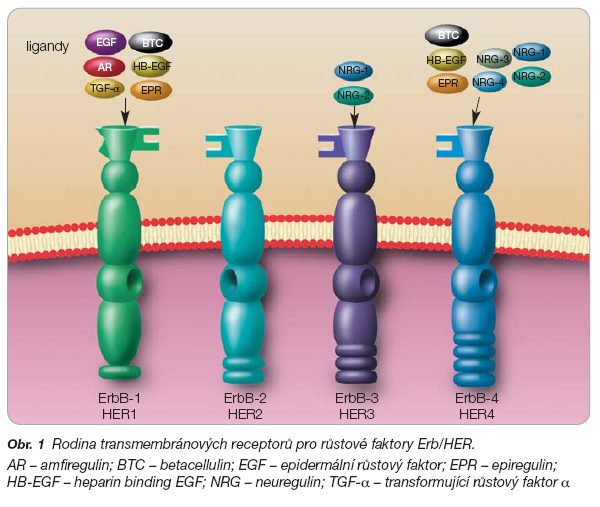
Lapatinib je aktivní malá molekula účinkující jako duální inhibitor tyrozinkinázy, vyvinutá k perorálnímu použití. Inhibuje tyrozinkinázovou složku receptorů ErbB-1 (EGFR, receptor pro epidermální růstový faktor) a ErbB-2 (HER2/neu), patřících do rodiny transmembránových receptorů pro růstové faktory Erb/HER (obr. 1).
Stimulace uvedených receptorů vede k proliferaci buněk a k mnoha dalším pochodům souvisejícím s progresí, invazí a metastazováním nádorů. Zvýšená tvorba těchto receptorů, zjištěná u mnoha lidských nádorů (nejen u karcinomu prsu), je spojena s horší prognózou a s podstatně nižším celkovým přežitím.
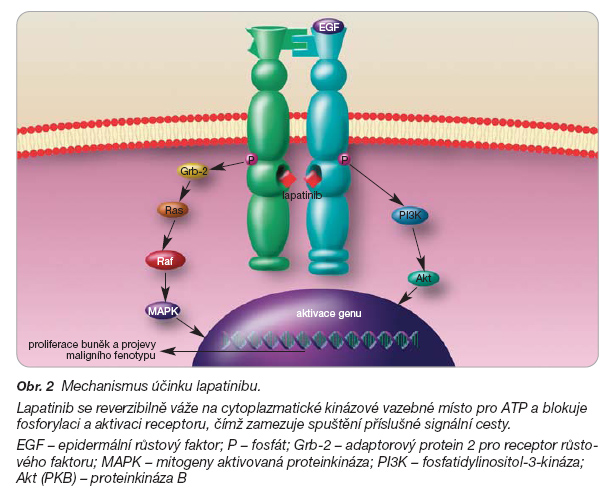
Lapatinib, malá molekula inhibující oba receptory, a to ErbB-1 a ErbB-2, se reverzibilně váže na cytoplazmatické kinázové vazebné místo pro ATP a blokuje fosforylaci a aktivaci receptoru, čímž zamezuje spuštění příslušné signální cesty (obr. 2).
Inhibitor obou receptorů má řadu výhod ve srovnání s inhibitorem pouze jednoho z receptorů. Z literatury vyplývá, že u řady buněk, které exprimují více členů rodiny ErbB a jiné receptory růstových faktorů (např. IGF-1R), nemusí nekompletní blokáda receptorů ErbB-1 a ErbB-2 vést k blokaci signálních cest pro růst a přežití těchto buněk. Zvýšená exprese epidermálního růstového faktoru (EGF) nebo transformujícího růstového faktoru a (TGF-a), jež jsou ligandy pro ErbB-1, je nepříznivým prognostickým faktorem. Lapatinib vykazuje mnohem větší inhibici nádorových buněk s prokázanou aktivací TGF-a ve srovnání s pouhými antagonisty receptorů ErbB-1 a/nebo ErbB-2. Z uvedených poznatků vyplývá, že duální inhibitor zasahující jak ErbB-1, tak ErbB-2 povede k vyššímu léčebnému účinku než inhibitory zasahující pouze jeden z uvedených receptorů [9, 10].
Lapatinib u pokročilého a metastazujícího karcinomu prsu
V říjnu 2006 byla podána žádost výrobce o schválení přípravku obsahujícího lapatinib k Evropskému úřadu pro léčiva (EMEA), v níž se požaduje schválení a distribuce uvedeného přípravku v kombinaci s přípravkem obsahujícím kapecitabin pro léčbu pokročilých či metastazujících forem karcinomu prsu s pozitivitou HER2/neu u žen, které se již v minulosti pro toto onemocnění léčily (včetně léčby trastuzumabem). Lapatinib byl v březnu 2007 schválen americkým Úřadem pro kontrolu potravin a léků (FDA). V České republice není dosud přípravek obsahující lapatinib registrován.
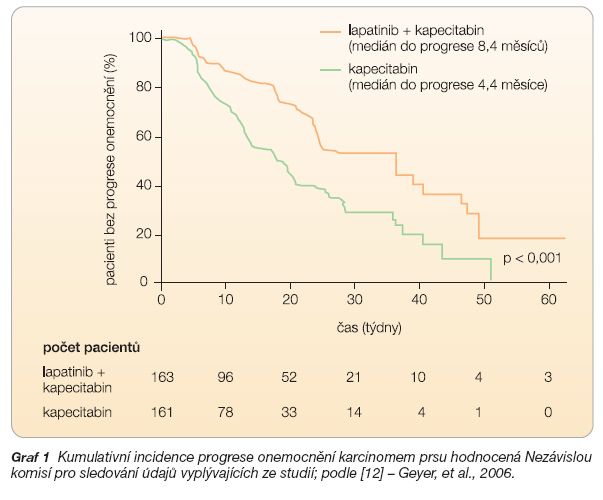
Žádost o schválení přípravku obsahovala analýzu údajů získaných z hlavní studie EGF100151 [11]. Je to mezinárodní, multicentrická, otevřená, randomizovaná studie třetí fáze, do které vstoupilo 324 žen s pokročilým či metastazujícím karcinomem prsu se zjištěnou zvýšenou expresí HER2/neu. U žen zahrnutých do studie selhala předchozí chemoterapie (antracykliny a taxany) kombinovaná s trastuzumabem. Nemocné byly randomizovány do dvou ramen. V prvním rameni dostávaly kombinovanou léčbu, a to lapatinib per-orálně 1250 mg denně kontinuálně dlouhodobě a kapecitabin v dávce 2000 mg/m2 tělesného povrchu denně po dva týdny v třítýdenním cyklu. V druhém rameni dostávaly pacientky pouze kapecitabin v dávce 2500 mg/m2 po dva týdny v třítýdenním cyklu. Primárním cílem studie bylo porovnání doby do progrese v obou ramenech. Nábor nemocných započal 29. března 2004 a interim analýza byla provedena 20. března 2006. Podrobným statistickým zpracováním se zjistilo, že v rameni s kombinací přípravků (lapatinib plus kapecitabin) je medián doby do progrese signifikantně delší (činí 36,7 týdnů, tj. 8,4 měsíců) oproti rameni s monoterapií, kde činí pouze 19,1 týdnů, tj. 4,4 měsíce (p < 0,001), viz graf 1.
Tohoto zlepšení se dosáhlo bez jakéhokoliv zvýšení incidence nebo intenzity vedlejších účin-ků či symptomatických kardiálních příhod [12].
K nejčastějším nežádoucím událostem (> 25 %) patřily v rameni s kombinací přípravků především projevy gastrointestinální (průjem, nauzea, zvracení) a projevy zejména typu „hand-foot syndromu" (zarudnutí a změny čití na dlaních rukou a ploskách nohou). Veškeré nežádoucí účinky byly pouze mírné až střední závažnosti. Jakékoliv vedlejší účinky kardiovaskulárního charakteru jsou bezvýznamné, jak vyplývá i z jiné rozsáhlé práce provedené nejprve u 2812 a posléze u 3358 nemocných [13, 14].
Vzhledem k předpokládané možnosti kombinací lapatinibu s kardiotoxickými cytostatiky a trastuzumabem vyvstala potřeba analyzovat podrobně vztah tohoto preparátu k možnému poškození kardiálních funkcí. Analýza vedlejších kardiálních účinků u nemocných ze 43 studií vykázala snížení LVEF (ejekční frakce levé komory) průměrně u 1,6 % nemocných. Četnost symptomatického snížení LVEF činila však pouze 0,2 %. Subanalýza získaných dat prokázala u skupiny pacientů předléčených režimy na základě antracyklinů bez trastuzumabu (n = 698), dále u pacientů léčených týmiž chemickými režimy následovanými podáváním trastuzumabu (n = 700) a konečně u nemocných léčených bez antracyklinů a bez trastuzumabu (n = 2200) snížení LVEF přibližně v 1,4–1,6 %, přičemž symptomatické snížení LVEF se vyskytlo v pouhých 0,1–0,3 %. Kardiální příhody byly reverzibilní a krátkého trvání s mediánem přibližně 13 týdnů. Předběžná analýza u nemocných léčených kombinací trastuzumabu a lapatinibu nepotvrdila zvýšenou kardiotoxicitu.
V březnu 2006 podala Nezávislá komise pro sledování údajů vyplývajících ze studií (IDMC) jednomyslné doporučení k ukončení dalšího zařazování pacientek do uvedené studie. Důvodem byl časný úspěch hodnocení, které zcela naplnilo svůj hlavní cíl, tj. sledování a zhodnocení doby do progrese v obou ramenech. Hodnocení studie rovněž splnilo předem dané podmínky k ukončení studie vydané zmíněnou Nezávislou komisí. Výše uvedené údaje byly poprvé zveřejněny v rámci 42. meetingu ASCO 2006 a posléze publikovány i časopisecky [12, 15].
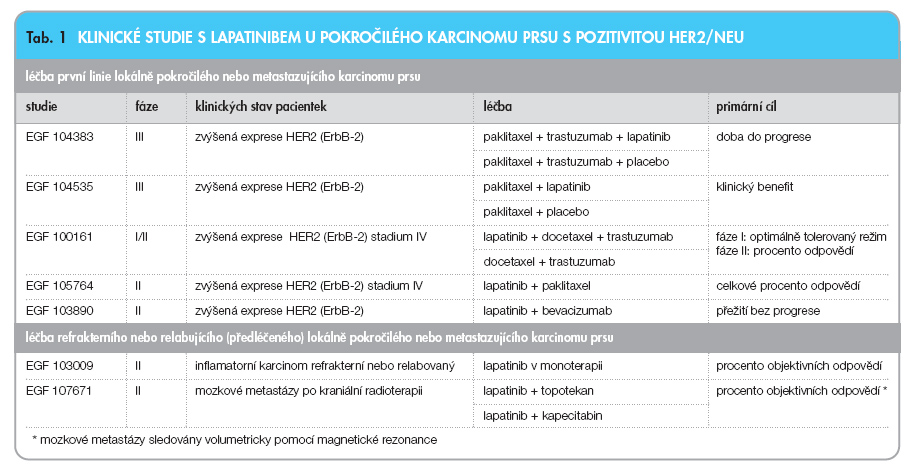
Na tomtéž 42. meetingu ASCO se kolektivy autorů zaměřily na představení lapatinibu jako malé molekuly procházející hematoencefalickou bariérou a zasahující v mozku cíleně nádorovou tkáň. Je známo, že mozkové metastázy u karcinomu prsu jsou současnou chemoterapií neovlivnitelné [16, 17]. Lapatinib se nyní podrobuje rozsáhlému hodnocení v randomizovaných multicentrických studiích II. fáze s cílem posoudit vliv monoterapie lapatinibem na mozkové metastázy. Sledování mozkových lézí je velmi sofistikované a k hodnocení se používá zejména magnetická rezonance [18]. Neméně slibné jsou i studie II. fáze věnované refrakternímu a relabujícímu inflamatornímu karcinomu prsu [19]. Přehled probíhajících studií s lapatinibem u pokročilého karcinomu prsu podává tab. 1.
Lapatinib v adjuvantní léčbě nepokročilého karcinomu prsu
Úspěchy s kombinovanou léčbou lapatinibem a kapecitabinem u nemocných s pokročilým a metastazujícím karcinomem prsu podnítily zkušené výzkumníky k sestavování studií s lapatinibem použitým v adjuvantní léčbě nepokročilého karcinomu prsu.
ALTTO (Adjuvant Lapatinib and/or Tras-tuzumab Treatment Optimization) je mezinárodní, randomizovaná, otevřená studie ve III. fázi, určená pro adjuvanci nepokročilého karcinomu prsu s overexpresí HER2/neu. Studie je čtyřramenná a podle plánu do ní vstoupí 8000 žen s ukončenou standardní adjuvantní chemoterapií. V prvním rameni studie se pacientky budou léčit během 46 měsíců trastuzumabem (8 mg/kg a posléze 6 mg/kg i.v. každé tři týdny po 52 týdnů), ve druhém rameni budou léčeny lapatinibem (1500 mg p.o. denně po 52 týdnů), ve třetím budou dostávat sukcesivně trastuzumab následovaný lapatinibem (trastuzumab 4 mg/kg, posléze 2 mg/kg i.v. každých 7 dní po 12 týdnů a po šestitýdenní pauze lapatinib 1500 mg p.o. denně po 34 týdnů) a ve čtvrtém rameni bude léčba kombinovaná trastuzumab + lapatinib (lapatinib 1000 mg p.o. denně po 52 týdnů a současně s ním i trastuzumab 8 mg/kg a posléze 6 mg/kg každé 3 týdny po 52 týdnů). Primárním cílem je porovnání délky beznádorového intervalu v jednotlivých ramenech, sekundárním cílem je zjištění celkové doby přežití, doby do rekurence, doby do výskytu vzdálených metastáz a dále zjištění bezpečnosti a snášenlivosti. Už samo uspořádání studie slibuje velmi zajímavé výsledky, ať již budou jakékoliv.
Během sympozia v San Antoniu (San Antonio Breast Cancer Symposium 2006) zveřejnili výzkumníci z Massachusetts General Hospital datum zahájení mezinárodní multicentrické randomizované studie TEACH (Tykerb Evaluation After Chemotherapy). Stane se první studií III. fáze, která zkoumá oproti placebu, zda adjuvantní léčba lapatinibem u nepokročilého HER2/neu pozitivního karcinomu prsu prodlouží beznádorový interval. Předpokládá se, že do studie bude zahrnuto na 3000 žen ze 450 center ve 30 zemích světa. Nemocné s pozitivními i negativními regionálními uzlinami vstoupí do studie po ukončení adjuvantní chemoterapie bez trastuzumabu. Pacientky budou randomizovány do dvou ramen, přičemž v jednom rameni budou dostávat lapatinib 1500 mg p.o. denně a ve druhém placebo. Pacientky budou pokračovat v léčbě maximálně 12 měsíců a nebo do relapsu onemocnění. Všechny pacientky budou sledovány do smrti a nebo do konečného uzavření studie. Primárním cílem je porovnání doby beznádorového přežití v obou ramenech studie. Uvedená studie TEACH je první, která používá duální inhibitor tyrozinkinázy lapatinib v čisté adjuvantní léčbě nepokročilého karcinomu prsu, s prokázanou zvýšenou expresí HER2/neu.
Lapatinib v léčbě jiných solidních nádorů
Lapatinib se v současné době nachází v časné fázi klinického výzkumu pro léčbu řady dalších solidních nádorů se zvýšenou tvorbou ErbB-1 a ErbB-2. Jedná se zejména o pokročilý renální karcinom [20] a pokročilé karcinomy hlavy a krku [21, 22]. První výsledky zveřejněných studií jsou velmi slibné.
Závěr
Lapatinib je velice slibné léčivo, u kterého se zatím prokázal vysoce signifikantní účinek u předléčeného HER2/neu pozitivního pokročilého karcinomu prsu v kombinaci s kapecitabinem. Předběžné výsledky studií věnovaných léčbě mozkových metastáz a léčbě inflamatorního karcinomu prsu jsou velmi povzbudivé. Místo lapatinibu v adjuvantní léčbě nepokročilého karcinomu prsu nám v budoucnu odhalí studie III. fáze, které nyní začínají.
Lapatinib jako duální inhibitor tyrozinkinázy bude mít nepochybně své místo i v léčbě jiných solidních nádorů exprimujících ErbB-1 (EGFR) a ErbB-2 (HER2). K tomu nám snad již v blízké budoucnosti více řeknou výsledky studií III. fáze týkající se renálního karcinomu a karcinomů hlavy a krku.
Seznam použité literatury
- [1] Novotvary 2004. ÚZIS, Praha 2007.
- [2] Brand FX, Ravanel N, Gauchez AS, et al. Prospect for anti-her2 receptor therapy in breast cancer. Anticancer Res 2006; 26 (1B): 715–722.
- [3] Burstein HJ. The distinctive nature of HER-2 positive breast cancer. N Eng J Med 2005; 353: 1652–1654.
- [4] Yeon CH, Pegram MD. Anti-erbB-2 antibody trastuzumab in the treatment of HER2-ampli-fied breast cancer. Invest New Drugs 2005; 23: 391–409.
- [5] Montemurro F, Donadio M, Clavarezza M, et al. Outcome of patients with HER2-positive advanced breast cancer progressing during trastuzumab-based therapy. Oncol 2006; 11: 318–324.
- [6] Xia W, Bacus S, Hedge P, et al. Autoresistance to ErbB2 kinase inhibitors: elucidating mechanisms and identfying strategies to prevent its onset in breast cancer. ASCO Ann Meeting Proc 2006; 2075.
- [7] Konecny GE, Pegram MD, Venkatesan N, et al. Activity of the dual kinase inhibitor lapatinib (GW572016) against HER-2-overexpressing and trastuzumab-treated breast cancer cells. Cancer Res 2006; 66: 1630–1639.
- [8] Rusnak DW, Lackey K, Affleck K, et al. The effects of the novel, reversible epidermal growth factor receptor/ErbB-2 tyrosine kinase inhibitor, GW2016, on the growth of human normal and tumor-derived cell lines in vitro and in vivo. Mol Cancer Ther 2001; 1: 85–94.
- [9] Spector NL, Xia W, Burris H, et al. Study of the biological effects of lapatinib, a reversible inhibitor of ErbB1 and ErbB2 tyrosine kinases, on tumor growth and survival pathways in patients with advanced malignancies. J Clin Oncol 2005; 23: 2502–2512.
- [10] Wood ER, Truesdale AT, McDonald OB, et al. A unique structure for epidermal growth factor receptor bound to GW572016 (lapatinib): rela-tionships among protein conformation, inhibitor off-rate, and receptor activity in tumor cells. Cancer Res 2004; 64: 6652–6659.
- [11] Schwartz G, Chu QS, Hammond LA, et al. Phase I clinical, biology, and pharmacokinetic study of the combination of GW 572016 and capecitabine in patients with advanced solid tumors. Proc Am Soc Clin Oncol 2004; 23: (Suppl. 14S): 212a. Abstract.
- [12] Geyer CE, Forster J, Lindquist D, et al. Lapatinib plus Capecitabine for HER2 – positive advanced breast cancer. N Engl J Med 2006; 353: 2733–2743.
- [13] Perez EA, Byrne JA, Hammond IW, et al. Results of an analysis of cardiac function in 2,812 patients treated with lapatinib. ASCO Ann Meeting Proc 2006; 583.
- [14] Perez EA, Byrne JA, Hammond IW, et al. Cardiac safety experience in 3358 patients treated with lapatinib. Meeting of the European Society of Medical Oncology (ESMO). 2006a.
- [15] Geyer CE Jr, et al. Phase III Randomized, Open-Label, International Study Comparing Lapatinib and Cepecitabine vs. Capecitabine in Women with Refractory Advanced or Metastatic Breast Cancer (EGF100151). In ASCO 2006; 503.
- [16] Clayton AJ, Danson S, Jolly S, et al. Incidence of cerebral metastases in patients treated with trastuzumab for metastatic breast cancer. Br J Cancer 2004; 91: 639–643.
- [17] Lin NU, Bellon JR, Winer EP. CNS metastases in breast cancer. J Clin Oncol 2004; 22: 3608–3617.
- [18] Lin NU, Carey LA, Liu MC, et al. Phase II trial of lapatinib for brain metastases in patients with HER2+ breast cancer. ASCO Ann Meeting Proc 2006; 503.
- [19] Spector NL, Blackwell K, Hurley J, et al. EGF103009, a phase II trial of lapatinib mono-therapy in patients with relapsed/refractory inflammatory breast cancer (IBC): Clinical activity and biologic predictors of response. ASCO Ann Meeting Proc 2006; 502.
- [20] Ravaud A, Gardner J, Hawkins R, et al. Efficacy of lapatinib in patients with high tumor EGFR expression: Results of a phase trial in advanced renal cell carcinoma (RCC). ASCO Ann Meeting Proc 2006; 4502.
- [21] Abidoye OO, Cohen EE, Wong SJ, et al. A phase II study of lapatinib (GW572016) in recurrent/metastatic (R/M) squamous cell carcinoma of the head and neck (SCCHN). ASCO Ann Meeting Proc 2006; 5568.
- [22] Harrington KJ, Bourhis J, Nutting CM, et al. A phase I, open-label study of lapatinib plus chemoradiation in patients with locally advanced squamous cell carcinoma of the head and neck (SCCHN). ASCO Ann Meeting Proc 2006; 5553.