Inhibice osy renin-angiotenzin-aldosteron – jsou rozdíly ve strategii, jsou rozdíly mezi léčivy
Cílem tohoto článku je podat přehled o možnostech inhibice systému renin-angiotenzin-aldosteron, srovnání skupiny inhibitorů angiotenzin konvertujícího enzymu (ACE) s blokátory receptoru AT1 pro angiotenzin II z hlediska účinnosti. V řadě klíčových indikací je doložen výraznější efekt inhibitorů ACE. Další část textu je věnována vnitroskupinovému srovnání jednotlivých inhibitorů ACE. Uvedeny jsou rozdíly ve snížení mortality a morbidity v řadě indikací. Při nepřímém srovnání je velmi pravděpodobný výraznější efekt perindoprilu a ramiprilu. Závěrečná část upozorňuje na význam farmakogenetiky, tj. řady polymorfismů v systému renin-angiotenzin-aldosteron, a vliv paralelních systémů na výslednou účinnost léčby.
Úvod
Blokáda hyperaktivovaného systému renin-angiotenzin-aldosteron (RAAS) je klíčovou strategií léčby hypertenze, systolického srdečního selhání, sekundární prevence aterotrombotických příhod či nefropatie s proteinurií. Společným jmenovatelem těchto klinických jednotek je významná hyperaktivace regulačních mechanismů: na jedné straně RAAS, na straně druhé systému sympatoadrenálního.
Chronická hyperaktivace těchto defenzivních systémů má významný podíl na progresi choroby a deterioraci orgánových funkcí. Stejně jako u ostatních regulačních a reparativních systémů platí, že optimálně působí při akutním krátkodobém ohrožení organismu (adapativní reakce). V případě aktivace RAAS přispívá k udržení cirkulace a zachování homeostázy. Naopak při dlouhodobém působení patologického stavu vede hyperaktivace RAAS k reakci maladaptační, tj. konkrétně k vývoji hypertenze, k retenci tekutin, k protrombotickému stavu, k degenerativním změnám v cirkulačním systému (včetně fibrózy a aterogeneze), k poškození glomerulu s proteinurií a deterioraci renálních funkcí a k řadě dalších změn. Jinak řečeno, „příroda chrání akutně ohrožené, nikoli však chronicky nemocné“. Proto je u řady kardiovaskulárních (KV), metabolických či renálních onemocnění, která jsou spojena s chronickou aktivací RAAS, nutno potlačit aktivitu tohoto systému či zamezit dopadu dlouhodobé stimulace.
Vlastní RAAS můžeme tlumit na několika úrovních. Výdej reninu potlačují betablokátory, aktivitu reninu (jako proteázy, nikoli jako hormonu) inhibitory reninu, konverzi angiotenzinu I (AI) na angiotenzin II (AII) inhibitory angiotenzin konvertujícího enzymu (inhibitory ACE), periferní efekt stimulace receptorů pro AII podtypu 1 pak blokátory receptoru AT1 čili sartany, a konečně efekt aldosteronu tlumí blokátory mineralokortikoidních receptorů.
Účinek betablokátorů na snížení výdeje reninu je jen částečný, vedle adrenergních receptorů β1 se na stimulaci reninu podílejí též osmo-, chemo- a volumoreceptory. Klinický význam inhibitorů reninu nebyl dosud stanoven. U aliskirenu je doložen antihypertenzní účinek bez určení dopadu na prognózu nemocných a dále víme, že není vhodná jejich kombinace s jinými způsoby inhibice RAAS.
Hlavní strategií blokády syst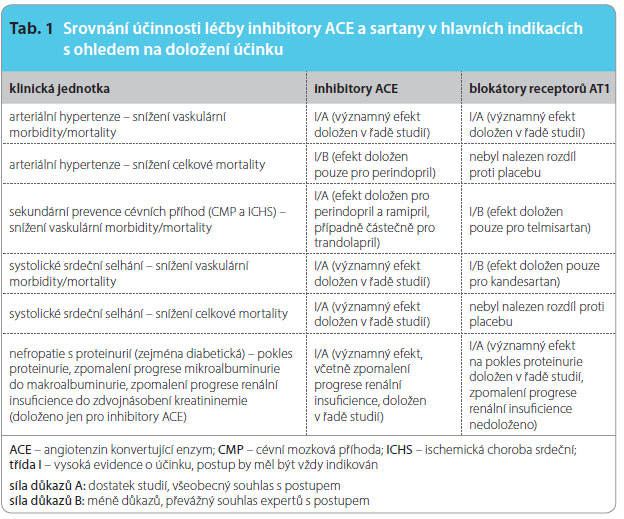 ému tak jsou inhibitory ACE a sartany, respektive na úrovni aldosteronu blokátory mineralokortikoidních receptorů. Blokáda těchto receptorů je výhodnější, neboť inhibice sekrece aldosteronu inhibitory ACE či sartany je jen částečná, vedle receptorů AT1 kontrolují výdej zejména chemoreceptory a adrenokortikotropní hormon (ACTH).
ému tak jsou inhibitory ACE a sartany, respektive na úrovni aldosteronu blokátory mineralokortikoidních receptorů. Blokáda těchto receptorů je výhodnější, neboť inhibice sekrece aldosteronu inhibitory ACE či sartany je jen částečná, vedle receptorů AT1 kontrolují výdej zejména chemoreceptory a adrenokortikotropní hormon (ACTH).
Zaměřme se proto na inhibitory ACE a sartany a podívejme se, zda existují rozdíly v účinnosti mezi těmito skupinami i rozdíly uvnitř skupiny inhibitorů ACE. Najdeme-li rozdíly, pak se pokusme určit jejich příčiny.
Existují rozdíly mezi skupinou inhibitorů ACE a sartanů?
Inhibujeme-li aktivitu regulačního systému, dalo by se předpokládat, že různými cestami dojdeme k obdobnému výsledku. Tento předpoklad platí jen omezeně. V hlavních indikacích se možnosti užití obou skupin shodují, nicméně dopad léčby na rozhodující ukazatele účinnosti je rozdílný, viz tab. 1.
Zaměřme se blíže na jednotlivé indikace.
Hypertenze
V léčbě hypertenze jsou inhibitory ACE mírně účinnější než blokátory receptoru AT1. Velká metaanalýza 39 studií, která zahrnov![Graf 1 Nepřímé porovnání účinku inhibitorů ACE a sartanů na celkovou a KV mortalitu/morbiditu; podle [1] – Strauss, et al., 2006. ACE – angiotenzin konvertující enzym; CMP – cévní mozková příhoda; ICHS – ischemická choroba srdeční; IM – infarkt myokardu; KV – kardiovaskulární; RRR – relative risk reduction, redukce relativního rizika](https://www.remedia.cz/photo-a-29945---.jpg) ala více než 150 tisíc probandů užívajících inhibitory ACE, a 11 studií, jichž se zúčastnilo více než 55 tisíc probandů léčených sartany, ukázala (v porovnání s aktivní antihypertenzní léčbou) příznivý dopad inhibitorů ACE i sartanů na snížení rizika iktu. Naopak výskyt infarktu myokardu byl významně snížen při podávání inhibitorů ACE, ale zvýšen při podávání sartanů, viz graf 1 [1].Při sledování poklesu celkové mortality u hypertoniků mají inhibitory ACE doloženo snížení tohoto ukazatele asi o 10 %; sartany v této ani v recentnější metaanalýze mortalitu nesnížily [2]. Bohužel srovnání obou skupin je pouze nepřímé, reprezentativní head-to-head studie nebyly provedeny. Nicméně větší účinek inhibitorů ACE na snížení výskytu KV příhod je na základě výsledků metaanalýz pravděpodobný.
ala více než 150 tisíc probandů užívajících inhibitory ACE, a 11 studií, jichž se zúčastnilo více než 55 tisíc probandů léčených sartany, ukázala (v porovnání s aktivní antihypertenzní léčbou) příznivý dopad inhibitorů ACE i sartanů na snížení rizika iktu. Naopak výskyt infarktu myokardu byl významně snížen při podávání inhibitorů ACE, ale zvýšen při podávání sartanů, viz graf 1 [1].Při sledování poklesu celkové mortality u hypertoniků mají inhibitory ACE doloženo snížení tohoto ukazatele asi o 10 %; sartany v této ani v recentnější metaanalýze mortalitu nesnížily [2]. Bohužel srovnání obou skupin je pouze nepřímé, reprezentativní head-to-head studie nebyly provedeny. Nicméně větší účinek inhibitorů ACE na snížení výskytu KV příhod je na základě výsledků metaanalýz pravděpodobný.
Sekundární prevence aterotrombotických příhod
Indikace sekundární prevence aterotrombotických příhod byla prověřována nejprve u ramiprilu (studie HOPE) a perindoprilu (studie EUROPA a PROGRESS), později i u trandolaprilu (studie PEACE). Prvé dvě studie ukázaly pokles výskytu velkých KV příhod o pětinu, pro trandolapril účinek v sekundární prevenci doložen nebyl. Ze skupiny sartanů byl v sekundární prevenci prověřován pouze účinek telmisartanu – jak proti placebu (studie TRANSCEND), tak proti ramiprilu (studie ONTARGET).
V prvé studii byl pozorován významný pokles KV výskytu morbidity a mortality, ve druhé pak srovnatelný efekt na obdobné ukazatele v porovnání s ramiprilem. Dá se tedy konstatovat, že v této indikaci nebyl pozorován rozdíl mezi skupinami, respektive konkrétně mezi ramiprilem a telmisartanem.Analýza účinku inhibitorů ACE a sartanů v sekundární prevenci byla provedena srovnáním výsledků dlouhodobých (2 roky a déle) prospektivních studií kontrolovaných placebem, analyzována byla data více než 77 tisíc nemocných [3]. U nemocných léčených inhibitory ACE byl doložen významný pokles celkové i KV mortality o 10–20 % a pokles výskytu mozkových příhod o 25 %. Léčba sartany v rámci sekundární prevence byla sledována pouze poklesem výskytu iktů (o 10 %). S výjimkou telmisartanu je pravděpodobný nižší efekt sartanů v sekundární prevenci.
Systolické srdeční selhání
V léčbě systolického srdečního selhání jsou inhibitory ACE výrazně účinnější. Sartany mají doloženo pouze mírné snížení KV mortality (při léčbě kandesartanem ve studii CHARM), avšak inhibitory ACE v řadě studií výrazně snížily nejen morbiditu, ale i celkovou mortalitu. V této indikaci je jednoznačně doložen výraznější efekt skupiny inhibitorů ACE.
Profylaxe progrese diabetické nefropatie s proteinurií
Poslední velkou indikací je profylaxe progrese diabetické nefropatie s proteinurií. Velká metaanalýza dokládá efekt obou skupin léčiv na pokles proteinurie či progrese mikroalbuminurie do makroalbuminurie. Výraznější zpomalení progrese nefropatie (měřeno dobou do zdvojnásobení hodnot kreatininemie) však bylo doloženo pouze při léčbě inhibitory ACE [4]. Výsledky ukazují, že inhibitory ACE jsou při hodnocení tzv. tvrdých dat účinnější. Shrneme-li předložená data, pak je zřejmé, že v řadě významných indikací je inhibice ACE nejúčinnějším léčebným postupem, účinnějším než blokáda receptoru AT1. Porovnání se třetí strategií – inhibicí reninové katalytické aktivity – není možné, chybějí data. Daní za významně vyšší účinnost inhibitorů ACE je horší snášenlivost daná vyšším výskytem kašle; bezpečnost obou skupin je u indoevropské rasy srovnatelná. Častější výskyt angioedému, který byl při léčbě inhibitory ACE pozorován v klinických studiích, byl dán zejména jeho vyšší incidencí u Afroameričanů.
Proč jsou strategie blokády RAAS rozdílné?
Rozdíly v různých strategiích blokády RAAS mají řadu příčin. Prvou z nich je odlišný účinek jednotlivých inhibitorů ACE na blokádu konverze různých substrátů, konkrétně na blokádu aktivace AI na AII a blokádu degradace řady regulačních proteinů. ACE je multipotentní dipeptidáza, která z karboxylového konce peptidu odštěpí dvě terminální aminokyseliny. V organismu se objevuje ve dvou izoformách – somatické a testikulární. Somatická izoforma je přítomna v řadě tkání, zejména však v endoteliích cév, v epiteliích nefronu či v neuroepiteliích mozkové tkáně. Zde kontroluje řadu biologických pochodů, mimo jiné reguluje krevní tlak, složení vnitřního prostředí či reparační pochody. Testikulární izoforma má význam v maturaci spermií. Inhibitory ACE tlumí pouze aktivitu somatického ACE.
Vlast![Obr. 1 Schéma obou katalytických domén ACE a uvolnění membránového ACE do cirkulace; podle [22] – Husain, et al., 2003. ACE – angiotenzin konvertující enzym](https://www.remedia.cz/photo-a-29946---.jpg) ní ACE je membránovým enzymem, nicméně z ukotvení může být působením sekretázy ACE uvolněn do cirkulace, viz obr. 1. Somatická izoforma má dvě aktivní domény označované podle lokalizace na peptidovém řetězci písmeny N (aminový konec) a C (karboxylový konec). Díky tomu, že obě katalytické domény mají homologní sekvenci aminokyselin pouze z 60 %, jejich fyziologická úloha je odlišná [19].
ní ACE je membránovým enzymem, nicméně z ukotvení může být působením sekretázy ACE uvolněn do cirkulace, viz obr. 1. Somatická izoforma má dvě aktivní domény označované podle lokalizace na peptidovém řetězci písmeny N (aminový konec) a C (karboxylový konec). Díky tomu, že obě katalytické domény mají homologní sekvenci aminokyselin pouze z 60 %, jejich fyziologická úloha je odlišná [19].
Vzhledem k tomu, že přítomnost dvou homologních katalytických míst na jednom enzymu je neobvyklá, je zajímavé zjistit příčinu. Srovnávací biologie ukazuje, že ve fylogenetickém stromu obratlovců došlo asi před 50–550 miliony let k duplikaci genu a k vývoji takto raritního enzymu. Zdá se, že odlišné katalytické vlastnosti jednoho enzymu jsou výhodné, obdobně se totiž objevují i u některých dalších kmenů a tříd. Stejná duplikace genu vznikla nezávisle na sobě ve fylogenezi vícekrát a udržela se po celou dobu existence druhu [20]. Doména C se účastní zejména konverze AI na AII a degradace bradykininu, proto je toto katalytické místo rozhodující pro regulaci krevního tlaku a homeostázy. Naopak doména N preferuje jiné substráty; vedle degradace bradykininu (společně s doménou C) i řadu neuropeptidů (neuropeptid Y aj.) či některých hormonů, např. růstový hormon. Zde je prvý rozdíl mezi inhibitory ACE, které nabídku řady regulačních a reparačních peptidů zvyšují, a sartany, které ji významně neovlivňují. Zvýšení hladiny neuropeptidu Y a snad i bradykininu bývá označováno za příčinu kašle provázejícího léčbu inhibitory ACE.
Z dalších aktivit ACE je vysoce významná degradace regulačního oligopeptidu goralatidu. Tento tetrapeptid (N-Acetyl-Ser-Asp-Lys-Pro) má řadu funkcí: v levé komoře a ve dřeni ledvin inhibuje infiltraci makrofágy a fibroblasty či v hemopoetické tkáni kontroluje proliferaci zárodečných buněk. Zvýšení nabídky goralatidu při léčbě inhibitory ACE je více než pětinásobné; doloženo je snížení infiltrace levé komory fibroblasty a redukce proliferace fibroblastů [5].
Vzhledem k tomu, že blokáda receptorů AT1 nabídku goralatidu neovlivňuje, nabízí se další z možných vysvětlení rozdílného dopadu léčby inhibitory ACE a sartany, které se může uplatnit např. u srdečního selhání. Právě zde fibrotizace svaloviny komor přispívá k progresivní deterioraci systolické i diastolické funkce.
V neuroepiteliích degraduje izoforma N amyloid beta, který se kumuluje v mozku pacientů s Alzheimerovou chorobou. Biologický význam je však nejasný, léčba inhibitory ACE nevedla ke zvýšení obsahu amyloidu v CNS při této chorobě [6].
Proteolytická aktivita ACE vycházející z domény N má vliv na regulaci krevního tlaku spíše jen okrajový. Naopak její významné uplatnění spočívá v ovlivnění a kontrole imunitních a reparačních pochodů a pravděpodobně (spolu s aldosteronem) se podílí na progresivním úbytku myocytů s fibrotizací svaloviny myokardu, jak to vidíme u chronického srdečního selhání.
Inhibitory ACE se váží na různá místa enzymu v oblasti katalytických center elektrostatickými vazbami. Zdá se, že existují rozdíly mezi jednotlivými inhibitory ACE v poměru inhibice izoformy C a N, obecně však převažuje útlum izoformy C (kontrolující krevní tlak) [7]. Tyto rozdíly v působení na obě izoformy mohou přispívat i k rozdílům mezi inhibitory ACE, které nepochybně existují a budou diskutovány později.
Vlastní osa RAAS není jedním regulačním systémem, ale velmi složitým mechanismem udržujícím vnitřní prostředí. Klasická koncepce osy renin-angiotenzin I a II-aldosteron je sice páteří, nicméně v rámci systému je významná řada dalších 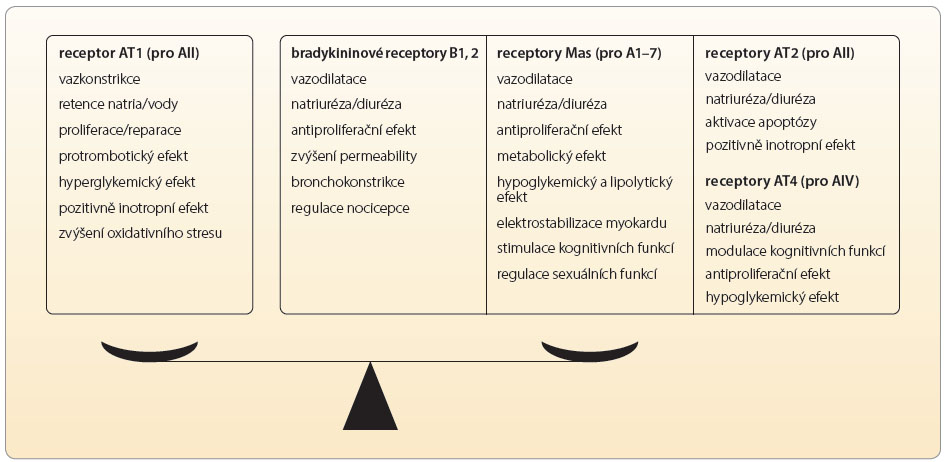 působků modifikujících výsledný účinek. Oba centrální peptidy – angiotenzin I a II – jsou degradovány řadou aminopeptidáz a dávají vznik dceřiným, rovněž biologicky aktivním molekulám, které jsou označovány jako angiotenzin 1–7, angiotenzin 2–10, angiotenzin III (angiotenzin 2–8) a angiotenzin IV (angiotenzin 3–8). Tyto oligopeptidy se váží na specifické receptory (např. receptor Mas) nebo na receptor AT1 či AT4. Překvapivé je, že výsledný efekt vazby jednotlivých angiotenzinů je v různých orgánech odlišný. Například angiotenzin III má ve srovnání s AII asi třetinový účinek na zvýšení cévního tonu, výdej aldosteronu však stimuluje s AII rovnocenně. Za fyziologických podmínek je aktivita obou ramen vyrovnaná – na jedné straně je stimulace receptoru AT1, na straně druhé aktivace bradykininových recepto
působků modifikujících výsledný účinek. Oba centrální peptidy – angiotenzin I a II – jsou degradovány řadou aminopeptidáz a dávají vznik dceřiným, rovněž biologicky aktivním molekulám, které jsou označovány jako angiotenzin 1–7, angiotenzin 2–10, angiotenzin III (angiotenzin 2–8) a angiotenzin IV (angiotenzin 3–8). Tyto oligopeptidy se váží na specifické receptory (např. receptor Mas) nebo na receptor AT1 či AT4. Překvapivé je, že výsledný efekt vazby jednotlivých angiotenzinů je v různých orgánech odlišný. Například angiotenzin III má ve srovnání s AII asi třetinový účinek na zvýšení cévního tonu, výdej aldosteronu však stimuluje s AII rovnocenně. Za fyziologických podmínek je aktivita obou ramen vyrovnaná – na jedné straně je stimulace receptoru AT1, na straně druhé aktivace bradykininových recepto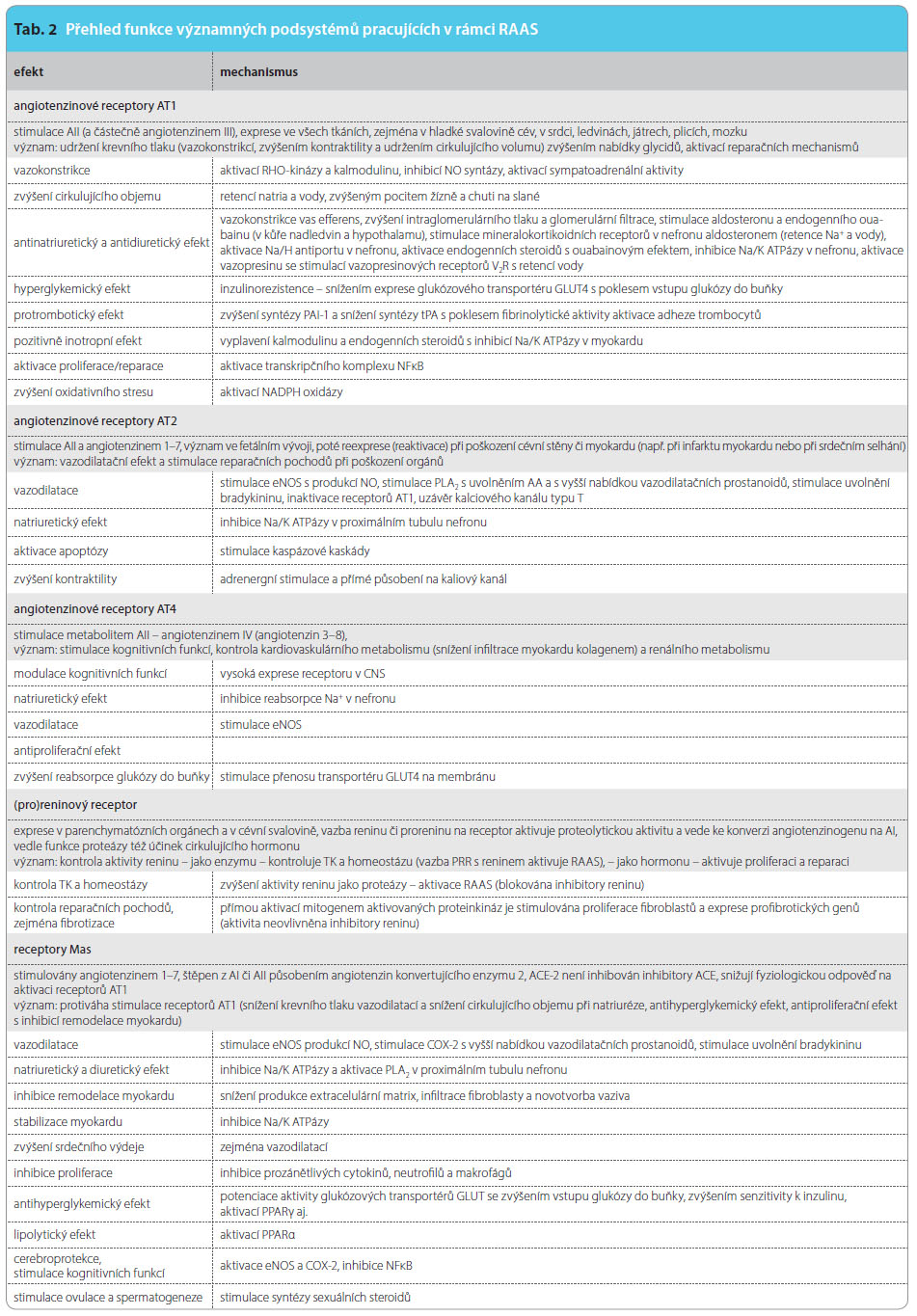 rů B1 a B2, receptorů Mas či receptorů AT2 a AT4, viz obr. 2.
rů B1 a B2, receptorů Mas či receptorů AT2 a AT4, viz obr. 2.
Vně systému jsou regulační pochody příbuzné – řada enzymů je společných, klíčový produkt jednoho systému významně aktivuje systém druhý apod. Zmiňme bioaktivní peptidy, jako jsou natriuretické hormony, apelinový či kininový systém. Není pochyb o tom, že nejvýznamnější je AII, který stimuluje zejména receptory AT1. Za podmínek aktivace reparačních pochodů (např. při aterosklerotickém postižení cévní stěny) jsou stimulovány i receptory AT2 a eventuálně AT4. Aktivita jednotlivých receptorů je přehledně uvedena v tab. 2. Výsledkem aktivace receptorů AT1 je zajištění cirkulace při dlouhodobě nepříznivých podmínkách, tj. adaptativní udržení krevního tlaku (díky vazokonstrikci, retenci vody a iontů a díky pozitivně inotropnímu účinku). Méně vyjádřena je aktivace hemostázy s inhibicí fibrinolýzy a stimulace proliferačních pochodů. Tyto děje pak umožní reparaci při poškození cirkulačního aparátu.
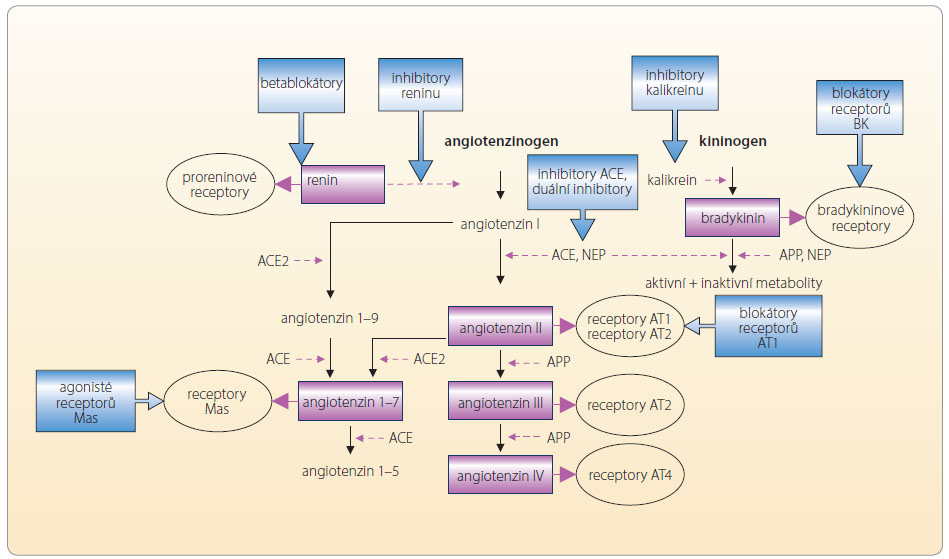
Výsledný efekt velmi výkonné stimulace receptorů AT1 je vyvážen aktivitou několika podobných receptorů s opačným účinkem – bradykinového recep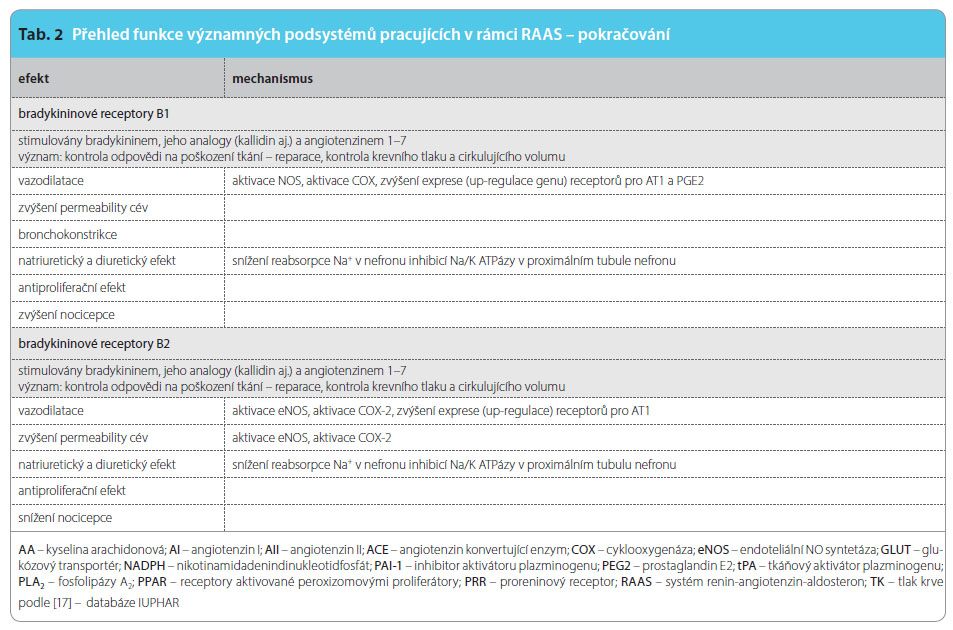 toru B1 a B2, receptoru Mas a receptorů AT2 a AT4. Jejich funkce i ligandy jsou uvedeny v tab. 3. Jednotlivé vztahy mezi systémem RAA, systémem kininovým a možnosti terapeutického zásahu ukazuje obr. 3.
toru B1 a B2, receptoru Mas a receptorů AT2 a AT4. Jejich funkce i ligandy jsou uvedeny v tab. 3. Jednotlivé vztahy mezi systémem RAA, systémem kininovým a možnosti terapeutického zásahu ukazuje obr. 3.
Por ovnáme-li účinek inhibitorů ACE a sartanů, pak hlavní rozdíl při podávání sartanů lze spatřovat v možnosti dosáhnout většího útlumu systému. Blokáda receptorů AT1 je dokonalejší než inhibice konverze AI na AII. Dalším rozdílem je, že díky vyšší nabídce AII dochází k jeho konverzi na angiotenzin 1–7 a ke stimulaci receptorů Mas. Nevýhodou je malý vliv na zvýšení nabídky bradykininu, neuropeptidů a dalších reparačních a regulačních oligopeptidů, např. goralatidu. Naopak předností inhibice ACE je významné zvýšení nabídky bradykininu a řady zmíněných regulačních peptidů, aktivace receptorů Mas je i zde plně vyjádřena – angiotenzin 1–7
ovnáme-li účinek inhibitorů ACE a sartanů, pak hlavní rozdíl při podávání sartanů lze spatřovat v možnosti dosáhnout většího útlumu systému. Blokáda receptorů AT1 je dokonalejší než inhibice konverze AI na AII. Dalším rozdílem je, že díky vyšší nabídce AII dochází k jeho konverzi na angiotenzin 1–7 a ke stimulaci receptorů Mas. Nevýhodou je malý vliv na zvýšení nabídky bradykininu, neuropeptidů a dalších reparačních a regulačních oligopeptidů, např. goralatidu. Naopak předností inhibice ACE je významné zvýšení nabídky bradykininu a řady zmíněných regulačních peptidů, aktivace receptorů Mas je i zde plně vyjádřena – angiotenzin 1–7 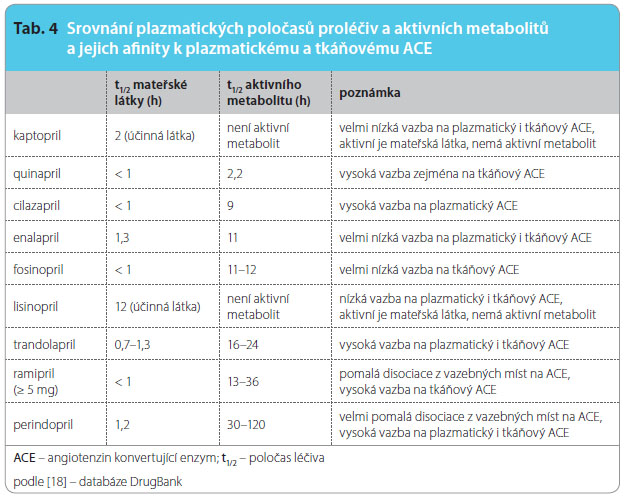 je tvořen i z AI (jehož hladina je vysoká). Nedostatkem je nedokonalá inhibice konverze AI na AII, přeměna je částečně umožněna také neutrálními endopeptidázami, chymázou a jinými nespecifickými proteázami, viz tab. 4. Výsledný farmakologický účinek různých strategií blokády systému se tak liší a v různých indikacích mohou mít tyto odlišnosti klinický význam. Rozdíly dané různou nabídkou regulačních peptidů – substrátů ACE, stejně jako rozdíly v inhibici či aktivaci jednotlivých větví RAAS, např. receptorů Mas, jsou pravděpodobně nejvýznamnějšími faktory, které jsou zodpovědné za rozdíly v klinickém efektu inhibitorů ACE a sartanů.
je tvořen i z AI (jehož hladina je vysoká). Nedostatkem je nedokonalá inhibice konverze AI na AII, přeměna je částečně umožněna také neutrálními endopeptidázami, chymázou a jinými nespecifickými proteázami, viz tab. 4. Výsledný farmakologický účinek různých strategií blokády systému se tak liší a v různých indikacích mohou mít tyto odlišnosti klinický význam. Rozdíly dané různou nabídkou regulačních peptidů – substrátů ACE, stejně jako rozdíly v inhibici či aktivaci jednotlivých větví RAAS, např. receptorů Mas, jsou pravděpodobně nejvýznamnějšími faktory, které jsou zodpovědné za rozdíly v klinickém efektu inhibitorů ACE a sartanů.
Jsou mezi jednotlivými inhibitory ACE rozdíly?
V současné době jsou inhibitory ACE nejužívanější skupinou léčiv v terapii hypertenze a řady dalších KV onemocnění. Jejich spotřeba (samotných či ve fixní kombinaci) v České republice se v posledních letech pohybuje na úrovni 650 milionů definovaných denních dávek (DDD) ročně. Spotřeba sartanů (opět samotných či v kombinacích) je méně než poloviční (305 mil. DDD/rok). Vzhledem k tomu, že inhibitory ACE u nás užívá kolem půl druhého milionu osob a že na trhu je devět různých inhibitorů ACE, je položená otázka důležitá.
Jednotlivé inhibitory ACE v léčbě hypertenze V této „hlavní“ indikaci nemáme k dispozici žádnou prospektivní prognostickou studii, která by vzájemně porovnávala jednotlivé inhibitory ACE. Zbývá tedy analýza nepřímá. Porovnáním účinku na profylaxi výskytu aterotrombotických příhod se zabývaly dvě velké metaanalýzy provedené u nemocných (v naprosté většině hypertoniků). Léčba byla indikována pro snížení KV rizika. Prvá, již zmíněná retrospektivní analýza sledovala v kohortě více než 150 tisíc pacientů (celkem 300 tisíc pacientoroků) vliv na prognózu nemocných [2]. Vzhledem k nestejnému cílovému ukazateli účinku a prezentovaným datům nebylo možno analyzovat rozdíly v incidenci jednotlivých KV příhod, ale byla hodnocena pouze celková mortalita.
Ve skupině inhibitorů ACE bylo možno konstatovat, že pouze ve třech studiích (ASCOT-BPLA, ADVANCE a HYVET) byl doložen efekt na pokles celkové mortality – sdružená data z nich ukazují významný pokles o 13 % (poměr rizik – hazard ratio, HR: 0,87; 95% konfidenční interval – CI: 0,81–0,93; p < 0,001). Ve všech těchto studiích tvořil alespoň jednu složku léčby perindopril. Rozdíly mezi inhibitory ACE v ovlivnění KV mortality a morbidity nebylo kvůli heterogenitě možno analyzovat. K podobnému závěru, tj. ovlivnění celkové mortality inhibitory ACE (o 10 %) a absence efektu na mortalitu při léčbě sartany, dospěli i autoři novější metaanalýzy [8]. I oni nalezli doklady o snížení celkové mortality v populaci s vysokou prevalencí hypertenze pouze pro perindopril.
Retrospektivní srovnání dlouhodobé (nejméně pět let trvající) léčby hypertenze perindoprilem proti léčbě lisinoprilem bylo provedeno v registru více než 15 tisíc čínských hypertoniků [9]. Při léčbě perindoprilem byla doložena významně nižší celková mortalita i KV mortalita (rozdíl 19 %) než při podávání lisinoprilu. Příznivější efekt byl patrný zejména u seniorů. V indikaci léčby hypertenze nemáme přímé doklady o rozdílném efektu jednotlivých inhibitorů ACE v profylaxi KV příhod či KV mortality. Při retrospektivní analýze však byl při ovlivnění mortality perindopril účinnější než lisinopril. Snížení výskytu celkové mortality při léčbě hypertenze inhibitory ACE bylo dokladováno pouze pro perindopril.
Jednotlivé inhibitory ACE v sekundární prevenci
V této indikaci bylo provedeno několik velkých studií se třemi inhibitory ACE: ramiprilem, perindoprilem a trandolaprilem. Pozitivní účinek ramiprilu byl velmi dobře doložen výsledky studie HOPE. V populaci se středně vysokou prevalencí hypertenze (46 %) bylo prokázáno snížení výskytu kombinovaného ukazatele (infarktu myokardu, iktu či úmrtí) o 22 %, snížení výskytu iktu o 32 %. Obdobně v populaci s nízkou prevalencí hypertenze (27 %) byl podobný účinek pozorován u perindoprilu ve studii EUROPA, kde došlo ke snížení výskytu infarktu, iktu či úmrtí o 20 %, či ve studii PROGRESS se snížením stejného ukazatele o 26 %.
U populace s velmi nízkým rizikem nebylo možno doložit ve studii PEACE efekt trandolaprilu na pokles výskytu velkých KV příhod, pozorováno bylo pouze snížení počtu mozkových příhod o 24 %. Ramipril a perindopril v indikaci prevence aterotrombotických příhod mají, na rozdíl od ostatních inhibitorů ACE, jednoznačně doložen příznivý efekt. U ostatních inhibitorů účinek v sekundární prevenci dokladován nemáme.
Dosud chybí prospektivní head-to-head studie, která by porovnávala jednotlivé inhibitory ACE v této indikaci. Nicméně, na rozdíl od léčby hypertenze, máme v oblasti sekundární prevence velmi cennou retrospektivní analýzu dopadu léčby různými inhibitory založenou na analýze dat zdravotní pojišťovny z Kanady, tedy dat nezávislých [10]. Cílem této retrospektivní kohortové studie bylo porovnat mortalitu starších pacientů (≥ 65 let), kteří byli hospitalizováni pro akutní infarkt myokardu a kteří byli dále v rámci sekundární prevence dlouhodobě léčeni inhibitory ACE. Celkem bylo sledová![Graf 2 Srovnání účinku ramiprilu s ostatními inhibitory ACE na prognózu nemocných po IM (studie ONTARIO I), výskyt celkové mortality, n > 7500 nemocných, průměrné sledování 2,3 roku; data zdravotních pojišťoven Kanada; podle [10] – Pilote, et al., 2004. ACE – angiotenzin konvertující enzym; NS – nesignifikantní](https://www.remedia.cz/photo-a-29953---.jpg) no téměř 8 tisíc nemocných léčených déle než rok. Mortalita pacientů léčených kaptoprilem, enalaprilem, fosinoprilem nebo quinaprilem byla statisticky významně vyšší než mortalita pacientů léčených ramiprilem (referenční lék) nebo perindoprilem, jak ukazuje graf 2. Studie měla sice drobné metodologické nedostatky, nicméně skutečnost, že se jednalo o reálnou praxi, byla velmi cenná.
no téměř 8 tisíc nemocných léčených déle než rok. Mortalita pacientů léčených kaptoprilem, enalaprilem, fosinoprilem nebo quinaprilem byla statisticky významně vyšší než mortalita pacientů léčených ramiprilem (referenční lék) nebo perindoprilem, jak ukazuje graf 2. Studie měla sice drobné metodologické nedostatky, nicméně skutečnost, že se jednalo o reálnou praxi, byla velmi cenná.
Obdobné pozorování bylo učiněno i v rámci užití inhibitorů ACE v akutní a subakutní fázi infarktu myokardu při analýze registru MITRA PLUS v kohortě téměř 15 tisíc nemocných s akutní koronární příhodou [11]. Při multivariantní analýze prognostických ukazatelů vedla léčba ramiprilem ve srovnání s léčbou ostatními inhibitory ACE ke snížení výskytu nefatálních koronárních a cerebrovaskulárních příhod o třetinu (HR: 0,65; 95% CI: 0,462–0,93; p = 0,002).
Na základě předložených dat se dá učinit závěr, že v sekundární prevenci u nemocných po infarktu myokardu je doloženo snížení KV mortality a morbidity při léčbě ramiprilem a perindoprilem; retrospektivní analýza dokumentuje výraznější účinek ramiprilu a perindoprilu na pokles mortality, než mají inhibitory ACE s kratší dobou účinku, nutno však zdůraznit, že ve studii nebyly užívány modernější inhibitory typu trandolaprilu či spiraprilu.
Jednotlivé inhibitory ACE v léčbě systolického srdečního selhání
Ani v léčbě srdečního selhání nebyla provedena prospektivní komparativní studie s různými inhibitory ACE. Pro malý počet a nehomogennost není proveditelná ani nepřímá síťová analýza kontrolovaných studií. Jedinou informaci tak přináší retrospektivní analýza registru. Stejná autorka, která provedla srovnání inhibitorů ACE u nemocných léčených v rámci sekundární prevence po infarktu myokardu, analyzovala i rozdíly v prognóze při léčbě inhibitory ACE podávanými pro léčbu městnavého srdečního selhání [12]. Z dat získaných z registru zdravotní pojišťovny byla sledována prognóza více než 43 tisíc pojištěnců se srdečním selháním, kteří byli léčeni různými inhibitory ACE. Ramipril opět sloužil jako referenční lék. I v tomto případě, při srovnávání neadjustovaných hodnot, bylo relativní riziko úmrtí pro kaptopril i enalapril zvýšeno.
Ze sofistikovanější analýzy založené na fixním mod![Graf 3 Srovnání účinku ramiprilu s ostatními inhibitory ACE na prognózu nemocných se srdečním selháním (studie ONTARIO II), sledována celková mortalita, n = 43 000 nemocných, průměrná doba sledování 2,1 roku; podle [12] – Pilote, et al., 2008. ACE – angiotenzin konvertující enzym; NS – nesignifikantní](https://www.remedia.cz/photo-a-29954---.jpg) elu dávky vyplývá, že s výjimkou perindoprilu a cilazaprilu byla léčba sledovanými inhibitory ACE spojena s horší prognózou, viz graf 3. Vzestup mortality se ve srovnání s léčbou ramiprilem pohyboval mezi 10 % až 60 %. Nedostatkem analýzy je, že opět nebyly posuzovány další dlouhodobě účinkující inhibitory ACE – trandolapril, moexipril a spirapril. Důvod je prostý, v době analýzy nebyly v Kanadě tyto léky užívány. Obě nezávislé analýzy tak docházejí ke stejnému závěru: existují významné rozdíly v účinku inhibitorů ACE v léčbě srdečního selhání. Výsledky druhé analýzy jsou cennější, neboť důkladná preskripční analýza nenašla významné rozdíly mezi skupinami, úctyhodný počet zařazených nemocných poskytuje dostatečný počet jedinců pro podskupinovou analýzu.
elu dávky vyplývá, že s výjimkou perindoprilu a cilazaprilu byla léčba sledovanými inhibitory ACE spojena s horší prognózou, viz graf 3. Vzestup mortality se ve srovnání s léčbou ramiprilem pohyboval mezi 10 % až 60 %. Nedostatkem analýzy je, že opět nebyly posuzovány další dlouhodobě účinkující inhibitory ACE – trandolapril, moexipril a spirapril. Důvod je prostý, v době analýzy nebyly v Kanadě tyto léky užívány. Obě nezávislé analýzy tak docházejí ke stejnému závěru: existují významné rozdíly v účinku inhibitorů ACE v léčbě srdečního selhání. Výsledky druhé analýzy jsou cennější, neboť důkladná preskripční analýza nenašla významné rozdíly mezi skupinami, úctyhodný počet zařazených nemocných poskytuje dostatečný počet jedinců pro podskupinovou analýzu.
Jednotlivé inhibitory ACE v léčbě nefropatie s proteinurií
V indikaci snížení proteinurie a zpomalení progrese renální insuficience u nefropatie, zejména diabetické etiologie, jsou užívány jak inhibitory ACE, tak sartany. V klinické praxi se užívá též kombinace obou strategií, nicméně při užití plné dávky inhibitoru ACE či sartanu nezvyšuje tento postup účinnost (při sledování mortality či vaskulárních příhod), naopak dochází k významnému nárůstu nežádoucích účinků – hyperkalemie, hypotenze či renálního selhání [14]. Vzájemné porovnání jednotlivých inhibitorů ACE v této indikaci není dostupné.
Shrneme-li předložená data, máme pro řadu indikací (léčbu srdečního selhání, sekundární prevenci po infarktu myokardu či do jisté míry i pro hypertenzi) doklady o existenci významného rozdílu v klinickém efektu mezi inhibitory ACE. Nejvíce dat podporujících předpoklad příznivějšího působení existuje pro perindopril a ramipril.
Možné příčiny rozdílů mezi inhibitory ACE
Otázka možných příčin rozdílů mezi inhibitory ACE není zpravidla řešena. Nicméně řada rozdílů ve farmakokinetice i ve farmakodynamickém účinku uvnitř skupiny existuje. Při sledování farmakokinetických vlastností je prvým rozdílem nutnost biokonverze na aktivní metabolit u většiny inhibitorů ACE (s výjimkou kaptoprilu a lisinoprilu). Teprve meta bolit prilát má vlastní farmakologický účinek. Pro posouzení délky účinku je proto rozhodující poločas tohoto aktivního metabolitu a délka jeho setrvání ve vazbě na enzym. Jak je zřejmé a jak ukazuje tab. 4, lze nalézt ve skupině výrazné rozdíly.
bolit prilát má vlastní farmakologický účinek. Pro posouzení délky účinku je proto rozhodující poločas tohoto aktivního metabolitu a délka jeho setrvání ve vazbě na enzym. Jak je zřejmé a jak ukazuje tab. 4, lze nalézt ve skupině výrazné rozdíly.
Perindopril, ramipril, trandolapril a spirapril mají velmi dlouhý plazmatický poločas aktivního metabolitu; perindopril a ramipril pak mají navíc výhodu velmi pomalé disociace z vazby na katalytické centrum enzymu. Na druhém pólu stojí kaptopril či quinapril s krátkým poločasem i s rychlým uvolněním z vazby. Této skutečnosti odpovídá též výhodný poměr T/P indexu (trough-to-peak index), tedy poměr mezi minimálním a maximálním účinkem při posuzování poklesu tlaku. Ten se u perindoprilu, ramiprilu či trandolaprilu blíží 100 %. Kolísání efektu během 24hodinového dávkovacího intervalu je u těchto inhibitorů ACE klinicky nevýznamné. Dlouhodobé přetrvání perindoprilu či ramiprilu ve vazbě na enzym i po poklesu plazmatické koncentrace pak zajistí dostatečný účinek i při náhodném vynechání dávky.
Vedle délky účinku a afinity k cílovému enzymu je významná řada dalších ukazatelů. Inhibitory ACE (tedy s výjimkou výše zmiňovaného kaptoprilu a lisinoprilu) jsou proléčiva (prodrugs). Konverze na aktivní formu diacidu nepodléhá lékovým interakcím, není ovlivněna farmakogenetickými vlivy ani renálním či hepatálním postižením. Aktivní diacidická forma je z větší části eliminována renálně – tubulární sekrecí, pouze trandolapril, ramipril a fosinopril je z významné části vyloučen rovněž biliární cestou. Na úrovni biotransformace tedy nelze najít zásadnější meziskupinové rozdíly.
Dalším aspektem, tentokrát již typu farmakodynamického působení, je míra účinku na plazmatický a tkáňový enzym. Rozhodující část ACE je vázána na tkáňové membrány, pouze 10 % je vázáno na endotel cév. Penetrace do tkání i afinita ke tkáňovému ACE se liší. Na jednom pólu stojí quinaprilát, ramiprilát a perindoprilát s vysokou afinitou, na druhém enalaprilát, fosinoprilát a kaptopril s vazbou nízkou. I když je vyslovena řada předpokladů o významu tkáňové selektivity, nemáme doklady o výraznějším klinickém významu.
Relativně novým aspektem, který může vysvětlit rozdíly mezi inhibitory ACE, je jejich efekt na jedno či druhé katalytické místo ACE, tedy na inhibici domény N či domény C. Jak bylo již rozvedeno, inhibice domény N více ovlivní biodegradaci řady aktivních regulačních peptidů (bradykininu, goralatidu apod.) a ovlivní převážně reparační pochody, naopak útlum domény C, zodpovědné za konverzi AI na AII, ovlivní více krevní tlak a složení vnitřního prostředí. Z hlediska mechanismu působení na obě katalytická místa a v poměru jejich ovlivnění existují mezi inhibitory ACE rozdíly. Ty by mohly vysvětlit diference, nicméně tato oblast se nachází teprve v časných fázích výzkumu a budeme muset počkat na hmatatelné výsledky.
Poslední rozdíl mezi inhibitory ACE lze nalézt na úrovni lékových interakcí. Mnohé z inhibitorů ACE jsou proléčivy ve formě esterů a jejich biokonverze na účinný metabolit je zprostředkována v enterocytu hydrolýzou karboxylesterázou 1 (carboxylesterase 1, CES1). Některé inhibitory ACE se k tomuto enzymu chovají jako prosté substráty (např. ramipril), jiné (např. enalapril) jsou jeho inhibitory. Zajímavý je vztah k antitrombotikům, léčivům často kombinovaným s inhibitory ACE. Klopidogrel je proléčivem, které je CES1 z 80–90 % hydrolyzováno na neúčinný metabolit. Inhibice této esterázy pak významně zvýšila nabídku aktivního metabolitu klopidogrelu a klinicky významně potencovala účinek, konkrétně se zvýšil výskyt krvácivých komplikací [20]. Také dabigatran etexilát je substrátem CES1, tentokrát tento enzym umožňuje bioaktivaci na dabigatran [21]. Inhibice CES1, např. enalaprilem, by tak mohla snížit či opozdit konverzi dabigatran etexilátu na účinný dabigatran.
Mohou farmakogenetické odchylkyovlivnit účinek inhibitorů ACE?
Jako je tomu u většiny léčiv, též v léčbě inhibitory ACE se uplatňuje farmakogenetický aspekt. Ten by mohl mít při strategii orientované na potlačení hyperaktivovaného RAAS dvojí efekt. Na jedné straně by rozdíly na podkladě genetických odchylek na úrovni aktivace, biotransformace a eliminace jednotlivých inhibitorů ACE mohly významně měnit expozici léčivům. Na straně druhé může úroveň odpovědi vlastního systému na fyziologické podněty (na stimulaci či inhibici) ovlivnit výsledný účinek blokády. Víme totiž, že polymorfismy měnící aktivitu systému (na úrovni receptoru AT1, bradykininového receptoru či např. receptoru Mas) mohou významně ovlivnit terapeutickou odpověď. Příčinou může být, vedle úrovně aktivity systému, zejména snížená afinita léčiv k cílovým strukturám [14].
Byla publikována řada pozorování o faktorech zhoršujících prognózu nemocných se srdečním selháním či po infarktu myokardu u různých polymorfismů, příkladem je varianta ACE typu Del (rs1799752) s vysokou aktivitou RAAS. Tato pozorování však bude nutno ověřit. Navíc, díky velké plasticitě systému, odchylka na jedné úrovni je zpravidla vyvážena hyperaktivitou či hypoaktivitou systémů ostatních.
Daleko pravděpodobnější je, že teprve kombinace dvou či více polymorfismů měnících aktivitu stejným směrem na více úrovních významněji ovlivní výsledný účinek farmakologického zásahu. Tuto hypotézu skutečně prověřovala reprezentativní studie PERGENE [15]. Tato genetická studie byla provedena v rámci studie EVROPA a jejím cílem bylo prověřit účinek perindoprilu na prognózu v závislosti na farmakogenetické výbavě u nemocných s ischemickou chorobou srdeční.
Vlastní farmakogenetická analýza byla provedena u více než 9 tisíc nemocných, prověřován byl efekt 12 polym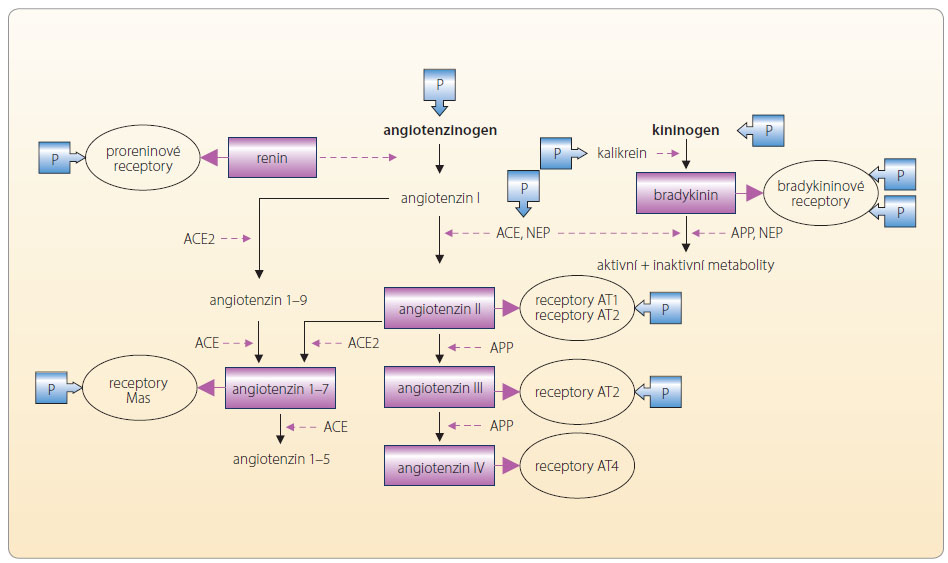 orfních kandidátních genů, které mění aktivitu RAAS a mohly by ovlivňovat prognózu léčených nemocných, viz obr. 4. Významné byly zejména dva polymorfismy měnící aktivitu angiotenzinového receptoru AT1 (varianty rs275651 a rs5182) a jeden polymorfismus měnící aktivitu bradykininového receptoru B1 (rs12050217). Ostatních devět polymorfismů mělo výrazně menší význam, nicméně jejich vliv v kombinaci s ostatními polymorfismy nebyl zanedbatelný.
orfních kandidátních genů, které mění aktivitu RAAS a mohly by ovlivňovat prognózu léčených nemocných, viz obr. 4. Významné byly zejména dva polymorfismy měnící aktivitu angiotenzinového receptoru AT1 (varianty rs275651 a rs5182) a jeden polymorfismus měnící aktivitu bradykininového receptoru B1 (rs12050217). Ostatních devět polymorfismů mělo výrazně menší význam, nicméně jejich vliv v kombinaci s ostatními polymorfismy nebyl zanedbatelný.
Do výsledné analýzy bylo zařazeno všech dvanáct genetických variant. Výsledek jasně potvrdil původní předpoklad – nemocní s KV postižením a s přítomností menšího počtu rizikových alel, maximálně dvou (tři čtvrtiny populace), měli z léčby inhibitorem ACE přínos, nosiči většího počtu rizikových alel však nikoli, viz graf 4. Prognosticky pozitivní účinek byl dokonce dvojnásobný u nositelů „příznivých“ polymorfismů v majoritní populaci ve srovnání s celou populací (po![Graf 4 Výsledný účinek perindoprilu na primární ukazatel efektu v závislosti na přítomnosti počtu nepříznivých polymorfismů RAAS ve studii PERGENE/EVROPA. Přítomnost 3 a více těchto polymorfismů eliminovala vliv na zlepšení prognózy jejich nositelů; podle [15] – Brugts, et al., 2012. ACE – angiotenzin konvertující enzym; CI – konfidenční interval; HR – hazard ratio, poměr rizik; IM – infarkt myokardu; KV – kardiovaskulární](https://www.remedia.cz/photo-a-29956---.jpg) kles KV mortality, výskytu infarktu myokardu a náhlé koronární smrti o 42 % proti poklesu o 20 %). Naopak u nemocných s „rizikovým“ profilem se efekt inhibice ACE neobjevil vůbec.
kles KV mortality, výskytu infarktu myokardu a náhlé koronární smrti o 42 % proti poklesu o 20 %). Naopak u nemocných s „rizikovým“ profilem se efekt inhibice ACE neobjevil vůbec.
Nález v jedné studii nemusí být obecně platný. V případě studie PERGENE však byl význam „farmakogenetické zátěže“ potvrzen retrospektivní analýzou obdobné prognostické studie PROGRESS u populace s cerebrovaskulárním postižením a analýzou studie ERGO s rizikovou populací seniorů [15, 16]. V obou studiích byl potvrzen zvyšující se výskyt hypertenze i příhod s přítomností každé další „rizikové“ alely. Na každou jednotlivou alelu se zvyšovalo riziko o 7 % (HR: 1,07; 95% CI: 1,02–1,14; p < 0,01). Do budoucna se tak nabízí individualizace léčby inhibitory ACE na základě farmakogenetického vyšetření. Zodpovězena není otázka ovlivnění účinku blokády receptoru AT1. Pokud by byl účinek zachován, pak by se otevřel prostor pro preferenci sartanů u této subpopulace.
Zásadní otázkou je, zda závěry studie PERGENE platí nejen pro perindopril, ale též pro jiné inhibitory ACE. U ostatních léčiv této skupiny bohužel nemáme žádná data. Nic však nenasvědčuje tomu, že by se v tomto ohledu měl účinek lišit. Nicméně, předpokládáme-li rozdílný účinek jednotlivých inhibitorů ACE na inhibici domény C a N, pak nemůžeme vyloučit ani rozdíly v ovlivnění účinku polymorfismy v RAAS a v systémech paralelních u různých inhibitorů ACE.
Závěr
Shrňme závěrem hlavní poselství tohoto přehledu, který byl věnován pouze účinnosti léčby (pro srovnání bezpečnosti a snášenlivosti různých strategií nebyl dostatek prostoru):
- Zcela jistě existují významné rozdíly v účinku mezi inhibitory ACE a blokátory receptoru AT1 – sartany – v řadě indikací. Je pravděpodobný obecně výraznější efekt inhibitorů ACE, zcela jistě je tento přítomen v léčbě systolického srdečního selhání. Rozdíly v ovlivnění jednotlivých receptorů v RAAS i v ose kininogen-kalikrein-bradykinin či v ovlivnění dalších regulačních peptidů odlišný farmakodynamický účinek vysvětlují.
- Nemáme sice přímé srovnání v prospektivní studii, nicméně retrospektivní kohortové studie svědčí pro přítomnost významných rozdílů mezi jednotlivými inhibitory ACE. Minimálně to platí pro indikace jejich užití v sekundární prevenci a v léčbě srdečního selhání. V pozadí za rozdíly uvnitř skupiny inhibitorů ACE mohu stát nejen vlastnosti farmakokinetické, ale snad též odlišný účinek na plazmatický a tkáňový ACE a pravděpodobně též různý efekt na inhibici katalytických center v doméně C a N vlastního enzymu. Potvrzují se slova významného farmakologa W. H. Frishmana: „Class-effect je zaklínadlem legitimujícím užití méně nákladných inhibitorů ACE namísto molekul, se kterými byl proveden důkaz o účinku v dané indikaci.“ V současné době máme řadu dokladů pro přednostní užití perindoprilu či ramiprilu. V praxi je tato skutečnost lékaři respektována, z analýzy preskripce jednotlivých inhibitorů ACE v roce 2013 v České republice vyplynulo, že více než 80 % spotřeby je realizováno ramiprilem a perindoprilem. V tomto ohledu je možno označit chování českých lékařů jako velmi racionální. Ve Spojených státech je užíván na prvém místě například lisinopril.
- Existují rozdíly v účinku inhibitorů ACE (minimálně perindoprilu) na podkladě polymorfismů RAAS a systémů paralelních. V blízké budoucnosti je možno očekávat zavedení farmakogenetického testování, které určí subpopulaci nemocných s výraznějším účinkem léčby.
Seznam použité literatury
- [1] Strauss MH, Hall AS. Angiotensin receptor blockers may increase risk of myocardial infarction: unraveling the ARB-MI paradox. Circulation 2006; 114: 838–854.
- [2] van Vark LC, Bertrand M, Akkerhuis KM, et al. Angiotensin-converting enzyme inhibitors reduce mortality in hypertension: a meta-analysis of randomized clinical trials of renin-angiotensin-aldosterone system inhibitors involving 158,998 patients. Eur Heart J 2012; 33: 2088–2097.
- [3] Ong HT, Ong LM, Ho JJ. Angiotensin-Converting Enzyme Inhibitors (ACEIs) and Angiotensin-Receptor Blockers (ARBs) in Patients at High Risk of Cardiovascular Events: A Meta-Analysis of 10 Randomised Placebo-Controlled Trials. ISRN Cardiol 2013; 2013: 478597.
- [4] Wu HY, Huang JW, Lin HJ, et al. Comparative effectiveness of renin-angiotensin system blockers and other antihypertensive drugs in patients with diabetes: systematic review and bayesian network meta-analysis. BMJ 2013; 347: f6008.
- [5] Pokharel S1, Rasoul S, Roks AJ, et al. N-acetyl-Ser-Asp-Lys-Pro inhibits phosphorylation of Smad2 in cardiac fibroblasts. Hypertension 2002; 40: 155–161.
- [6] Hemming ML, Selkoe DJ. Amyloid beta-protein is degraded by cellular angiotensin-converting enzyme (ACE) and elevated by an ACE inhibitor. J Biol Chem 2005; 280: 37644–37650.
- [7] Michaud A, Williams TA, Chauvet MT, et al. Substrate dependence of angiotensin I-converting enzyme inhibition: captopril displays a partial selectivity for inhibition of N-acetyl-seryl-aspartyl-lysyl-proline hydrolysis compared with that of angiotensin I. Mol Pharmacol 1997; 51: 1070–1076.
- [8] Ferrari R, Boersma E. The impact of ACE inhibition on all-cause and cardiovascular mortality in contemporary hypertension trials: a review. Expert Rev Cardiovasc Ther 2013; 11: 705–717.
- [9] Tsoi KK, Wong MC, Tam WW, et al. Cardiovascular mortality in hypertensive patients newly prescribed perindopril vs. lisinopril: A 5-year cohort study of 15,622 Chinese subjects. Int J Cardiol 2014: S0167-5273(14)01324-2.
- [10] Pilote L, Abrahamowicz M, Rodrigues E, et al. Mortality Rates in Elderly Patients Who Také Different Angiotenzin-Converting Enzyme Inhibitors after Acute Myocardial Infarction: A Class Effect? Ann Intern Med 2004; 141: 102–112.
- [11] Wienbergen H et MITRA PLUS Study Group. Impact of ramipril versus other angiotensin-converting enzyme inhibitors on outcome of unselected patients with ST-elevation acute myocardial infarction. Am J Cardiol 2002; 90: 1045–1049 .
- [12] Pilote L, Abrahamowicz M, Eisenberg M, et al. Effect of different angiotensin-converting-enzyme inhibitors on mortality among elderly patients with congestive heart failure. CMAJ 2008; 178: 1303–1311.
- [13] Catalá-López F, Macías Saint-Gerons D, de la Fuente Honrubia C, et al. Risks of dual blockade of the renin-angiotensin system compared with monotherapy: a systematic review and cumulative meta-analysis of randomized trials and observational studies. Rev Esp Salud Publica 2014; 88: 37–65.
- [14] Talameh JA, McLeod HL, Adams KF, et al. Genetic tailoring of pharmacotherapy in heart failure: optimize the old, while we wait for something new. J Card Fail 2012; 18: 338–349.
- [15] Brugts JJ, de Maat MP, Danser AH, et al. Individualised therapy of angiotensin converting enzyme (ACE) inhibitors in stable coronary artery disease: overview of the primary results of the PERindopril GENEtic association (PERGENE) study. Neth Heart J 2012; 20: 24–32.
- [16] Brugts JJ, Isaacs A, de Maat M, et al. A pharmacogenetic analysis of determinants of hypertension and blood pressure response to angiotensin-converting enzyme inhibitor therapy in patients with vascular disease and healthy subjects. J Hypertens 2011; 29: 509–519.
- [17] Databáze IUPHAR (IUPHAR-DB), http://www.iuphar-db.org/DATABASE/, navštíveno 15. srpna 2014.
- [18] Databáze DrugBank, verze 4.1, www:drugbank.ca/drugs/, navštíveno 15. srpna 2014.
- [19] Bernstein KE, Ong FS, Blackwell WL, et al. A modern understanding of the traditional and nontraditional biological functions of angiotensin-converting enzyme. Pharmacol Rev 2012; 65: 1–46.
- [20] Kristensen KE, Zhu HJ, Wang X, et al. Clopidogrel bioactivation and risk of bleeding in patients co-treated with ACE inhibitors after myocardial infarction: A proof of concept study. Clin Pharmacol Ther 2014. doi: 10.1038/clpt.2014.183. [Epub ahead of print].
- [21] Laizure SC, Parker RB, Herring VL, et al. Identification of carboxylesterase-dependent dabigatran etexilate hydrolysis. Drug Metab Dispos 2014; 42: 201–206.
- [22] Husain A, Li M, Graham RM. Do Studies With ACE N- and C-Domain-Selective Inhibitors Provide Evidence for a Non-ACE, Non-Chymase Angiotensin II-Forming Pathway? Circ Res 2003; 93: 91–93.