Apixaban
Apixaban je perorální, přímý, kompetitivní a vysoce selektivní inhibitor aktivovaného faktoru Xa, zařazuje se tak po boku rivaroxabanu do nově se konstituující skupiny xabanů. Perorální podání je předností zejména při nutnosti déle trvající aplikace antikoagulační léčby. Přímá inhibice faktoru Xa je výhodná, neboť účinek není závislý na přítomnosti antitrombinu a inhibován je i faktor vázaný na fibrin. Antikoagulační účinek je tak spolehlivější a nehrozí riziko rebound fenoménu po odeznění účinku antikoagulancia.
Farmakokinetické vlastnosti jsou charakterizovány dobrou, více než 50% dostupností, dlouhým plazmatickým poločasem (více než 12 hodin), dvojí možností eliminace (játry a ledvinami), nekomplikovaným metabolismem s nízkým rizikem lékových interakcí a s velmi malou interindividuální i intraindviduální variabilitou účinku.
Klinický efekt apixabanu byl prověřován zejména v profylaxi tromboembolických komplikací u nemocných po náhradě nosných kloubů (kyčel, koleno). Výsledky několika studií programu ADVANCE dokumentovaly srovnatelný efekt apixabanu v dávce 2krát denně 2,5 mg a současně vyšší bezpečnost ve srovnání s enoxaparinem podávaným 2krát denně v dávce 30 mg či vyšší profylaktický účinek a srovnatelné riziko krvácení ve srovnání s enoxaparinem podávaným v dávce 40 mg jedenkrát denně. Na základě těchto dat bylo u uvedených indikací schváleno klinické užití apixabanu. Rovněž v prevenci tromboembolických příhod u nemocných s fibrilací síní je doložen příznivý efekt, tato indikace však není dosud uvolněna pro klinické použití.
Farmakologická skupina
Antikoagulans ze skupiny selektivních, kompetitivních a perorálně dostupných přímých inhibitorů faktoru Xa. ATC kód dosud nebyl přidělen.
Chemické a fyzikální vlastnosti
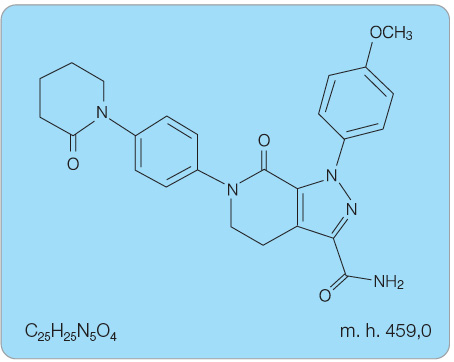 Apixaban je syntetická látka, celý chemický vzorec (viz obr. 1) je možno popsat jako 1-[3-(aminomethyl)fenyl]-N-[3-fluoro-2'-(methylsulfonyl)[1,1'-bifenyl]-4-yl]-3-(tri-fluoromethyl)-1H-pyrazol-5-karboxamid.
Apixaban je syntetická látka, celý chemický vzorec (viz obr. 1) je možno popsat jako 1-[3-(aminomethyl)fenyl]-N-[3-fluoro-2'-(methylsulfonyl)[1,1'-bifenyl]-4-yl]-3-(tri-fluoromethyl)-1H-pyrazol-5-karboxamid.
Sumární vzorec: C25H25N5O4
Relativní molekulová hmotnost: 459,0
Struktura apixabanu je odvozena od původní mateřské látky razaxabanu, modifikací (cyklizací) karboxamidového řetěz-ce bylo dosaženo rezistence k hydrolýze in vivo při zachování vysoké afinity k faktoru Xa.
Mechanismus účinku, farmakodynamika
Strategie antikoagulační léčby je postavena na třech strategiích – na snížení syntézy hemostatických působků závislých na vitaminu K (antivitaminy K, např. warfarin), nebo na blokádě jednoho či dvou faktorů, a to zpravidla trombinu nebo faktoru Xa (např. hepariny, xabany či gatrany). Mechanismus účinku apixabanu je proto výhodné posuzovat též v širších souvislostech.
Mechanismus účinku apixabanu
Apixaban – stejně jako ostatní představitelé skupiny xabanů – je perorálně účinný, přímý, kompetitivní, potentní a vysoce selektivní inhibitor aktivovaného faktoru Xa (fXa). Možnost perorálního podání, navíc s rychlým nástupem účinku, je významnou předností zejména při déle trvající antikoagulační léčbě. Dosud dostupné inhibitory fXa (nízkomolekulární hepariny a pentasacharidy) byly účinné pouze při aplikaci parenterální. Přívlastek přímý značí, že se jedná o primární inhibici katalytického místa faktoru Xa. Inhibován je fXa volný, vázaný v protrombinázovém komplexu s kofaktorem V i faktor začleněný do fibrinové sítě koagula. Tak je zajištěna, na rozdíl od nepřímých inhibitorů fXa, dostatečná blokáda faktoru vázaného ve fibrinové síti a neobjevuje se druhotná aktivace koagulace po rozpadu trombu. Pro apixaban je afinita k fXa vázanému v koagulu asi pětinásobná proti afinitě k fXa v plazmě. Druhou předností je, že na rozdíl od nepřímých inhibitorů (frakcionované hepariny, pentasacharidy) není k účinku potřeba vazby na antitrombin. Hlavní výhodou přímé inhibice je skutečnost, že je zachován účinek i při získané či vrozené deficienci antitrombinu. To znamená, že nedochází k selhání efektu až u 5 % populace.
Další charakteristikou je adjektivum kompetitivní. Pomocí kompetitivní vazby je zachován vztah mezi dávkou a efektem, který je v terapeutických dávkách lineární. Vzhledem ke krátkému poločasu aktivovaného X. faktoru i ke skutečnosti, že na inhibici se nepodílí žádný aktivní metabolit, je antikoagulační účinek přímo úměrný hladině apixabanu v plazmě a trvá pouze po tuto dobu. Též označení vysoce selektivní je zcela namístě. Inhibice faktoru Xa (posuzováno hodnotou inhibiční konstanty K(i) [nM]) je pro fXa 0,08 až 0,15; pro ostatní enzymy typu serinových proteáz a kofaktory je inhibice zanedbatelná, pro trombin je K(i) 6000, pro aktivovaný protein C 1800, pro faktor IXa 2200 či pro faktor VIIa je to více než 15 000 [1]. Rovněž účinek na inhibici primární hemostázy je zanedbatelný, sekundární dopad poklesu aktivity trombinu na aktivaci trombocytu je velmi malý [2].
Podívejme se na hemokoagulační kaskádu, konkrétně na strategii inhibice faktoru Xa z pohledu účinnosti antikoagulační léčby a rizika krvácení, a srovnejme ji se strategií cílenou na inhibici trombinu. Znalost fyziologie a pochopení souvislostí pomůže při výběru mezi dvěma moderními přístupy antikoagulační léčby – mezi přímou inhibicí faktoru Xa xabany či přímou inhibicí trombinu gatrany.
Hemokoagulační kaskáda a možnosti její inhibice
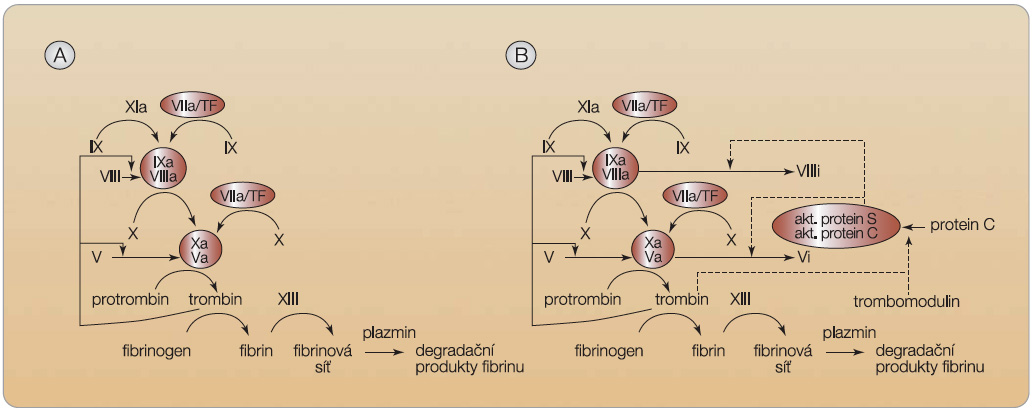 Vlastní hemokoagulační kaskáda amplifikuje aktivaci řetězce hemostatických enzymů vedoucích k vytvoření fibrinové sítě. Hemostázu zpravidla iniciuje relativně malé množství tkáňového faktoru uvolněného z buněčných membrán různých buněk. K tomu dochází zejména při poškození subendoteliálních vrstev cévní stěny. Tento krok vede ke spuštění vnější cesty hemostázy (obr. 2a). Na konci vnější cesty je uvolnění malého množství trombinu, které by nestačilo k významnější katalýze protrombinu na trombin. Rozeběhnutí kaskády je zajištěno tak, že toto malé množství iniciuje aktivaci faktoru V a VIII a rozbíhá se vnitřní cesta koagulace. Na jednotlivých úrovních kaskády dochází ke zvýšení koncentrace níže stojícího enzy-mu nejméně o 2–3 řády. Tak je dosaženo aktivace mnohonásobně většího množství trombinu schopného již spustit koagulační kaskádu s dostatečnou tvorbou fibrinu.
Vlastní hemokoagulační kaskáda amplifikuje aktivaci řetězce hemostatických enzymů vedoucích k vytvoření fibrinové sítě. Hemostázu zpravidla iniciuje relativně malé množství tkáňového faktoru uvolněného z buněčných membrán různých buněk. K tomu dochází zejména při poškození subendoteliálních vrstev cévní stěny. Tento krok vede ke spuštění vnější cesty hemostázy (obr. 2a). Na konci vnější cesty je uvolnění malého množství trombinu, které by nestačilo k významnější katalýze protrombinu na trombin. Rozeběhnutí kaskády je zajištěno tak, že toto malé množství iniciuje aktivaci faktoru V a VIII a rozbíhá se vnitřní cesta koagulace. Na jednotlivých úrovních kaskády dochází ke zvýšení koncentrace níže stojícího enzy-mu nejméně o 2–3 řády. Tak je dosaženo aktivace mnohonásobně většího množství trombinu schopného již spustit koagulační kaskádu s dostatečnou tvorbou fibrinu.
V celé kaskádě je několik klíčových míst, která se účastní iniciální (vnější) i pokračující (vnitřní) fáze koagulace. Prvým je trombin (faktor IIa), druhým faktor Xa. Oba jsou aktivovány z proenzymu čili zymogenu (protrombinu či fX) na vlastní enzym – serinovou proteázu. Součástí koagulačního systému je i antikoagulační systém, který musí udržet rovnováhu a omezit vývoj trombu jen na místo poškození cévy. Tento antikoagulační systém je reprezentován řetězcem trombin–trombomodulin–proteiny C a S. Část generovaného trombinu totiž vytvoří komplex s trombomodulinem (povrchovým proteinem endoteliální membrány), čímž pozbude hemokoagulační potenciál a naopak aktivuje proteiny C a S, které inaktivují faktory Va a VIIIa rozběhlé hemokoagulační kaskády (obr. 2b). Trombin i faktor Xa mohou být inhibovány též aktivovanými antitrombiny (např. komplexem ATIII s heparinem). Zajištění rovnováhy mezi oběma systémy – prokoagulačním a antikoagulačním – je důležité, výsledkem vychýlení rovnováhy na úrovni koagulačního a antikoagulačního ramene je trombóza či krvácení.
Úloha faktoru Xa a trombinu a srovnání důsledku jejich inhibice
Podíváme-li se na trombin a faktor Xa v širších souvislostech, zjistíme, že jejich úloha nespočívá jen v hemostáze.
Význam trombinu v hemostáze je jistě klíčový – štěpí fibrinogen na fibrin, který je schopen polymerizace a tvorby vlastní hemostatické zátky, aktivuje kofaktory V a VIII v iniciální době koagulace, aktivuje trombocyty a vazbou s trombomodu-linem kontroluje antikoagulační systém. Trombin je však také multipotentním působkem kontrolujícím řadu defenzivních a reparačních pochodů. Během fyloge-neze se z něj stala klíčová molekula kontrolující primární a zejména sekundární hemostázu. Zavedené představě odpovídá trombin jako proteáza aktivující polymerizaci rozpustného fibrinogenu na vláknitou fibrinovou síť jako aktivátor kofaktoru V a VIII či krevních 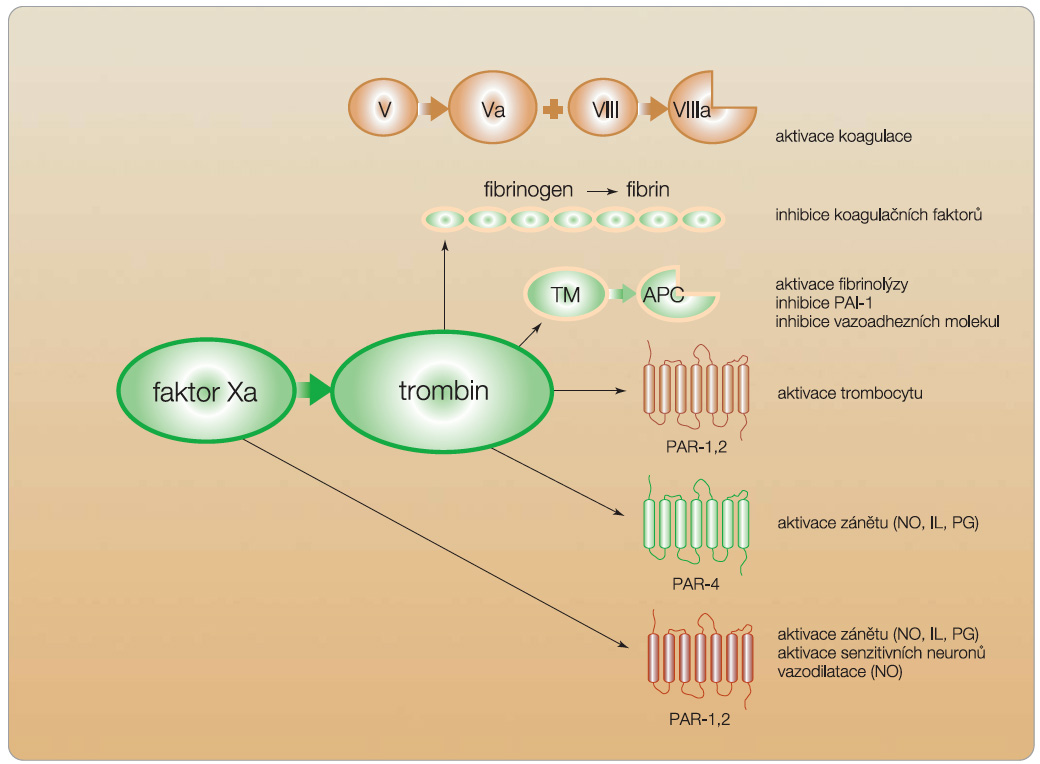 destiček. Vedle aktivace koagulace má trombin stejně důležitou úlohu antitrombotickou, která zajišťuje včasné zastavení koagulační kaskády po vytvoření zátky. Po vazbě na trombomodulin ztrácí trombin koagulační schopnosti a naopak aktivuje antikoagulační protein C a jeho kofaktor protein S. V řadě tkání pak trombin aktivuje také specifické „proteázou aktivované receptory“ (PAR), které stimulují trombocyty či v endotelu zvyšují syntézu řady prozánětlivých substancí, např. oxidu dusnatého, interleukinů či prostaglandinů (obr. 3). Komplex trombin–trom-bomodulin aktivuje protein C (APC); ten inaktivuje koagulační faktory Va a VIIIa, čímž působí jako kontrolní mechanismus brzdící již rozběhlý hemostatický proces. Vedle toho má APC též další funkce – aktivuje fibrinolýzu, čímž umožní rekanalizaci trombotizované cévy či tlumí expresi vazoadhezních molekul a reguluje zánětlivou odpověď. Komplexní pohled na trombin jako na proteázu s prohemostatickou i antihemostatickou funkcí či proteázu řídící reparační děje a proliferaci buněk účastnících se zánětu je velmi důležitý při výběru optimální léčebné strategie.
destiček. Vedle aktivace koagulace má trombin stejně důležitou úlohu antitrombotickou, která zajišťuje včasné zastavení koagulační kaskády po vytvoření zátky. Po vazbě na trombomodulin ztrácí trombin koagulační schopnosti a naopak aktivuje antikoagulační protein C a jeho kofaktor protein S. V řadě tkání pak trombin aktivuje také specifické „proteázou aktivované receptory“ (PAR), které stimulují trombocyty či v endotelu zvyšují syntézu řady prozánětlivých substancí, např. oxidu dusnatého, interleukinů či prostaglandinů (obr. 3). Komplex trombin–trom-bomodulin aktivuje protein C (APC); ten inaktivuje koagulační faktory Va a VIIIa, čímž působí jako kontrolní mechanismus brzdící již rozběhlý hemostatický proces. Vedle toho má APC též další funkce – aktivuje fibrinolýzu, čímž umožní rekanalizaci trombotizované cévy či tlumí expresi vazoadhezních molekul a reguluje zánětlivou odpověď. Komplexní pohled na trombin jako na proteázu s prohemostatickou i antihemostatickou funkcí či proteázu řídící reparační děje a proliferaci buněk účastnících se zánětu je velmi důležitý při výběru optimální léčebné strategie.
Faktor X je vitamin K-dependentní protein syntetizovaný v játrech a cirkulující v plazmě. Aktivace faktoru X je zprostředkována dvěma cestami. Prvou z nich je cesta vnějším faktorem (komplexem faktorů VIIa, tkáňového faktoru, fosfolipidů buněčného povrchu a kalciových iontů). Tato cesta iniciuje vlastní sekundární hemostázu. Druhou a nedílnou součástí hemostázy je aktivace vnitřního faktoru (komplexu faktorů IXa, VIIIa, fosfolipidů buněčného povrchu a kalciových iontů). Vnitřní faktor aktivuje mnohonásobně více fXa, čímž umožňuje pokračování hemo-stázy a mohutnou amplifikaci koagulačních enzymů nutnou k rychlému vzniku trombu. Faktor Xa participuje v protrombinázovém komplexu, který aktivuje zymogen protrombin na trombin proteolytickým odštěpením fragmentu 1.2. Protrombi-názový komplex se skládá z kofaktoru Va a z vlastní proteázy fXa vázané na fosfo-lipidy membrány. Vazba fXa v komplexu zvyšuje rychlost konverze protrombinu na trombin až 300 000násobně. Úloha faktoru Xa je, podobně jako úloha trombinu, komplexnější. Tento faktor je rovněž multipotentní proteázou s primární úlohou aktivovat protrombin na trombin. Dále však, podobně jako trombin, aktivuje receptory PAR a zvyšuje syntézu působků účastnících se zánětu (opět zejména oxidu dusnatého, interleukinů či prostaglandinů) v endoteliích a v dalších tkáních cévní stěny (obr. 3).
Při srovnání obou cest – inhibice trombinu a faktoru Xa – se zdá, že inhibice fXa je výhodnější: omezí aktivaci trombinu, ale netlumí zcela jeho fyziologické funkce, zejména umožní zachovat aktivaci anti-koagulačního ramene hemostázy. Poměr účinnost/bezpečnost, jak ukazují výsledky experimentálních i klinických studií, je tak u strategií založených na inhibici fXa (gatrany, pentasacharidy, nízkomolekulární hepariny) výhodnější. Experimentální práce potvrzují, že při léčbě apixabanem (podobně jako při léčbě jiným inhibitorem fXa fondaparinuxem) je zachována hemostáza v dávkách snižujících riziko trombotických komplikací. V experimentu byl doložen jen malý antihemostatický účinek při plném účinku antitrombotickém. Ve srovnání s warfarinem se prodloužila doba krvácení o 20 % při plné antitrombotické dávce apixabanu, zatímco tato dávka warfarinu prodloužila dobu krvácení šestinásobně [2].
Při výběru může hrát významnou roli i skutečnost, že blokáda jedné molekuly faktoru Xa zamezí aktivaci více než tisíce molekul trombinu a inhibice fXa je zpravidla dlouhodobější než inhibice trombinu. Kolísání efektu je tak relativně malé.
Možnosti sledování antikoagulační aktivity apixabanu
Na rozdíl od léčby antivitaminy K či hepariny (nefrakcionovaným i nízkomolekulárním) není nutno aktivitu apixabanu monitorovat. V klinické praxi se však objevují situace, kdy je užitečné mít informaci o případném odeznívání účinku, typicky například před urgentním operačním zákrokem.
V průběhu léčby apixabanem dochází k prodloužení řady hemokoagulačních testů odrážejících aktivitu fXa – protrombinového času, aktivovaného parciálního tromboplastinového času (aPPT) i INR. Bohužel ovlivnění těchto testů při podávání tera-peutických dávkek nebylo úměrné anti-koagulační aktivitě a byla zaznamenána velká intra- i interindividuální variabilita výsledků. Uvedené testy nejsou tedy k určení antikoagulační aktivity vhodné.
Další možností je sledování aktivity anti-Xa některým z komerčně dostupných kitů. Bohužel ani zde není situace ideální, výsledky testů jednotlivých kitů se vzájemně významně liší. Je však dokumen-továno, že v rámci jedné metodiky je zachován lineární vztah mezi anti-Xa působením a koncentrací apixabanu. Spolehlivost byla stejná jako při monitorování efektu nízkomolekulárního heparinu, lineární závislost dávky a efektu platila pro nízké, stejně jako pro vysoké dávky [3].
V klinických studiích v rámci III. fáze hodnocení byla používána metodika založená na heparinové chromogenní analýze komerčně dostupným kitem Rotachrom. Při podávání 2,5 mg apixabanu 2krát denně byla touto metodou sledována varia-bilita měření, testy doložily uspokojivou citlivost s přijatelnou variabilitou. Při sledování kolísání aktivity mezi maximálním a minimálním efektem (trough-to-peak) anti-Xa byl dokumentován relativně malý pokles aktivity na konci dávkovacího intervalu, fluktuace byla nižší než 1,6. Dosavadní zkušenosti podporují názor, že sledování antikoagulační aktivity apixabanu pomocí heparinové chromogenní aktivity je optimálním postupem, též výrobce doporučuje tuto analýzu s užitím komerčně dostupné soupravy Rotachrom.
Farmakokinetické vlastnosti
Pro optimální klinický efekt antikoagulancia je z farmakokinetických vlastností rozhodující: dostatečná rychlost nástupu účinku po perorálním či parenterálním podání, predikovatelná a stabilní plazmatická hladina účinné látky po celou dobu dávkovacího intervalu, malá interindividuální a intraindividuální variabilita účinku daná spolehlivou a stabilní biologickou dostupností, nízkou variabilitou biotransformace a bioeliminace s malým dopadem renálního či jaterního selhání a minimálním rizikem interakcí s potravou či s léky.
Po perorální aplikaci se apixaban dobře vstřebává, biologická dostupnost je 50 % až 85 %. Na úrovni enterocytu, epitelie tubulu nefronu a hepatocytu je substrátem dvou efluxních transmembrá-nových pump – glykoproteinu P (P-gp) a BCRP (breast cancer resistence pro-tein). Vzhledem k tomu, že afinita k pumpám je malá, není ani resorpce výrazně snížena. Též polymorfismy s nízkou či vysokou aktivitou pump výrazně neovlivňují farmakokinetické parametry, tj. resorpci a eliminaci apixabanu [4]. Podobně apixaban ani jeho metabolity významně neovlivňují aktivitu transportních pump [5]. Resorpce je rychlá – maximální plazmatické koncentrace cmax je dosaženo za 30 minut až 3 hodiny. Nástup účinku lze očekávat zpravidla za 1 hodinu. V plazmě je apixaban z 87 % až 95 % vázán na transportní bílkoviny. V játrech je částečně metabolizován na biologicky neaktivní metabolity (zejm. O-demethyl apixaban sulfát), hlavní cirkulující látkou však zůstává mateřská molekula. Plazmatický poločas apixabanu je dlouhý – dosahuje 8–14 hodin, průměr představoval 12,7 Ī 8,6 ho-din. Rovnovážného stavu je dosaženo do 3 dnů.
Eliminace je zajištěna asi ze dvou třetin játry a z jedné třetiny ledvinami. Renální či jaterní selhání expozici apixabanu zvyšuje jen málo, anti-Xa aktivita se významně nezměnila. U seniorů a u žen se expozice (AUC) apixabanu klinicky nevýznamně zvyšuje o 20–30 %. Tělesná hmotnost pohybující se v rozmezí 50–120 kg expozici významně nemění. Při nižší hmotnosti AUC mírně (asi o 30 %) stoupá, při vyšší hmotnosti naopak klesá. Rasové rozdíly prokázány nebyly.
Jak bylo řečeno, hlavní látkou pro bioeliminaci a bioinaktivaci zůstává vlastní apixaban. Z menší části je transformován na řadu biologicky inaktivních metabolitů. Konverze v hepatocytu je katalyzována oxidázami CYP3A4/5 s malou účastí CYP1A2 a CYP2J2. K izoenzymům CYP se apixaban (i jeho metabolity) chová jako čistý substrát, nebyla pozorována aktivace či inhibice. Testování metabolismu typických substrátů jednotlivých oxidáz CYP (CYP1A2, 2C8, 2C9, 3A4/5 a 2J2) nebylo apixabanem ovlivněno. Je proto nepravděpodobné, že by apixaban významně ovlivňoval metabolismus jiných léčiv [6]. Na druhé straně je třeba říci, že resorpce, transformace i eliminace je ovlivněna induktory a inhibitory transportních pump a izoenzymů CYP. Z tohoto pohledu jsou významné dvě interakce – na úrovni efluxní pumpy P-gp a oxidázy CYP3A4. Oba systémy jsou zpravidla inhibovány a indukovány stejnými molekulami (léčivy či potravou).
 Silné inhibitory P-gp a CYP3A4, jako jsou azolová antimykotika (zejména ketokonazol) a antiretrovirotika (zejména ritonavir), zvyšují jak dosažitelnost, tak zpomalují eliminaci a inaktivaci. Expozice apixabanu se zvyšuje na dvojnásobek a maximální koncentrace stoupá asi o polovinu [6]. Podobně lze očekávat zvýšení expozice apixabanu po podání silných inhibitorů ze skupiny makrolidových antibiotik (klarithromycin a erythromycin). Slabší inhibitory obou systémů – verapamil, diltiazem, amiodaron, flavonoidy grepové šťávy – zvyšují expozici jen málo, řádově o třetinu. Naproxen, který inhibuje pouze P-gp, zvyšuje již v jedné dávce expozici apixabanu asi o polovinu, o efektu dlouhodobějšího podávání nejsou k dispozici údaje.
Silné inhibitory P-gp a CYP3A4, jako jsou azolová antimykotika (zejména ketokonazol) a antiretrovirotika (zejména ritonavir), zvyšují jak dosažitelnost, tak zpomalují eliminaci a inaktivaci. Expozice apixabanu se zvyšuje na dvojnásobek a maximální koncentrace stoupá asi o polovinu [6]. Podobně lze očekávat zvýšení expozice apixabanu po podání silných inhibitorů ze skupiny makrolidových antibiotik (klarithromycin a erythromycin). Slabší inhibitory obou systémů – verapamil, diltiazem, amiodaron, flavonoidy grepové šťávy – zvyšují expozici jen málo, řádově o třetinu. Naproxen, který inhibuje pouze P-gp, zvyšuje již v jedné dávce expozici apixabanu asi o polovinu, o efektu dlouhodobějšího podávání nejsou k dispozici údaje.
Silné induktory P-gp a CYP3A4 (některá antiepileptika a antikonvulziva – fenobarbital, fenytoin, karbamazepin či antibio-tikum rifampicin nebo třezalka tečkovaná) naopak expozici významně snižují, není sice nutná úprava dávky, nicméně raději se jejich podávání vyhýbáme [7].
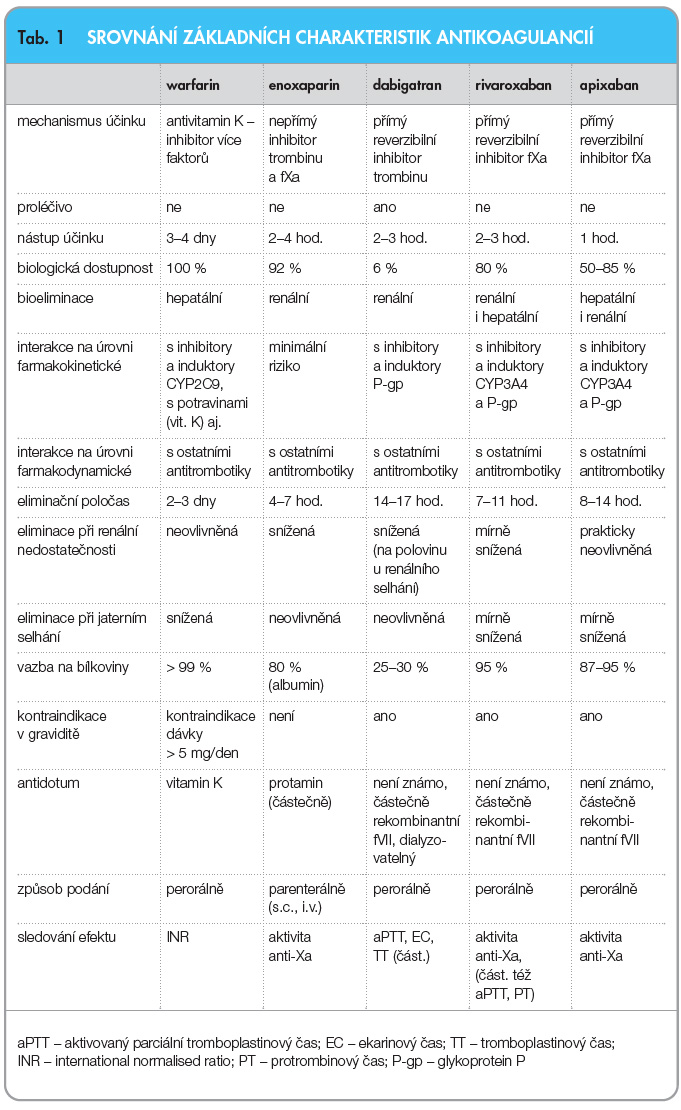
Přehled základních farmakokinetických ukazatelů apixabanu a ostatních antikoagulancií je uveden v tab. 1.
Klinické zkušenosti
Studie I. a II. fáze klinického hodnocení
V prvé fázi klinického hodnocení byla stanovena optimální léčebná dávka u zdravých dobrovolníků. K dosažení účinné blokády sekundární hemostázy při dostatečné bezpečnosti byla určena dávka 5–20 mg apixabanu denně v jedné či dvou dávkách, nástup efektu byl rychlý – 30 až 120 minut, rozhodující množství apixabanu se vyskytovalo intravaskulárně, v jiných orgánech byla koncentrace zanedbatelná. Eliminace byla bifázická, plazmatický poločas byl v průměru 12,7 hodiny, dlouhý poločas umožňoval podávání v jedné či dvou denních dávkách.
Iniciálně byla testována účinnost a bezpečnost v profylaxi tromboembolické nemoci (TEN) u nemocných po ortopedické náhradě velkých kloubů. Na základě analýzy výsledků incidence tromboembolie či mortality (primární ukazatel) u nemocných po náhradě kolene ve srovnání s enoxaparinem byla doložena větší účinnost a bezpečnost (6,8 % až 10,6 % příhod při podávání apixabanu a 15,6 % při podává-ní enoxaparinu či 26,6 % při léčbě warfari-nem) [8]. Výskyt krvácení byl při užití nízkých dávek apixabanu stejný jako u komparátoru. Podobně, z hlediska bezpečnosti, dopadly studie II. fáze u nemocných po náhradě kyčle ve studii BOTTICELLI DVT [9]. Na základě výsledků výše uvedených studií byla pro profylaxi v ortopedických indikacích stanovena dávka 2krát denně 2,5 mg apixabanu jako optimální.
Paralelně byla ve II. fázi hodnocení testována bezpečnost různých dávek apixaba-nu (5 až 20 mg denně) v indikaci sekundární prevence po akutní koronární příhodě (studie APPRAISE) v kombinaci se stávající protidestičkovou léčbou kyselinou acetylsalicylovou a klopidogrelem [10]. Pro vyšší výskyt krvácení při vysokých dávkách apixabanu při „triální“ antitrombotické léčbě byla ukončena část studie s vyšší dávkou apixabanu (20 mg denně). Nicméně po skončení studie byl i ve větvi s léčbou 5 mg a s 10 mg apixabanu denně zjištěn vyšší výskyt krvácení – 5,7 % a 7,9 % – oproti 3 % v placebové větvi (kde pacienti dostávali pouze protidestičkovou léčbu). Při posuzování účinnosti se u nižších dávek apixabanu objevil trend ke snížení rizika kardiovaskulární příhody – HR 0,73; 95% CI 0,44 až 1,19; p = 0,21. Pro ověření účinku byla doplněna studie APPRAISE-2, která bude diskutována později.
Shrneme-li, pak studie časných fází klinického hodnocení doložily uspokojivý antitrombotický účinek i bezpečnost v profylaxi TEN u nemocných po náhradě velkých kloubů při dávce 2krát 2,5 mg apixabanu denně, klinické studie přešly do III. fáze hodnocení.
Studie III. fáze klinického hodnocení
Pro schválení léku před zavedením do praxe jsou klíčové výsledky III. fáze hodnocení. Apixaban byl prověřován v sérii klinických megastudií v indikacích: profylaxe TEN u nemocných po náhradě kyčelního kloubu (studie ADVANCE-3), po náhradě kolenního kloubu (studie ADVANCE-2), v sekundární prevenci TEN – profylaxe rekurence – u nemocných po proběhlé plicní embolii na podkladě flebotrombózy (studie AMPLIFY) či studie u rizikové neortopedické populace (studie ADOPT). Jiným směrem se ubíraly studie zaměřené na profylaxi mozkové či systémové embolie u nemocných s fibrilací síní (studie AVERROES proti acetylsalicylové kyselině u nemocných neindikovaných k léčbě antivitaminem K či studie ARISTOTLE proti warfarinu). Dále byla provedena studie srovnávající efekt apixabanu proti placebu u nemocných po akutní koronární příhodě léčených v obou větvích duální protides-tičkovou léčbou (studie APPRAISE-2).
Nejdříve byly dokončeny studie u ne-mocných léčených krátkodobě v rámci profylaxe TEN po implantaci kolenní či kyčelní endoprotézy. Program předregistrační fáze hodnocení byl nazván ADVANCE. Na jeho základě byla doložena účinnost a bezpečnost apixabanu v daných indikacích a jeho srovnatelná, či dokonce vyšší účinnost a bezpečnost proti standardní léčbě enoxaparinem. V obou těchto indikacích je klinické užívání apixabanu schváleno.
Prvou studií programu byla non-infe-riorní studie ADVANCE-1, která porovnávala efekt apixabanu podávaného perorálně v dávce 2,5 mg 2krát denně s enoxaparinem podávaným subkutánně v dávce 30 mg 2krát denně u 3195 pacientů, kteří podstoupili totální náhradu kolenního kloubu [11]. Primárním ukazatelem účinnosti byl výskyt symptomatické i asymptomatické flebotrombózy, nefatální plicní embolie (PE) a úmrtí z jakékoli příčiny. Sekundární cíle sledovaly závažné tromboembolie (proximální flebotrombózy, nefatální PE) a úmrtí v důsledku TEN či alternativně symptomatické tromboembolie zahrnující symptomatickou flebotrombózu a nefatální PE. Primární ukazatel se objevil v obou režimech stejně často – v 9 % v apixabanové větvi a v 8,8 % ve větvi enoxaparinové. Rovněž ve výskytu sekundárních ukazatelů nebyl zjištěn rozdíl. Při sledování bezpečnosti byla hodnocena incidence závažných krvácení, zde byl doložen významný pokles výskytu při léčbě apixabanem (0,7 % vs. 1,4 %), naopak při sledování všech typů krvácení rozdíl nalezen nebyl (5,3 % vs. 6,8 %). Shrneme-li, pak studie ADVANCE-1 ukázala srovnatelný účinek apixabanu podávaného ve standardní dávce s enoxaparinem v dávce 30 mg 2krát denně, bezpečnost léčby apixabanem však byla větší.
Obdobně uspořádaná, se stejnými vstupními kritérii i ukazateli účinnosti a bezpečnosti a s obdobným počtem nemocných, byla studie ADVANCE-2 [12]. Zatímco prvá studie zvolila režim dávkování enoxaparinu užívaný převážně v USA, tj. 2krát denně 30 mg, druhá studie volila režim obvyklejší v Evropě, tj. enoxaparin v jedné denní dávce 40 mg. Při tomto dávkovacím schématu se primární ukazatel (celkový výskyt flebotrombóz, tromboembolických příhod či úmrtí) objevuje významně méně často při léčbě apixabanem (15,1 % vs. 24,4 %), sekundární ukazatele též významně poklesly při léčbě apixabanem (tab. 2). Riziko krvácení přitom bylo v obou léčebných ramenech stejné.
Porovnáme-li obě studie, pak apixaban je v indikaci prevence TEN po náhradě kolenního kloubu při srovnání s enoxaparinem podávaným dvakrát denně stejně účinný, ale bezpečnější z hlediska výskytu závažných krvácivých komplikací, naopak při dávkování enoxaparinu v jedné denní dávce je apixaban účinnější při stejném riziku krvácení.
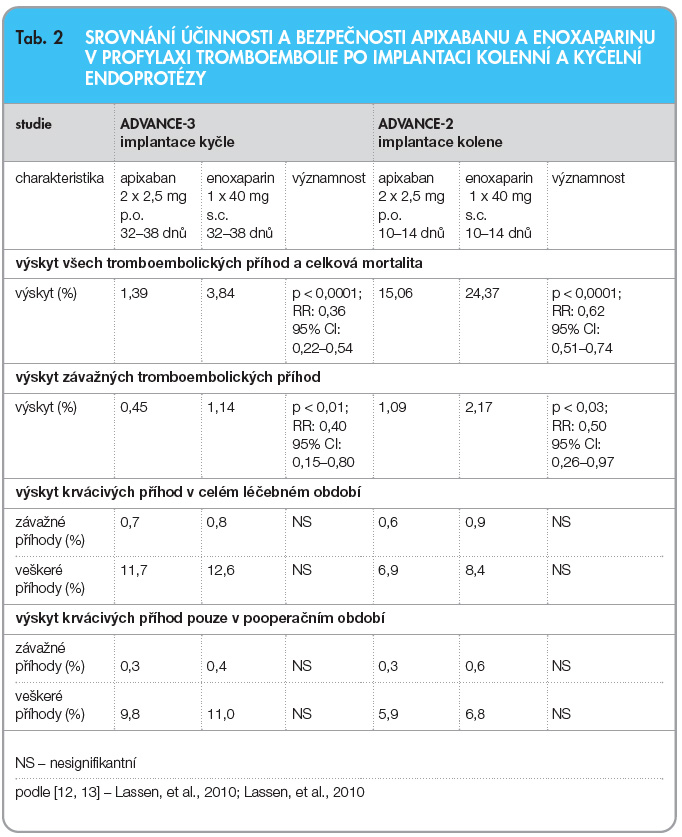 Poslední z programu prevence TEN u ortopedických nemocných byla studie ADVANCE-3 [13]. Schéma bylo opět obdobné, jen indikací byla náhrada kyčelního kloubu, délka léčby byla na rozdíl od 12 dnů u kolenního kloubu 35denní, delší doba léčby vyplývala z pomalejší mobilizace nemocných. Dávka apixabanu byla opět standardní – 2krát 2,5 mg denně, enoxaparin byl podáván v jedné denní dávce 40 mg. Také v této studii byl v rameni s léčbou apixabanem doložen pokles výskytu primárních i sekundárních ukazatelů účinnosti (tab. 2 a graf 1). Výskyt všech tromboembolických příhod a úmrtí byl jen třetinový (1,4 % vs. 3,9 %), relativní riziko 0,36; 95% CI: 0,22–0,54; p < 0,0001. Bezpečnost, tj. riziko krvácení (závažné i veškeré), přitom zůstala stejná. Dá se tedy konstatovat, že apixaban podávaný v dávce 2,5 mg 2krát denně je účinnější a stejně bezpečný jako enoxaparin v dávce jedenkrát denně 40 mg v indikaci implantace kyčelní endoprotézy.
Poslední z programu prevence TEN u ortopedických nemocných byla studie ADVANCE-3 [13]. Schéma bylo opět obdobné, jen indikací byla náhrada kyčelního kloubu, délka léčby byla na rozdíl od 12 dnů u kolenního kloubu 35denní, delší doba léčby vyplývala z pomalejší mobilizace nemocných. Dávka apixabanu byla opět standardní – 2krát 2,5 mg denně, enoxaparin byl podáván v jedné denní dávce 40 mg. Také v této studii byl v rameni s léčbou apixabanem doložen pokles výskytu primárních i sekundárních ukazatelů účinnosti (tab. 2 a graf 1). Výskyt všech tromboembolických příhod a úmrtí byl jen třetinový (1,4 % vs. 3,9 %), relativní riziko 0,36; 95% CI: 0,22–0,54; p < 0,0001. Bezpečnost, tj. riziko krvácení (závažné i veškeré), přitom zůstala stejná. Dá se tedy konstatovat, že apixaban podávaný v dávce 2,5 mg 2krát denně je účinnější a stejně bezpečný jako enoxaparin v dávce jedenkrát denně 40 mg v indikaci implantace kyčelní endoprotézy. ![Graf 1 Účinnost a bezpečnost apixabanu v prevenci tromboembolické nemoci (TEN) po operaci kyčle (studie ADVANCE-3); podle [13] – Lassen, et al., 2010.](https://www.remedia.cz/photo-a-28549---.jpg) Druhou oblastí, již se věnovala III. fáze klinického hodnocení, byla profylaxe mozkové a ostatní systémové embolizace u nemocných s fibrilací síní. I když již máme zdokumentovány příznivé výsledky, užití apixabanu v této indikaci ještě není schváleno, registrační řízení však probíhá. Studie u nemocných s non-valvulární fibrilací síní prověřovaly efekt apixabanu ve dvou indikacích – první byla u nemocných neindikovaných k léčbě antagonisty vitaminu K pro intoleranci či z jiných příčin, zde bylo provedeno porovnání s kyselinou acetylsalicylovou. Druhá byla zaměřena na srovnání apixabanu s warfarinem jako alternativa antikoagulační léčby.
Druhou oblastí, již se věnovala III. fáze klinického hodnocení, byla profylaxe mozkové a ostatní systémové embolizace u nemocných s fibrilací síní. I když již máme zdokumentovány příznivé výsledky, užití apixabanu v této indikaci ještě není schváleno, registrační řízení však probíhá. Studie u nemocných s non-valvulární fibrilací síní prověřovaly efekt apixabanu ve dvou indikacích – první byla u nemocných neindikovaných k léčbě antagonisty vitaminu K pro intoleranci či z jiných příčin, zde bylo provedeno porovnání s kyselinou acetylsalicylovou. Druhá byla zaměřena na srovnání apixabanu s warfarinem jako alternativa antikoagulační léčby.
Studie AVERROES byla navržena k potvrzení předpokladu, že u nemocných neindikovaných k léčbě antivitaminem K a indikovaných k protidestičkové léčbě kyselinou acetylsalicylovou (ASA) bude podávání apixabanu účinnější v prevenci mozkové příhody či systémové emboli-zace (primární ukazatel). Do studie bylo zařazeno 5,5 tisíce nemocných s CHADS2 skóre ≥ 1, kteří byli randomizováni do větve léčené 81 mg ASA či 5 mg apixabanu podávaného 2krát denně [14]. Po roce trvání (průměrná doba sledování 1,1 roku) byla studie předčasně ukončena pro vysokou statistickou významnost přednosti léčby apixabanem proti ASA. V apixabanovém rameni se objevuje iktus či systémová embolie v 1,6 %/rok léčby, ve větvi léčené ASA byl výskyt více než dvojnásobný – 3,7 %/rok léčby. Relativní riziko pro léčbu apixabanem bylo 0,45 při 95% intervalu spolehlivosti 0,32–0,62; p < 0,001. Odpovídajícím způsobem poklesl též výskyt ischemických iktů – 1,1% /rok při léčbě apixabanem proti 3,0% /rok při podávání ASA (RR 0,37; 95% CI: 0,25–0,55; p < 0,001). Celková mortalita poklesla o pětinu (RR 0,79; 95% CI 0,61–1,02; p = 0,07). Bezpečnost léčby byla v obou ramenech srovnatelná – hemoragický iktus se objevil u 6 nemocných v apixabanové větvi a u 9 pacientů léčených ASA. Závažné krvácení se vyskytlo u 44 nemocných (1,4 %/rok) léčených apixabanem a u 39 léčených ASA (1,2 %/rok). Při souhrnném hodnocení účinnosti i bezpečnosti (výskyt iktu, systémové embolizace, infarktu myokardu, kardiovas-kulární mortality nebo závažného krvácení) byl apixaban opět výhodnější, incidence klesla o více než čtvrtinu (RR 0,74; 95% CI: 0,60–0,90; p = 0,003). Studie potvrdila, že antikoagulační léčba, v tomto případě apixabanem, je v profylaxi tromboembo-lických komplikací při fibrilaci síní výrazně výhodnější nežli léčba protidestičková. Podskupinová analýza pak navíc ukázala, že čím rizikovější skupina nemocných byla posuzována (hodnotou CHADS2 skóre), tím větší rozdíl ve prospěch apixabanu byl pozorován.
Zcela recentně, tj. koncem srpna 2011, byly na kongresu ESC (European Society of Cardiology) zveřejněny výsledky druhé studie u nemocných s non-valvulární fibrilací síní – studie ARISTOTLE [15]. I tato studie byla dvojitě zaslepená; primárně byla koncipována jako non-inferiorní proti warfarinu. Randomizováno bylo více než 18 tisíc nemocných s fibrilací síní (s alespoň jedním rizikovým faktorem CHADS2) do dvou větví: v první byli pacienti léčeni apixabanem podávaným v dávce 5 mg 2krát denně, ve druhé větvi byl pacientům podáván warfarin v dávce podle cílové hodnoty INR 2–3. Primárním ukazatelem byl výskyt mozkové příhody (ischemické, hemoragické či blíže neurčené) nebo systémové embolizace.
![Graf 2 Účinnost a bezpečnost apixabanu v prevenci iktu či systémové embolizace, celkové mortality a krvácení u fibrilace síní (studie ARISTOTLE); podle [15] – Granger, et al., 2011.](https://www.remedia.cz/photo-a-28550---.jpg) Po 18 měsících sledování (medián) byl doložen pokles primárního ukazatele účinnosti o 21%, RR 0,79 (95% CI: 0,66–0,95), p = 0,01 pro superioritu ve prospěch apixabanu. Primární ukazatel bezpečnosti (významné krvácení podle klasifikace International Society on Thrombosis and Haemostasis) poklesl při léčbě apixabanem rovněž významně o 31%, RR 0,69 (95% CI: 0,60–0,80), p < 0,001. Velmi důležitý ukazatel – výskyt hemoragického iktu – poklesl téměř o polovinu, RR 0,51 (95% CI: 0,35–0,75), p < 0,001 a celková mortalita klesla v apixabanové větvi o 11 %, RR 0,89 (95% CI: 0,80–0,99), p = 0,047 (graf 2). Výsledky dokumentují nejen významně vyšší účinnost apixabanu v prevenci mozkové příhody a systémové embolizace (pokles o pětinu), ale i v redukci výskytu fatálních příhod. Současně se významně zvýšila bezpečnost, tedy výskyt závažného krvácení poklesl asi o třetinu a výskyt hemoragických iktů asi o polovinu.
Po 18 měsících sledování (medián) byl doložen pokles primárního ukazatele účinnosti o 21%, RR 0,79 (95% CI: 0,66–0,95), p = 0,01 pro superioritu ve prospěch apixabanu. Primární ukazatel bezpečnosti (významné krvácení podle klasifikace International Society on Thrombosis and Haemostasis) poklesl při léčbě apixabanem rovněž významně o 31%, RR 0,69 (95% CI: 0,60–0,80), p < 0,001. Velmi důležitý ukazatel – výskyt hemoragického iktu – poklesl téměř o polovinu, RR 0,51 (95% CI: 0,35–0,75), p < 0,001 a celková mortalita klesla v apixabanové větvi o 11 %, RR 0,89 (95% CI: 0,80–0,99), p = 0,047 (graf 2). Výsledky dokumentují nejen významně vyšší účinnost apixabanu v prevenci mozkové příhody a systémové embolizace (pokles o pětinu), ale i v redukci výskytu fatálních příhod. Současně se významně zvýšila bezpečnost, tedy výskyt závažného krvácení poklesl asi o třetinu a výskyt hemoragických iktů asi o polovinu.
Pokračováním již zmíněné pilotní studie APPRAISE, která testovala optimální dávku apixabanu u nemocných po akutní koronární příhodě léčených duální protidestičkovou léčbou, byla studie APPRAISE-2 [16]. V této studii byla testována dávka 2krát denně 5 mg apixabanu proti placebu u nemocných recentně po koronární příhodě, kteří byli léčeni ASA či kombinací ASA s klopidogrelem. Studie byla předčasně ukončena pro nárůst výskytu závažných hemoragických příhod (2,4 % ročně vs. 0,9 % ročně), aniž by byl pozorován pokles kardiovaskulárních příhod (7,5 % v apixabanové a 7,9 % v placebové větvi – při sledování výskytu infarktu myokardu, iktu či kardiovaskulární mortality).
Vedle uvedených studií probíhají, či již byly ukončeny a zatím nezveřejněny další studie. U nemocných po proběhlé plicní embolii na podkladě flebotrombózy, tj. v sekundární profylaxi rekurence TEN, probíhá studie AMPLIFY, ukončení studie se očekává koncem roku 2012. Obdobně ještě nejsou zveřejněny výsledky studie zaměřené na profylaxi TEN u hospitali-zované rizikové neortopedické populace (studie ADOPT). Studie byla v květnu 2011 ukončena, nicméně výsledky nejsou ještě zveřejněny. Významné jsou i studie u pediatrických nemocných či u nemocných v hemodialyzační léčbě, obě studie jsou stále aktivní.
Zařazení do současné palety léčiv – porovnání léčebných strategií
Při srovnání apixabanu s ostatními antikoagulancii je vhodné porovnání v několika rovinách. První komparace se nabízí v indikaci prevence TEN u ortopedických nemocných proti nízkomolekulárním heparinům, resp. proti „zlatému standardu“ enoxaparinu. Zde máme v několika studiích k dispozici přímé srovnání. V dané indikaci je potřeba porovnat účinek také s ostatními přímými inhibitory fXa či s inhibitory trombinu, konkrétně s rivaroxabanem a s dabigatranem. Pro ostatní léčiva ze skupiny xabanů nemáme pro srovnání data.
Shrneme-li data z programu ADVANCE, máme k dispozici porovnání s enoxaparinem ve dvou doporučovaných léčebných režimech – aplikace 2krát denně v dávce 30 mg a jednou denně v dávce 40 mg. V prvém režimu je apixaban v profylaxi srovnatelně účinný, výskyt krvácení je však významně nižší, tedy je docíleno větší bezpečnosti léčby. Naopak při podávání enoxaparinu v jedné denní dávce, jak je rozšířeno v Evropě, je apixaban ve standardní dávce 2krát 2,5 mg v profylaxi výrazně účinnější, výskyt krvácení je však srovnatelný (graf 1).
Porovnáme-li v dané indikaci dva dostupné xabany – apixaban s rivaroxabanem, pak nemáme k dispozici žádnou studii srovnávající oba léky přímo. Existují však studie porovnávající oba léky s enoxaparinem ve stejném dávkovacím schématu, tj. proti 40 mg enoxaparinu v jedné denní dávce. Obdobně programu ADVANCE-2 a ADVANCE-3 odpovídá u rivaroxabanu program RECORD 1 až 3. Vybereme-li například indikaci profylaxe TEN po náhradě kyčelního kloubu, pak rivaroxaban snížil incidenci všech tromboembolických příhod o 70 % a závažných příhod o 88 % proti profylaxi enoxaparinem. Výskyt krvácení byl nízký a nebyl v obou skupinách významně rozdílný. Ve stejné indikaci a proti stejné dávce enoxaparinu poklesl při léčbě apixabanem výskyt všech TEN o 64 % a závažných TEN o 60 %. Výskyt krvácení byl i zde nízký a mezi skupinami nebyl zaznamenán rozdíl [17].
Dále je potřeba porovnat také dabigatran, perorálně účinný přímý inhibitor trombinu. Opět porovnejme efekt ve stejné indikaci (náhrada kyčle) a proti stejné dávce enoxaparinu (1krát denně 40 mg). Ve studii RE-NOVATE byl v obou zvolených dávkách dabigatranu (150 mg a 220 mg) srovnatelný efekt na pokles tromboembolických příhod s léčbou enoxaparinem. Riziko krvácení bylo rovněž stejné.
Je tedy možno konstatovat, že při nepřímém srovnání je léčba apixabanem a rivaroxabanem obdobně účinná i bezpečná, tedy oba xabany jsou účinnější nežli enoxaparin v jedné denní dávce. Ve stejném uspořádání je dabigatran srovnatelně účinný a bezpečný s enoxaparinem, lze tedy usuzovat na větší profylaktický efekt xa-banů.
Nespornou výhodou přímých inhibitorů je perorální aplikace. Ta je z hlediska jak zdravotnického personálu, tak nemocného jednoznačně preferována. Dosud dostupné perorální antikoagulans warfarin má řadu nevýhod, zejména pomalý nástup účinku, velkou intra- i interindividuální varia-bilitu efektu, nutnost monitorace léčby, riziko lékových a potravinových interakcí, vyšší riziko krvácení i dalších nežádoucích účinků. Naproti tomu výhodou warfarinu jsou nízké přímé náklady na léčbu. Srovnáme-li však náklady veškeré, tedy stanovení nákladů na získaný kvalitní rok života (QALY), pak ve vyspělejších zemích dopadl farmakoekonomický rozbor ve prospěch rivaroxabanu a dabigatranu. Farmakoekonomická analýza studie ARISTOTLE pro apixaban zatím k dispozici není.
Indikace
Apixaban je indikován v prevenci trombotických příhod u dospělých nemocných, kteří podstoupili náhradu kyčelního nebo kolenního kloubu.
V jiných indikacích užití apixabanu není schváleno, použití v profylaxi iktu a systémové embolizace u nemocných s kontraindikací antivitaminů K je v registračním procesu.
Kontraindikace
Stejně jako je tomu u ostatních anti-trombotik, není apixaban vhodný u nemocných s výrazným rizikem krvácení, opatrní jsme též u nemocných ohrožených krvácením kvůli vysokému riziku úrazu, s hypertenzí s vysokými hodnotami tlaku, po nedávných operacích či punkcích v oblasti CNS či oka.
Absolutní kontraindikací je významné aktivní krvácení, jako je závažná recentní hemoragická příhoda, zejména krvácení nitrolební (i v anamnéze), krvácení do zažívacího traktu apod. Podobně je kontraindikací jaterní onemocnění spojené s významnou koagulopatií nebo významná trombocytopenie či trombocytopatie.
Apixaban nepodáváme ani při známé hypersenzitivitě na léčivou látku nebo na kteroukoli pomocnou látku.
Pro nedostatek zkušeností se nedo-poručuje léčba u nemocných s renálním selháním (léčeným konzervativně či hemodialýzou). Podobně se nedoporučuje léčba při současném podávání silných inhibitorů CYP3A4 a P-gp (azolová antimykotika, některá makrolidová antibiotika – klarithromycin a erythromycin).
Nežádoucí účinky
Nejčastější nežádoucí účinek apixa-banu – krvácení – vychází z farmakody-namického účinku. Klinicky významné krvácení a velké krvácení (dle definice ISTH) se v perioperačním a postoperačním období (10–35 dnů po zákroku) objevi-lo asi u 3–5 % nemocných při dávce 5 mg apixabanu denně (údaj ze studií programu ADVANCE). Při dlouhodobé léčbě nemocných s fibrilací síní dávkou 10 mg apixabanu denně ve studii AVERROES se objevilo klinicky významné krvácení a velké krvácení ve 4–5 % ročně [14]. Obávané intrakraniální krvácení z toho činilo 0,5 %. Výskyt všech typů krvácení byl srovnatelný s incidencí krvácení při léčbě kyselinou acetylsalicylovou (ASA). Krvácení mělo nejčastěji charakter epistaxe, krvácení do zažívacího traktu, hematurie či krvácení v místě chirurgického zákroku, punkce či v místě instalovaného katétru.
Z ostatních nežádoucích účinků se setkáváme u více než 1 % nemocných s anémií, která se často vyskytuje jako následek krvácení. Obdobná je incidence zažívacích potíží. Daleko méně časté jsou asymptomatické elevace jaterních testů, vzestup byl zpravidla mírný a hodnoty se spontánně vracely k normálu i při pokračování léčby. Druhým, vzácnějším laboratorním nežádoucím účinkem byly mírné tranzitorní trombocytopenie.
Při srovnání s ostatními antikoagulancii bylo možno konstatovat, že při farmakolo-gicky ekvivalentních dávkách (z pohledu antikoagulačního efektu) byl pozorován nižší výskyt krvácení proti enoxaparinu či warfarinu. Ostatní nežádoucí účinky (např. hypersenzitivita) byly málo významné a velmi vzácné.
Lékové interakce
Lékové interakce na bázi farmakodynamické představují antitrombotika – jak antikoagulancia, tak protidestičkové léky. Komedikace apixabanu s těmito léky vý-znamně zvyšuje riziko krvácení. V praxi je nepravděpodobné současné podání apixabanu s antikoagulancii, ale kombinace s protidestičkovými léky (s ASA a s klopidogrelem) se v praxi objevuje. V preklinických studiích byl doložen významný dopad přidání ASA či klopidogrelu k léčbě apixabanem na prodloužení doby krvácení [18, 19]. V hodnocení fáze II a III byl testován účinek přidání apixabanu k současné léčbě ASA či ASA s klopidogrelem u akutních koronárních příhod [10, 16]. Přidání apixabanu k monoterapii ASA či k duální protidestičkové léčbě vedlo k významnému zvýšení rizika veškerého i závažného krvácení na dvojnásobek až trojnásobek. V absolutním počtu významné krvácení stouplo o 1–2 % ročně. V praxi je možno tuto kombinaci očekávat například při nutnosti účinné profylaxe tepenné trombózy a současné nutnosti antikoagulační léčby (např. u nemocných s koronární příhodou a současně s fibrilací síní).
Druhým typem interakcí jsou interakce na bázi farmakokinetické, tedy vzájemné ovlivnění resorpce, transformace a eliminace. Jak bylo probráno výše, apixaban je substrátem dvou efluxních pump – P-gp a BCRP. Aktivita obou systémů rozhoduje o biologické dostupnosti i rychlosti bioeliminace. Dále je apixaban substrátem řady izoenzymů CYP, nejvýznamnější je oxidáza CYP3A4, která ovlivňuje transformaci na inaktivní metabolity. Blokáda zejména P-gp zvyšuje biologickou dostupnost a zpomaluje eliminaci do žluče, blokáda CYP3A4 zpomaluje inaktivaci a transformaci. Mnohá léčiva jsou významnými inhibitory současně CYP3A4 i P-gp, účinek na zvýšení expozice apixabanu se tak zvyšuje. Ke klinicky významným inhibitorům obou systémů patří antimykotika azolové-ho typu (ketokonazol, flukonazol, itrakonazol aj.), antiretrovirotika (např. ritonavir aj.) či makrolidy klarithromycin a erythromycin. Komedikace s nimi zvyšuje expozici apixabanu asi dvojnásobně, klinicky již významně. Současnému podání se proto raději vyhneme či denní dávku apixabanu redukujeme. Ostatní inhibitory obou systémů (verapamil, diltiazem, amiodaron, grapefruit aj.) již nezvyšují expozici o více než 30–40 %, klinický význam je proto malý [19].
Interakce s induktory obou systémů (např. fenobarbital, rifampicin, třezalka či dexamethason) se projeví snížením expozice apixabanu. Nicméně při širokém terapeutickém oknu apixabanu není toto snížení plazmatické hladiny klinicky závažné.
O interakcích s induktory a inhibitory druhého transmembranózního transportního proteinu BCRP nejsou zprávy, nicméně při vysoké biologické dostupnosti apixabanu je klinický význam nepravděpodobný.
Apixaban neovlivňuje hladiny ostatních substrátů P-gp, BCRP a CYP3A4/5.
Nutno zdůraznit závěrem, že interakční potenciál apixabanu je velmi malý, v praxi se pouze vyhneme dlouhodobější kombinaci se silnými inhibitory CYP3A4.
Možnosti podání u specifických skupin nemocných
S podáváním apixabanu během těhotenství nejsou žádné zkušenosti. O průchodu transplacentární bariérou nejsou zprávy. Vzhledem k tomu, že apixaban je substrátem účinných efluxních pump (P-gp a BCRP), je nepravděpodobný významnější přechod placentou a vysoké koncentrace v plodu. V preklinických studiích nebyla prokázána reprodukční toxicita, nicméně aplikace se během těhotenství nedoporučuje.
Apixaban je aktivně secernován do mateřského mléka, expozice v mléce je asi 30krát vyšší než v mateřské plazmě, koncentrace je vyšší asi 8krát. Je tak pravděpodobný přímý vliv na kojence. Během kojení rozhodneme, zda ukončíme aplikaci apixabanu, či přerušíme kojení.
S podáváním apixabanu v pediatrické indikaci nejsou zkušenosti, nicméně pokračují studie u osob mladších 18 let, výsledky zatím nejsou k dispozici.
U nemocných s těžkou jaterní nedostatečností a s přítomnou koagulopatií je podávání apixabanu kontraindikováno. Při mírné a středně těžké jaterní insuficienci bez koagulopatie je možno apixaban aplikovat a není nutno dávku redukovat. Zvýšená opatrnost kvůli případnému riziku krvácení je však nutná.
Renální nedostatečnost mírného a středního stupně (s clearance kreatininu > 0,5 ml/s) neovlivňuje významně expozici apixabanu, není nutno dávky reduko-vat. S aplikací apixabanu ve fázi renálního selhání (léčeného konzervativně či hemodialýzou) nejsou zkušenosti. Pro riziko zvýšení expozice podáváme apixaban těmto nemocným s opatrností. Klinická studie u nemocných v renálním selhání pokra-čuje, výsledky nejsou zatím k dispozici. U ostatních skupin nemocných – u seniorů, u obézních či naopak u hubených nemocných – není nutné dávku upravovat. Rovněž pohlaví nemá významný vliv na podanou dávku.
Dávkování
V zatím jediné schválené indikaci – v profylaxi tromboembolických komplikací u nemocných po ortopedickém výkonu na nosných kloubech – je doporučena dávka 2krát denně 2,5 mg apixabanu per os. S aplikací začínáme zpravidla 12 až 24 hodin po operaci. Při vysokém riziku tromboembolie může být individuálně voleno časnější podání.
Délka aplikace se mění podle typu výkonu: po náhradě kyčelního kloubu je doporučená délka léčby 32 až 38 dnů, po náhradě kolene 10 až 14 dnů. Při náhodném vynechání dávky podáme ihned chybějící dávku a dále pokračujeme dle zavedeného schématu.
Je-li nutno převést pacienta z léčby apixabanem na warfarin, postupujeme stejně jako při převádění z léčby nízkomolekulárním heparinem, tj. je doporučeno překrývání léčby do dosažení účinné hladiny antikoagulace (dle INR). Nutno však upozornit, že apixaban může ovlivnit hladinu INR. Převedení na léčbu nízkomolekulárním heparinem a naopak z léčby nízkomolekulárním heparinem je možno uskutečnit plynule již při příštím dávkovém termínu, není indikováno překrývání dávek.
Předávkování
Podobně jako je tomu u ostatních přímých inhibitorů fXa či trombinu, ani u apixabanu není známo specifické antidotum. Při předávkování se zpravidla neobjevuje krvácení či jiné nežádoucí účinky, testovány byly dávky desetinásobně vyšší než dávka doporučená.
Objeví-li se při léčbě apixabanem krvácení, pak zvažujeme možnost cílené chirurgické zástavy krvácení. Není-li zákrok indikován, můžeme podat transfuzi mražené plazmy, eventuálně při masivním krvácení převody krve. S aplikací rekombinantního faktoru VIIa nejsou zkušenosti, je však možno jeho aplikaci zkusit.
Podání adsorpčního aktivního uhlí může mít význam pouze v prvých desítkách minut, apixaban je rychle eliminován ze střeva. Praktické zkušenosti chybí. Rovněž s podáním induktorů eliminačních a metabolických systémů nejsou zkušenosti. Je možno zkusit podat například extrakt z třezalky indukující expresi P-gp a CYP3A4.
Dostupné formy léčiva
V současné době je dostupná pouze jediná léková forma – tablety s obsahem 2,5 mg apixabanu.
Seznam použité literatury
- [1] Wong PC, Pinto DJ, Knabb RM. Nonpeptide factor Xa inhibitors: DPC423, a highly potent and orally bioavailable pyrazole antithrombotic agent. Cardiovasc Drug Rev 2002; 20: 137–152.
- [2] Wong PC, Crain EJ, Xin B, et al. Apixaban, an oral, direct and highly selective factor Xa inhi-bitor: in vitro, antithrombotic and antihemostatic studies. J Thromb Haemost 2008; 6: 820–829.
- [3] Becker RC, Yang H, Barrett Y, et al. Chromo-genic laboratory assays to measure the factor Xa-inhibiting properties of apixaban-an oral, direct and selective factor Xa inhibitor. J Thromb Thrombolysis 2011; 32: 183–187.
- [4] Raghavan N, Frost CE, Yu Z, et al. Apixaban metabolism and pharmacokinetics after oral administration to humans. Drug Metab Dispos 2009; 37: 74–81.
- [5] Pinto DJ, Orwat MJ, Koch S, et al. Discovery of 1-(4-methoxyphenyl)-7-oxo-6-(4-(2-oxopiperi-din-1-yl)phenyl)-4,5,6,7-tetrahydro-1H-pyra-zolo[3,4-c]pyridine-3-carboxamide (apixaban, BMS-562247), a highly potent, selective, effi-cacious, and orally bioavailable inhibitor of blood coagulation factor Xa. J Med Chem 2007; 50: 5339–5356.
- [6] Wang L, Zhang D, Raghavan N, et al. In vitro assessment of metabolic drug-drug interaction potential of apixaban through cytochrome P450 phenotyping, inhibition, and induction studies. Drug Metab Dispos 2010; 38: 448–458.
- [7] Walenga JM, Adiguzel C. Drug and dietary interactions of the new and emerging oral anticoagulants. Int J Clin Pract 2010; 64: 956–967.
- [8] Lassen MR, Davidson BL, Gallus A, et al. The efficacy and safety of apixaban, an oral, direct factor Xa inhibitor, as thromboprophylaxis in pa-tients following total knee replacement. J Thromb Haemost 2007; 5: 2368–2375.
- [9] Botticelli Investigators, Writing Committe, Buller H, Deitchman D, Prins M, Segers A. Efficacy and safety of the oral direct factor Xa inhibitor api-xaban for symptomatic deep vein thrombosis. The Botticelli DVT dose-ranging study. J Thromb Haemost 2008; 6: 1313–1318.
- [10] APPRAISE Steering Committee and Investigators, Alexander JH, Becker RC, Bhatt DL, et al. Apixaban, an oral, direct, selective factor Xa inhibitor, in combination with antiplatelet therapy after acute coronary syndrome: results of the Apixaban for Prevention of Acute Ischemic and Safety Events (APPRAISE) trial. Circulation 2009; 119: 2877–2885.
- [11] Lassen MR, Raskob GE, Gallus A, et al. Apixaban or Enoxaparin for Thromboprophylaxis after Knee Replacement. N Engl J Med 2009; 361: 594–604.
- [12] Lassen MR, Raskob GE, Gallus A, et al. Apixaban versus enoxaparin for thromboprophylaxis after knee replacement (ADVANCE-2): a randomised double-blind trial. Lancet 2010; 375: 807–815.
- [13] Lassen MR, Gallus A, Raskob GE, et al. Apixa-ban versus Enoxaparin for Thromboprophylaxis after Hip Replacement. N Engl J Med 2010; 363: 2487–2498.
- [14] Connolly SJ, Eikelboom J, Joyner C, et al. Apixaban in patients with atrial fibrillation. N Engl J Med 2011, 364: 806–817.
- [15] Granger CB, Alexander JH, McMurray JJ, et al. Apixaban versus warfarin in patients with atrial fibrilation. N Engl J Med 2011 Aug 27. [Epub ahead of print], web since 2011-08-29.
- [16] Alexander JH, Lopes RD, James S, et al. Api-xaban with Antiplatelet Therapy after Acute Co-ronary Syndrome. N Engl J Med 2011; 365: 699–708.
- [17] Welzel D, Hull R, Fareed J. Prophylaxis of venous thromboembolism: low molecular weight heparin compared to the selective anticoagulants rivaroxaban, dabigatran and fondaparinux. Int Angiol 2011; 30: 199–211.
- [18] Wong PC, Watson CA, Crain EJ. Arterial anti-thrombotic and bleeding time effects of apixaban, a direct factor Xa inhibitor, in combination with antiplatelet therapy in rabbits. J Thromb Haemost 2008; 6: 1736–1741.
- [19] Walenga JM, Adiguzel C. Drug and dietary interactions of the new and emerging oral anticoagulants. Int J Clin Pract 2010; 64: 956–967.