Atogepant
Migréna představuje chronické záchvatovité onemocnění. Podle počtu akutních atak rozlišujeme migrénu epizodickou (4–14 záchvatů za měsíc) a chronickou (≥ 15 záchvatů měsíčně). Cílem akutní léčby migrény je ovlivnit vzniklý/vznikající migrenózní záchvat, preventivní léčba je využívána se záměrem redukovat frekvenci a závažnost migrenózních atak.
Významným pokrokem v léčbě migrény byl objev specifické antimigrenózní terapie cílící na CGRP (calcitonin gene‑related peptide) a jeho receptor. Tento peptid hraje významnou úlohu v patofyziologii migrény, patří mezi vazoaktivní neurotransmitery a uplatňuje se v perivaskulárním neurogenním zánětu. Antagonizace účinků CGRP se využívá v akutní, ale zejména v preventivní léčbě migrény. V léčbě se využívají jednak anti‑CGRP monoklonální protilátky podávané injekčně, jednak léková skupina gepantů, malých molekul, jejichž výhodou je perorální podávání, které řada pacientů preferuje.
Atogepant je prvním perorálním antagonistou receptoru pro CGRP schváleným pro preventivní léčbu epizodické i chronické migrény.
Mechanismus účinku
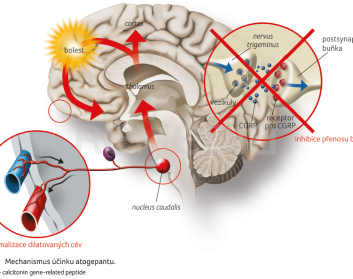 Primárním mechanismem účinku je blokovat signalizaci CGRP. Atogepant je kompetitivní, selektivní antagonista receptoru pro CGRP [1]. Mechanismus jeho účinku ilustruje obrázek 1.
Primárním mechanismem účinku je blokovat signalizaci CGRP. Atogepant je kompetitivní, selektivní antagonista receptoru pro CGRP [1]. Mechanismus jeho účinku ilustruje obrázek 1.
Farmakokinetika
Atogepant se po perorálním podání rychle vstřebává, farmakologicky účinných plazmatických koncentrací dosahuje v průběhu 30 minut, maximálních plazmatických koncentrací za 1–2 hodiny. Při dávce 60 mg činí maximální plazmatická koncentrace atogepantu (cmax) 740 ng/ml a plocha pod křivkou plazmatické koncentrace v čase (AUC) 3 470 ng·h/ml. Atogepant je primárně metabolizován prostřednictvím systému cytochromu P450 (CYP3A4). Eliminační poločas atogepantu je asi 11 hodin [2,3].
Indikace
Atogepant (AquiptaÒ) je indikován k profylaxi migrény u dospělých, kteří mívají nejméně čtyři dny s migrénou za měsíc (monthly migraine days, MMD). Bezpečnost a účinnost atogepantu u osob mladších 18 let nebyly stanoveny [3].
Aktuálně je léčba hrazena u pacientů s diagnózou migrény s více než čtyřmi MMD za poslední tři měsíce, a to po selhání (nedostatečné účinnosti) nebo intoleranci minimálně dvou zástupců rozdílných skupin konvenční profylaktické medikace, z nichž alespoň jeden lék musí být antikonvulzivum (topiramát nebo valproát), pokud nejsou u daného pacienta kontraindikovány. Pacientům, kteří ve třetím měsíci terapie atogepantem nedosáhnou poklesu počtu MMD minimálně o 50 % v porovnání s výchozím stavem, není léčba dále hrazena [4].
Kontraindikace
Jedinou kontraindikací léčby je přecitlivělost na atogepant nebo na kteroukoliv pomocnou látku přípravku [3].
Dávkování a způsob podání
Doporučená dávka je 60 mg atogepantu jednou denně. Přípravek se podává bez ohledu na jídlo. Tablety se nemají půlit, drtit ani žvýkat [3].
Úprava dávkování
Denní dávku atogepantu je doporučeno snížit na 10 mg v případě souběžného podávání inhibitorů CYP3A4 (např. ketokonazol, itrakonazol, klaritromycin, ritonavir) a OATP (polypeptidu transportujícího organické anionty, organic anion transporting polypeptide – např. rifampicin, cyklosporin, ritonavir) a u nemocných s těžkou poruchou funkce ledvin (clearance kreatininu [Clcr] 15–29 ml/min) a v konečném stadiu onemocnění ledvin (Clcr < 15 ml/min). U dialyzovaných pacientů je doporučeno užívat atogepant přednostně po dialýze [3].
U starších pacientů, nemocných s lehkou nebo středně těžkou poruchou funkce ledvin nebo jater není doporučena žádná úprava dávky. U nemocných s těžkou poruchou funkce jater je třeba se podávání atogepantu vyhnout [3].
Klinické zkušenosti
Účinnost a bezpečnost atogepantu v profylaktické léčbě migrény byly sledovány u pacientů s migrénou epizodickou (4–14 MMD) i chronickou (15 nebo více dnů s bolestí hlavy za měsíc s nejméně 8 MMD). Atogepant demonstroval v porovnání s placebem statisticky významnou účinnost hodnocenou dle sledovaných parametrů.
Léčba pacientů s epizodickou migrénou
ADVANCE byla randomizovaná multicentrická, dvojitě zaslepená studie fáze III, která zkoumala účinnost atogepantu v dávkách 10 mg, 30 mg nebo 60 mg denně oproti placebu u pacientů s epizodickou migrénou. Účastníci studie byli randomizováni v poměru 1 : 1 : 1 : 1. Klinické hodnocení zahrnovalo čtyřtýdenní screening, 12týdenní dvojitě zaslepené léčebné období a následné čtyřtýdenní období sledování bezpečnosti. Zařazeni byli dospělí pacienti ve věku 18–80 let se 4–14 MMD, s diagnózou migrény (s aurou nebo bez aury) dle ICHD‑3 (International Classification of Headache Disorders) minimálně jeden rok a s jejím nástupem ve věku před 50. rokem [5].
Primárním cílovým ukazatelem byla změna MMD od počáteční hodnoty během 12 týdnů léčby. Sekundární cílové ukazatele zahrnovaly změnu průměrného počtu dnů s bolestí hlavy za měsíc oproti výchozí hodnotě, změnu průměrného počtu dnů za měsíc, kdy byla použita akutní medikace, podíl pacientů, kteří dosáhli alespoň 50% snížení MMD oproti výchozí hodnotě (průměr za tři měsíce), a další ukazatele účinnosti hlášené pacienty (kvalita života a skóre AIM‑D [Activity Impairment in Migraine‑Diary]).
Klinické a demografické charakteristiky účastníků se v jednotlivých skupinách nelišily. Průměrný věk pacientů byl 41,6 roku, 88,8 % tvořily ženy a 83,4 % bělošská populace. Pacientům bylo dovoleno používat v průběhu sledování medikaci pro akutní léčbu migrény (triptany, ergotaminové deriváty, opioidy, analgetika a nesteroidní antiflogistika), nikoliv ale přípravky cílící na dráhu CGRP. Užívat nesměli ani jinou preventivní léčbu migrény.
Z 910 randomizovaných pacientů dokončilo studii 805 (88,5 %). Nejčastějším důvodem pro ukončení účasti ve studii ve všech skupinách bylo stažení souhlasu účastníka. Do analýzy účinnosti bylo zahrnuto 873 pacientů; 214 s dávkou 10 mg atogepantu, 223 s dávkou 30 mg atogepantu, 222 s dávkou 60 mg atogepantu a 214 v placebové skupině. Průměrná hodnota MMD na počátku byla 7,5–7,9 v jednotlivých skupinách.
 Podávání atogepantu v dávkách 10 mg, 30 mg a 60 mg jednou denně během 12týdenního léčebného období vedlo k významně vyššímu snížení MMD v porovnání s placebem. Průměrná změna MMD od výchozí hodnoty dosáhla –3,7 ve skupině s 10 mg atogepantu, –3,9 ve skupině s 30 mg atogepantu, −4,2 při dávce 60 mg atogepantu a −2,5 v placebové skupině (graf 1). Průměrný rozdíl oproti placebu byl –1,2 dne při dávce 10 mg atogepantu (95% interval spolehlivosti [CI] –1,8 až –0,6), –1,4 dne při 30 mg atogepantu (95% CI –1,9 až –0,8) a –1,7 dne při dávce 60 mg atogepantu (95% CI –2,3 až –1,2); p < 0,001 pro všechna srovnání s placebem.
Podávání atogepantu v dávkách 10 mg, 30 mg a 60 mg jednou denně během 12týdenního léčebného období vedlo k významně vyššímu snížení MMD v porovnání s placebem. Průměrná změna MMD od výchozí hodnoty dosáhla –3,7 ve skupině s 10 mg atogepantu, –3,9 ve skupině s 30 mg atogepantu, −4,2 při dávce 60 mg atogepantu a −2,5 v placebové skupině (graf 1). Průměrný rozdíl oproti placebu byl –1,2 dne při dávce 10 mg atogepantu (95% interval spolehlivosti [CI] –1,8 až –0,6), –1,4 dne při 30 mg atogepantu (95% CI –1,9 až –0,8) a –1,7 dne při dávce 60 mg atogepantu (95% CI –2,3 až –1,2); p < 0,001 pro všechna srovnání s placebem.
Signifikantní rozdíly byly zaznamenány i v sekundárních cílových ukazatelích. Průměrná změna od výchozí hodnoty v průměrném počtu dnů s bolestí hlavy za měsíc během 12týdenního léčebného období dosáhla –3,9 pro atogepant 10 mg, –4,0 pro atogepant 30 mg, –4,2 pro atogepant 60 mg a –2,5 pro placebo. Průměrná změna v průměrném počtu dnů s užíváním medikace k léčbě záchvatů migrény za měsíc oproti výchozí hodnotě byla –3,7 pro atogepant 10 mg, –3,7 pro atogepant 30 mg, –3,9 pro atogepant 60 mg a –2,4 pro placebo. Snížení tříměsíčního průměrného MMD o ≥ 50 % bylo zaznamenáno u 55,6 % účastníků ve skupině s atogepantem 10 mg, u 58,7 % účastníků ve skupině s atogepantem 30 mg, u 60,8 % účastníků ve skupině s atogepantem 60 mg a 29,0 % ve skupině s placebem. Významné rozdíly mezi všemi třemi dávkami atogepantu a placebem byly pozorovány pro všechny sekundární cílové ukazatele s výjimkou skóre v doméně Výkon denních činností (Performance of Daily Activities, PDA) a Fyzické postižení (Physical Impairment, PI) AIM‑D při podávání atogepantu v dávce 10 mg [5].
Nežádoucí účinky byly hlášeny u 52,2–53,7 % pacientů, kteří dostávali atogepant, a u 56,8 % ze skupiny placeba. Nejčastěji hlášenými nežádoucími účinky při léčbě atogepantem byly zácpa (6,9–7,7 % napříč dávkovými skupinami), nauzea (4,4–6,1 %) a infekce horních cest dýchacích (3,9–5,7 %). Ve skupině s placebem byly nejčastějšími nežádoucími účinky infekce horních cest dýchacích (4,5 %), infekce močových cest (3,6 %) a nazofaryngitida (3,6 %). Výskyt zácpy byl vyšší ve skupinách s atogepantem (6,9–7,7 %) než ve skupině s placebem (0,5 %). S ohledem na hepatotoxicitu dříve zkoumaných gepantů byly sledovány rovněž aktivity jaterních enzymů. Zvýšené hodnoty alaninaminotransferázy (ALT) nebo aspartátaminotransferázy (AST) – alespoň trojnásobek horní hranice normy – byly zaznamenány u dvou účastníků ve skupině s atogepantem 10 mg, shodně u dvou ve skupině s atogepantem 30 mg, u jednoho sledovaného ve skupině s atogepantem 60 mg a u čtyř z placebové skupiny. Nebyly hlášeny žádné závažné případy onemocnění jater [5].
Hodnocení výsledků hlášených pacienty (patient‑reported outcomes, PROs) ve studii ADVANCE předložila detailně práce Richarda Liptona a kol. [6]. Dotazník MSQ (Migraine‑Specific Quality‑of‑Life Questionnaire, verze 2.1) sledoval kvalitu života související se zdravím (health‑related quality of life, HRQoL) specifickou pro migrénu v intervalu čtyř týdnů. Jednotlivé domény zaznamenávaly ovlivnění každodenních sociálních a pracovních činností migrénou. AIM‑D slouží k dennímu zaznamenávání efektu migrény na vykonávání denních aktivit (PDA – potíže s domácími pracemi, pochůzkami, volnočasovými aktivitami doma a mimo domov, namáhavé fyzické aktivity, soustředění a jasné myšlení) a na fyzické funkce (PI – potíže s chůzí, pohyb těla, předklon a pohyb hlavy). Odpovědi v dotazníku Headache Impact Test‑6 (HIT‑6) byly sledovány každé čtyři týdny. Hodnocení sleduje efekt bolestí hlavy na normální každodenní život a schopnost fungovat v zaměstnání, ve škole, doma a v sociálních situacích. Jak již bylo uvedeno, atogepant v dávkách 30 mg a 60 mg prokázal klinicky významné zlepšení fungování v každodenním životě a provádění činností souvisejících s prací a výkonem každodenních činností. Nejnižší dávka atogepantu nezajistila zlepšení ve všech doménách hodnocení. Pro pacienty je důležitý zejména časný nástup účinku léčby.
Léčba atogepantem v dlouhodobém horizontu
Dlouhodobou bezpečnost, snášenlivost a účinnost atogepantu v dávce 60 mg sledovala navazující studie Ashiny a kol. [7]. Do této 52týdenní otevřené studie byli randomizováni dospělí pacienti se 4–14 MMD; jednalo se o účastníky (n = 107) předchozí studie fáze IIb/III (NCT02848326) [8] nebo o nové účastníky (n = 637). Pacienti byli randomizováni v poměru 5 : 2 k podávání atogepantu v dávce 60 mg denně (n = 546) nebo k perorální standardní preventivní terapii migrény (n = 198). Ta mohla být dle vyhodnocení lékaře v průběhu sledování měněna nebo vysazena. Všichni zařazení mohli v průběhu studie užívat akutní medikaci.
Primárně byla hodnocena bezpečnost léčby. Nežádoucí účinky související s léčbou (treatment‑emergent adverse events, TEAE) se vyskytly u 67,0 % (n = 364/543) účastníků léčených atogepantem 60 mg. Nejčastěji hlášenými TEAE (≥ 5 %) byly infekce horních cest dýchacích (10,3 %; 56/543), zácpa (7,2 %; 39/543), nauzea (6,3 %; 34/543) a infekce močových cest (5,2 %; 28/543). Závažné TEAE byly hlášeny u 4,4 % (24/543) ve skupině atogepantu. Změny hodnot jaterních testů byly minimální a srovnatelné mezi skupinami s aktivní léčbou a placebem [7].
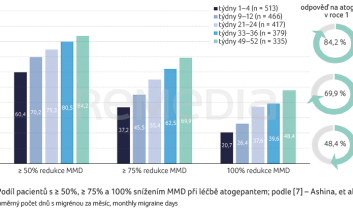 Co se týče účinnosti, na počátku sledování byl průměrný MMD 7,3. Průměrná změna MMD při podávání atogepantu činila –3,8 v týdnech 1–4 a −5,2 v týdnech 49–52. V průběhu léčby se zvyšoval podíl pacientů s ≥ 50%, ≥ 75% a 100% snížením MMD; z 60,4 % (310/513), 37,2 % (191/513) a 20,7 % (106/513) v týdnech 1–4 až na 84,2 % (282/335), 69,9 % (234/335) a 48,4 % (162/335) v týdnech 49–52 (graf 2). Došlo také k redukci počtu dnů s potřebou užití akutní medikace, který na počátku činil 6,6 dne a v týdnech 49–52 se snížil o 4,9 dne.
Co se týče účinnosti, na počátku sledování byl průměrný MMD 7,3. Průměrná změna MMD při podávání atogepantu činila –3,8 v týdnech 1–4 a −5,2 v týdnech 49–52. V průběhu léčby se zvyšoval podíl pacientů s ≥ 50%, ≥ 75% a 100% snížením MMD; z 60,4 % (310/513), 37,2 % (191/513) a 20,7 % (106/513) v týdnech 1–4 až na 84,2 % (282/335), 69,9 % (234/335) a 48,4 % (162/335) v týdnech 49–52 (graf 2). Došlo také k redukci počtu dnů s potřebou užití akutní medikace, který na počátku činil 6,6 dne a v týdnech 49–52 se snížil o 4,9 dne.
Nejčastějším důvodem pro přerušení účasti ve studii bylo v obou léčebných ramenech odvolání souhlasu účastníkem. Přerušení kvůli nežádoucím účinkům (< 6 %) nebo nedostatečná účinnost (< 1 %) nebyly v rameni s atogepantem časté. Průměrná expozice atogepantu ve studii byla 291,6 dne a 433,6 pacientoroku léčby.
Výsledky studie jsou konzistentní s výsledky 12týdenní studie ADVANCE. Atogepant představuje bezpečnou, dobře tolerovanou a účinnou preventivní léčbu migrény.
Efekt léčby po selhání předchozí preventivní terapie
Na bezpečnost, snášenlivost a účinnost atogepantu v preventivní léčbě epizodické migrény u pacientů, u kterých selhaly dvě až čtyři konvenční perorální preventivní terapie, se zaměřila klinická studie ELEVATE [9]. Předchozí konvenční preventivní léčba zahrnovala betablokátory, antiepileptika, blokátory kalciových kanálů, tricyklická antidepresiva, inhibitory zpětného vychytávání serotoninu a noradrenalinu, inhibitory angiotenzin konvertujícího enzymu a inhibitory angiotenzinových receptorů.
V tomto randomizovaném dvojitě zaslepeném klinickém hodnocení fáze IIIb byli pacienti ve věku 18–80 let randomizováni v poměru 1 : 1 k podávání 60 mg atogepantu denně nebo k podávání placeba. Primárním cílovým ukazatelem byla změna změna MMD od výchozí hodnoty během 12týdenního léčebného období.
Atogepant prokázal, že může být účinnou preventivní léčebnou možností i pro obtížně léčitelné pacienty, u nichž selhaly 2–4 typy konvenční preventivní terapie. Studie se účastnilo celkem 313 pacientů, 89 % tvořily ženy a 95 % bělošská populace. Průměrná změna MMD činila ve skupině atogepantu –4,2 a ve skupině placeba –1,9. Profil bezpečnosti odpovídal předchozímu klinickému hodnocení. Většina nežádoucích účinků byla mírná. Nejčastějším nežádoucím účinkem v souvislosti s léčbou (TEAE) byla zácpa (10 % [16/156] ve skupině atogepantu vs. 3 % [4/157] ve skupině placeba) [9].
Léčba pacientů s chronickou migrénou
Chronická migréna je spojena s vysokou mírou invalidity a s ovlivněním kvality života. Zhodnotit účinnost, bezpečnost a snášenlivost léčby atogepantem u pacientů s chronickou migrénou si dala za cíl studie PROGRESS [10]. Šlo o multicentrickou randomizovanou, dvojitě zaslepenou studii fáze III kontrolovanou placebem. Zařazeni byli dospělí pacienti s minimálně roční anamnézou chronické migrény. Účastníci studie byli randomizováni v poměru 1 : 1 : 1 k podávání atogepantu v dávce 30 mg dvakrát denně, 60 mg jednou denně a k podávání placeba. Primárním cílovým ukazatelem byla změna MMD oproti výchozí hodnotě během 12týdenního léčebného období. Pacienti směli během klinického hodnocení podle potřeby užívat akutní medikaci (s výjimkou gepantů).
 Randomizováno bylo celkem 778 pacientů; 257 pacientů k podávání atogepantu 30 mg dvakrát denně, 262 pacientů k podávání atogepantu 60 mg jednou denně a 259 pacientů k podávání placeba. Do hodnocení bezpečnosti byli zařazeni všichni pacienti, kteří dostali alespoň jednu dávku studijní léčby. Průměrný věk činil 42,1 roku, 88 % tvořily ženy a 59 % byli běloši. Průměrná počáteční hodnota MMD činila 18,6 ve skupině atogepantu 30 mg dvakrát denně, 19,2 u atogepantu 60 mg jednou denně a 18,9 u placeba. Během 12 týdnů byla zaznamenána průměrná změna MMD –7,5 ve skupině atogepantu 30 mg dvakrát denně, –6,9 u atogepantu 60 mg jednou denně a –5,1 u placeba od výchozí hodnoty (graf 3).
Randomizováno bylo celkem 778 pacientů; 257 pacientů k podávání atogepantu 30 mg dvakrát denně, 262 pacientů k podávání atogepantu 60 mg jednou denně a 259 pacientů k podávání placeba. Do hodnocení bezpečnosti byli zařazeni všichni pacienti, kteří dostali alespoň jednu dávku studijní léčby. Průměrný věk činil 42,1 roku, 88 % tvořily ženy a 59 % byli běloši. Průměrná počáteční hodnota MMD činila 18,6 ve skupině atogepantu 30 mg dvakrát denně, 19,2 u atogepantu 60 mg jednou denně a 18,9 u placeba. Během 12 týdnů byla zaznamenána průměrná změna MMD –7,5 ve skupině atogepantu 30 mg dvakrát denně, –6,9 u atogepantu 60 mg jednou denně a –5,1 u placeba od výchozí hodnoty (graf 3).
K signifikantnímu poklesu MMD došlo již v průběhu prvních čtyř týdnů léčby. Numericky vyšší efekt léčby byl zaznamenán ve skupině s atogepantem 30 mg dvakrát denně oproti atogepantu 60 mg jednou denně. Oproti placebu došlo k poklesu počtu dnů s bolestí hlavy o 2,3 ve skupině s atogepantem 30 mg dvakrát denně a o 1,9 ve skupině s atogepantem 60 mg jednou denně.
Počet dnů s akutní medikací se od výchozí hodnoty snížil o 6,7 u atogepantu 30 mg dvakrát denně, o 6,2 u atogepantu 60 mg jednou denně a o 4,1 u placeba. Snížení MMD minimálně o 50 % v tříměsíčním průměru dosáhlo 43 % (108/253) účastníků ve skupině s atogepantem 30 mg dvakrát denně a 41 % (105/256) účastníků ve skupině s atogepantem 60 mg jednou denně ve srovnání s 26 % (64/246) účastníků v placebové skupině. Rovněž skóre hodnocení kvality života pomocí dotazníku specifického pro migrénu (MSQ) se ve skupinách s léčbou atogepantem oproti placebu výrazně zvýšilo (o 8,0 ve skupině s 30 mg dvakrát denně a o 6,1 ve skupině s 60 mg jednou denně). Výrazné rozdíly (zlepšení) byly demonstrovány také v dalších sekundárních parametrech – AIM‑D a HIT‑6.
Nejčastějšími nežádoucími účinky při léčbě atogepantem byly zácpa (u 10,9 % ve skupině atogepantu 30 mg dvakrát denně, 10 % při podávání atogepantu 60 mg jednou denně a u 3 % v placebové skupině) a nauzea (u 8 % ve skupině atogepantu 30 mg dvakrát denně, 10 % při podávání atogepantu 60 mg jednou denně a u 4 % v placebové skupině).
Obě dávky atogepantu prokázaly u pacientů s chronickou migrénou klinicky relevantní snížení MMD během 12týdenní léčby a zlepšení kvality života. Léčba byla dobře tolerována, bezpečnostní profil léčby odpovídal předchozím zjištěním.
Nežádoucí účinky
Mezi nejčastěji se vyskytující nežádoucí účinky při léčbě atogepantem, které byly hlášeny v klinickém hodnocení, patří nauzea, zácpa a únava/somnolence. Většina nežádoucích účinků byla mírné nebo střední intenzity. Nežádoucím účinkem, který nejčastěji (0,4 %) vedl k přerušení léčby, byla nauzea [3]. O bezpečnosti atogepantu blíže v pasáži Klinické hodnocení.
V rámci klinického hodnocení byl atogepant podán jednorázově až do dávky 300 mg. Nebyla zaznamenána žádná zvláštní toxicita. Nežádoucí účinky byly srovnatelné s těmi, které byly pozorovány při nižších dávkách [3].
Interakce
Souběžné podávání se silnými inhibitory CYP3A4 (např. ketokonazol, itrakonazol, klaritromycin, ritonavir) zvyšuje systémovou expozici atogepantu. Systémovou expozici atogepantu mohou zvýšit rovněž inhibitory OATP (např. rifampicin, cyklosporin, ritonavir). Dávku atogepantu je proto třeba redukovat (viz výše) [3].
Těhotenství a kojení
Studie u zvířat neprokázaly vliv na fertilitu, nicméně u člověka údaje nejsou dostupné. Co se týče léčby atogepantem v těhotenství, dostupné jsou pouze omezené údaje. Studie u zvířat reprodukční toxicitu prokázaly, podávání atogepantu těhotným ženám se proto nedoporučuje. Zda se atogepant vylučuje do mateřského mléka, není známo. U zvířat bylo potvrzeno, a riziko pro kojené dítě proto nelze vyloučit. Léčbu je doporučeno během kojení přerušit [3].
Literatura
[1] Boinpally R, Shebley M, Trugman JM, et al. Atogepant: Mechanism of action, clinical and translational science. Clin Transl Sci 2024; 17: e13707.
[2] Min KC, Kraft WK, Bondiskey P, et al. Atogepant is not associated with clinically meaningful alanine aminotransferase elevations in healthy adults. Clin Transl Sci 2021; 14: 599‑605.
[3] Souhrn údajů o přípravku Aquipta. Dostupné na: https://www.sukl.cz
[4] Ceny a úhrady Aquipta.Státní ústav pro kontrolu léčiv. Dostupné na: https://prehledy.sukl.cz/prehled_leciv.html#/leciva/0271887
[5] Ailani J, Lipton RB, Goadsby PJ, et al. Atogepant for the Prevetive Treatment of Migraine. N Engl J Med 2021; 385: 695–706.
[6] Lipton RB, Pozo‑Rosich P, Blumenfeld AM, et al. Effect of Atogepant for Preventive Migraine Treatment on Patient‑Reported Outcomes in the Randomized, Double‑blind, Phase 3 ADVANCE Trial. Neurology 2023; 100: e764‑e777.
[7] Ashina M, Tepper SJ, Reuter U, et al. Once‑daily oral atogepant for the long‑term preventive treatment of migraine: Findings from a multicenter, randomized, open‑label, phase 3 trial. Headache 2023; 63: 79–88.
[8] Goadsby PJ, Dodick DW, Ailani J, et al. Safety, tolerability, and efficacy of orally administered atogepant for the prevention of episodic migraine in adults: a double‑blind, randomised phase 2b/3 trial. Lancet Neurol 2020; 19: 727–737.
[9] Tassorelli C, Nagy K, Pozo‑Rosich P, et al. Safety and efficacy of atogepant for the preventive treatment of episodic migraine in adults for whom conventional oral preventive treatments have failed (ELEVATE): a randomised, placebo‑controlled, phase 3b trial. Lancet Neurol 2024; 23: 382–392.
[10] Pozo‑Rosich P, Ailani J, Ashina M, et al. Atogepant for the preventive treatment of chronic migraine (PROGRESS): a randomised, double‑blind, placebo‑controlled, phase 3 trial. Lancet 2023; 402: 775–785.
Komentář k článku: Atogepant
MUDr. Tomáš Nežádal, Ph.D.
Neurologické oddělení, Ústřední vojenská nemocnice – Vojenská fakultní nemocnice; Institut neuropsychiatrické péče; Neurochirurgická klinika 1. LF UK, Praha
Atogepant je prvním perorálním antagonistou receptoru pro CGRP (calcitonin gene‑related peptide) schváleným pro preventivní léčbu epizodické (EM) a chronické migrény (CM) s nastavenou plnou úhradou zdravotními pojišťovnami od 1. července 2024 vázanou v České republice na centra pro diagnostiku a léčbu bolestí hlavy.
Indikační kritéria jsou totožná jako u anti‑CGRP monoklonálních protilátek, tedy podání je schváleno od věkové hranice 18 let u pacientů s EM, kteří trpí migrénou nejméně čtyři dny za měsíc (monthly migraine days, MMD), a u pacientů s CM po předchozím selhání dvou standardních perorálních profylaxí. V terapii je možné pokračovat při snížení počtu MMD minimálně o 50 % v porovnání s výchozím stavem, a to po třech měsících užívání.
Dávkování atogepantu je jednoduché, doporučená dávka a registrovaná dávka je 60 mg jednou denně. Ve studiích s podáváním dávky 30 mg dvakrát denně u CM byla zaznamenána obdobná účinnost, dávkování 10 mg jednou denně u EM bylo méně efektivní.
Farmakokinetika atogepantu je příznivá, po perorálním podání se rychle vstřebává, farmakologicky účinných plazmatických koncentrací dosahuje v průběhu 30 minut, maximálních plazmatických koncentrací za 1–2 hodiny. Atogepant je primárně metabolizován prostřednictvím systému cytochromu P450 (CYP3A4). Eliminační poločas atogepantu je kolem 11 hodin. Vzhledem k tomu, že látka je substrátem CYP3A4, je třeba pamatovat na možnost lékových interakcí s inhibitory tohoto enzymu a na následné zvýšení koncentrace atogepantu, a to zejména v případě klaritromycinu, jiných makrolidů, antimykotik a antivirotik. V těchto situacích je nutná redukce dávky atogepantu.
Jak bylo uvedeno, studie účinnosti byly prováděny u EM i CM s výslednou dávkou 60 mg jednou denně. Ve studii ADVANCE u pacientů s EM představovala redukce počtu MMD ve třetím týdnu podávání 4,2 dne a ≥ 50% snížení průměrného počtu MMD dosáhlo 60,8 % pacientů. V dlouhodobé 52týdenní studii byl efekt terapie u EM potvrzen, v posledních čtyřech týdnech sledování počet MMD klesl o 5,2 dne a v průběhu léčby se zvyšoval podíl pacientů s ≥ 50%, ≥ 75% a 100% snížením počtu MMD: z 60,4 %, 37,2 % a 20,7 % v týdnech 1–4 až na 84,2 %, 69,9 % a 48,4 % v týdnech 49–52. Z toho vyplývá, že téměř u 50 % pacientů po roce terapie bolesti hlavy zcela vymizely.
Z hlediska stanovení úhrady za našich indikačních podmínek byla podstatná studie ELEVATE u pacientů s EM po selhání 2–4 standardních perorálních profylaxí s redukcí počtu MMD o 4,2 dne, obdobně jako v první studii, s ≥ 50% průměrnou redukcí u 51 % pacientů po třech měsících sledování.
Ve studii PROGRESS s CM činil pokles počtu MMD 6,2 dne při podávání atogepantu v dávce 60 mg jednou denně. Snížení počtu MMD minimálně o 50 % v tříměsíčním průměru dosáhlo 41 % pacientů.
Neméně zásadní je pozorování redukce užití akutní medikace a zlepšení kvality života pacientů (například MSQ [Migraine-Specific Quality-of-Life Questionnaire] nebo HIT‑6 [Headache Impact Test]), které kopírovaly významnou redukci počtu MMD.
Mezi nejčastěji se vyskytující nežádoucí účinky při léčbě atogepantem, které byly hlášeny v klinickém hodnocení, patří nauzea, zácpa a únava/ospalost. Většina nežádoucích účinků byla mírné nebo střední intenzity. Nežádoucím účinkem, který nejčastěji (0,4 %) vedl k přerušení léčby, byla nauzea.
Závěrem lze konstatovat, že s atogepantem se do klinické praxe dostává specifická účinná léčba migrény s velmi dobrou tolerancí prokázanou po dobu nejméně jednoho roku sledování. Efekt terapie se pak s délkou užívání zvyšoval s vysokým poměrem zcela kompenzovaných pacientů.
MUDr. Tomáš Nežádal, Ph.D.
Neurologické oddělení
Ústřední vojenská nemocnice – Vojenská fakultní nemocnice
U Vojenské nemocnice 1 200/1, 169 02 Praha 6
e-mail: nezadal@gmail.com