Bevacizumabum
Bevacizumab je humanizovaná monoklonální protilátka proti vaskulárnímu endoteliálnímu růstovému faktoru (VEGF), který je klíčovým faktorem pro novotvorbu cév. Omezení angiogeneze bevacizumabem u nádorových onemocnění zpomaluje růst nádoru a snižuje riziko metastazování. To předurčuje použití bevacizumabu v léčbě nádorových onemocnění. Příznivé výsledky se popisují především u kolorektálního karcinomu v kombinaci se standardní chemoterapií. Léčba se dobře toleruje, nebyla popsána synergní toxicita s chemoterapií. Účinnost bevacizumabu u dalších nádorových onemocnění se prověřuje v početných klinických studiích.
Farmakologická skupina
Inhibitor angiogeneze, antineoplastický přípravek.
Chemické a fyzikální vlastnosti
Bevacizumab je humanizovaná monoklonální IgG1 protilátka proti vaskulárnímu endoteliálnímu růstovému faktoru VEGF (vascular endothelial growth factor) (rhu Mab VEGF) připravená rekombinantní technologií na buňkách ovaria čínských křečků. Přibližně 93 % aminokyselinových sekvencí pochází z lidského imunoglobulinu, 7 % tvoří myší protilátka [1]. Molekulová hmotnost je 149 kilodaltonů. Schéma molekuly bevacizumabu viz obr. 1.
Mechanismus účinku
Bevacizumab brání interakci VEGF se specifickými receptory na endotelových buňkách (VEGFR-1 a VEGFR-2) a blokuje biologické účinky tohoto růstového faktoru.
Po vazbě VEGF na receptor se aktivuje transdukční kaskáda, která vyústí ve změny odpovědné za růst, proliferaci a migraci endotelových buněk a inhibici jejich apoptózy. Výsledkem je novotvorba cév v nádoru. Umožní se tak plynulý přísun kyslíku a živin do nádoru, což usnadní jeho růst a metastazování. Inhibice zmíněných účinků navozená bevacizumabem těmto pochodům zabrání a růst nádoru se omezí a riziko metastazování sníží.
Farmakodynamické vlastnosti
Bevacizumab inhibuje různé účinky všech izoforem VEGF-A, především cévní permeabilitu a proliferaci endotelií [2]. Blokuje i další účinky VEGF, jako je indukce exprese proteinu bcl-2 a apoptózy endotelových buněk. Nemá však neutralizační účinek na VEGF-C a má jen částečný účinek na VEGF-B. Inhibice angiogeneze bevacizumabem byla experimentálně doložena, mimo jiné i videomikroskopickou technikou.
Farmakokinetické vlastnosti
Farmakokinetický profil byl stanoven analýzou celkové sérové koncentrace bevacizumabu, tj. volného bevacizumabu i bevacizumabu vázaného na ligandy pro VEGF. Farmakokinetika je lineární a je podobná jako u jiných monoklonálních protilátek. V klinických studiích I. fáze byl terminální poločas stanoven na 21 dnů, což odpovídá terminálnímu eliminačnímu poločasu endogenního IgG u člověka, který je 18–23 dnů [3]. Clearance bevacizumabu je 0,23/ l/den a je závislá na celkové tělesné hmotnosti, pohlaví (u mužů je vyšší) a celkové nádorové mase (vyšší u velké nádorové masy). Nicméně tyto rozdíly neovlivňují účinnost léčby bevacizumabem. Změny farmakokinetiky při současném renálním nebo hepatálním onemocnění ani rozdíly farmakokinetiky v závislosti na věku nebyly studovány.
Klinické zkušenosti
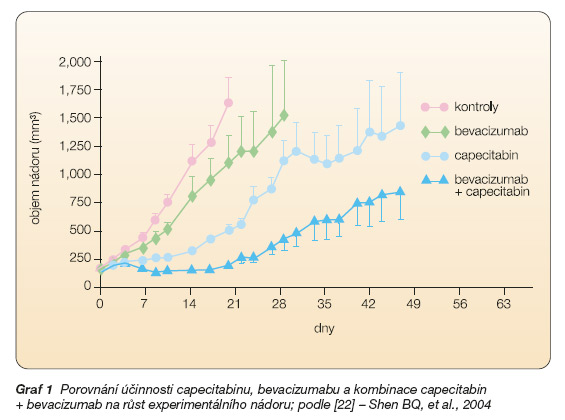
Experimentální studie prokázaly, že protinádorový účinek bevacizumabu lze výrazně potencovat současným podáním cytostatik. Přidání bevacizumabu zase zcela evidentně posiluje účinnost cytostatik. Názorně to ukazuje graf 1 porovnávající účinek samostatně podaného bevacizumabu, capecitabinu a jejich kombinace na růst experimentálního nádoru.
Tento synergní účinek lze vysvětlit snazším průnikem cytostatik do nádoru, v němž dochází vlivem bevacizumabu k poklesu nitronádorového tlaku [4]. Mimoto morfologicky nesouvislé novotvořené cévy v nádoru umožňují únik cytostatika z cévy do nádorové tkáně. Přesto byl i v prvních klinických studiích zkoušen bevacizumab v adjuvantním podání jako monoterapie. Protinádorová účinnost byla sice evidentní, ale záhy se přikročilo k testování kombinace bevacizumabu s protinádorovou chemoterapií u různých solidních nádorů [5].
Kolorektální karcinom se zdál nejvhodnějším cílem pro testování, neboť buňky tohoto nádoru exprimují ve vysoké koncentraci receptory pro VEGF. Koncentrace VEGFR koreluje s prognózou onemocnění [6, 7]. K léčbě se doporučuje bevacizumab ve standardní dávce, s různými cytostatiky (např. s capecitabinem) nebo s chemoterapeutickými kombinacemi FuFa (fluorouracil + kyselina folinová – folinic acid), IFL (irinotecan + fluorouracil + leucovorin), XELOX (capecitabin – Xeloda + oxaliplatina) aj. [8–10]. Ve většině studií byli léčeni nemocní s pokročilým metastazujícím onemocněním. V průměru zvyšovalo přidání bevacizumabu léčebnou odpověď o 10 % a prodloužilo dobu přežití o 3–4 měsíce. Ukázalo se, že zvýšení dávky bevacizumabu z 5 mg až na 15 mg nezvyšovalo protinádorovou účinnost léčby, ale pouze některé nežádoucí účinky. Proto se doporučuje používat standardní dávkování 5 mg, nejvýše 10 mg 1krát za 2 týdny. Porovnání nežádoucích účinků mezi skupinou léčenou pouze chemoterapií a skupinou s bevacizumabem ukázalo častější výskyt epistaxe (krvácení z nosu) a tromboembolických komplikací a rovněž hypertenze a průjmy byly při léčbě bevacizumabem častější. Všechny nežádoucí účinky byly však dobře léčebně zvládnutelné [8, 10].
U karcinomu prsu byl prognostický význam vystupňované angiogeneze popsán již na sklonku minulého století [11]. Proto lze předpokládat, že inhibice angiogeneze může průběh onemocnění příznivě ovlivnit. První klinické studie tento předpoklad potvrzují. Bevacizumab se kombinuje buď s capecitabinem, nebo s vinorelbinem [12, 13]. Porovnání účinnosti popsaných kombinací zatím chybí. Výsledky dosud provedených studií, v nichž byly zmíněné kombinace podávány, sice ukázaly u těžce předléčených nemocných zvýšenou odpověď na léčbu, ale pouze nevýznamné ovlivnění celkové doby přežití. Účinnější se zdá kombinace bevacizumabu s paclitaxelem, po jejíž aplikaci se popisuje až dvojnásobné prodloužení doby do progrese onemocnění.
U nemalobuněčného bronchogenního karcinomu probíhá současně větší počet studií, v nichž se bevacizumab kombinuje s platinovými deriváty (cisplatinou či carboplatinou), s etoposidem nebo s taxany [14]. Erlotinib a gefitinib jsou další potenciální komponenty kombinací. Přidání bevacizumabu ke standardní chemoterapii prodlužuje dobu do progrese onemocnění. K definitivnímu zhodnocení přínosu bevacizumabu je nutno vyčkat, až budou získány zkušenosti s početnějšími soubory nemocných.
U karcinomu pankreatu je léčba bevacizumabem vhodná buď u lokálně pokročilého nádoru, kde se zkouší v kombinaci s capecitabinem a radioterapií, nebo u metastazujícího onemocnění. Za nejúčinnější se považuje kombinace s gemcitabinem, popřípadě trojkombinace bevacizumab + gemcitabin + cetuximab.
U karcinomu ledviny se předpokládá účinnost bevacizumabu hlavně v případech delece supresorového genu VHL. Incidence mutací VHL, která způsobuje nadprodukci VGF, TGF-a a PDGF, je u renálního karcinomu relativně vysoká [16]. To zvyšuje naděje na úspěch léčby bevacizumabem. Kromě monoterapie se zkouší i kombinace s interferonem a [17] a s erlotinibem.
U hematologických malignit byl prognostický význam vystupňované angiogeneze jistým překvapením. Byl však prokázán význam zvýšené vaskularizace kostní dřeně a zvýšené exprese angiogenních faktorů pro prognózu onemocnění, a to jak u akutních, tak i u chronických leukémií [18, 19]. U nemocných s akutní myeloidní leukémií bylo podání bevacizumabu (10 mg/kg) 8. den po skončené chemoterapii (cytarabin + mitoxantron) provázeno vyšším procentem remisí [20].
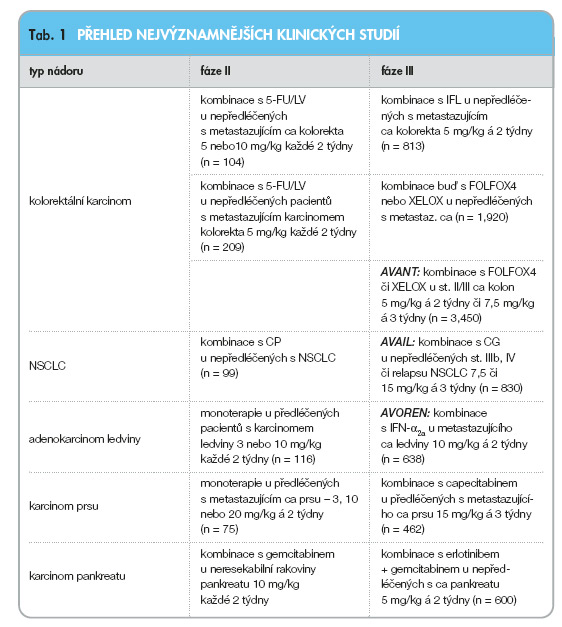
Přehled současně probíhajících klinických studií s bevacizumabem shrnuje tab. 1.
Zařazení do současné palety léčiv
Bevacizumab se jeví jako užitečná součást komplexní léčby kolorektálního karcinomu v kombinaci se standardní chemoterapií, jejíž protinádorový účinek potencuje. Je pravděpodobné, že se uplatní i v léčbě dalších nádorových onemocnění (zejména karcinomu prsu, pankreatu a plic).
Indikace
V současné době se považuje za hlavní indikaci metastazující kolorektální karcinom, kde se bevacizumab doporučuje podávat s chemoterapií. Např. s IFL (irinotecan, fluorouracil, leucovorin), s capecitabinem, popř. s jinými kombinacemi. Léčba je indikována u nemocných, jejichž stav tělesné výkonnosti (performance status)je v rozmezí 0–1, u nemocných starších 18 let a u nemocných s adekvátními hematologickými, renálními a hepatálními funkcemi.
Nežádoucí účinky a kontraindikace
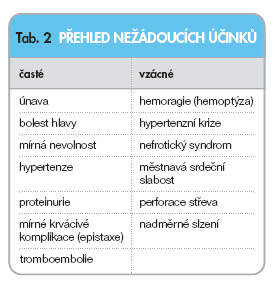
Léčba bevacizumabem je zpravidla velmi dobře tolerována, toxicita je mírná a dobře zvládnutelná. Nejčastější nežádoucí účinky jsou shrnuty v tab. 2.
Hypertenze bývá mírného stupně a je, jak se zdá, závislá na výši podané dávky. Většinou dobře reaguje na běžnou antihypertenzní léčbu a jen výjimečně je důvodem k přerušení léčby bevacizumabem. Přesto je vhodné výši krevního tlaku pravidelně kontrolovat. Mechanismus jejího vzniku se vysvětluje tím, že bevacizumab blokádou VEGF zruší jeho účinek na zvýšenou produkci oxidu dusnatého, který má vazodilatační účinky. Následná vazokonstrikce se pak může podílet na vzniku hypertenze. Proteinurie bývá rovněž mírná (častěji se vyskytne u nemocných s hypertenzí) a jen vzácně působí vznik nefrotického syndromu [l0]. Léčbu bevacizumabem se doporučuje přerušit jen při ztrátách bílkovin nad 2 g/24 hod.
Zvláštní pozornost je třeba věnovat nemocným s tromboembolickými komplikacemi v anamnéze, neboť léčba bevacizumabem může tyto komplikace sama indukovat. Byly zaznamenány žilní i arteriální trombózy. Vzhledem k tomu, že normální angiogeneze je nutná pro hojení ran, nedoporučuje se podávat bevacizumab před plánovaným chirurgickým výkonem, a začátek léčby po operaci oddálit o 28 dnů [2l]. U metastazujících nádorů se v souvislosti s léčbou může objevit krvácení. Jsou to jednak krvácivé projevy mírného stupně (nejčastěji epistaxe nebo krvácení do kůže), ale při léčbě bronchogenního karcinomu byly popsány i fatální hemoptýzy. Nepříjemnou komplikací léčby může být perforace v gastrointestinálním traktu s následným intraabdominálním abscesem. Projeví se bolestí břicha, nevolností a obstipací. Hrozí zejména u nemocných s metastazujícím karcinomem kolorekta a pankreatu. Nebyla však popsána při léčbě jiných solidních nádorů. Městnavá srdeční slabost se vyskytla převážně u nemocných dříve léčených antracykliny.
U nemocných starších 65 roků jsou nežádoucí účinky častější. Jsou pestřejší, ale nejsou závažné. Je to dyspepsie, zácpa, změna hlasu, nadměrné slzení, poněkud častější jsou u těchto nemocných tromboembolické komplikace.
V laboratorním nálezu se léčba bevacizumabem projeví některými odchylkami, jako je leukopenie, hypokalémie, hypofosfatémie nebo mírná hyperglykémie. Kontraindikací léčby je pouze přecitlivělost na bevacizumab nebo na jiné rekombinantní protilátky, přecitlivělost na pomocné látky v galenickém přípravku a metastázy do CNS. Nedoporučuje se podávat lék gravidním ženám. Nelze totiž vyloučit průnik bevacizumabu placentární bariérou (imunoglobuliny mají schopnost průniku) a tím inhibici angiogeneze u plodu. Není známo, zda bevacizumab proniká do mateřského mléka, ale při laktaci se rovněž léčba bevacizumabem nedoporučuje. Bevacizumab není kancerogenní, u žen může omezovat fertilitu.
Lékové interakce
Jediná potvrzená interakce byla zjištěna s irinotecanem. Při současném podání zvyšuje bevacizumab sérovou koncentraci aktivního metabolitu irinotecanu (SN 38). Jiné interakce nebyly popsány. Rovněž nebyla zaznamenána synergní toxicita s chemoterapií.
Dávkování
Doporučená dávka je 5 mg/kg tělesné hmotnosti jedenkrát za 2 týdny. Lék se podává výhradně formou nitrožilní kapénkové infuze po zředění substance ve 100 ml fyziologického roztoku. Trvání první infuze by mělo být nejméně 90 min. Při dobré toleranci je možné zkrátit dobu aplikace druhé infuze na 60 minut a dalších infuzí na 30 min. První dávka bevacizumabu se má podat po chemoterapii, u dalších dávek je možný i opačný sled podání. Léčba je dlouhodobá, doporučuje se až do známek progrese onemocnění. Lék se nesmí podávat v roztoku glukózy. Zvýšení jednotlivé dávky na 10 či 15 mg nezvyšuje významně účinek léčby, ale přináší zvýšené riziko nežádoucích účinků. Maximální tolerovaná dávka nebyla stanovena, nejvyšší testovaná dávka je 20 mg/kg, ta však vyvolává silnou migrénu.
Balení
Bevacizumab je k dispozici v lahvičkách obsahujících koncentrovaný roztok 100 mg v 4 ml nebo 400 mg v 16 ml stabilizačního roztoku (tj. vždy 25 mg/ml) obsahujícího fosfát, dihydrát trehalózy, polysorbát a vodu pro injekci (tab. 3). Potřebné množství se naředí 0,9% roztokem NaCl až do objemu 100 ml. Přípravek má být uchováván při teplotě 2–9 °C. Neobsahuje antibakteriální přísady, proto je nutno při přípravě infuze dbát na zásady sterility. Po zředění ve fyziologickém roztoku je stabilita roztoku 48 hod.
Seznam použité literatury
- [1] Ferrara N, Davis-Smyth T. The biology of vascular endothelial growth factor. Endocr Rev 1997; 18: 4–25.
- [2] Ignofo RJ. Overview of bevacizumab: A new anticancer therapeutic strategy targeting vascular endothelial growth factor. Am J Health Syst Pharm 2000; 61 (Suppl. 5): 21–26.
- [3] Gordon MS, Margolin K, Talpaz M, et al. Phase I safety and pharmacokinetic study of recombinant human anti-vascular endothelial growth factor in patients with advanced cancer. J Clin Oncol 2001; 19: 843–850.
- [4] Tong R, Boucher Y, Kozin SV, et al. Vascular normalization by vascular endothelial growth factor receptor 2 blockade induces a pressure gradient across the vasculature and improves drug penetration in tumors. Cancer Res 2004; 64: 3731–3736.
- [5] Jain RK. Normalizing tumor vasculature with anti-angiogenic therapy: a new paradigm for combination therapy. Nat Med 2001; 7: 987–989.
- [6] Harada Y, Ogata Y, Shirouzu K. Expression of vascular endothelial growth factor and its receptor KDR (kinase domain-containing receptor) (Flk 1-fetal liver kinase-1) as prognostic factors in human colorectal cancer. Int J Clin Oncol 2001; 6: 221–228.
- [7] Reinmuth N, Parikh AA. Ahmad SA, et al. Biology of angiogenesis in tumors of gastrointestinal tract. Microsc Res Tech 2003; 69: 3–10.
- [8] Kabbinavar FF, Schulz J, McCleod M, et al. Addition of bevacizumab to bolus fluorouracil and leucovorin. First line metastatic colorectal cancer: Results of randomized phase II trial. J Clin Oncol. 2005; 23 (16): 3697–3705.
- [9] Wildiers H,Guetens G, Boek G, et al. Effects of antivascular endothelial growth factor treatment on the intratumoral uptake of CPT-11. Br J Cancer 2003; 88: 1979–1986.
- [20] Karp JE, Gojo I, Pili R, et al. Targeting vascular endothelial growth factor for relapsed and refractory adult acute myelogenous leukemias. Clin Cancer Res 2004; 10: 3577–3585.
- [21] Hurwitz H, Fehrenbacher L, Cartwright T, et al. Wound healing/bleeding in metastatic colorectal patients who undergo surgery during treatment with bevacizumab. J Clin Oncol 2004; 22 (Suppl. 14), Abstr. 3702.
- [22] Shen BQ, et al. Proc Am Assoc Cancer Res 2004; 45 (Abstract 2203).