Linagliptin
Léčba diabetes mellitus inhibitory dipeptidyl peptidázy 4 (DPP-4) představuje velmi nadějný terapeutický směr, který pomáhá zlepšit kompenzaci diabetu při minimálním výskytu hypoglykemie a dalších nežádoucích účinků. Linagliptin je nový, vysoce selektivní inhibitor DPP-4, který se od stávajících preparátů této skupiny odlišuje především unikátní metabolizací umožňující jeho podávání u pacientů jak s renální, tak s jaterní insuficiencí bez nutnosti úpravy dávky. V tomto článku se zaměřujeme na mechanismus účinku, farmakokinetiku a farmakodynamiku linagliptinu a jeho zařazení do současné palety léčiv v rámci stávajících terapeutických možností diabetes mellitus 2. typu.
Farmakologická skupina
Linagliptin náleží mezi léčiva určená k terapii diabetu 2. typu, konkrétně do skupiny inhibitorů dipeptidyl peptidázy 4 (DPP-4), ATC kód: A10BH05.
Chemické a fyzikální vlastnosti
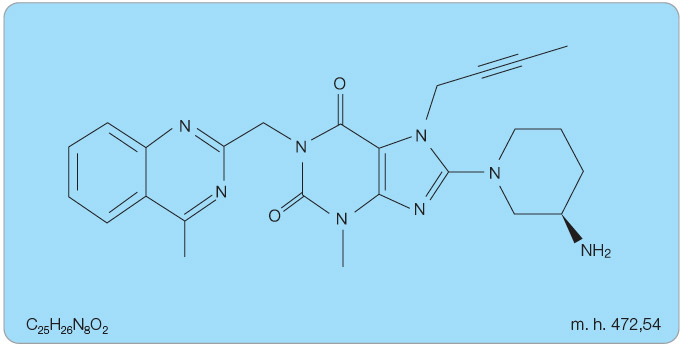 Struktura linagliptinu je odvozena od molekuly xantinu. Chemicky se jedná o 8-[(3R)-3-aminopiperidin-1-yl]-7-(but-2-yn-1-yl)-3-methyl-1-[(4-methylchinazolin-2-yl)methyl]-3,7-dihydro-1H-purin-2,6-dion (obr. 1).
Struktura linagliptinu je odvozena od molekuly xantinu. Chemicky se jedná o 8-[(3R)-3-aminopiperidin-1-yl]-7-(but-2-yn-1-yl)-3-methyl-1-[(4-methylchinazolin-2-yl)methyl]-3,7-dihydro-1H-purin-2,6-dion (obr. 1).
Sumární vzorec: C25H26N8O2
Molekulová hmotnost: 472,54
Linagliptin je bílá až nažloutlá nehygroskopická nebo jen lehce hygroskopická pevná látka. Je velmi málo rozpustný ve vodě (0,9 mg/ml), poměrně dobře rozpustný v methanolu (cca 60 mg/ml), mírně rozpustný v ethanolu (cca 10 mg/ml), velmi těžce rozpustný v isopropanolu (< 1 mg/ml) a velmi těžce rozpustný v acetonu (cca 1 mg/ml) [1].
Mechanismus účinku, farmakodynamika
Linagliptin je potentní, vysoce selektivní inhibitor enzymu dipeptidyl peptidázy 4 (DPP-4), který se přímo váže na aktivní místo enzymu. DPP-4 je ubikviterně přítomná aminopeptidáza, která odštěpuje dvě N-terminální aminokyseliny biologicky aktivních inkretinových hormonů (štěpí vazbu, ve které musí být obsažen alanin nebo prolin). Inkretinové hormony jsou polypeptidy, jež jsou secernovány endokrinními buňkami trávicího ústrojí po požití potravy. Obvykle jsou mezi ně řazeny glucagon-like peptide 1 (glukagonu podobný peptid 1, GLP-1) a glucose-dependent insulinotropic polypeptide/gastric inhibitory polypeptide (na glukóze závislý inzulinotropní peptid, GIP). Jejich plazmatický poločas je velmi krátký (2–7 minut), neboť jsou velmi rychle degradovány DPP-4. Hlavními mechanismy, kterými inkretiny ovlivňují homeostázu glukózy, jsou ovlivnění sekrece inzulinu závislé na glykemii, postprandiální suprese sekrece glukagonu a ovlivnění evakuace žaludku. Účinek na sekreci inzulinu je tzv. glukózo-dependentní. To znamená, že se neprojevuje při normální nebo snížené glykemii, taktéž ustává při poklesu postprandiální glykemie na normální hodnotu [2, 3].
![Graf 1 Inhibice enzymu DPP-4 po podání 5 mg linagliptinu; volně podle [4] – Heise, et al., 2009.](https://www.remedia.cz/photo-a-28588---.jpg) Linagliptin se velmi efektivně a reverzibilně váže na DPP-4 a tím vede k setrvalému zvýšení a prodloužení hladin aktivních inkretinů. Inhibice plazmatické aktivity DPP-4 dobře koreluje s koncentrací linagliptinu v
Linagliptin se velmi efektivně a reverzibilně váže na DPP-4 a tím vede k setrvalému zvýšení a prodloužení hladin aktivních inkretinů. Inhibice plazmatické aktivity DPP-4 dobře koreluje s koncentrací linagliptinu v ![Obr. 2 Schematické znázornění mechanismu účinku linagliptinu; volně podle [2, 5] – Ahrén, 2003; Drucker, 2003.](https://www.remedia.cz/photo-a-28589---.jpg) plazmě. Podání dávky 5 mg linagliptinu vede k více než 90% inhibici DPP-4; i 24 hodin po podání jednorázové dávky je inhibice DPP-4 velmi vysoká a činí > 80 % (graf 1) [4]. Linagliptin v závislosti na hladině glykemie zvyšuje sekreci inzulinu a snižuje sekreci glukagonu, čímž vede k celkovému zlepšení glukózové homeostázy (obr. 2) [2, 5]. Linagliptin se váže na DPP-4 selektivně a in vitro vykazuje více než 10 000násobnou selektivitu oproti jiným dipeptidyl peptidázám (DPP-8 nebo DPP-9) [6].
plazmě. Podání dávky 5 mg linagliptinu vede k více než 90% inhibici DPP-4; i 24 hodin po podání jednorázové dávky je inhibice DPP-4 velmi vysoká a činí > 80 % (graf 1) [4]. Linagliptin v závislosti na hladině glykemie zvyšuje sekreci inzulinu a snižuje sekreci glukagonu, čímž vede k celkovému zlepšení glukózové homeostázy (obr. 2) [2, 5]. Linagliptin se váže na DPP-4 selektivně a in vitro vykazuje více než 10 000násobnou selektivitu oproti jiným dipeptidyl peptidázám (DPP-8 nebo DPP-9) [6].
Farmakokinetické vlastnosti
Farmakokinetické vlastnosti linagliptinu byly zkoumány na rozsáhlém souboru zdravých dobrovolníků i dospělých pacientů s diabetem 2. typu [7]. Bylo prokázáno, že farmakokinetika je nelineární, hodnoty plochy pod křivkou (AUC) a maximální plazmatické koncentrace (cmax) se zvyšují v závislosti na dávce, nikoli však proporcionálně. 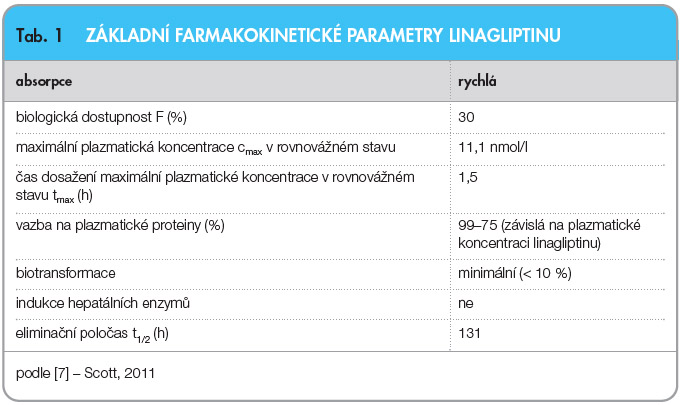 Přehledně jsou farmakokinetické parametry linagliptinu shrnuty v tab. 1.
Přehledně jsou farmakokinetické parametry linagliptinu shrnuty v tab. 1.
Absolutní biologická dostupnost linagliptinu činí po perorálním podání přibližně 30 %. Hodnota AUC0-24 měřená u zdravých dobrovolníků činila 191 nM . h [8]. Po podání dávky 5 mg linagliptinu pacientům s diabetem 2. typu se léčivo rychle vstřebává a maximální plazmatické koncentrace je v rovnovážném stavu (cmax = 11,1 nmol/l) dosaženo za 1,5 hodiny [4]. Ve studii se 32 zdravými dobrovolníky nebyl zjištěn žádný klinicky relevantní vliv potravy na absorpci linagliptinu [9]. Nepředpokládá se, že by potrava měla vliv na farmakokinetické vlastnosti linagliptinu, léčivo je možné užívat spolu s jídlem nebo bez jídla.
V důsledku vazby v tkáních je průměrný zdánlivý distribuční objem po jednorázové nitrožilní dávce 5 mg linagliptinu zdravým dobrovolníkům přibližně 1110 litrů, což svědčí o tom, že linagliptin je extenzivně distribuován do tkání. Vazba linagliptinu na plazmatické bílkoviny je závislá na koncentraci léčiva, klesá z asi 99 % při koncentraci 1 nmol/l na 75–89 % při koncentraci ≥ 30 nmol/l.
Biotransformace linagliptinu je minimální, 90 % účinné látky se vylučuje v nezměněné formě [8]. Většina metabolitů se v krvi a tkáních nachází v nízkých koncentracích. Farmakologicky inaktivní metabolit CD1790 byl jediným metabolitem, který představoval více než 10 % celkové koncentrace léčiva. Linagliptin není substrátem cytochromu P-450 a nepůsobí ani jako induktor ani jako inhibitor tohoto oxidázového systému. Linagliptin je substrátem transportního systému P-glykoproteinu a působí jako jeho velmi slabý inhibitor. Jeho podávání je obecně spojeno s nízkým rizikem lékových interakcí [10].
Linagliptin je vylučován především enterohepatálně, po perorálním podání dávky 10 mg linagliptinu se 84,7 % léčiva vyloučí stolicí a pouze 5,4 % močí [8]. Celková clearance linagliptinu je nízká a představuje 150 ml/min. U pacientů s diabetem 2. typu je po 12denním podávání 5 mg linagliptinu denně průměrný terminální poločas 131 hodin [4].
Pacienti s renální insuficiencí
Farmakokinetické vlastnosti linagliptinu byly studovány u pacientů s různým stupněm renální insuficience (diabetiků i nediabetiků) a rovněž u pacientů v konečném stadiu onemocnění ledvin léčeném hemodialýzou. Výsledky byly srovnávány s farmakokinetickými vlastnostmi u osob s normální funkcí ledvin (diabetiků i nediabetiků) [11].
V ustáleném stavu byla expozice linagliptinu i jeho maximální plazmatická koncentrace srovnatelná u pacientů s mírným stupněm renální insuficience a u zdravých jedinců. Při středně závažné renální insuficienci bylo pozorováno nevýrazné, asi 1,7násobné zvýšení expozice ve srovnání s kontrolou. Expozice u pacientů s diabetem 2. typu se závažnou renální insuficiencí byla zvýšena asi 1,4násobně ve srovnání s pacienty s diabetem 2. typu s normální funkcí ledvin. Předpovědi AUC linagliptinu za rovnovážného stavu u pacientů v konečném stadiu onemocnění ledvin svědčily o srovnatelné expozici jako u pacientů se středně závažnou až závažnou renální insuficiencí. Vedle toho se neočekává, že by byl linagliptin odstraňován v terapeuticky významném stupni hemodialýzou nebo peritoneální dialýzou. Proto není nutná žádná úprava dávkování linagliptinu u pacientů s jakýmkoliv stupněm renální insuficience [11].
Další specifické skupiny pacientů
Farmakokinetické vlastnosti linagliptinu nebyly zásadně ovlivněny tělesnou hmotností pacientů, pohlavím, věkem (pacienti starší 65 let) či rasou nemocných. Proto se u těchto skupin nepředpokládá žádná úprava dávkování. Rovněž u pacientů nediabetiků s mírnou, středně závažnou či závažnou jaterní insuficiencí není doporučována žádná úprava dávkování. Farmakokinetické studie u pediatrické populace dosud nebyly provedeny [12].
Klinické zkušenosti
K hodnocení účinnosti a bezpečnosti bylo provedeno 8 randomizovaných kontrolovaných studií fáze III zahrnujících celkem 5239 pacientů s diabetem 2. typu, z nichž bylo 3319 léčeno linagliptinem. Tyto studie zahrnovaly 929 pacientů ve věku 65 let či starších, kteří užívali linagliptin. Do těchto studií bylo též zařazeno 1238 pacientů s mírnou poruchou funkce ledvin a 143 pacientů se středně závažnou poruchou funkce ledvin, kteří byli léčeni linagliptinem. Linagliptin podávaný jednou denně vedl ke klinicky významnému zlepšení kontroly glykemie, aniž by došlo ke klinicky významné změně tělesné hmotnosti. Snížení glykovaného hemoglobinu (HbA1c) bylo podobné napříč různými podskupinami včetně podskupin podle pohlaví, věku, poruchy funkce ledvin a indexu tělesné hmotnosti (BMI). Vyšší výchozí hodnota HbA1c byla spojena s výraznějším poklesem HbA1c. V souhrnných studiích byl významný rozdíl ve snížení HbA1c mezi pacienty asijské rasy (0,8 %) a pacienty bílé rasy (0,5 %) [12]. Pozn. Vzhledem k tomu, že všechny studie byly provedeny v zemích vyjadřujících glykovaný hemoglobin v hodnotách podle DCCT, ponecháváme dále v textu originální hodnoty. Pro čtenáře upřesňujeme, že hodnota HbA1c 7,0 % dle DCCT odpovídá hodnotě 5,4 % podle českých hodnot IFCC, hodnota 9,0 % dle DCCT pak odpovídá hodnotě 7,6 % podle IFCC.
Linagliptin v monoterapii u pacientů, pro něž není vhodná léčba metforminem
Účinnost a bezpečnost linagliptinu v monoterapii byla hodnocena v dvojitě zaslepené, placebem kontrolované studii o délce 24 týdnů. Léčba linagliptinem v dávce 5 mg jednou denně vedla k významnému zlepšení HbA1c (změna o 0,69 % ve srovnání s placebem) u pacientů s výchozí hodnotou HbA1c přibližně 8 %. Linagliptin také vykázal ve srovnání s placebem významné zlepšení hodnot glukózy v plazmě nalačno (FPG) a za 2 hodiny postprandiálně (PPG). Pozorovaný výskyt hypoglykemie u pacientů léčených linagliptinem byl podobný jako u placeba [13]. Ve dvojitě zaslepené, placebem kontrolované studii v délce 18 týdnů byla účinnost a bezpečnost linagliptinu v monoterapii hodnocena také u pacientů, u kterých je terapie metforminem nevhodná z důvodu jeho intolerance nebo kontraindikace z důvodu poruchy funkce ledvin. Linagliptin vedl k významnému zlepšení hodnot HbA1c (změna o 0,57 % ve srovnání s placebem) z průměrné výchozí hodnoty HbA1c 8,09 %. Linagliptin také prokázal ve srovnání s placebem významné zlepšení hodnot glukózy v plazmě nalačno (FPG). Pozorovaný výskyt hypoglykemie u pacientů léčených linagliptinem byl podobný jako při podávání placeba.
Linagliptin jako přídavná léčba k terapii metforminem
Účinnost a bezpečnost linagliptinu v kombinaci s metforminem byla hodnocena ve dvojitě zaslepené, placebem kontrolované studii v délce 24 týdnů. Linagliptin vedl k významnému poklesu hodnot HbA1c (změna o 0,64 % ve srovnání s placebem) z průměrné výchozí hodnoty HbA1c 8 %. Linagliptin také vykázal ve srovnání s placebem významné zlepšení hodnot glukózy v plazmě nalačno (FPG) a za 2 hodiny postprandiálně (PPG). Pozorovaný výskyt hypoglykemie u pacientů léčených linagliptinem byl podobný jako u placeba [14].
Linagliptin jako přídavná léčba ke kombinované terapii metforminem a sulfonylureou
Byla provedena placebem kontrolovaná studie v délce 24 týdnů zaměřená na zhodnocení účinnosti a bezpečnosti linagliptinu podávaného v dávce 5 mg oproti placebu u pacientů nedostatečně kompenzovaných na kombinaci metforminu a derivátů sulfonylurey. Linagliptin vedl k významnému snížení hodnot v (změna 0,62 % ve srovnání s placebem) z průměrné výchozí hodnoty HbA1c 8,14 % a k signifikantnímu zlepšení hodnot glukózy v plazmě nalačno (FPG) a za 2 hodiny postprandiálně (PPG) [15].
Linagliptin jako přídavná léčba k metforminu ve srovnání s kombinací metformin-glimepirid
Ve 24měsíční studii srovnávající účinnost a bezpečnost přidání linagliptinu 5 mg nebo glimepiridu (průměrná dávka 3 mg) u pacientů s nedostatečnou kontrolou glykemie při monoterapii metforminem představovalo průměrné snížení HbA1c při podávání linagliptinu 0,16 % (průměrná výchozí hodnota HbA1c 7,69 %) a při podávání glimepiridu 0,36 % (průměrná výchozí hodnota HbA1c 7,69 %), přičemž průměrný léčebný rozdíl byl 0,20 % (97,5% interval spolehlivosti: 0,09; 0,299). Relativně nízký pokles HbA1c v obou skupinách je dán skutečností, že se jednalo o pacienty s primárně poměrně dobrou kompenzací (vstupní HbA1c 7,6 % dle DCCT odpovídá hodnotě HbA1c 5,9 % podle našich IFCC hodnot). Výskyt hypoglykemie ve skupině linagliptinu (7,5 %) byl významně nižší než ve skupině glimepiridu (36,1%). U pacientů léčených linagliptinem došlo k signifikantnímu snížení tělesné hmotnosti oproti výchozím hodnotám ve srovnání s významným nárůstem tělesné hmotnosti u pacientů léčených glimepiridem (pokles o 1,39 kg oproti nárůstu o 1,29 kg) [16].
Linagliptin jako přídavná léčba u pacientů se závažnou poruchou funkce ledvin
Účinnost a bezpečnost linagliptinu oproti placebu byla hodnocena u pacientů s diabetem 2. typu se závažnou poruchou funkce ledvin ve dvojitě zaslepené studii kontrolované placebem. Studie trvala 12 týdnů a vstupní antidiabetická léčba nebyla během studie měněna. Většina pacientů (80,5 %) dostávala jako vstupní terapii inzulin samotný nebo v kombinaci s různými perorálními antidiabetiky (sulfonylurea, glinid a pioglitazon). Po ukončení studie následovalo její 40týdenní pokračování, na jehož počátku bylo povoleno upravit dávkování antidiabetik. Linagliptin vedl k významnému poklesu hodnot HbA1c (změna o 0,59 % ve srovnání s placebem po 12 týdnech) z průměrné výchozí hodnoty HbA1c 8,2 %. Pozorovaný rozdíl hodnot HbA1c oproti placebu byl po 52 týdnech 0,72 %. Skupiny se mezi sebou významně nelišily v tělesné hmotnosti subjektů. Pozorovaný výskyt hypoglykemie byl u pacientů léčených linagliptinem vyšší než u placebové skupiny z důvodu nárůstu asymptomatických hypoglykemických nežádoucích příhod. V počtu závažných hypoglykemických nežádoucích příhod nebyl mezi skupinami nalezen rozdíl [17].
Kardiovaskulární riziko
V prospektivní předem specifikované metaanalýze nezávisle posuzovaných kardiovaskulárních příhod z 8 klinických studií fáze III (trvajících 18 týdnů až 12 měsíců), které zahrnuly 5239 pacientů s diabetem 2. typu, nebyla léčba linagliptinem spojena se zvýšením kardiovaskulárního rizika. Primární složený cíl (výskyt kardiovaskulárního úmrtí nebo čas do prvního výskytu kardiovaskulárního úmrtí, nefatální infarkt myokardu, nefatální mozková příhoda nebo hospitalizace pro nestabilní anginu pectoris) byl signifikantně nižší u pacientů léčených linagliptinem oproti pacientům, kteří dostávali kombinace placeba s aktivními srovnávanými látkami (poměr rizika 0,34; 95% interval spolehlivosti 0,17; 0,70). V absolutním vyjádření bylo pozorováno 11 kardiovaskulárních příhod při podávání linagliptinu a 23 příhod u kontrolních pacientů bez léčby linagliptinem. Lze tedy konstatovat, že uvedené výsledky nesvědčí pro zvýšení kardiovaskulárního rizika a naopak naznačují možnost jeho snížení při léčbě linagliptinem. Počet příhod v klinických studiích byl ovšem relativně nízký, takže jednoznačné závěry mohou přinést až výsledky prospektivních randomizovaných studií přímo zaměřených na otázku ovlivnění kardiovaskulárního rizika léčbou linagliptinem [18].
Pediatrická populace
Evropská agentura pro léčivé přípravky udělila odklad povinnosti předložit výsledky studií s linagliptinem u jedné nebo více podskupin pediatrické populace s diabetem 2. typu [12].
Zařazení do současné palety léčiv
V rámci léčby diabetes mellitus 2. typu jsou v současné době stále více hodnoceny komplexní účinky jednotlivých antidiabetik, nikoliv „pouze“ na zlepšení glykemické kompenzace, ale také jejich vliv na tělesnou hmotnost, výskyt nežádoucích účinků a ovlivnění kardiovaskulární morbidity a mortality. Z tohoto pohledu je inkretinová léčba, mezi kterou gliptiny patří, v současné době nejnadějnějším léčebným přístupem. Léčba všemi gliptiny je totiž kromě účinného zlepšení kompenzace diabetu hmotnostně neutrální, případně hmotnost mírně snižuje. Zcela zásadní je však především minimální výskyt hypoglykemie při podávání gliptinů a rovněž vysoká kardiovaskulární bezpečnost, kterou u všech léčiv z této skupiny naznačují kombinované analýzy dosud provedených studií.
Jak již bylo uvedeno výše, náleží linagliptin (registrovaný v ČR v roce 2011) do výše popsané skupiny gliptinů neboli inhibitorů dipeptidyl peptidázy 4 (DPP-4). Do této skupiny dále patří sitagliptin (registrovaný v ČR v roce 2007), vildagliptin (registrovaný v ČR v roce 2007), saxagliptin (registrovaný v ČR v roce 2009) a alogliptin, který dosud v ČR není registrován.
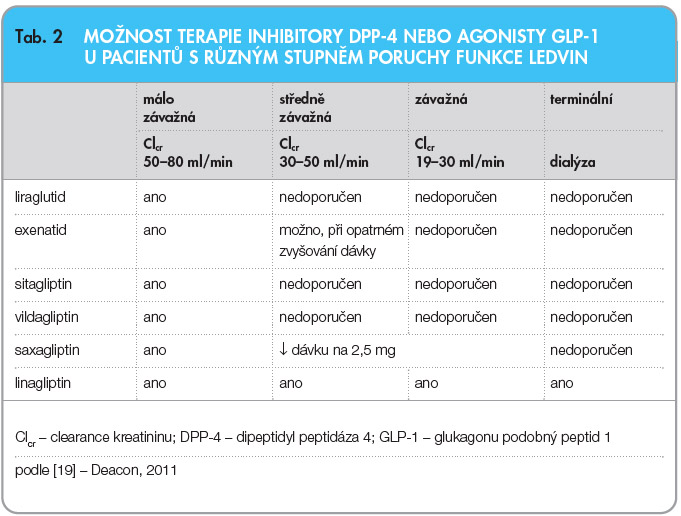 Linagliptin se od sitagliptinu, vildagliptinu a saxagliptinu odlišuje především cestou eliminace z organismu. Extrarenální způsob eliminace může být značnou výhodou u pacientů s poruchou funkce ledvin, protože se podávání těchto léčiv u pacientů s těžší poruchou funkce ledvin nedoporučuje, naproti tomu dávky linagliptinu není nutné upravovat podle míry postižení funkce ledvin, a linagliptin tak může být podáván pacientům ve všech stadiích renální insuficience (tab. 2) [19]. Tento fakt může být z hlediska klinické využitelnosti velmi významný, protože obecně platí, že u pacientů s těžšími stadii onemocnění ledvin jsou prakticky všechna perorální antidiabetika kontraindikována. Přitom prevalence chronického onemocnění ledvin dosahuje u pacientů s diabetem kolem 40 % nebo i více a lze předpokládat, že tento výskyt bude s prodlužujícím se dožitím diabetiků dále stoupat.
Linagliptin se od sitagliptinu, vildagliptinu a saxagliptinu odlišuje především cestou eliminace z organismu. Extrarenální způsob eliminace může být značnou výhodou u pacientů s poruchou funkce ledvin, protože se podávání těchto léčiv u pacientů s těžší poruchou funkce ledvin nedoporučuje, naproti tomu dávky linagliptinu není nutné upravovat podle míry postižení funkce ledvin, a linagliptin tak může být podáván pacientům ve všech stadiích renální insuficience (tab. 2) [19]. Tento fakt může být z hlediska klinické využitelnosti velmi významný, protože obecně platí, že u pacientů s těžšími stadii onemocnění ledvin jsou prakticky všechna perorální antidiabetika kontraindikována. Přitom prevalence chronického onemocnění ledvin dosahuje u pacientů s diabetem kolem 40 % nebo i více a lze předpokládat, že tento výskyt bude s prodlužujícím se dožitím diabetiků dále stoupat.
Další výhodnou vlastností linagliptinu je jeho dlouhý efekt, který přetrvává významně déle než 24 hodin po opakovaném podávání.
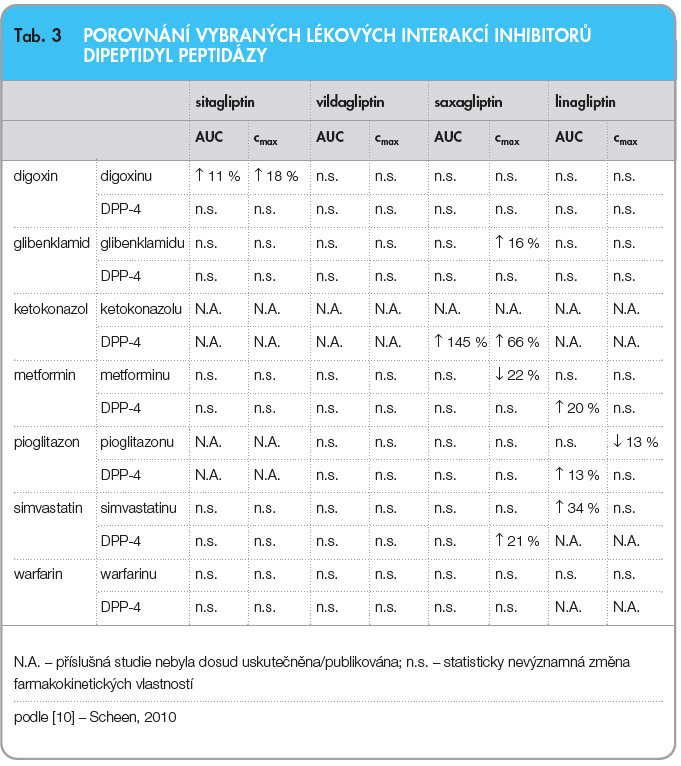 Jak bylo uvedeno výše, linagliptin není substrátem ani inhibitorem či induktorem jednotlivých izoenzymů cytochromu P-450. Je však substrátem P-glykoproteinu a působí jako jeho slabý inhibitor. Ze skupiny inhibitorů dipeptidyl peptidázy je především saxagliptin substrátem CYP3A4, zatímco vildagliptin není, obdobně jako linagliptin, substrátem ani inhibitorem či induktorem jednotlivých izoenzymů cytochromu P-450. Sitagliptin též není substrátem ani inhibitorem či induktorem jednotlivých izoenzymů cytochromu P-450, je však substrátem P-glykoproteinu (tab. 3) [10].
Jak bylo uvedeno výše, linagliptin není substrátem ani inhibitorem či induktorem jednotlivých izoenzymů cytochromu P-450. Je však substrátem P-glykoproteinu a působí jako jeho slabý inhibitor. Ze skupiny inhibitorů dipeptidyl peptidázy je především saxagliptin substrátem CYP3A4, zatímco vildagliptin není, obdobně jako linagliptin, substrátem ani inhibitorem či induktorem jednotlivých izoenzymů cytochromu P-450. Sitagliptin též není substrátem ani inhibitorem či induktorem jednotlivých izoenzymů cytochromu P-450, je však substrátem P-glykoproteinu (tab. 3) [10].
Výrobce saxagliptinu v ČR uvádí, že současné podání ketokonazolu a saxagliptinu vedlo ke zvýšení expozice saxagliptinu, k současnému podávání jiných silných inhibitorů CYP3A4 se nevyjadřuje. Výrobce saxagliptinu v USA výslovně uvádí, že při současném podávání saxagliptinu se silnými inhibitory CYP3A4 (jako je ketokonazol, atazanavir, klarithromycin, indinavir, itrakonazol, nefazodon, nelfinavir, ritonavir, saquinavir a telithromycin) se nesmí překročit denní dávka saxagliptinu 2,5 mg [20, 21].
V souvislosti s klinickou využitelností linagliptinu stojí za opakovanou zmínku i výše diskutované ovlivnění kardiovaskulárního rizika. Kombinované analýzy kardiovaskulárních příhod u pacientů s dokončenými gliptinovými studiemi potvrzují jejich vysokou bezpečnost a naznačují možný potenciál pro snížení kardiovaskulárního rizika, přičemž poměr rizik byl u používaných inhibitorů DPP-4 relativně nejnižší právě pro linagliptin. Definitivní odpověď na otázku možné kardioprotektivity gliptinů nám mohou dát až prospektivní randomizované studie zaměřené na tuto problematiku, nicméně již nyní můžeme říci, že kardiovaskulární bezpečnost léčby linagliptinem i dalšími gliptiny je podle stávajících poznatků zcela uspokojivá. Tento fakt je dán nejen možným přímým kardioprotektivním účinkem GLP-1, ale především nepřítomností hypoglykemie a také mírným poklesem hmotnosti a pozitivním ovlivněním řady kardiovaskulárních rizikových faktorů (krevní tlak, lipidy atp.) při léčbě gliptiny.
Výhodné farmakokinetické vlastnosti linagliptinu spolu s dalšími vlastnostmi, které mají i ostatní zástupci inhibitorů dipeptidyl peptidázy 4, tj. příznivý vliv na tělesnou hmotnost pacientů, nízký výskyt nežádoucích účinků a příznivý „interakční potenciál“, činí z linagliptinu velmi vhodné léčivo pro terapii diabetu 2. typu, a to nejen u pacientů s poruchou funkce ledvin.
Indikace
Linagliptin je indikován při léčbě diabetu 2. typu ke zlepšení kontroly glykemie u dospělých pacientů:
a) jako monoterapie u pacientů s nedostatečnou kompenzací diabetu samotnou dietou a tělesným cvičením, u kterých je léčba metforminem nevhodná z důvodu nesnášenlivosti či kontraindikace kvůli poruše funkce ledvin;
b) jako kombinovaná terapie v kombinaci s metforminem, jestliže samotná dieta a tělesné cvičení spolu s metforminem nepostačují k přiměřené kontrole glykemie, nebo v kombinaci se sulfonylureou a metforminem, jestliže dieta a tělesné cvičení spolu s kombinovanou terapií těmito léčivými přípravky nepostačují k přiměřené kontrole glykemie [12].
Kontraindikace
Přecitlivělost na léčivou látku nebo na kteroukoli pomocnou látku [12].
Zvláštní upozornění a opatření pro použití
Linagliptin nesmí být podáván u pacientů s diabetem 1. typu nebo při léčbě diabetické ketoacidózy [12].
Linagliptin samotný vykázal výskyt hypoglykemie srovnatelný s placebem. V klinických studiích, ve kterých byl linagliptin součástí kombinované terapie spolu s léčivými přípravky, o nichž není známo, že by způsobovaly hypoglykemii (metformin), byl výskyt hypoglykemie hlášený při léčbě linagliptinem podobný výskytu hypoglykemie u pacientů užívajících placebo. Pokud byl linagliptin přidán k terapii sulfonylureou (při již existující terapii metforminem), výskyt hypoglykemie se oproti placebu zvýšil. O derivátech sulfonylurey je známo, že způsobují hypoglykemii. Z tohoto důvodu je nutná opatrnost, pokud je linagliptin užíván v kombinaci s deriváty sulfonylurey. Lze zvážit snížení dávky derivátu sulfonylurey [12].
Nežádoucí účinky
Bezpečnost linagliptinu byla hodnocena celkem u 4687 pacientů s diagnózou diabetes mellitus 2. typu, z nichž 4040 dostávalo cílovou dávku 5 mg. Ve studiích kontrolovaných placebem bylo zahrnuto 3749 pacientů a 2566 pacientů bylo léčeno terapeutickou dávkou 5 mg linagliptinu; 2360 pacientů bylo vystaveno linagliptinu v dávce 5 mg jednou denně po dobu 12 týdnů či delší. V souhrnné analýze studií kontrolovaných placebem byl celkový výskyt nežádoucích účinků u pacientů léčených placebem podobný jako při léčbě linagliptinem v dávce 5 mg (53,8 % vs. 55,0 %). Přerušení terapie z důvodu nežádoucích účinků bylo častější u pacientů užívajících placebo v porovnání s linagliptinem 5 mg (3,6 % vs. 2,3 %) [12, 22].
Nejčastěji hlášeným nežádoucím účinkem byla hypoglykemie, která však byla pozorována zejména při podávání trojkombinace linagliptin s metforminem a deriváty sulfonylurey, a to ve 14,7 % oproti 7,6 % při podávání placeba. Ve studiích kontrolovaných placebem hlásilo 5,0 % pacientů „hypoglykemii“ jako nežádoucí účinek podávání linagliptinu. U 86,8 % z nich se jednalo o hypoglykemii mírnou a u 13,2 % z nich o středně závažnou. Žádná z hypoglykemií nebyla klasifikována jako závažná. Pankreatitida byla hlášena častěji u pacientů randomizovaných k terapii linagliptinem (2 případy na 2566 pacientů užívajících linagliptin vs. 0 případů na 1183 pacientů užívajících placebo).
Tabulkový přehled nežádoucích účinků
Vzhledem k dopadu vstupní terapie na nežádoucí účinky (například na výskyt hypoglykemií) byly analýza a rozdělení nežádoucích účinků založeny na příslušných léčebných režimech (monoterapie, přidání k metforminu a přidání k metforminu plus derivátu sulfonylurey).
Studie kontrolované placebem zahrnovaly klinická hodnocení, ve kterých byl linagliptin podáván jako:
- monoterapie s krátkodobým trváním v délce až 4 týdnů,
- monoterapie s trváním 12 či více týdnů,
- přídavná léčba k metforminu,
- přídavná léčba k metforminu a derivátu sulfonylurey.
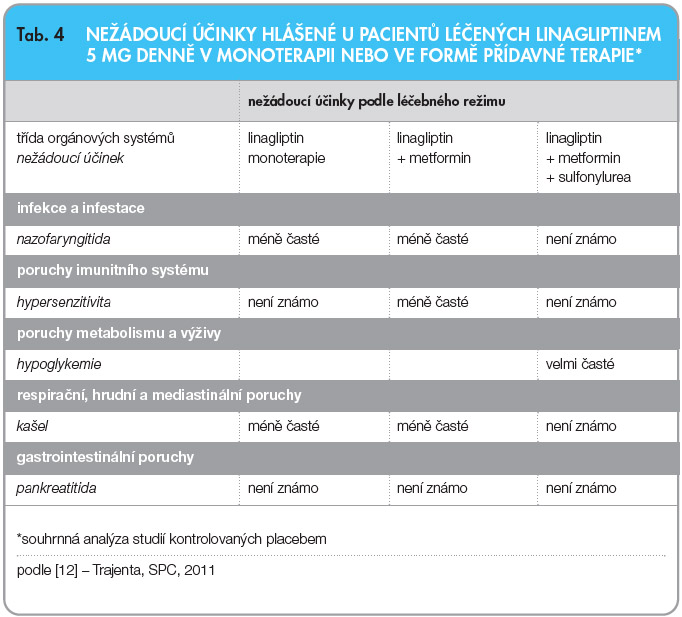 Nežádoucí účinky v níže uvedené tabulce (viz tab. 4), které byly hlášeny u pacientů užívajících 5 mg linagliptinu ve dvojitě zaslepených studiích ve formě monoterapie nebo přídavné terapie, jsou prezentovány podle léčebného režimu a rozděleny podle tříd orgánových systémů a MedDRA (Medical Dictionary for Regulatory Activities) preferovaných termínů [12].
Nežádoucí účinky v níže uvedené tabulce (viz tab. 4), které byly hlášeny u pacientů užívajících 5 mg linagliptinu ve dvojitě zaslepených studiích ve formě monoterapie nebo přídavné terapie, jsou prezentovány podle léčebného režimu a rozděleny podle tříd orgánových systémů a MedDRA (Medical Dictionary for Regulatory Activities) preferovaných termínů [12].
Předklinické údaje vztahující se k bezpečnosti
Játra, ledviny a gastrointestinální trakt jsou hlavními cílovými orgány toxicity u myší a potkanů při opakovaném podávání dávek linagliptinu 300násobně vyšších, než je expozice u lidí.
U potkanů byly pozorovány účinky na reprodukční orgány, štítnou žlázu a lymfoidní orgány při více než 1500násobku expozice u lidí. Při podávání středních dávek byly pozorovány u psů silné pseudoalergické reakce druhotně způsobující změny kardiovaskulární. Tyto reakce byly považovány za druhově specifické. Játra, ledviny, žaludek, reprodukční orgány, brzlík, slezina a lymfatické uzliny byly cílovými orgány toxicity u opic druhu Cynomolgus při více než 450násobku expozice u lidí. Při více než 100násobku expozice u lidí byla hlavním nálezem u těchto opic iritace žaludku.
Linagliptin a jeho hlavní metabolit nevykázaly genotoxický potenciál
Dvouleté perorální studie kancerogenity u potkanů a myší neodhalily žádný důkaz kancerogenity u potkanů a samců myší. Významně vyšší výskyt maligního lymfomu pouze u samic myší při nejvyšší dávce (> 200násobek expozice u lidí) není považován za významný pro člověka (vysvětlení: ne ve vztahu k léčbě, ale díky vysoce variabilní výchozí incidenci). Na základě těchto studií nejsou žádné obavy z kancerogenity u lidí.
Dávka, při které ještě nebylo možno pozorovat nežádoucí účinky (no observable averse effect level, NOAEL) na plodnost, časný embryonální vývoj a teratogenitu u potkanů, byla stanovena na více než 900násobek expozice u lidí. NOAEL pro toxicitu mateřskou, toxicitu embryofetální a toxicitu u potomstva potkanů byla 49násobkem expozice u lidí. Nebyly pozorovány žádné teratogenní účinky u králíků při více než 1000násobku expozice u lidí. NOAEL ve výši 78násobku expozice u lidí byla odvozena pro embryofetální toxicitu u králíků a pro mateřskou toxicitu byla NOAEL 2,1násobkem expozice u lidí. Proto se považuje za nepravděpodobné, že linagliptin ovlivňuje reprodukci při terapeutických expozicích u lidí.
Lékové interakce
Hodnocení interakcí in vitro
Linagliptin je slabým kompetitivním a slabým až středně silným ireverzibilním inhibitorem izoenzymu CYP3A4, jiné CYP izoenzymy ale neinhibuje. Není induktorem CYP izoenzymů.
Linagliptin je substrátem glykoproteinu P a slabě inhibuje glykoproteinem P zprostředkovaný transport digoxinu. Na základě těchto výsledků a studií interakcí in vivo je považováno za nepravděpodobné, že by linagliptin vedl k interakcím s jinými substráty glykoproteinu P [12].
Hodnocení interakcí in vitro
Účinky dalších léčivých přípravků na linagliptin. Klinické údaje popsané níže naznačují, že riziko klinicky významných interakcí se současně podávanými léčivými přípravky je nízké [12].
Metformin. Opakované podávání metforminu v dávkách 850 mg třikrát denně současně s linagliptinem v dávkách 10 mg jednou denně nevedlo u zdravých dobrovolníků ke klinicky významné změně farmakokinetických vlastností linagliptinu.
Deriváty sulfonylurey. Farmakokinetické vlastnosti linagliptinu podávaného v dávce 5 mg se nezměnily současným podáním jednotlivé dávky 1,75 mg glibenklamidu.
Ritonavir. Současné podání jednotlivé dávky 5 mg linagliptinu a opakovaných perorálních dávek 200 mg ritonaviru, silného inhibitoru glykoproteinu P a CYP3A4, zvýšilo AUC linagliptinu přibližně dvojnásobně a cmax linagliptinu přibližně trojnásobně. Koncentrace na plazmatické bílkoviny nevázané frakce, které jsou obvykle nižší než 1 % terapeutické dávky linagliptinu, byly zvýšeny 4–5krát po současném podávání s ritonavirem. Simulace rovnovážných plazmatických koncentrací linagliptinu s ritonavirem a bez něj naznačily, že zvýšená expozice nebude spojena se zvýšenou akumulací. Tyto změny farmakokinetických vlastností linagliptinu nebyly považovány za klinicky významné. Proto se neočekávají klinicky významné interakce s jinými inhibitory glykoproteinu P a/neboCYP3A4.
Rifampicin. Opakované podávání linagliptinu v dávkách 5 mg s rifampicinem, silným induktorem glykoproteinu P a CYP3A4, vedlo k poklesu AUC o 39,6 % a poklesu cmax o 43,8 % a k přibližně o 30 % snížené inhibici DPP-4 v době minimálních (trough) koncentrací. Plného účinku linagliptinu v kombinaci se silnými induktory glykoproteinu P by tedy nemuselo být dosaženo, zvláště pokud jsou podávány dlouhodobě. Nebylo zkoumáno současné podávání s jinými silnými induktory glykoproteinu P a/nebo CYP3A4, jako je karbamazepin, fenobarbital a fenytoin.
Účinek linagliptinu na jiná léčiva
Jak je uvedeno níže, v klinických studiích neměl linagliptin klinicky významný účinek na farmakokinetické vlastnosti metforminu, glibenklamidu, simvastatinu, warfarinu, digoxinu nebo perorálních antikoncepčních přípravků, což poskytuje in vivo důkaz o nízkém potenciálu linagliptinu vyvolávat lékové interakce se substráty CYP3A4, CYP2C9, CYP2C19, CYP2C8, glykoproteinu P a přenašeče organických kationtů [12].
Metformin. Opakované podávání linagliptinu v dávkách 10 mg denně společně s metforminem, který je substrátem přenašeče organických kationtů, podávaným v dávkách 850 mg, nemělo statisticky ani klinicky významný vliv na farmakokinetické vlastnosti metforminu u zdravých dobrovolníků.
Deriváty sulfonylurey. Opakované podávání linagliptinu v perorální dávkách 5 mg společně s jednotlivou perorální dávkou 1,75 mg glibenklamidu (glyburidu) vedlo ke statisticky i klinicky nevýznamnému 14% snížení AUC i cmax glibenklamidu. Protože glibenklamid je biotransformován primárně CYP2C9, tyto údaje také podporují závěr, že linagliptin není inhibitorem CYP2C9. Klinicky významné interakce se neočekávají s jinými deriváty sulfonylurey (například glipizidem, tolbutamidem a glimepiridem), které jsou podobně jako glibenklamid primárně eliminovány prostřednictvím CYP2C9.
Digoxin. Opakované podávání linagliptinu v dávkách 5 mg spolu s opakovanými dávkami digoxinu ve výši 0,25 mg nemělo žádný statistický i klinický vliv na farmakokinetické vlastnosti digoxinu u zdravých dobrovolníků.
Warfarin. Opakované dávky linagliptinu ve výši 5 mg nezměnily farmakokinetické vlastnosti S(-) nebo R(+)-warfarinu, který je substrátem CYP2C9 a CYP2C19, a to po podání warfarinu v jednorázové dávce.
Simvastatin. Opakované dávky linagliptinu ve výši 10 mg měly u zdravých dobrovolníků minimální účinek na farmakokinetické vlastnosti simvastatinu podávaného v dávkách 40 mg (AUC simvastatinu zvýšila o 34 % a cmax zvýšila o 10%).
Perorální kontraceptiva. Podávání linagliptinu v dávkách 5 mg nezměnilo farmakokinetické vlastnosti současně podávané kombinace levonorgestrelu (0,15 mg) nebo ethinylestradiolu (0,03 mg).
Těhotenství a kojení
Těhotenství
Užívání linagliptinu u těhotných žen nebylo studováno. Studie reprodukční toxicity na zvířatech nenaznačují přímé nebo nepřímé škodlivé účinky. Podávání v těhotenství se z preventivních důvodů nedoporučuje.
Kojení
Dostupné farmakokinetické údaje u zvířat prokázaly vylučování linagliptinu a jeho metabolitů do mateřského mléka. Riziko pro kojené dítě nelze vyloučit. Po zvážení přínosu kojení pro dítě a přínosu léčby pro kojící ženu je třeba učinit rozhodnutí, zda přerušit kojení, nebo pozastavit či ukončit léčbu linagliptinem.
Fertilita
S linagliptinem nebyly provedeny žádné studie účinků na plodnost u lidí. Studie na zvířatech nesvědčí pro přímé nebo nepřímé škodlivé účinky, pokud jde o plodnost.
Ovlivnění pozornosti
Nebyly provedeny žádné studie účinků na schopnost řízení a obsluhy strojů. Nicméně pacienti by měli být upozorněni na riziko hypoglykemie, zejména při podávání linagliptinu v kombinaci s deriváty sulfonylurey.
Dávkování
Obvyklá dávka linagliptinu je 5 mg jednou denně. Pokud je linagliptin přidán k metforminu, dávkování metforminu je nutno zachovat v původní výši a linagliptin podávat současně. Pokud je linagliptin podáván v kombinaci se sulfonylureou, lze zvážit nižší dávku sulfonylurey z důvodu snížení rizika vzniku hypoglykemie [12].
Zvláštní populace
Porucha funkce ledvin. U pacientů s poruchou funkce ledvin není nutná žádná úprava dávky linagliptinu.
Porucha funkce jater. Studie farmakokinetických vlastností linagliptinu ukazují, že není nutná úprava jeho dávek u pacientů s poruchou funkce jater, ale klinické zkušenosti u takových pacientů dosud chybí.
Starší pacienti. Není nutná žádná úprava dávky s ohledem na věk. Klinické zkušenosti u pacientů starších 75 let jsou však omezené.
Pediatrická populace. Bezpečnost a účinnost linagliptinu u dětí a dospívajících nebyla dosud stanovena. Nejsou dostupné žádné údaje.
Způsob podání
Linagliptin lze užívat kdykoliv v průběhu dne spolu s jídlem nebo bez jídla. Pokud je jednotlivá dávka opomenuta, je třeba ji užít ihned, jakmile si na ni pacient vzpomene. Nelze užívat dvojnásobnou dávku v týž den.
Předávkování
Během kontrolovaných klinických studií u zdravých jedinců byly obecně dobře tolerovány jednotlivé dávky až do 600 mg linagliptinu (což odpovídá 120násobku doporučené dávky). U lidí nejsou žádné zkušenosti s dávkami vyššími než 600 mg.
V případě předávkování je vhodné provést obvyklá podpůrná opatření, například odstranit nevstřebané léčivo z gastrointestinálního traktu, zajistit klinické monitorování a zahájit klinická opatření, pokud jsou nutná.
Balení
Léčivý přípravek Trajenta® obsahuje potahované tablety s 5 mg linagliptinu.
Podpořeno MZOVFN2005.
Seznam použité literatury
- [1] Tradjenta, Prescribing information. http://www. drugs.com/pro/tradjenta.html Accessed 23 October 2011.
- [2] Ahrén B. Gut peptides and type 2 diabetes mellitus treatment. Curr Diab Rep 2003; 3: 365–372.
- [3] Drucker DJ. The biology of incretin hormones. Cell Metabolism 2006; 3: 153–165.
- [4] Heise T, Graefe-Mody EU, Hüttner S, et al. Pharmacokinetics, pharmacodynamics and tolerability of multiple oral doses of linagliptin, a dipeptidyl peptidase-4 inhibitor in male type 2 diabetes patients. Diabet Obes Metab 2009; 11: 786–794.
- [5] Drucker DJ. Therapeutic potential of dipeptidyl peptidase IV inhibitors for the treatment of type 2 diabetes. Expert Opin Investig Drugs 2003; 12: 87–100.
- [6] Thomas L, Eckhardt M, Langkopf E, et al. (R)-8-(3-Amino-piperidin-1-yl)-7-but-2-ynyl-3-methyl-1-(4-methylquinazolin-2-ylmethyl)-3,7-dihydropurine-2,6-dione (BI 1356), a novel xanthine-based dipeptidyl peptidase 4 inhibitor, has a superior potency and longer duration of action compared with other dipeptidyl peptidase-4 inhibitors. J Pharmacol Experimental Therapeut 2008; 325: 175–182.
- [7] Scott LJ. Linagliptin: in type 2 diabetes mellitus. Drugs 2011; 71: 611–624.
- [8] Blech S, Ludwig-Schwellinger E, Gräfe-Mody EU, et al. The metabolism and disposition of the oral dipeptidyl peptidase-4 inhibitor, linagliptin, in humans. Drug Metab Dospod 2010; 38: 667–678.
- [9] Graefe-Mody U, et al. A randomized, open-label, crossover study evaluating the effect of food on the relative bioavailability of linagliptin in healthy subjects. Clin Ther 2011; 33: 1096–1103.
- [10] Scheen AJ. Dipeptidylpeptidase-4 inhibitors (gliptins): focus on drug-drug interactions. Clin Pharmacokinet 2010; 49: 573–588.
- [11] Graefe-Mody U, Friedrich C, Port A, et al. Effect of renal impairment on the pharmacokinetics of the dipeptidyl peptidase-4 inhibitor linagliptin. Diabetes Obes Metab 2011; 13: 939–946.
- [12] Trajenta, Summary of product characteristics. http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_- _Product_Information/ human/002110/WC500115745.pdf Accessed 23 October 2011.
- [13] Del Prato S, Barnett AH, Huisman H, et al. Effect of linagliptin monotherapy on glycaemic control and markers of _-cell function in patients with inadequately controlled type 2 diabetes: a randomized controlled trial. Diabetes Obes Metab 2011; 13: 258–267.
- [14] Taskinen MR, Rosenstock J, Tamminen I, et al. Safety and efficacy of linagliptin as add-on therapy to metformin in patients with type 2 diabetes: a randomized, double-blind, placebo-controlled study. Diabetes Obes Metab 2011; 13: 65–74.
- [15] Owens DR, Swallow R, Dugi KA, Woerle HJ. Efficacy and safety of linagliptin in persons with Type_2 diabetes inadequately controlled by a combination of metformin and sulphonylurea: a 24-week randomized study(1). Diabet Med 2011. doi: 10.1111/j.1464-5491.2011.03387.x. [Epub ahead of print].
- [16] Gallwitz B, Uhlig-Laske B, Bhattacharaya S, et al. Linagliptin has Similar Efficacy to Glimepiride but Improved Cardiovascular Safety over 2 Years in Patients with Type 2 Diabetes Inadequately Controlled on Metformin 71th Scientific Sessions of the American Diabetes Association, San Diego, California. 2011; Poster 39-LB.
- [17] Sloan L, Newman J, Sauce C, et al. Safety and Efficacy of Linagliptin in Type 2 Diabetes Patients with Severe Renal Impairment. 71th Scientific Sessions of the American Diabetes Association, San Diego, California. 2011; Poster 413-PP.
- [18] Johansen OE, Neubacher D, von Eynatten M, et al. Cardiovascular risk with linagliptin in patients with type 2 diabetes: A pre-specified, prospective, and adjudicated meta-analysis from a large phase III program. American Diabetes Association 2011 Scientific Sessions; June 27, 2011; San Diego, CA. Abstract 0030-LB.
- [19] Deacon CF. Dipeptidyl peptidase-4 inhibitors in the treatment of type 2 diabetes: a comparative review. Diabetes Obes Metab 2011; 13: 7–18.
- [20] Onglyza, Summary of product characteristics. http: //www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_Product_Information/human/ 001039/WC500044316.pdf Accessed 23 October 2011.
- [21] Onglyza, Summary of product characteristics. http://www.drugs.com/pro/onglyza.html Accessed 23 October 2011.
- [22] Scherntharner G, von Eynatten M, Emser A, Woerle H-J. Safety and Tolerability of Linagliptin: A Pooled Analysis of Data from 3572 Patients with Type 2 Diabetes. American Diabetes Association, 71st Scientific Sessions, San Diego, CA, June 24–28, 2011; 2327-PO.