Pramipexol
Pramipexol je řazen mezi non-ergolinové agonisty dopaminu, jeho struktura není odvozena od struktury námelových alkaloidů. Selektivně působí na rodinu D2-dopaminových receptorů (D2, D3, D4). Pramipexol se velice snadno vstřebává, v organismu se minimálně metabolizuje, vylučuje se převážně ledvinami. Jeho biologický poločas se pohybuje okolo 11 hodin. Indikován je jako monoterapie v časných stadiích Parkinsonovy nemoci k oddálení nutnosti užívání levodopy, jako přídatná terapie v pozdních stadiích Parkinsonovy nemoci u různých typů hybných komplikací a nově i k potlačení příznaků restless legs syndromu. U pacientů léčených pramipexolem se častěji vyskytly halucinace (13 % v 5 % placebo), somnolence (15 % v 6 %) a gastrointestinální obtíže (nauzea, zácpa). Léčba pramipexolem se zahajuje dávkou 0,264 mg/den (3 x 0,088 mg) v prvním týdnu a postupně se zvyšuje na 0,546 mg/den (3 x 0,18 mg) v 2. týdnu a dále o 0,54 mg/den do doby, než nastane klinická reakce, nebo do doby, než je dosaženo maximální denní dávky 3,3 mg. V případě restless legs syndromu je doporučováno dávkování 0,088–0,54 mg pramipexolu 2–3 hodiny před spaním.
Farmakologická skupina
Antiparkinsonikum, non-ergolinový agonista dopaminu, ATC N04BC05.
Chemické a fyzikální vlastnosti
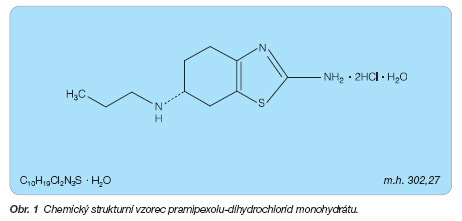
Pramipexol je chemicky (S)-2-amino-4,5,6,7-tetrahydro-6-(propylamino)benzothiazol. V léčivých přípravcích je obsažen ve formě monohydrátu pramipexol-dihydrochloridu (obr. 1).
Sumární vzorec:
C10H17N3S (pramipexol)
C10H19Cl2N3S . H2O (pramipexol-dihydrochlorid monohydrát)
Molekulová hmotnost:
211,33 (pramipexol)
302,27 (pramipexol-dihydrochlorid monohydrát)
Přibližně 1,43 mg pramipexol-dihydrochloridu monohydrátu odpovídá 1 mg báze pramipexolu (0,125 mg pramipexol-dihydrochloridu monohydrátu odpovídá 0,088 mg pramipexolu).
Pramipexol-dihydrochlorid monohydrát je bílý nebo téměř bílý prášek, snadno rozpustný ve vodě, dobře rozpustný v methanolu, těžce rozpustný v ethanolu a prakticky nerozpustný v dichlormethanu.
Mechanismus účinku, farmakodynamika
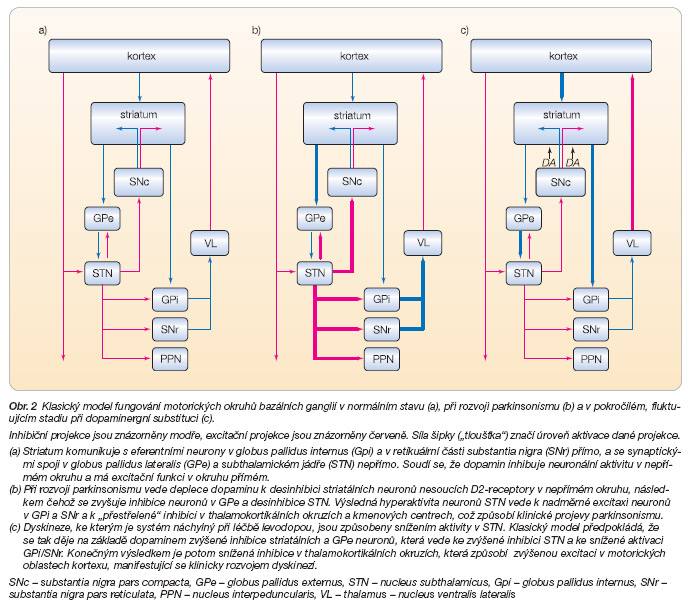
Volní i mimovolní pohyby podléhají komplikované přípravě a kontrole nervovými okruhy. U Parkinsonovy nemoci má rozhodující význam selhání regulace v oblasti bazálních ganglií. Mozková kůra vysílá impulzy k neuronům ve striatu. Striatální neurony pak inhibují další neurony v globus pallidus. Odsud vedou GABAergní inhibiční projekce do motorických oblastí thalamu, anebo probíhají smyčkou přes nucleus subthalamicus. Výsledkem fungování popsaných okruhů je krátkodobé „odbrzdění" neuronů v motorické části thalamu, které působí neuronální excitaci v premotorických oblastech kortexu. Tato stimulace je předpokladem plynulého a koordinovaného pohybu. Snížené uvolňování dopaminu ve striatu následkem degenerace neuronů vedoucích sem ze substantia nigra pars compacta vyvolá rostoucí excitaci GABA-neuronů směřujících své axony ke globus pallidus externus. Tím se zvýší frekvence výbojů GABAergních (inhibičních) projekčních neuronů jader bazálních ganglií. Výsledná vyšší inhibice projekčních jader v thalamu (nucleus ventralis anterior) snižuje excitaci v premotorické mozkové kůře a zvláště v suplementární motorické areji. Tato porucha je pravděpodobně podstatou akineze či hypokineze u Parkinsonovy nemoci. Klidový tremor a zvýšení svalového tonu (rigor) vznikají potom spíše v důsledku poruch neuronální regulace v mozkovém kmeni a míše, kam komplex globus pallidus/substantia nigra pars reticulata také inhibičně projikuje (obr. 2) [1, 2].
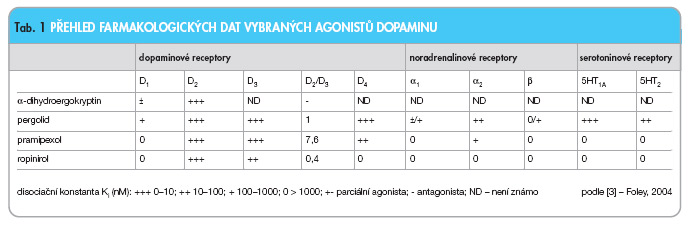
Pramipexol je perorálně účinný non-ergolinový agonista dopaminu. Studie uskutečněné in vitro i in vivo potvrdily, že pramipexol je pre- i postsynaptický agonista D2-podskupiny dopaminových receptorů (patří sem receptorové subtypy D2, D3, D4). Receptory D1-podskupiny (D1, D5) neovlivňuje stejně tak jako další receptory v centrálním nervovém systému. Ve studiích in vitro byla prokázána větší afinita pramipexolu k receptorům D3 než k receptorům D2 (tab. 1) [3, 4].
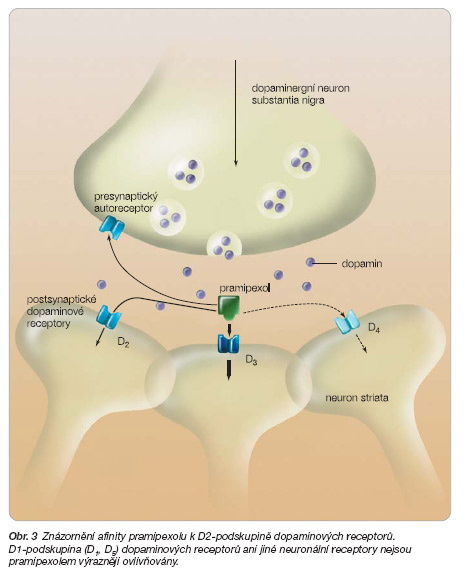
Vzhledem k progredující degeneraci presynaptických dopaminergních neuronů se předpokládá, že za účinek je zodpovědná především vazba na postsynaptické receptory D2 a D3 (obr. 3) [5, 6].
Neuroprotektivní účinky
Četné experimentální studie hodnotily neuroprotektivní vlastnosti pramipexolu. Ling a kol. pozorovali schopnost pramipexolu bránit odumření embryonálních mezencefalických buněk způsobenému toxicitou levodopy. V tomto systému pramipexol indukoval expresi autotrofního proteinu, který bránil oxidačnímu stresu buňky [7]. Kitamura a kol. simulovali neuronální degeneraci jako u Parkinsonovy nemoci pomocí působení N-methyl-4-fenyl-pyridinia na buňky neuroblastomu SH-SY5Y. Preinkubace buněk pramipexolem bránila jejich buněčné smrti [8]. Podobné výsledky byly zjištěny i na zvířecím modelu. Protektivní účinky byly sledovány, jen pokud byl opicím podán pramipexol před působením toxinu [9]. Izumi a kol. v recentní studii pozorovali na mezencefaliálních neuronech, že glutamát jako excitotoxin zapříčinil selektivní neuronální dopaminergní buněčnou smrt v závislosti na obsahu dopaminu v neuronu. Pramipexol v této studii chránil dopaminergní neurony před neurotoxicitou glutamátu redukcí obsahu dopaminu v neuronu nezávisle na aktivaci dopaminových receptorů podskupiny D2 [10].
Ověřit neuroprotektivní působení pramipexolu v klinické praxi měla za cíl studie CALM-PD-CIT [11]. V této randomizované dvojitě slepé studii bylo rozděleno 82 pacientů v časné fázi PN do skupiny léčené levodopou (n = 40) a pramipexolem (n = 42). Rozsah degenerace dopaminových neuronů byl monitorován pomocí jednofotonové emisní počítačové tomografie (SPECT). Jako marker funkce striatálních neuronů byla použita látka 123I b-CIT. Po 46 měsících bylo pozorováno snížení uptake 123I b-CIT o 16 % ve skupině pramipexolu oproti 25,5% snížení ve skupině léčené levodopou. Studie vyvolala četné diskuse o jejích limitech. Diskutovalo se např. o tom, zda rozdíl ve výsledcích na konci studie nezapříčinilo spíše neurotoxické působení levodopy než neuroprotektivní působení pramipexolu, zda počítačová tomografie je vhodnou metodou pro sledování degenerace neuronů (dle definice sleduje biochemické markery, ne přímo degeneraci neuronu) apod. [3, 12]. Proto není teorie neuroprotektivního působení dopaminových agonistů dosud obecně přijata [13, 14].
Farmakokinetické vlastnosti
Pramipexol vykazuje v terapeutických dávkách lineární farmakokinetiku. Nástup účinku je viditelný po 2 hodinách od jednorázového podání. Účinek přetrvává 8 hodin. Maximálního účinku je dosaženo až po 2–4 týdnech pravidelného užívání pramipexolu.
Po perorálním užití je rychle absorbován, maximálních koncentrací v plazmě dosahuje již po 2 hodinách od podání (tab. 2).
Ustálených koncentrací při pravidelném podávání dosahuje po 2 dnech. Biologická dostupnost přesahuje 90 %. Současný příjem potravy může prodloužit délku vstřebávání, avšak nikoli rozsah. Ve studii se zdravými dobrovolníky vykazoval pramipexol o třetinu vyšší plazmatické koncentrace a plochu pod křivkou (AUC) u postmenopauzálních žen oproti mužům. Pramipexol se jen z malé části váže na plazmatické bílkoviny (15 %), má velký distribuční objem (500 l). V organismu dochází k minimálnímu metabolismu, z 90 % je vylučován ledvinami, a proto je při snížené funkci ledvin nutno přiměřeně redukovat dávku. Biologický poločas eliminace se pohybuje v rozmezí 8–14 hodin, ve stáří se může až o 40 % prodloužit [15]. Pramipexol není odstraněn z těla hemodialýzou (< 9 % dávky) [16].
Klinické zkušenosti
Parkinsonova nemoc
Účinnost v klinických studiích byla nejčastěji hodnocena pomocí stupnice UPDRS (The Unified Parkinson´s Disease Rating Scale), která má čtyři části.
I. duševní činnost, chování, nálada;
II. aktivity denního života (ADL) – řeč, polykání, hygiena, oblékání apod.;
III. motorické funkce – rychlost řeči, mimika obličeje, klidový třes, držení těla apod.;
IV. komplikace terapie – přítomnost a rozsah dyskinezí, fluktuací a dalších komplikací.
Studie, které by srovnávaly účinnost jednotlivých dopaminových agonistů navzájem, dosud chybějí [3].
Časná fáze Parkinsonovy nemoci
Látky nazývané agonisté dopaminu byly uvedeny na trh jako adjuvantní terapie levodopy u pacientů v pozdní fázi PN. Novější klinické studie hodnotily schopnost agonistů dopaminu bránit příznakům nemoci, oddálit tím nutnost prvního podání levodopy, a tím oddálit pozdní motorické komplikace léčby levodopou.
Hubbleová a spolupracovníci provedli 9týdenní randomizovanou studii s 55 nově diagnostikovanými pacienty trpícími PN (průměrný věk 63 let). Dávka pramipexolu byla postupně titrována maximálně do 4,5 mg/den. Účinnost byla hodnocena pomocí UPDRS II a III. Výsledky ukázaly větší benefit léčby pramipexolem oproti placebové větvi (změna UPDRS II 5,19 v 2,16 placebo, p < 0,002; UPDRS III 11,97 v 8,31, avšak statisticky nevýznamně) [17].
Lékaři z neurologických center v USA a Kanadě sdružení v organizaci Parkinson Study Group zkoumali účinnost pramipexolu v randomizované dvojitě slepé studii, do níž bylo zařazeno 264 pacientů s nově diagnostikovanou PN. Pacienti byli randomizováni celkem do 5 skupin (4 dle dávkování pramipexolu, 1 placebo). Cílem studie bylo sledovat změny v UPDRS skóre po 10 týdnech podávání pramipexolu (dávkování bylo titrováno max. 6 týdnů). Na konci studie vykazovali pacienti léčení pramipexolem zlepšení skóre UPDRS o 20 %. Průměrné změny skóre ve skupině pramipexolu se pohybovaly v rozmezí 5,9–7 jednotek v 0,9 jednotek v placebové skupině [18].
Shannon a kol. uspořádali randomizovanou placebem kontrolovanou studii s 355 pacienty v časné fázi PN. Pramipexol byl titrován 7 týdnů, po kterých následovalo dalších 24 týdnů terapie. Primárním cílem studie bylo zjistit rozdíly ve skóre UPDRS II a III mezi léčebnými skupinami. Pramipexol (střední dávka 3,8 mg/den) redukoval závažnost příznaků PN ve všech sledovaných parametrech. UPDRS ADL pokleslo z 8,2 na začátku studie na 6,4 jednotek na konci studie. V placebové skupině došlo k růstu skóre z 8,3 na 8,7 jednotek (rozdíl účinnosti pramipexol v placebo, p < 0,0001). Podobně UPDRS III pokleslo po léčbě pramipexolem z 18,8 na začátku studie na 14,1 jednotek, zatímco ve skupině placeba skóre vzrostlo (p < 0,0001) [19].
Po potvrzení krátkodobé účinnosti pramipexolu byl výzkum zaměřen na ověření jeho dlouhodobé účinnosti u pacientů v časné fázi PN. Hlavním sledovaným parametrem bylo prodloužení doby do vzniku motorických komplikací spojených s dopaminergní léčbou, jako je "wearing off", dyskineze, "on-off" fluktuace ve srovnání s terapií levodopou.
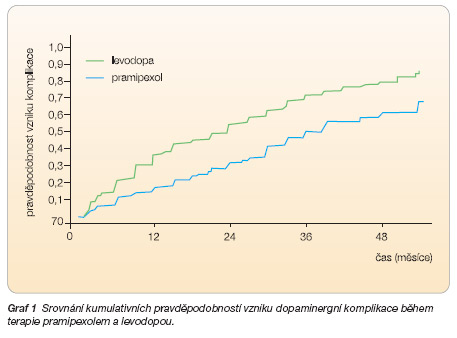
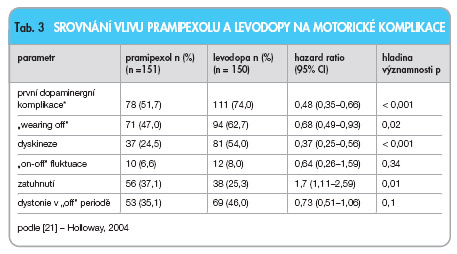
Největší studie byla provedena opět pod záštitou Parkinson Study Group [20, 21]. Pacienti byli randomizováni do skupiny léčené pramipexolem (0,5 mg 3krát denně, n = 151) a levodopou/karbidopou (25/100 mg 3krát denně, n = 150). Dávkování mohlo být v případě přetrvávajících obtíží zvýšeno. Od 11. týdne studie mohla být ve skupině pramipexolu přidána k léčbě "nezaslepeně" levodopa. Primárním cílem bylo sledovat procento pacientů s motorickými komplikacemi, sekundárními cíli zůstalo skóre UPDRS, dále bylo analyzováno: ovlivnění kvality života (škála Parkinson´s Disease Quality-of-Life PDQUALIF a EuroQal Visual Analog Scale, VAS), nežádoucí účinky léčby a u podskupiny pacientů utilizace dopaminu v mozku metodou SPECT. Po 23,5 měsících studie došlo ve skupině pramipexolu k motorickým komplikacím u 28 % pacientů oproti 51 % pacientů léčených levodopou (hazard ratio 0,45; 95% CI 0,3–0,66). UPDRS skóre však bylo výrazněji zlepšeno ve skupině léčené levodopou (9,2 v 4,5 jednotek). Po čtyřech letech PN progredovala, počet komplikací se zvýšil, nicméně relativní rozdíly ve sledovaných parametrech zůstaly zachovány. Dopaminergní komplikaci (primární cíl studie) prožilo 51,7 % pacientů ve skupině pramipexolu a 74 % pacientů ve skupině levodopy (HR: 0,48; 95% CI: 0,35–0,66). Kumulativní pravděpodobnost dopaminergních komplikací během studie viz graf 1.
Zajímavým nálezem je zvýšený počet zatuhnutí („freezing") ve skupině pramipexolu (tab. 3).
Celkové UPDRS skóre se oproti počátečním hodnotám ve skupině léčené pramipexolem zhoršilo (-3,2 jednotek), ve skupině, které byla podávána levodopa, přetrvávalo mírné zlepšení (2,0).
Pozdní fáze Parkinsonovy nemoci
V pozdní fázi Parkinsonovy nemoci se projevují nežádoucí účinky léčby levodopou – abnormální mimovolní pohyby (dyskineze), bolestivé křeče v končetinách (dystonie), zkrácené odpovědi na léčbu ("wearing-off" fenomén), "on-off" fluktuace. Právě snaha o ovlivnění těchto projevů vedla k vývoji dopaminových agonistů.
Odpověď na otázku, zda je pramipexol účinnější než placebo u pacientů dlouhodobě léčených levodopou s projevujícími se komplikacemi léčby, se pokusil přinést Clarke a kol. v systematickém review [22]. Stanovená kritéria splnily 4 studie zahrnující celkem 669 pacientů. Během terapie pramipexolem došlo ke zkrácení "off" stavu oproti placebu průměrně o 1,8 hodin (95% CI: 1,2–2,3 hod/den). Významný rozdíl v UPDRS ADL skóre ve prospěch pramipexolu byl potvrzen ve všech studiích. Zlepšení motorických funkcí (UPDRS III) bylo pozorováno ve třech studiích. Podání pramipexolu umožnilo snížit dávku levodopy v průměru o 115 mg (95% CI: 87–143 mg/den). Doba trvání studií nepřesáhla 24 týdnů. K podobným výsledkům dospěla i randomizovaná dvojitě slepá studie Mollera a kol. s 354 pacienty (174 nemocných dostávalo pramipexol) trvající 32 týdnů. Léčba pramipexolem zlepšila skóre UPDRS II a III o 30 %, zkrátila "off" stav o 2,5 hod/den, pozitivně ovlivněna byla i duševní činnost (UPDRS I). Studie dále pokračovala v otevřené fázi. I po třech letech od začátku celé studie dokázala terapie pramipexolem snížit celkové skóre UPDRS II–IV o 11 % oproti počátečním hodnotám [23].
Syndrom neklidných nohou
V klinických studiích se od roku 2003 hodnotí nejen lékařem pozorované zlepšení syndromu neklidných nohou (restless legs syndrome – RLS) či polysomnografické ukazatele během pobytu ve spánkové laboratoři, ale v úvahu se bere i pohled pacienta, vyjádřený vyplněným validizovaným dotazníkem (IRLS) vypracovaným Mezinárodní skupinou pro studium restless legs syndromu [24].
První studií hodnotící účinnost pramipexolu v léčbě RLS byla studie Mont-plaisira a kol. z roku 1999. Večerní dávka ≤ 0,75 mg pramipexolu zlepšila během 1 měsíce nejen hodnocení léčby pacienty v dotaznících, ale i objektivní ukazatele pohybu nohou a nočního buzení měřené ve spánkové laboratoři. Účinnost léčby pramipexolem byla sledována i po ukončení studie a byla prokázána i po 7 měsících [25, 26]. Účinné byly v jiné studii i dávky 0,27 mg pramipexolu [27]. Krátkodobý účinek pramipexolu byl sledován v třítýdenní studii PRELUDE [28]. Studie se účastnilo 109 pacientů se středně těžkým či těžkým RLS. Sledovány byly polysomnografické ukazatele a pacientem či lékařem hodnocené zlepšení stavu pomocí dotazníků. Ve skupinách léčených pramipexolem (0,125–0,75 mg/den) hodnotilo zlepšení stavu na škále IRLS jako "o mnoho lepší" 50–77,3 % pacientů oproti 38 % nemocných užívajících placebo. Podobné hodnocení vykazovali i lékaři (62–86 % pacientů léčených pramipexolem oproti 43 % nemocných užívajících placebo). Index periodických pohybů nohou (periodic limb movements during time in bed index – PLMI) během pobytu ve spánkové laboratoři byl nejvíce snížen v dávkách 0,25 mg/ den pramipexolu (-1,93) oproti placebu.
Dlouhodobější účinnost a bezpečnost pramipexolu v terapii RLS byla sledována ve studii PIRLS [29]. Studie trvala 12 týdnů, během nichž bylo 344 pacientů s RLS rozděleno do 4 skupin (placebo, 0,25 mg, 0,50 mg a 0,75 mg pramipexolu/den). Titrace dávek trvala úvodní tři týdny. Na konci studie byl zjištěn pokles průměrných hodnot IRLS škály o 9,3 ve skupině placeba, o 12,8 ve skupině pramipexolu 0,25 mg/den, o 13,8 ve skupině pramipexolu 0,50 mg pramipexolu/den a o 14 ve skupině pramipexolu 0,75 mg/den (vše p < 0,01 oproti placebu). Jako o mnoho lepší hodnotili lékaři stav u zhruba 70 % pacientů léčených pramipexolem, nicméně velké zlepšení bylo pozorováno též u 50 % pacientů léčených placebem.
Zařazení do palety léčiv
Parkinsonova nemoc
Základní farmakoterapeutický přístup v léčbě PN představuje levodopa. V současné době je dostupná v kombinaci buď pouze s inhibitory dekarboxylázy (benserazid, karbidopa), které neprocházejí hematoencefalickou bariérou a zabraňují periferní degradaci levodopy, a zvyšují tím její dostupnost v mozku, anebo ještě navíc s inhibitorem COMT (entakapon), který hematoencefalickou bariérou také neprochází. Levodopa je v mozku dekarboxylázami metabolizována na dopamin. Inhibitory monoaminooxidázy typu B (selegilin, rasagilin) zabraňují odbourávání dopaminu v synaptické štěrbině. Prodlužují tak působení dopaminu, především na postsynaptických receptorech. Inhibitory katechol-O-methyltransferázy (COMT – entakapon, tolkapon) brání metabolismu levodopy v periferních tkáních, ale i v mozku. Při terapii kombinací levodopa + inhibitor dekarboxylázy je zvýrazněna degradace levodopy cestou COMT. Proto se jeví výhodným terapeutickým přístupem léčby PN kombinace levodopy s inhibitory karboxylázy i COMT v jedné tabletě. Amantadin byl původně objeven jako antivirotikum, teprve náhodné použití u pacientů s PN odhalilo jeho příznivý vliv především na rigiditu a akinezi. Perorální forma může být užita v monoterapii v časných fázích PN. Podání infuzního amantadinu se ukázalo jako účinné v pozdních fázích nemoci, kdy vyrovnává hlavně kolísající hybnost. Význam léčiv s anticholinergním účinkem (benzatropin, biperiden, procyklidin) je v poslední době omezen na použití u mladých pacientů v časné fázi PN s převažujícím třesem bez kognitivní dysfunkce a u parkinsonského syndromu navozeného léky. Jejich použití limitují též relativně časté nežádoucí účinky – sucho v ústech, žízeň, obstipace, poruchy mikce, halucinace apod. Agonisté dopaminu (DA) jsou skupinou léčiv, která prošla především v 90. letech výrazným rozvojem. Starší látky mají strukturu podobnou námelovým alkaloidům (ergolinové deriváty), v ČR jsou zastoupeny pergolidem a dihydroergokryptinem. Novější léčiva již nejsou odvozena od ergolinové struktury, v ČR jsou zastoupena pramipexolem a ropinirolem. Původní indikací DA bylo jejich společné podávání s levodopou v pozdních stadiích PN s cílem snížit výskyt motorických fluktuací. Důkazy posledních let favorizují DA jako monoterapii v časných stadiích PN. Monoterapie agonisty v začátku onemocnění potlačuje symptomy onemocnění. Jejich účinnost však postupně klesá a je nutno indikovat terapii levodopou. Oddálení terapie levodopou, či alespoň snížení jejího dávkování pomocí DA je vhodné např. kvůli neurotoxickému působení levodopy či snížení intenzity a frekvence dyskinezí zmiňovaných některými autory. Důkazy srovnávající klinickou účinnost jednotlivých DA zatím nejsou dostatečné, volba DA tedy závisí spíše na zkušenosti lékaře s konkrétní látkou, na profilu nežádoucích účinků a v neposlední řadě i na ekonomických faktorech. Apomorfin má specifické postavení mezi DA, je podáván s.c. autoinjektorem nebo pumpou v pozdních fázích PN ke zmírnění těžkých fluktuací nebo dyskinezí [30, 31].
Syndrom neklidných nohou
Syndrom neklidných nohou (restless legs syndrome) je charakterizován nucením k pohybu končetinami spojenému s nepříjemnými paresteziemi (pálením, svíráním, mravenčením apod.) projevujícími se hlavně v klidu a přechodně mizejícími s pohybem končetin. Charakteristický je i cirkadiánní výskyt potíží, nejčastěji večer a v noci, dochází tedy např. k poruchám spánku [32].
V terapii tohoto syndromu je nejdříve vhodné léčit faktory, které mohou tento syndrom sekundárně navodit. Nejčastější příčinou RLS je nedostatek železa, který lze jeho substitucí odstranit, a tím odstranit i příznaky RLS. Pokud není zjištěna příčina, je první volbou léčby levodopa. Avšak po delší době léčby dochází k tzv. augmentaci, kdy se obtíže přesunují do odpoledních hodin. Agonisté dopaminu mohou být též léky první volby, augmentace u nich nebyla zatím pozorována. Pokud obtíže přetrvávají, lze k léčbě dopaminovými agonisty přidat opiáty, benzodiazepiny či některá antiepileptika (gabapentin, valproát) [33].
Indikace
Pramipexol je určen k léčbě projevů a příznaků idiopatické Parkinsonovy nemoci. V časné fázi PN může být podáván v monoterapii. Jeho užívání redukuje symptomy nemoci a oddaluje nutnost zahájení léčby levodopou. V pozdní fázi PN je vhodné přidání pramipexolu ke stávající léčbě levodopou, pokud účinek levodopy slábne nebo se objevuje kolísání léčebného efektu („on-off" fluktuace).
Pramipexol lze podávat k symptomatické léčbě středně těžkého až těžkého idiopatického syndromu neklidných nohou (RLS) v dávkách až 0,54 mg báze (0,75 mg soli).
Indikace pramipexolu k léčbě deprese, panické poruchy a schizofrenie jsou zatím pouze předmětem výzkumu.
Kontraindikace
Kontraindikací je přecitlivělost ke složkám obsaženým v přípravku. Pramipexol není doporučován těhotným ženám (kategorie C dle FDA). Na zvířecím modelu bránil pramipexol nidaci vajíčka, snižoval hladinu prolaktinu a podporoval resorpci embrya. Zatím nebyla provedena žádná pozorování týkající se podání pramipexolu těhotným ženám. Soudí se též, že pramipexol kvůli dopaminergní aktivitě snižuje produkci mléka [16].
Nežádoucí účinky
Analýza nežádoucích účinků pramipexolu byla provedena na základě klinických studií, které zahrnovaly 782 pacientů léčených pramipexolem a 633 pacientů užívajících placebo. Abnormality vidění hlásila 3 % pacientů léčených pramipexolem oproti 0,4 % u kontrolního souboru. Zvýšený počet dyskinezí na začátkou konkomitantní terapie s levodopou může být vysvětlen pramipexolem indukovanou absorpcí levodopy.
Nejčastějšími důvody ukončení terapie pramipexolem v klinických studiích byly halucinace (2,7 % v 0,4 % placebo), nauzea (1,4 % v 0,7 %), hypotenze (1 % v 0,5 %) a somnolence (1,3 % v 0,2 %). V placebové větvi byly nejčastějším důvodem ukončení terapie extrapyramidové symptomy (5,5 % v 1,4 % pramipexol) a "nulový efekt léčiva" (1,3 % v 0,1 % pramipexol).
Většina nežádoucích účinků se vyskytovala v podobné míře v léčené i placebové větvi. U pacientů léčených pramipexolem se častěji vyskytly halucinace (13 % v 5 % placebo), somnolence (15 % v 6 %) a gastrointestinální obtíže (nauzea, zácpa). V postmarketingových sledováních se objevily případy náhlého upadnutí do spánku [34].
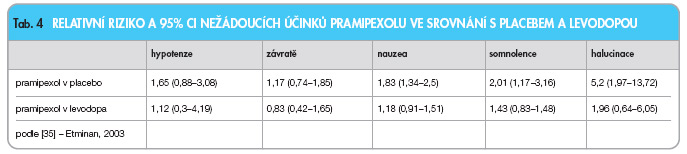
Metaanalýza nežádoucích účinků v klinických studiích s pramipexolem odhalila především zvýšené relativní riziko vzniku halucinací (tab. 4) [35].
Interakce
Pramipexol se jen z malé části (méně než 10 %) biotransformuje v játrech a z organismu se vylučuje převážně v nezměněné formě. Pramipexol neovlivňuje aktivitu jednotlivých izoenzymů cytochromu P-450 a není jejich inhibitorem nebo induktorem [36]. Pramipexol se přibližně z 90 % vylučuje močí v nezměněné formě, a to tubulární sekrecí prostřednictvím transportního systému bazických léčiv (kationů) v ledvinách. Inhibitory tohoto transportního systému (např. cimetidin nebo ranitidin) zvyšují nebo mohou zvyšovat expozici pramipexolu [36].
V dosud nepublikované studii uskutečněné výrobcem pramipexolu u 12 pacientů s Parkinsonovou nemocí léčených pramipexolem vedlo podávání cimetidinu v dávkách 300 mg 4krát denně ke zvýšení plochy pod křivkou pramipexolu o 50 % a k prodloužení jeho biologického poločasu o 40 % [36]. Slabý inhibitor tubulární sekrece organických bází (kationů) probenecid zvyšuje plochu pod křivkou pramipexolu jen statisticky nevýznamně (zvýšení o 10 %).
Současné podávání kombinace levodopy s karbidopou a pramipexolu v dávkách 1,5 mg 3krát denně 10 zdravým dobrovolníkům nevedlo ke změnám farmakokinetických parametrů pramipexolu [37]. Došlo však ke zvýšení maximálních plazmatických koncentrací levodopy o 40 % a ke zkrácení času nutného k jejich dosažení z 2,5 hodiny na 0,5 hodiny. Dávky levodopy je obvykle třeba redukovat, v jedné kontrolované studii to bylo průměrně o 17 % [38], v jiné studii o 27 % [39].
V dosud nepublikované studii provedené výrobcem pramipexolu u 11 zdravých dobrovolníků nemělo současné podávání selegilinu a pramipexolu vliv na farmakokinetické parametry pramipexolu [36].
Analýza populačních farmakokinetických dat prokázala, že současné podávání amantadinu nebo anticholinergik nemělo vliv na celkovou clearance pramipexolu. Stejná analýza však prokázala, že inhibitory transportního systému bazických léčiv (kationů) v ledvinách, jako jsou cimetidin, ranitidin, diltiazem, triamteren, verapamil, chinidin nebo chinin, snižují celkovou clearance pramipexolu přibližně o 20 % [36].
Výrobce pramipexolu upozorňuje, že ačkoli dosud nebyly provedeny žádné studie, je velmi pravděpodobné, že pramipexol jako agonista na dopaminových receptorech D2, D3 a D4 může antagonizovat účinek dopaminových antagonistů, jako jsou antipsychotika (zejména fenothiazinová, thioxanthenová nebo butyrofenonová) nebo benzamidy, jako jsou metoklopramid nebo sulpirid či amisulprid [36].
Dávkování
Dávkování pramipexolu je individuální. U Parkinsonovy nemoci se podává ve třech dílčích dávkách. Dávky jsou uvedeny v množství pramipexolu (báze). Při zahájení léčby by se dávka měla postupně každých 5–7 dní zvyšovat z počáteční dávky 0,264 mg/den (3 x 0,088 mg) v prvním týdnu, 0,546 mg/den (3 x 0,18 mg) ve 2. týdnu na 1,05 mg/den (3 x 0,35 mg) v týdnu třetím. Pokud je nutno dále zvýšit dávku, měla by se zvyšovat v týdenních intervalech o 0,54 mg/den do maximální denní dávky 3,3 mg. V případě nutnosti přerušení léčby by se dávka měla obdobným způsobem snižovat z důvodu možného výskytu neuroleptického maligního syndromu po náhlém přerušení léčby. U pacientů s ledvinovým selháním (clearance kreatininu < 50 ml/den) by mělo být dávkování redukováno.
V terapii RLS je doporučená počáteční dávka pramipexolu 0,088 mg báze (0,125 mg soli) užívaná jednou denně 2–3 hodiny před spaním. Pro pacienty, u nichž je potřebná další symptomatická úleva, lze dávku zvyšovat po 4–7 dnech do maxima 0,54 mg báze (0,75 mg soli) denně.
Náhlé přerušení dopaminergní léčby může vést k vývoji neuroleptického maligního syndromu. Z tohoto důvodu je třeba ukončovat léčbu pramipexolem postupně v průběhu jednoho týdne. Doporučuje se redukovat dávku o 0,54 mg báze (0,75 mg soli) denně do dosažení denní dávky 0,54 mg báze (0,75 mg soli). Poté je nutno dávku snižovat o 0,264 mg báze (0,375 mg soli) denně. Pramipexol v dávkách do 0,54 mg báze denně lze vysadit najednou.
Balení
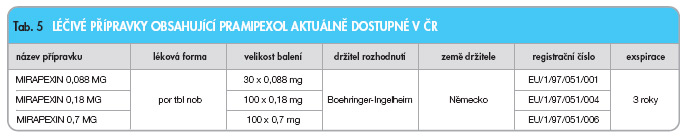
Léčivé přípravky obsahující pramipexol jsou přehledně uvedeny v tab. 5.
Seznam použité literatury
- [1] Lullmann H, Mohr K, Wehling M. Farmakologie a toxikologie. Praha, Grada, 2004. 15. vydání (2. české), kap. 10.3 Antiparkinsonika.
- [2] Folsch UR, Kochsiek K, Schmidt RF. Patologická fyziologie. Praha, Grada, 2003. 1. české vydání, kap. 32.4 Onemocnění bazálních ganglií.
- [3] Foley P, Gerlach M, Double KL, et al. Dopamine receptor agonists in the therapy of Parkinson´s disease. J Neural Transm 2004; 111: 1375–1446.
- [4] Coldwell MC, Boyfield I, Brown T, et al. Comparison of the functional potenties of ropinirole and other dopamine receptor agonist at human D2, D3 and D4. 4 receptors expressed in Chinese hamster ovary cells. Br J Pharmacol 1999; 127: 1696–1702.
- [5] Missale C, Nash SR, Robinson SW, et al. Dopamine receptors: from structure to function. Physiol Rev 1998; 78: 189–212.
- [6] Sechser T, Suchopár J, Kučera Z. Pramipexol. Remedia 2006; 16: 119–122.
- [7] Ling ZD, Robie HC, Tong CW, et al. Both the antioxidant and D3 agonist actions of pramipexole mediate its neuroprotective actions in mesencephalic cultures. J Pharmacol Exp Ther 1999; 289: 202–210.
- [8] Kitamura Y, Kosaka T, Kakimura JI, et al. Protective effects of the antiparkinsonian drugs talipexole and pramipexole against 1-methyl-4-phenylpyridinium-induced apoptotic death in human neuroblastoma SH-SY5Y cells. Mol Pharmacol 1998; 54: 1046–1054.
- [9] Jenner P, Iravani MM, Haddon CO, et al. Pramipexole protects against MPTP-induced nigral dopaminergic cell loss in primates. Neurology 2002; 58 (suppl. 3): A494.
- [10] Izumi Y, Sawada H, Yamamoto N, et al. Novel neuroprotective mechanisms of pramipexole, an anti-Parkinson drug, against endogenous dopamine-mediated excitotoxicity. Eur J Pharmacol Nov 2006. In press.
- [11] Parkinson Study Group. Dopamine transporter brain imaging to assess the effects of pramipexole vs levodopa on Parkinson disease progression. JAMA 2002; 287: 1653–1661.
- [12] Morrish PK. How valid is dopamine transporter imaging as a surrogate marker in research trials in Parkinson´s disease? Mov Disord 2003; 18 (Suppl 7): S63–S70.
- [13] Schapira AH, Olanow CW. Rationale for the use of dopamine agonists as neuroprotective agents in Parkinson´s disease. Ann Neurol 2003; 53 (Suppl 3): S149–S159.
- [14] NICE Guidelines. Parkinson´s disease. http:// www.nice.org.uk/page.aspx?o=33924 (on-line, 13. 2. 2006).
- [15] Dooley M, Markham A. Pramipexole. A Review of its Use in the Management of Early and Advanced Parkinson´s Disease. Drugs Aging 1998; 12: 495–514.
- [16] Pramipexole – Drug Evaluation. DRUGDEX® System: Klasco RK (Ed): DRUGDEX® System. Thomson Micromedex, Greenwood Village, Colorado (Vol. 130; exp. 12. 2006).
- [17] Hubble JP, Koller WC, Cutler NR, et al. Pramipexole in patients with early Parkinson´s disease. Clin Neuropharmacol 1995; 18: 338–347.
- [18] Parkinson Study Group. Safety and efficacy of pramipexole in early Parkinson´s disease: A randomized dose-ranging study. JAMA 1997; 278: 125–130.
- [19] Shannon KM, Bennett JPJ, Friedman JH. Efficacy of pramipexole, a novel dopamine agonist, as monotherapy in mild to moderate Parkinson´s disease. Neurology 1997; 49: 724–728.
- [20] Holloway R, Shoulson I, Kieburtz K, et al. Pramipexole vs Levodopa as initial treatment for Parkinson´s disease: A randomized controlled trial. JAMA 2000; 284: 1931–1938.
- [21] Holloway R, Shoulson I, Fahn S, et al. Pramipexole vs levodopa as initial treatment for Parkinson´s disease: a 4-year randomized controlled trial. Arch Neurol 2004; 61: 1044–1053.
- [22] Clarke CE, Speller JM, Clarke JA. Pramipexole for levodopa-induced complications in Parkinson´s disease. The Cochrane Database of Systematic Reviews, 2006, 1. (Last update 7. 2001).
- [23] Moller JC, Oertel WH, Koster J, et al. Long-term efficacy and safety of pramipexole in advanced Parkinson´s disease: results from a European multicenter trial. Mov Disord 2005; 20: 602–610.
- [24] The International Restless Legs Syndrome Study Group. Validation of the International Restless Legs Syndrome Study Group Rating Scale for Restless Legs Syndrome. Sleep Med 2003; 4: 121–132.
- [25] Montplaisir J, Nicolas A, Denesle R, et al. Restless legs syndrome improved by pramipexole: a double-blind randomized trial. Neurol 1999; 52: 938–943.
- [26] Montplaisir J, Denesle R, Petit D. Pramipexole in the treatment of restless legs syndrome: a follow-up study. Eur J Neurol 2000; 7 (Suppl 1): 27–31.
- [27] Saletu M, Anderer P, Saletu-Zyhlarz G, et al. Acute placebo-controlled sleep laboratory studies and clinical follow-up with pramipexole in restless legs syndrome. Eur Arch Psychiatry Clin Neurosci 2002; 252: 185–194.
- [28] Partinen M, Hirvonen K, Jama L, et al. Efficacy and safety of pramipexole in idiopathic restless legs syndrome: a polysomnographic dose-finding study – the PRELUDE study. Sleep Med 2006; 7: 407–417.
- [29] Winkelman JW, Sethi KD, Kushida CA, et al. Efficacy and safety of pramipexole in restless legs syndrome. Neurol 2006; 67: 1034–1039.
- [30] Dušek P, Roth J. Současná strategie léčby Parkinsonovy nemoci. Remedia 2006; 16: 382–388.
- [31] National Institute for Health and Clinical Excellence. Parkinson´s disease. London: National Institute for Health and Clinical Excellence, 2006, 2006. www.nice.org.uk Ref. CG035.
- [32] Allen RP, Picchietti D, Hening WA, et al. Restless Legs Syndrome Diagnosis and Epidemiology workshop at the National Institutes of Health; International Restless Legs Syndrome Study Group. Restless legs syndrome: diagnostic criteria, special considerations, and epidemiology. A report from the restless legs syndrome diagnosis and epidemiology workshop at the National Institutes of Health. Sleep Med 2003; 4: 101–119.
- [33] Gamaldo ChE, Earley ChJ. Restless legs syndrome. A clinical update. Chest 2006;130:1596–1604.
- [34] European Public Assessment Report. EMEA. http: //www.emea.eu.int/ (on-line, 14. 2. 2006).
- [35] Etminan M, Sudeep G, Samii A. Comparison of the risk of adverse events with pramipexole and ropinirole in patients with Parkinson´s disease: a meta-analysis. Drug Saf 2003; 26: 439–444.
- [36] Product Information: Mirapex® (pramipexole), Boehringer Ingelheim, March 2005 (PDR, 2006).
- [37] Suchopár J. (editor). Kompendium lékových interakcí Infopharm. Praha, Infopharm, 2005.
- [38] Lieberman A, Ranhosky A, Korts D. Clinical evaluation of pramipexole in advanced Parkinson´s disease: results of a double-blind, placebo-controlled, parallel-group study. Neurol 1997; 49: 162–168.
- [39] Pinter MM, Pogarell O, Oertel WH. Efficacy, safety, and tolerance of the non-ergoline dopamine agonist pramipexole in the treatment of advanced Parkinson´s disease: a double–blind, placebo-controlled, randomised, multicentre study. J Neurol Neurosurg Psychiatry 1999; 66: 436–441.