Tezepelumab v terapii těžkého astmatu
Souhrn
Suchopár J, Suchopár Š. Tezepelumab v terapii těžkého astmatu. Remedia 2024; 34: 420–426.
Tezepelumab představuje nový typ biologické léčby astmatu, jehož mechanismus účinku spočívá v blokádě vazby alarminu TSLP (thymický stromální lymfopoetin) na cílový receptor. To brání diferenciaci Th0 na Th1 a Th17 a snižuje produkci IL‑5 a IL‑13 přirozenými lymfoidními buňkami typu 2, což snižuje aktivaci eozinofilů. Důsledkem tohoto komplexního mechanismu je výrazná redukce počtu exacerbací astmatu u pacientů s těžkým astmatem nereagujícím dostatečně na standardní terapii zahrnující inhalační glukokortikoid, a to bez ohledu na fenotyp astmatu. Terapie tezepelumabem vedle toho redukuje spotřebu zdravotní péče, jako jsou hospitalizace a návštěvy pohotovosti, a zlepšuje tak kvalitu života pacientů. Toho všeho je dosahováno při velmi dobré toleranci léčby tezepelumabem, nízkém počtu nežádoucích účinků a při absenci lékových interakcí s jinou souběžnou terapií.
Klíčová slova: tezepelumab – mepolizumab – benralizumab – dupilumab – biologická léčba astmatu – monoklonální protilátky – bezpečnost terapie.
Summary
Suchopar J, Suchopar S. Tezepelumab in the treatment of severe asthma. Remedia 2024; 34: 420–426.
Tezepelumab is a new type of biological treatment for asthma, blocking the binding of the alarmin TSLP (thymic stromal lymphopoietin) to its target receptor. This prevents the differentiation of Th0 to Th1 and Th17 and simultaneously reduces the production of IL‑5 and IL‑13 by natural lymphoid cells type 2, which reduces the activation of eosinophils. As a consequence of this complex mechanism, significant reduction in the number of asthma exacerbations in patients with severe asthma who do not respond adequately to standard therapy including inhaled glucocorticoids – regardless of the asthma phenotype – occurs. In addition, tezepelumab therapy reduces the consumption of healthcare such as hospitalization and emergency room visits, thus improving the quality of life of patients. All this is achieved with a very good tolerance of tezepelumab, low number of adverse effects and no drug interactions with other concomitant therapy.
Key words: tezepelumab – mepolizumab – benralizumab – dupilumab – biological treatment of asthma – monoclonal antibodies – safety of therapy.
Úvod
Tezepelumab je plně humánní monoklonální IgG2λ protilátka namířená proti vazbě thymického stromálního lymfopoetinu (TSLP) na receptor. Je vyráběna metodou rekombinantní DNA biotechnologie s využitím ovariálních buněk čínského křečíka. TSLP patří k tzv. alarminům, což jsou cytokiny podobné interleukinu 2 s velmi širokým spektrem účinků jak při fyziologických, tak i při patologických procesech spojených s regulací funkce imunitních buněk. TSLP byl popsán jako růstový faktor B lymfocytů, přičemž poprvé byl identifikován v supernatantu myších thymických stromálních buněk [1]. Následně byly podrobněji zkoumány jeho účinky [2], byl klonován jeho receptor [3] a do současné doby bylo publikováno více než 2 000 prací, které se problematikou TSLP zabývají. TSLP se vyskytuje ve dvou izoformách, které mají zcela odlišné účinky [4]. Jeho dlouhá varianta, long‑form (lfTSLP), působí prozánětlivě, a naopak jeho krátká varianta, short‑form (sfTSLP) protizánětlivě. lfTSLP je produkován epiteliálními buňkami [5] a v epiteliích dýchacích cest je významně up‑regulován u pacientů s alergickými stavy, zatímco exprese sfTSLP není u alergických stavů změněna [6].
Podle epidemiologických studií není u 3,6 % pacientů v Nizozemsku [7] nebo u 4,3 % pacientů v Japonsku [8] s těžkým astmatem dosaženo kontroly při konvenční terapii zahrnující inhalační aplikaci glukokortikoidů a dlouhodobě působících β‑sympatomimetik. To odpovídá prevalenci 36–104 případů těžkého astmatu na 100 000 obyvatel. V podmínkách České republiky může být podíl pacientů s nedostatečně kontrolovaným astmatem vyšší [9] a mohl by dosahovat až 8 %. U těchto pacientů se přistupuje k biologické terapii, jejíž výběr je podřízen fenotypu (endotypu) astmatu přítomného u pacienta [10]. Po potvrzení, zda se jedná o nekontrolované astma, je nezbytné, aby fenotyp stanovil specialista. Může se jednat o zánět vyvolaný aktivitou pomocných lymfocytů Th2, pro který je charakteristický downstream interleukinů (IL) 3, IL‑4, IL‑5, IL‑9 a IL‑13 a upstream TSLP, IL‑25 a IL‑33 [11]. Nebo může být přítomen zánět vyvolaný aktivitou Th1 buněk spočívající ve zvýšené produkci interferonu γ [12]. Může se také jednat o zánět vyvolaný zvýšenou aktivitou lymfocytů Th17, pro který je charakteristický downstream IL‑17A, IL‑17E, IL‑17F a IL‑22, což vede k aktivaci neutrofilů prostřednictvím IL‑8 [13].
V podmínkách běžné klinické praxe však k určení fenotypu astmatu podle doporučených postupů [14–16] postačí posouzení přítomnosti eozinofilie a alergie. To umožňuje jednoduše rozlišit tři základní fenotypy – eozinofilní a alergický (IgE mediovaný) typ, eozinofilní nealergický typ a neeozinofilní nealergický typ astmatu. Z fenotypové klasifikace následně vyplývá výběr biologické terapie, neboť jednotlivé léky jsou namířeny na cíle, které odpovídají jednotlivým fenotypům, což se pochopitelně odráží v úhradových podmínkách.
Tezepelumab byl registrován ve Spojených státech amerických 17. 12. 2021 pod názvem TezspireÒ a v zemích Evropské unie 19. 9. 2022 pod stejným názvem. Každá předplněná injekční stříkačka nebo pero obsahuje v jedné dávce 1,91 ml roztoku o koncentraci 110 mg/ml, tedy celkem 210 mg.
Farmakodynamické vlastnosti
Jak již bylo uvedeno, tezepelumab je monoklonální IgG2λ protilátka s vysokou afinitou vůči receptoru pro TSLP v řádu pikomolárních koncentrací. Produkci TSLP v plicních nebo střevních epiteliálních buňkách nebo keratinocytech v kůži spouštějí alergeny, složky cigaretového kouře, cytokiny, viry, produkty bakterií nebo plísní a řada dalších látek. TSLP může také být produkován mastocyty [17] nebo dendritickými buňkami [18]. Vyprodukovaný TSLP se váže nejprve na svůj receptor a následně se komplex TSLP:TSLPr spojí s receptorem pro IL‑7α, v důsledku čehož dochází k fosforylaci v signalizační dráze JAK/STAT a k iniciaci prozánětlivé signalizace [19]. Cíl pro TSLP je tedy tvořen heterodimerem receptoru pro TSLP a receptoru pro IL‑7α [20]. Tezepelumab velmi silně brání vazbě TSLP na receptor. Blokáda účinku TSLP vede k omezení prozánětlivé signalizace, která se projevuje jako snížení produkce prozánětlivě působících cytokinů IL‑4, IL‑5, IL‑13, IL‑17, IL‑17A a IL‑33 [21].
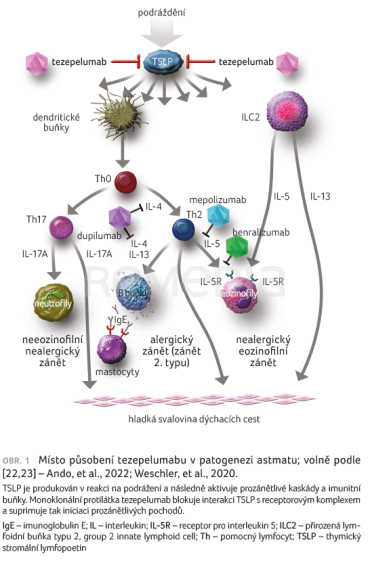 Tezepelumab z výše popsaných důvodů působí na všechny fenotypy astmatu (obr. 1) [22,23]. Příčinou působení u všech fenotypů je blokáda diferenciace Th0 na Th2, což omezuje riziko vzniku astmatu vyvolaného zánětem 2. typu, a současně blokáda diferenciace Th0 na Th17, což omezuje riziko vzniku neeozinofilního nealergického typu astmatu, současně tezepelumab blokuje TSLP zprostředkovanou aktivitu přirozených lymfoidních buněk typu 2 spočívající v produkci IL‑4, IL‑5, IL‑9 a IL‑13 [22,24].
Tezepelumab z výše popsaných důvodů působí na všechny fenotypy astmatu (obr. 1) [22,23]. Příčinou působení u všech fenotypů je blokáda diferenciace Th0 na Th2, což omezuje riziko vzniku astmatu vyvolaného zánětem 2. typu, a současně blokáda diferenciace Th0 na Th17, což omezuje riziko vzniku neeozinofilního nealergického typu astmatu, současně tezepelumab blokuje TSLP zprostředkovanou aktivitu přirozených lymfoidních buněk typu 2 spočívající v produkci IL‑4, IL‑5, IL‑9 a IL‑13 [22,24].
Farmakokinetické vlastnosti
Tezepelumab má lineární farmakokinetiku jak u zdravých dobrovolníků [25], tak i u pacientů s astmatem [26] nebo atopickou dermatitidou [27]. Biologický poločas tezepelumabu se pohybuje mezi 19,9 až 25,7 dne. Při měsíční aplikaci činil poměr akumulace 1,82, 1,64, respektive 1,59 při aplikaci dávek 35 mg, 105 mg nebo 210 mg. Při aplikaci dávky 210 mg činil poměr akumulace 1,59, 2,84, respektive 6,74 při aplikaci každé čtyři týdny, každé dva týdny nebo 1krát týdně [27]. Absolutní biologická dostupnost tezepelumabu při podkožní aplikaci průměrně činila 77 %, přičemž nebyly zjištěny rozdíly při aplikaci do různých míst. Tezepelumab se odbourává proteázami a není vylučován v intaktní formě močí nebo žlučí. Z tohoto důvodu není porucha funkce ledvin důvodem pro úpravu dávkování [26].
Nebyl zjištěn žádný klinicky významný vliv věku, pohlaví, etnické příslušnosti, funkce ledvin nebo jater, případně závažnosti astmatu na farmakokinetické vlastnosti tezepelumabu. Stejně tak nebyla farmakokinetika tezepelumabu ovlivněna souběžnou terapií antiastmatiky, včetně inhalačních glukokortikoidů. Pouze tělesná hmotnost souvisela s některými farmakokinetickými vlastnostmi léčiva. Protilátky proti tezepelumabu vzniklé při aplikaci byly zaznamenány u 2,9 % pacientů, kteří si tezepelumab aplikovali injekční jehlou a stříkačkou, u 1,0 % pacientů, kteří k aplikaci používali předplněnou injekci, a nebyly zjištěny u žádného z pacientů, kteří k aplikaci použili autoinjektor [26].
Klinické využití tezepelumabu a důkazy o jeho klinické účinnosti
Tezepelumab je v zemích EU i v USA schválen v indikaci přídavné, respektive doplňkové udržovací léčby těžkého astmatu u dospělých a dospívajících ve věku 12 let a starších, s doplňkem pro země EU, že se jedná o pacienty, kteří nejsou dostatečně kontrolováni navzdory vysokým dávkám inhalačních kortikosteroidů a dalšího léčivého přípravku pro udržovací léčbu.
Tezepelumab byl hodnocen v několika klinických studiích fáze II a III, které prokázaly jeho účinnost u pacientů s nekontrolovaným astmatem. Mezi klíčové studie patří PATHWAY (fáze IIb) a NAVIGATOR (fáze III), které významně přispěly k současnému porozumění klinickým přínosům tezepelumabu.
V rámci studie PATHWAY [28] bylo 580 pacientů s nekontrolovaným astmatem randomizováno k léčbě tezepelumabem ve třech dávkových režimech (70 mg každé 4 týdny, 210 mg každé 4 týdny nebo 280 mg každé 2 týdny) nebo placebem. Studie ukázala významné snížení roční míry exacerbací astmatu ve všech skupinách léčených tezepelumabem oproti placebu, a to o 61 %, 71 % a 66 % (p < 0,001). Účinek byl pozorován bez ohledu na výchozí hodnoty eozinofilů v krvi, což naznačuje široké spektrum účinnosti tezepelumabu. Kromě snížení míry exacerbací došlo také ke zlepšení prebronchodilatačního usilovného výdechového objemu za 1 sekundu (FEV1) o 0,12–0,15 litru oproti placebu. Nežádoucí účinky vedly k ukončení léčby pouze u několika pacientů a jejich výskyt nebyl výrazně vyšší než ve skupině s placebem.
Studie NAVIGATOR [29] potvrdila účinnost tezepelumabu v dávce 210 mg podávané subkutánně každé 4 týdny u 1 061 pacientů s těžkým nekontrolovaným astmatem. Tezepelumab vedl k významnému snížení roční míry exacerbací astmatu o 56 % (p < 0,001) v porovnání s placebem. U pacientů s nízkou výchozí hodnotou eozinofilů (< 300 buněk/µl) bylo dosaženo snížení míry exacerbace astmatu o 41 % (p < 0,001), což opět potvrzuje nezávislost účinnosti na fenotypu zánětu. Sekundární cílové ukazatele, zahrnující zlepšení FEV1, kontrolu astmatu (Asthma Control Questionnaire, ACQ‑6), kvalitu života (Asthma Quality of Life Questionnaire, AQLQ) a příznaky astmatu (Asthma and Autism Spectrum Disorder, ASD), prokázaly klinicky významné zlepšení ve všech parametrech oproti placebu. Frekvence a spektrum nežádoucích účinků byly mezi skupinami s tezepelumabem a placebem srovnatelné, což svědčí o příznivém bezpečnostním profilu léku.
Obě studie prokazují robustní účinnost tezepelumabu v redukci exacerbací astmatu, zlepšení plicních funkcí a kvality života pacientů s nekontrolovaným astmatem, přičemž jeho účinky nejsou závislé na výchozích hodnotách eozinofilů. Tento unikátní mechanismus působení rozšiřuje terapeutické možnosti u široké skupiny pacientů. Navzdory vysoké účinnosti je nezbytné nadále sledovat dlouhodobou bezpečnost tezepelumabu v reálné klinické praxi.
Souhrnná analýza výsledků pacientů zařazených do studií PATHWAY a NAVIGATOR zahrnující celkem 1 334 pacientů [30], kteří dostávali buď tezepelumab 210 mg, nebo placebo subkutánně každé 4 týdny po dobu 52 týdnů, prokázala snížení roční míry exacerbací astmatu o 60 % (poměr šancí [odds ratio, OR] 0,40; na 95% hladině spolehlivosti [confidence interval, CI] 0,34–0,48) oproti placebu. Tento účinek byl pozorován napříč celým spektrem podskupin pacientů definovaných hodnotami eozinofilů v krvi, frakčními koncentracemi vydechovaného oxidu dusnatého (FeNO) i stavem alergie. Sekundární analýzy dále prokázaly snížení počtu hospitalizací a návštěv pohotovosti v důsledku exacerbací a zlepšení funkce plic (FEV1) a kvality života. Bezpečnostní profil tezepelumabu byl srovnatelný s placebem. Analýza ukázala, že tezepelumab představuje univerzální léčebnou možnost pro široké spektrum pacientů s těžkým astmatem.
Byly také provedeny metaanalýzy publikovaných klinických studií. První z nich [31] hodnotila 9 201 pacientů zařazených do celkem 10 randomizovaných kontrolovaných klinických studií a srovnávala pomocí bayesovské síťové metodiky účinnost mepolizumabu, benralizumabu, dupilumabu. Tezepelumab dosáhl nižší roční míry exacerbací ve srovnání s benralizumabem (relativní riziko exacerbace: 0,63; 95% CI 0,46–0,86). Ve zlepšení FEV1 se tezepelumab i dupilumab ukázaly jako podobně účinné s více než 99% pravděpodobností klinicky významného zvýšení FEV1 o ≥ 100 ml oproti placebu. Zlepšení skóre v dotazníku kontroly astmatu (ACQ) bylo nejvýraznější u mepolizumabu, avšak rozdíly mezi hodnocenými biologickými léky nebyly statisticky významné.
Druhá metaanalýza byla součástí systematického přehledu klinických studií s tezepelumabem [32] a byly do ní zařazeny čtyři randomizované klinické studie zahrnující celkem 1 600 pacientů. Léčba tezepelumabem vedla k významnému snížení roční míry exacerbací (OR 0,67; 95% CI 0,57–0,80) a ke zlepšení FEV1 (rozdíl [standard mean difference, SMD] 0,28; 95% CI 0,11–0,45). Také skóre dotazníku kontroly astmatu (ACQ‑6) se výrazně zlepšilo (SMD: –0,29; 95% CI –0,20 až –0,39). Všechny změny byly statisticky vysoce významné. Analýza bezpečnosti neodhalila významné rozdíly ve výskytu závažných nežádoucích účinků mezi tezepelumabem a placebem. Mezi časté, avšak nezávažné nežádoucí účinky patřily zánět nosohltanu, bolest hlavy a bronchitida. Podle autorů systematického přehledu se tezepelumab jeví jako vysoce účinná a univerzální biologická léčba, která je schopna významně zlepšit kontrolu astmatu u pacientů napříč různými klinickými podskupinami.
Další klinická studie, jejímž cílem bylo zjistit dlouhodobou účinnost a bezpečnost tezepelumabu [33], již byla ukončena [34] a ze závěrů vyplývá, že pokračování terapie tezepelumabem ve srovnání s ukončením terapie po 24 měsících je pro pacienty přínosné. Nadto výsledky studie ukázaly, že i po ukončení terapie tezepelumabem jsou v období 40 týdnů hladiny IgE významně nižší než u skupiny pacientů, kteří dostávali placebo. Jiné klinické studie [23] zatím stále probíhají.
Bezpečnost tezepelumabu
Výskyt nežádoucích účinků
Terapie tezepelumabem je podle systematického přehledu a metaanalýzy [35] účinná a současně bezpečná. Výskyt nežádoucích účinků se podle egyptských autorů nelišil od výskytu jakýchkoliv nežádoucích účinků po placebu, když jejich relativní riziko činilo 0,92 (95% CI 0,62–1,38). Autoři také vyjádřili riziko vzniku jakéhokoliv nežádoucího důsledku, jehož relativní riziko dokonce činilo 0,71 (95% CI 0,54–0,93). Čínští autoři použili veřejná data z databáze FAERS [36], přičemž analyzovali celkem 2 153 záznamů nežádoucích účinků. Zaznamenali přitom nežádoucí účinky neuvedené v Souhrnu údajů o přípravku (tedy neočekávané nežádoucí účinky) – představovaly je dušnost, tělesná teplota a svědění jazyka. Dále zjistili, že medián doby terapie do nástupu nežádoucích účinků souvisejících s tezepelumabem byl 35 dní. Nejčastějšími nežádoucími účinky s rozdílným výskytem podle pohlaví byly artralgie a dušnost.
Dlouhodobá terapie tezepelumabem byla z hlediska bezpečnosti terapie podrobena metaanalýze, ve které bylo hodnoceno sedm klinických studií zahrnujících celkem 2 050 pacientů [37]. Závažné nežádoucí účinky se vyskytly ve srovnání s placebem s relativním rizikem 0,74 (95% CI 0,57–0,95), infekce horních cest dýchacích měly relativní riziko 0,73 (95% CI 0,55–0,96) a astma mělo relativní riziko 0,61 (95% CI 0,48–0,76). To svědčí o velmi dobré toleranci při až 52týdenní aplikaci tezepelumabu.
Také roční sledování bezpečnosti tezepelumabu v Japonsku prokázalo velmi dobrou toleranci [38], když nejčastěji se vyskytující nežádoucí účinek představoval zánět nosohltanu. Celkem bylo u 65 pacientů pozorováno 94 nežádoucích účinků. Ty ale postihly pouze 39 z nich (tj. 60 %). Závažné nežádoucí účinky postihly pouze čtyři pacienty a jediný nežádoucí účinek, který vedl k ukončení aplikace tezepelumabu, nesouvisel s jeho aplikací.
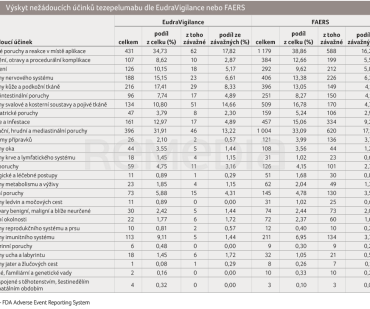
Byly analyzovány obsahy databáze FDA Adverse Event Reporting System (FAERS) a Evropské databáze hlášení podezření na nežádoucí účinky léčivých přípravků (EudraVigilance), a to k 30. 9. 2024. Data byla získána z https://www.fda.gov/drugs/questions‑and‑answers‑fdas‑adverse‑event‑reporting‑system‑faers/fda‑adverse‑event‑reporting‑system‑faers‑public‑dashboard (FAERS) a z https://www.adrreports.eu/cs/search_subst.html (EudraVigilance). Pro označení nežádoucích účinků byla zachována klasifikace MedDRA v anglickém jazyce s výjimkou konkrétních nežádoucích účinků. Z obou databází nežádoucích účinků byla získána data sledující jejich výskyt v jednotlivých skupinách dle klasifikace MedDRA. Výskyt nežádoucích účinků byl v obou databázích velice konzistentní. Převažovaly, přesně podle očekávání, nežádoucí účinky na respirační ústrojí a nežádoucí účinky – tzv. celkové projevy, mezi které mimo jiné patří i selhání terapie. Takových případů bylo popsáno 76 (tj. 6,12 % všech nežádoucích účinků) v databázi EudraVigilance a 297 (tj. 9,79 % všech nežádoucích účinků) v databázi FAERS. Čtenářům článku předkládáme výskyt nežádoucích účinků ve všech 27 skupinách dle klasifikace MedDRA s vyjádřením počtu a podílu závažných nežádoucích účinků (tab. 1).
Lékové interakce
Tezepelumab nevystupuje jako „victim“ v lékových interakcích, nepodléhá metabolismu 1. nebo 2. fáze, není ani transportován přenašečovými systémy.
Tezepelumab není ani „perpetrator“ v lékových interakcích, tj. jeho aplikace nemění farmakokinetické nebo farmakodynamické vlastnosti jiných léků. Avšak vzhledem k tomu, že terapie tezepelumabem způsobuje snížení hodnot prozánětlivých cytokinů, z nichž některé jsou schopny měnit expresi enzymů cytochromu P450 nebo některých transportních systémů, nelze vyloučit, že by tezepelumab mohl nepřímo mít vliv na aktivitu enzymů nebo transportérů. To zatím ale nebylo potvrzeno. Vzhledem k tomu, že in vitro mohou měnit expresi metabolizačních enzymů pouze monoklonální protilátky proti IL‑1β, IL‑6 nebo tumor nekrotizujícímu faktoru alfa (TNFα) [39], je případný vliv tezepelumabu krajně nepravděpodobný. To dokládají negativní výsledky studií monoklonálních protilátek proti IL‑2 [40], anti‑IL‑4/IL‑13 [41], anti‑IL‑17A [42] nebo anti‑IL‑23 [43].
Terapie tezepelumabem neměla vliv na dosažení sérokonverze při očkování proti chřipce [44] a očkování nebylo provázeno zvýšeným výskytem nežádoucích účinků.
Použití v těhotenství a v období kojení
U těžkého astmatu je v těhotenství a během kojení nejlépe prostudován omalizumab s relativně dobrými údaji, které svědčí o jeho bezpečnosti. O použití tezepelumabu, ale i dalších biologických léčiv – mepolizumabu, reslizumabu, benralizumabu a dupilumabu – v těhotenství a během kojení nejsou dostupné dostatečné údaje o bezpečnosti [45]. Léčiva používaná při terapii atopické dermatitidy, včetně tezepelumabu, byla předmětem systematického přehledu možnosti jejich aplikace v těhotenství [46]. Autoři v literatuře nalezli celkem 313 případů těhotenství žen, které byly léčeny tezepelumabem, omalizumabem, mepolizumabem, reslizumabem, benralizumabem, dupilumabem nebo tralokinumabem. Držitel rozhodnutí o registraci v EU uvádí: „Údaje o podávání tezepelumabu těhotným ženám jsou omezené (méně než 300 ukončených těhotenství) nebo nejsou k dispozici. Studie reprodukční toxicity na zvířatech nenaznačují přímé nebo nepřímé škodlivé účinky. Lidské IgG protilátky, jako je tezepelumab, jsou transportovány přes placentární bariéru; proto může být tezepelumab přenášen z matky na vyvíjející se plod. Podávání tezepelumabu v těhotenství se z preventivních důvodů nedoporučuje, pokud očekávaný přínos pro těhotnou matku není větší než jakékoliv možné riziko pro plod.“ K definitivnímu potvrzení, že je tezepelumab v těhotenství bezpečný, bychom museli disponovat randomizovanými klinickými studiemi, což nelze v nejbližší době očekávat. Zbývá tak vždy zhodnotit riziko vyplývající z přerušení terapie pro matku a riziko pro plod z možného poškození. To je jistě mimořádně obtížné, pokud zatím pouze víme, že tezepelumab sice nemá známky reprodukční toxicity, avšak lze považovat za téměř jisté, že prochází placentární bariérou.
Závěr
Tezepelumab představuje významný pokrok v léčbě těžkého, nekontrolovaného astmatu díky unikátnímu mechanismu účinku a jím dané schopnosti účinně snižovat míru exacerbací nezávisle na počtu eozinofilů, FeNO nebo alergickém stavu pacienta. V klinických studiích tezepelumab snížil roční míru exacerbací astmatu oproti placebu o 63–71 % u eozinofilního astmatu, o 58–68 % u alergického astmatu, o 67–71 % u alergického a eozinofilního astmatu a o 34–49 u neeozinofilního nealergického astmatu [47]. U všech těchto fenotypů astmatu navíc prokázal vyšší účinnost při snižování míry exacerbací vyžadujících hospitalizaci nebo návštěvy pohotovosti oproti placebu.
Společná analýza studií PATHWAY a NAVIGATOR prokázala nejen 60% snížení roční míry exacerbací oproti placebu, ale především velmi příznivý bezpečnostní profil. Tyto výsledky potvrdily také metaanalýzy randomizovaných klinických studií. Tezepelumab dosahuje vysoké pravděpodobnosti snížení míry exacerbací o ≥ 50 % oproti placebu a to jej staví na úroveň nejúčinnějších dostupných terapií. Jeho účinnost nebyla vázána na specifické biomarkery zánětu typu 2, což rozšiřuje jeho využití i na pacienty s jiným typem zánětu. Metaanalýzy také potvrdily, že tezepelumab je spojen s nízkým výskytem závažných nežádoucích účinků, což podtrhuje jeho příznivý bezpečnostní profil. Tato univerzálnost a účinnost z tezepelumabu činí velmi zajímavou terapeutickou možnost při personalizované léčbě těžkého astmatu, zejména u pacientů s komplikovaným klinickým profilem nebo u těch, kteří nedosahují dostatečné odpovědi na biologickou léčbu zaměřenou na eozinofilní zánět. Z aplikace tezepelumabu ale profituje naprostá většina pacientů s těžkým astmatem, což lze považovat za velmi přínosné pro klinickou praxi. Tezepelumab tak představuje první biologickou terapii astmatu se širokým spektrem klinického využití bez ohledu na fenotyp pacienta.
PharmDr. Josef Suchopár
DrugAgency, a.s.
Klokotská 833/1a, 142 00 Praha 4
e-mail: suchopar@drugagency.cz
Literatura
[1] Friend SL, Hosier S, Nelson A, et al. A thymic stromal cell line supports in vitro development of surface IgM+ B cells and produces a novel growth factor affecting B and T lineage cells. Exp Hematol 1994; 22: 321–328.
[2] Ray RJ, Furlonger C, Williams DE, Paige CJ. Characterization of thymic stromal‑derived lymphopoietin (TSLP) in murine B cell development in vitro. Eur J Immunol 1996; 26: 10–16.
[3] Park LS, Martin U, Garka K, et al. Cloning of the murine thymic stromal lymphopoietin (TSLP) receptor: Formation of a functional heteromeric complex requires interleukin 7 receptor. J Exp Med 2000; 192: 659–670.
[4] Fornasa G, Tsilingiri K, Caprioli F, et al. Dichotomy of short and long thymic stromal lymphopoietin isoforms in inflammatory disorders of the bowel and skin. J Allergy Clin Immunol 2015; 136: 413–422.
[5] Smolinska S, Antolín‑Amérigo D, Popescu FD, Jutel M. Thymic Stromal Lymphopoietin (TSLP), Its Isoforms and the Interplay with the Epithelium in Allergy and Asthma. Int J Mol Sci 2023; 24: 12725.
[6] Tsilingiri K, Fornasa G, Rescigno M. Thymic Stromal Lymphopoietin: To Cut a Long Story Short. Cell Mol Gastroenterol Hepatol 2017; 3: 174–182.
[7] Hekking PW, Wener RR, Amelink M, et al. The prevalence of severe refractory asthma. J Allergy Clin Immunol 2015; 135: 896–902.
[8] Kimura Y, Suzukawa M, Jo T, et al. Epidemiology of patients with severe asthma in Japan: a nationwide descriptive study. ERJ Open Res 2024; 10: 00122‑2024.
[9] Teřl M, Pohunek P, Kuhn M, Bystron J. Four seasons of Czech asthma study: asthma characteristics and management reality in the Czech Republic. J Asthma 2020; 57: 898–910.
[10] Chung KF. Asthma phenotyping: a necessity for improved therapeutic precision and new targeted therapies. J Intern Med 2016; 279: 192–204.
[11] Lambrecht BN, Hammad H, Fahy JV. The Cytokines of Asthma. Immunity 2019; 50: 975–991.
[12] Kumar RK, Yang M, Herbert C, Foster PS. Interferon‑gamma, pulmonary macrophages and airway responsiveness in asthma. Inflamm Allergy Drug Targets 2012; 11: 292–297.
[13] Christenson SA, van der Berge M, Faiy A, et al. An airway epithelial IL‑17A response signature identifies a steroid‑unresponsive COPD patient subgroup. J Clin Invest 2019; 129: 169–181.
[14] Teřl M, Sedlák V, Krčmová I. Doporučený postup diagnostiky a léčby těžkého astmatu. část I. Odesílání pacientů do center. Stud Pneumol Phthiseol 2022; 82: 122–127.
[15] Salajka F, Teřl M, Prokeš M. Doporučené diagnostické a terapeutické postupy pro všeobecné praktické lékaře. Asthma bronchiale. Novelizace 2022. Dostupné na: https://www.svl.cz/doporucene‑postupy/
[16] Teřl M, Sedlák V, Krčmová I. Doporučený postup diagnostiky a léčby těžkého astmatu. Geum, 2023.
[17] Okayama Y, Okumura S, Sagara H, et al. FcepsilonRI‑mediated thymic stromal lymphopoietin production by interleukin‑4‑primed human mast cells. Eur Respir J 2009; 34: 425–435.
[18] Spadoni I, Iliev ID, Rossi G, Rescigno M. Dendritic cells produce TSLP that limits the differentiation of Th17 cells, fosters Treg development, and protects against colitis. Mucosal Immunol 2012; 5: 184–193.
[19] Verstraete K, Peelman F, Braun H, et al. Structure and antagonism of the receptor complex mediated by human TSLP in allergy and asthma. Nat Commun 2017; 8: 14937.
[20] Varricchi G, Pecoraro A, Marone G, et al. Thymic Stromal Lymphopoietin Isoforms, Inflammatory Disorders, and Cancer. Front Immunol 2018; 9: 1595.
[21] Bagnasco D, De Ferrari L, Bondi B, et al. Thymic Stromal Lymphopoietin and Tezepelumab in Airway Diseases: From Physiological Role to Target Therapy. Int J Mol Sci 2024; 25: 5972.
[22] Ando K, Fukuda Y, Tanaka A, Sagara H. Comparative Efficacy and Safety of Tezepelumab and Other Biologics in Patients with Inadequately Controlled Asthma According to Thresholds of Type 2 Inflammatory Biomarkers: A Systematic Review and Network Meta‑Analysis. Cells 2022; 11: 819.
[23] Wechsler ME, Colice G, Griffiths JM, et al. SOURCE: a phase 3, multicentre, randomized, double‑blind, placebo‑controlled, parallel group trial to evaluate the efficacy and safety of tezepelumab in reducing oral corticosteroid use in adults with oral corticosteroid dependent asthma. Respir Res 2020; 21: 264.
[24] Doherty TA, Broide DH. Airway innate lymphoid cells in the induction and regulation of allergy. Allergol Int 2019; 68: 9–16.
[25] Zheng Y, Abuqayyas L, Megally A, et al. Tezepelumab Pharmacokinetics, Safety, and Tolerability After Administration via Vial‑and‑syringe, Accessorized Prefilled Syringe, or Autoinjector: A Randomized Trial in Healthy Volunteers. Clin Ther 2021; 43: 142–155.
[26] Zheng Y, Abuqayyas L, Quartino A, et al. Population Pharmacokinetic Modeling and Exposure‑Efficacy and Body Weight‑Response Analyses for Tezepelumab in Patients With Severe, Uncontrolled Asthma. J Clin Pharmacol 2024; 64: 908–921.
[27] Parnes JR, Sullivan JT, Chen L, Dias C. Pharmacokinetics, Safety, and Tolerability of Tezepelumab (AMG 157) in Healthy and Atopic Dermatitis Adult Subjects. Clin Pharmacol Ther 2019; 106: 441–449.
[28] Corren J, Parnes JR, Wang L, et al. Tezepelumab in Adults with Uncontrolled Asthma. N Engl J Med 2017; 377: 936–946.
[29] Menzies‑Gow A, Colice G, Griffiths JM, et al. NAVIGATOR: a phase 3 multicentre, randomized, double‑blind, placebo‑controlled, parallel‑group trial to evaluate the efficacy and safety of tezepelumab in adults and adolescents with severe, uncontrolled asthma. Respir Res 2020; 21: 266.
[30] Corren J, Menzies‑Gow A, Chupp G, et al. Efficacy of Tezepelumab in Severe, Uncontrolled Asthma: Pooled Analysis of the PATHWAY and NAVIGATOR Clinical Trials. Am J Respir Crit Care Med 2023; 208: 13–24.
[31] Nopsopon T, Lassiter G, Chen ML, et al. Comparative efficacy of tezepelumab to mepolizumab, benralizumab, and dupilumab in eosinophilic asthma: A Bayesian network meta‑analysis. J Allergy Clin Immunol 2023; 151: 747–755.
[32] Lin F, Yu B, Deng B, He R. The efficacy and safety of tezepelumab in the treatment of uncontrolled asthma: A systematic review and meta‑analysis of randomized controlled trials. Medicine (Baltimore) 2023; 102: e34746.
[33] Menzies‑Gow A, Ponnarambil S, Downie J, et al. DESTINATION: a phase 3, multicentre, randomized, double‑blind, placebo‑controlled, parallel‑group trial to evaluate the long‑term safety and tolerability of tezepelumab in adults and adolescents with severe, uncontrolled asthma. Respir Res 2020; 21: 279.
[34] Brightling CE, Caminati M, Llanos JP, et al. Biomarkers and clinical outcomes after tezepelumab cessation: Extended follow‑up from the 2‑year DESTINATION study. Ann Allergy Asthma Immunol 2024; 133: 310–317.
[35] Shaban Abdelgalil M, Ahmed Elrashedy A, Awad AK, et al. Safety and efficacy of tezepelumab vs. placebo in adult patients with severe uncontrolled asthma: a systematic review and meta‑analysis. Sci Rep 2022; 12: 20905.
[36] Mao Z, Huang Y, Zhu X, et al. Adverse events associated with tezepelumab: a safety analysis of clinical trials and a pharmacovigilance system. Expert Opin Drug Saf 2024; 22: 1–10.
[37] Qin J, Wang G, Han D. Long‑term safety of tezepelumab in patients with asthma: a systematic review and meta‑analysis of randomized controlled trials. J Asthma 2024; 2: 1–10.
[38] Shinkai M, Ebisawa M, Fukushima Y, et al. One‑year safety and tolerability of tezepelumab in Japanese patients with severe uncontrolled asthma: results of the NOZOMI study. J Asthma 2023; 60: 616–624.
[39] Wollmann BM, Syversen SW, Vistnes M, et al. Associations between Cytokine Levels and CYP3A4 Phenotype in Patients with Rheumatoid Arthritis. Drug Metab Dispos 2018; 46: 1384–1389.
[40] Tran JQ, Othman AA, Wolstencroft P, Elkins J. Therapeutic protein‑drug interaction assessment for daclizumab high‑yield process in patients with multiple sclerosis using a cocktail approach. Br J Clin Pharmacol 2016; 82: 160–167.
[41] Davis JD, Bansal A, Hassman D, et al. Evaluation of Potential Disease‑Mediated Drug‑Drug Interaction in Patients With Moderate‑to‑Severe Atopic Dermatitis Receiving Dupilumab. Clin Pharmacol Ther 2018; 104: 1146–1154.
[42] Bruin G, Hasselberg A, Koroleva I, et al. Secukinumab Treatment Does Not Alter the Pharmacokinetics of the Cytochrome P450 3A4 Substrate Midazolam in Patients With Moderate to Severe Psoriasis. Clin Pharmacol Ther 2019; 106: 1380–1388.
[43] Khatri A, Cheng L, Camez A, et al. Lack of Effect of 12‑Week Treatment with Risankizumab on the Pharmacokinetics of Cytochrome P450 Probe Substrates in Patients with Moderate to Severe Chronic Plaque Psoriasis. Clin Pharmacokinet 2019; 58: 805–814.
[44] Cole J, Cąpała‑Szczurko I, Roseti S, et al. Effect of Tezepelumab on the Humoral Immune Response to Seasonal Quadrivalent Influenza Vaccination in Patients with Moderate to Severe Asthma: The Phase 3b VECTOR Study. Pulm Ther 2024; 10: 53–67.
[45] Ramos CL, Namazy J. Monoclonal Antibodies (Biologics) for Allergic Rhinitis, Asthma, and Atopic Dermatitis During Pregnancy and Lactation. Immunol Allergy Clin North Am 2023; 43: 187–197.
[46] Shakuntulla F, Chiarella SE. Safety of Biologics for Atopic Diseases During Pregnancy. J Allergy Clin Immunol Pract 2022; 10: 3149–3155.
[47] Panettieri R Jr, Lugogo N, Corren J, Ambrose CS. Tezepelumab for Severe Asthma: One Drug Targeting Multiple Disease Pathways and Patient Types. J Asthma Allergy 2024; 17: 219–236.