Chronická obstrukční plicní nemoc na podkladě deficitu alfa -1 antitrypsinu a možnosti léčby.Co přinesla studie RAPID?
Souhrn:
Deficit alfa-1 antitrypsinu (AAT) je významným rizikovým faktorem pro časný vývoj chronické obstrukční plicní nemoci (CHOPN). Dosud chyběly důkazy o tom, zda augmentační léčba lidským AAT poskytuje jakýkoliv prospěch pacientům se středně pokročilou CHOPN při deficitu AAT. Studie RAPID je první randomizovanou, placebem kontrolovanou studií, která pomocí CT denzitometrie prokázala, že augmentační léčba vede u pacientů s CHOPN na podkladě deficitu AAT ke zpomalení úbytku plicní tkáně. Studie navíc ukázala, že augmentační léčba pravděpodobně přináší i zlepšení prognózy těchto pacientů.
Key words:
COPD – alpha-1 antitrypsin deficiency – augmentation therapy – CT densitometry – prognosis.
Summary:
Alpha-1 antitrypsin (AAT) deficiency bears a high risk for early development of COPD. There has been no evidence of any benefit conferred by augmentation therapy with human AAT in patients with moderate COPD due to AAT deficiency. RAPID is the first randomised, placebo controlled trial showing that the augmentation therapy in COPD patients due to AAT deficiency slows the loss of lung tissue as assessed by CT lung densitometry. Furthermore, the study shows possible prognostic benefit in this group of patients.
Deficit alfa‑1 antitrypsinu
Těžký deficit alfa‑1 antitrypsinu (AAT), který objevili a poprvé popsali Laurell a Eriksson v roce 1963, je dědičná porucha spojená s vysokým rizikem vývoje chronické obstrukční plicní nemoci (CHOPN) emfyzematického fenotypu [1]. U postižených jedinců se vyvine nemoc v mladším věku a s typicky bazální predilekcí emfyzematických změn. Pro CHOPN na podkladě deficitu AAT je rovněž charakteristický rychlý pokles plicních funkcí a jeho nositelé jsou častými kandidáty na transplantaci plic.
Předpokládá se, že k rozvoji nemoci dochází v důsledku nedostatečné neutralizace přirozeně se vyskytujících proteáz, zejména neutrofilní elastázy, jejichž nadbytek vede ke zrychlené destrukci plicního parenchymu [2]. Samotný deficit AAT nemusí nutně vést k poškození plicní tkáně, pro plný vývoj onemocnění jsou zřejmě důležité další faktory, hlavně kouření cigaret. Alfa‑1 antitrypsin je tvořen v hepatocytech, mutace jeho genu vede ke konformačním změnám enzymu, který mění nejen jeho funkci, ale i prostorovou konformaci. Konformační změny AAT jsou odpovědné za sklon k tvorbě polymerů. Hepatocyt nedokáže polymerovaný AAT vyloučit do krevního oběhu a jeho akumulace vede k poškození buňky a k její apoptóze [2]. Jaterní cirhóza je proto druhou nejčastější komplikací deficitu AAT, mezi další se počítají panikulitida či nemoci spojené s autoprotilátkami proti proteináze 3 (PR3), jako je např. granulomatóza s polyangiitidou. Není zcela jasné, zda spojení s dalšími nemocemi není jen náhodné.
Odhaduje se, že na světě existuje přibližně 3,5 milionu postižených jedinců, nicméně jejich záchyt je velmi nízký a naprostá většina nemocných zůstává nediagnostikována [3]. Základní léčba pacientů s CHOPN se řídí platnými doporučeními, která spočívají jak v režimových opatřeních, tak zejména v inhalační bronchodilatační terapii. Dosud není dostupná farmakologická léčba, která by byla schopna nemocným s CHOPN prodloužit život, což mnohem více dopadá na většinu pacientů s deficitem AAT, u nichž je progrese onemocnění rychlejší.
Léčba deficitu alfa‑1 antitrypsinu
V posledních přibližně třiceti letech je v některých zemích dostupná podpůrná léčba náhradním lidským AAT získávaným z krevní plazmy dárců. Jde o velmi nákladnou a náročnou léčbu, která spočívá v pravidelném intravenózním podávání AAT s cílem udržet jeho plazmatickou koncentraci na hodnotě, jež je všeobecně pokládána za protektivní (≥ 0,5 g/l). Průkaz účinnosti této léčby byl po dlouhá léta založen na pozorování pacientů zařazených do amerického registru Národního institutu pro srdce, plíce a krev (National Heart, Lung, and Blood Institute, NHLBI) [4] a do německo‑dánské otevřené studie [5]. V obou sledováních byl prokázán vliv podávání AAT na zpomalení rychlosti poklesu plicních funkcí a data z amerického registru svědčila pro zlepšení prognózy pacientů. Účinek byl patrný u středně těžce pokročilých stadií onemocnění s hodnotami objemu vzduchu za první vteřinu usilovného výdechu (FEV1) v rozmezí 35–60 % náležitých hodnot. Ani jedna ze studií však nebyla zaslepená a randomizovaná, a proto lze jejich výsledky interpretovat jen s velkou opatrností.
Do nedávné doby nebyla dostupná žádná randomizovaná a zaslepená studie, protože proveden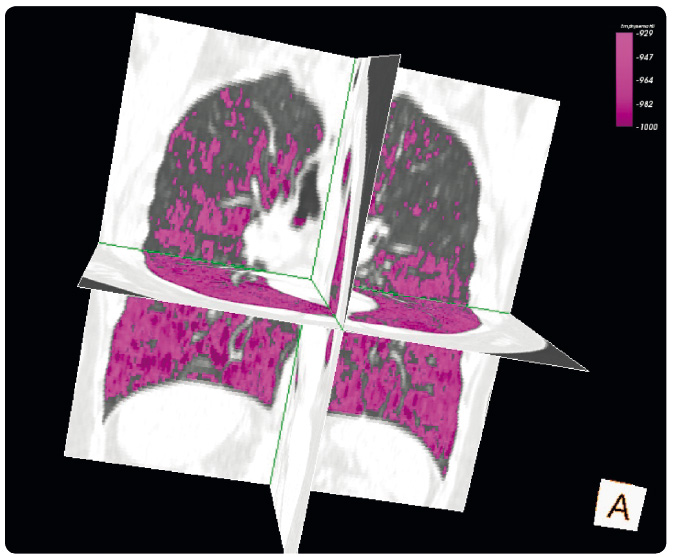 í takové studie nebylo považováno za vhodné. Pokud by bylo použito k hodnocení účinnosti této léčby běžně doporučovaných hodnot plicních funkcí (jako např. FEV1), pak by k průkazu významných rozdílů mezi skupinami bylo nutné zařadit několik set pacientů na dobu minimálně pěti let. Takové nároky jsou považovány při omezeném počtu pacientů za nemožné a délka pozorování za neetickou. Výpočet hustoty plicní tkáně z vyšetření plic počítačovou tomografií (CT) je novou a v současné době nejcitlivější metodou k hodnocení progrese emfyzematických změn (obr. 1). Měření hustoty plicní tkáně pomocí CT bylo použito ve dvou menších randomizovaných, zaslepených studiích, které zkoumaly účinek podávání AAT na progresi plicního emfyzému. Ačkoliv jednotlivé studie nebyly schopny dosáhnout statisticky významného výsledku, společné hodnocení pacientů z obou studií prokázalo efekt podávání AAT na zpomalení destrukce plicní tkáně [6].
í takové studie nebylo považováno za vhodné. Pokud by bylo použito k hodnocení účinnosti této léčby běžně doporučovaných hodnot plicních funkcí (jako např. FEV1), pak by k průkazu významných rozdílů mezi skupinami bylo nutné zařadit několik set pacientů na dobu minimálně pěti let. Takové nároky jsou považovány při omezeném počtu pacientů za nemožné a délka pozorování za neetickou. Výpočet hustoty plicní tkáně z vyšetření plic počítačovou tomografií (CT) je novou a v současné době nejcitlivější metodou k hodnocení progrese emfyzematických změn (obr. 1). Měření hustoty plicní tkáně pomocí CT bylo použito ve dvou menších randomizovaných, zaslepených studiích, které zkoumaly účinek podávání AAT na progresi plicního emfyzému. Ačkoliv jednotlivé studie nebyly schopny dosáhnout statisticky významného výsledku, společné hodnocení pacientů z obou studií prokázalo efekt podávání AAT na zpomalení destrukce plicní tkáně [6].
Studie RAPID
Studie RAPID byla navržena k potvrzení účinnosti podávání AAT z předešlých pozorování v jedné randomizované, zaslepené studii s použitím hodnocení změn hustoty plicní tkáně [7]. Jednalo se o multicentrickou, randomizovanou, dvojitě zaslepenou studii kontrolovanou placebem, do které bylo zařazeno 208 pacientů s CHOPN na podkladě deficitu AAT se středně pokročilým stadiem onemocnění (FEV1 v rozmezí 35–70 % náležitých hodnot), kteří byli prokazatelně nekuřáky. Pacienti byli randomizováni v poměru 1 : 1 pro podávání AAT v dávce 60 mg/kg tělesné hmotnosti nebo k podávání placeba intravenózně jednou týdně po dobu 24 měsíců. Po skončení tohoto období, kdy byla studie zaslepena, mohli všichni pacienti vstoupit do otevřené fáze studie a dostávat AAT po dobu dalších 24 měsíců; CT vyšetření hrudi bylo prováděno celkem pětkrát, při zařazení pacienta a poté ve 3., 12., 21. a 24. měsíci léčby, a to v úrovni maximálního nádechu (celkové plicní kapacity, TLC) a klidného výdechu (funkční reziduální kapacity, FRC). Z celkem 208 zařazených pacientů jich 180 bylo randomizováno, výsledky CT vyšetření byly dostupné u 177 pacientů a mohly být použity k hodnocení.
Denzita plicní tkáně měřená v úrovni TLC klesala u pacientů, kterým byl podáván AAT, významně pomaleji než u těch, kteří dostávali placebo. U pacientů léčených AAT byla rychlost ztráty 1,45 g/l za rok (standard error, SE 0,23), zatímco v placebové skupině ztráta představovala 2,19 g/l za rok, rozdíl mezi skupinami byl statisticky významný (graf 1, p = 0,03). Změny hustoty plicní tkáně hodnocené z CT vyšetření/obrazu provedeného v úrovni FRC, případně kombinací obou měření (v úrovni TLC a FRC dohromady), nebyly statisticky významné![Graf 1 Srovnání rychlosti poklesu hustoty plicní tkáně mezi skupinami pacientů ve studii RAPID; podle [7] – Chapman, et al., 2015.](https://www.remedia.cz/photo-a-30626---.jpg) . Mezi skupinami nebyly zjištěny rozdíly v dalších sledovaných parametrech. Pokles hodnot plicních funkcí, FEV1, transfer faktoru plic pro oxid uhelnatý (TLCO) a kyvadlového testu chůzí (shuttle walking test, SWT) byl u obou skupin pacientů prakticky shodný. Stejně tak nebyly zaznamenány rozdíly v počtu exacerbací CHOPN a v poklesu kvality života hodnocené podle Respiračního dotazníku Nemocnice sv. Jiří (St. George‘s Respiratory Questionnaire, SGRQ).
. Mezi skupinami nebyly zjištěny rozdíly v dalších sledovaných parametrech. Pokles hodnot plicních funkcí, FEV1, transfer faktoru plic pro oxid uhelnatý (TLCO) a kyvadlového testu chůzí (shuttle walking test, SWT) byl u obou skupin pacientů prakticky shodný. Stejně tak nebyly zaznamenány rozdíly v počtu exacerbací CHOPN a v poklesu kvality života hodnocené podle Respiračního dotazníku Nemocnice sv. Jiří (St. George‘s Respiratory Questionnaire, SGRQ).
Výskyt nežádoucích účinků byl u obou skupin pacientů podobný, vyskytlo se jedno úmrtí v aktivní skupině (respirační selhání) a tři úmrtí v placebové skupině (sepse, pneumonie a generalizovaný karcinom prsu). Sérové hodnoty AAT ve skupině s aktivní léčbou měly sklon být vyšší u pacientů s vyšší vstupní hodnotou (s vyšší vlastní produkcí) a s vyšší tělesnou hmotností. Post hoc analýzy ukázaly, že pokles hustoty plicní tkáně byl nejpomalejší u pacientů s nejvyšší „trough“ sérovou koncentrací AAT (sérovou koncentrací měřenou před další aplikací léku, tedy 7 dnů po předchozí aplikaci), přičemž tento jev nevykazoval plató efekt.
Terminální událostí u progredujícího emfyzému je úmrtí nebo transplantace plic; ty byly zaznamenány u pěti pacientů v rámci studie, přičemž průměrná hustota plicní tkáně byla v době události 19,0 g/l. Při znalosti vstupní hodnoty lze interpolovat průběh poklesu hustoty plicní tkáně a vypočítat čas do výskytu takové příhody. S využitím měřených hodnot byla vypočtena doba do terminálního respiračního selhání, která je pro léčené pacienty 18,1 (12,2–30,1) roku, zatímco pro pacienty v placebové skupině 12,3 (8,1–19,9) roku.
Účinek aplikace AAT byl potvrzen v otevřené části studie, kdy pacienti původně zařazení do placebové skupiny dosáhli stejné rychlosti poklesu hustoty plicní tkáně jako pacienti, kteří byli léčeni AAT od samého počátku. Došlo tedy ke zpomalení dynamiky destrukce plíce u pacientů, kteří přešli od podávání placeba k léčbě AAT.
Závěr
Z výsledků studie RAPID lze učinit několik zásadních závěrů. Pravidelná aplikace lidského AAT pacientům s CHOPN na podkladě deficitu tohoto enzymu vede k průkaznému zpomalení destrukce plicní tkáně. Tento efekt má zřejmě prognostický dopad, neboť odhadovaná doba do terminálního respiračního selhání (případně do transplantace plic) se prodlužuje. Následné analýzy ukázaly, že protektivní účinek AAT je úměrný dosažené sérové koncentraci. Je tudíž pravděpodobné, že zvýšením dávek AAT by mohlo být dosaženo významnějšího účinku. Hodnocení následné otevřené části studie prokázalo, že i opožděné zahájení podávání AAT vede ke zpomalení poklesu hustoty plicní tkáně, ale zničená tkáň již nemůže být obnovena. Účinnost podávání AAT je tudíž tím výraznější, čím dříve se léčba zahájí. Nepochybně je zapotřebí dalších studií, které by určily optimální dávku a frekvenci podávání AAT.
Seznam použité literatury
- [1] Kelly E, Greene CM, Carroll TP, et al. Alpha 1 antitrypsin deficiency. Respir Med 2010; 104: 763–772.
- [2] Stoller, J K. American Thoracic Society/European Respiratory Society Statement. Am J Respir Crit Care Med 2003; 168: 818–900.
- [3] Campos MA, Lascano J. Current Best Practice in Testing and Augmentation Therapy. Ther Adv Resp Dis 2014; 8: 150–161.
- [4] Vreim CE. Survival and FEV1 decline in individuals with severe deficiency of alpha1 antitrypsin. The Alpha 1 Antitrypsin Deficiency Registry Study Group. Am J Respir Crit Care Med 1998; 158: 49–59.
- [5] Seersholm N, Wencker M, Banik N, et al. Does alpha1--antitrypsin augmentation therapy slow the annual decline in FEV1 in patients with severe hereditary alpha1 antitrypsin deficiency? Wissenschaftliche Arbeitsgemeinschaft zur Therapie von Lungenerkrankungen (WATL) alpha1 AT study group. Eur Respir J 1997; 10: 2260–2263.
- [6] Stockley RA, Parr DG, Piitulainen E, et al. Therapeutic efficacy of α 1 antitrypsin augmentation therapy on the loss of lung tissue: an integrated analysis of 2 randomised clinical trials using computed tomography densitometry. Respir Res 2010; 11: 136.
- [7] Chapman KR, Burdon JGW, Piitulainen E, et al. Intravenous augmentation treatment and lung density in severe α1 antitrypsin deficiency (RAPID): a randomised, double blind, placebo controlled trial. Lancet 2015; 386: 360–368.