Denosumab v první linii léčby osteoporózy
Souhrn:
Brunerová L. Denosumab v první linii léčby osteoporózy. Remedia 2020; 30: 645–649.
Od 1. dubna 2020 došlo v České republice změnou úhradové vyhlášky k posunutí denosumabu do první linie léčby osteoporózy u pacientů starších 70 let. Při rozhodování o optimálním typu léčby osteoporózy v první linii a volbě mezi denosumabem a bisfosfonáty je třeba zvážit specifické kontraindikace a toleranci léčby zásadně ovlivňující adherenci (riziko fraktur i mortalitu). V předkládaném textu jsou všechny tyto faktory diskutovány. Zároveň je porovnána účinnost obou těchto léčebných strategií na denzitu kostního minerálu, riziko fraktur, riziko závažných nežádoucích účinků, srovnávána je rovněž adherence k léčbě a zmíněny faktory, které adherenci a perzistenci ovlivňují. V závěru je uvedeno současné doporučení stran délky léčby a naznačeny možné denzitometrické terapeutické cíle.
Summary:
Brunerova L. Denosumab in the first‑line treatment of osteoporosis. Remedia 2020; 30: 645–649.
In the Czech Republic, denosumab has been approved as the first‑line anti‑osteoporotic treatment in patients older than 70 years since April 1, 2020. While choosing optimal anti‑osteoporotic treatment in the first line (denosumab or bisphosphonates), it is essential to consider specific contraindications and tolerance (with great impact on adherence, thus the fracture and even mortality risk). All these factors are discussed, as well as the comparison of efficacy (BMD increase, reduction of fracture risk, risk of serious adverse events), adherence and persistence to treatment are provided. At the end, current expert recommendation is commented and possible densitometry therapeutic goals are suggested.
Key words: osteoporosis, first‑line treatment, denosumab, bisphosphonates, efficacy, safety, adherence to treatment
Úvod
Denosumab představuje první biologikum v léčbě osteoporózy s unikátním mechanismem účinku zasahujícím do kaskády aktivace osteoklastů (vazbou na ligand receptoru pro aktivovaný nukleární faktor kappa B [RANKL] zabrání aktivaci osteoklastů a následné osteoresorpci). Jedná se o lidskou monoklonální protilátku IgG2 indikovanou pro léčbu osteoporózy u postmenopauzálních žen a mužů, dále u pacientů s glukokortikoidy indukovanou osteoporózou a u mužů s karcinomem prostaty, u nichž hormonální léčba vede k úbytku kostní hmoty. V indikaci osteoporózy je denosumab aplikován subkutánně v intervalu šesti měsíců [1].
Od 1. dubna 2020 se změnila úhradová kritéria denosumabu v České republice. K původní úhradě u postmenopauzálních žen a u mužů s denzitometricky prokázanou osteoporózou (s T skóre kostní denzity ‒2,5 až ‒4,0 směrodatné odchylky) po osteoporotické fraktuře či při dokumentované neúčinnosti, kontraindikaci nebo nesnášenlivosti bisfosfonátů přibylo nové kritérium – dosažení věku 70 let. Tím se tedy denosumab dostává (byť ve vyšší věkové kategorii) do první léčebné linie [2].
Desetiletá data
Pro denosumab máme v současné době k dispozici již i desetiletá data z extenze registrační studie FREEDOM, v níž pacientky z původního tříletého placebem kontrolovaného klinického hodnocení buď pokračovaly v léčbě denosumabem po dobu dalších sedmi let, nebo byly z placeba po třech letech na období následujících sedmi let na terapii denosumabem převedeny. Tato rozšířená studie prokázala setrvale nízký výskyt všech sledovaných fraktur u pacientek s pokračující léčbou denosumabem a významné snížení rizika rozvoje fraktur u pacientek převedených na denosumab [3].
Nejlepší informace o přínosech a rizicích dlouhodobé léčby získáváme z dlouhodobých studií kontrolovaných placebem, ovšem jakmile se účinnost léčebného postupu prokázala v kratší studii, není možné uvedená hodnocení z etických a praktických důvodů provádět. Proto byla pro extenzi původního registračního klinického sledování FIT s alendronátem – studii FLEX [4] ‒ vyvinuta speciální statistická metoda, tzv. metoda dvojčat, která byla následně použita i pro denosumab (extenze studie FREEDOM [5]). Jednoduše lze metodu popsat následně: pro každého účastníka v dlouhodobé studii bylo vytvořeno virtuální dvojče s identickými vstupními charakteristikami a délkou sledování. Očekávané výskyty fraktur u virtuálních dvojčat byly kalkulovány pomocí Poissonova modelu při použití vstupních prediktorů (věk, body mass index, anamnéza fraktur, T skóre bederní páteře a proximálního femuru, kouření) [5]. Fraktury byly hodnoceny jako klinické (nonvertebrální a klinicky evidentní vertebrální), hlavní osteoporotické (klinicky evidentní fraktura obratle, předloktí, proximálního femuru či humeru), vertebrální (radiografické) a nonvertebrální. Odhadnutý výskyt fraktur ve skupině virtuálního placeba a pozorovaný výskyt fraktur u pacientek dlouhodobě exponovaných denosumabu na 100 000 pacientoroků činil pro klinické zlomeniny 3 180 vs. 1 777, pro hlavní osteoporotické zlomeniny 2 699 vs. 1 525, pro vertebrální zlomeniny byl poměr 1 879 vs. 901 a pro nonvertebrální zlomeniny 2 924 vs. 1 528. Obdobným způsobem byl zpracován rovněž výskyt obávaných závažných nežádoucích účinků – atypické zlomeniny femuru (AFF) a osteonekrózy čelisti (ONJ) ‒, jenž zahrnoval pět případů, respektive 35 případů na 100 000 pacientoroků. Autoři na základě poměru počtu klinických fraktur, jimž bylo léčbou zabráněno (odhad fraktur v placebové skupině – pozorovaný výskyt fraktur při terapii denosumabem/100 000 pacientoroků), k počtu pozorovaných AFF či ONJ (při léčbě denosumabem, v placebové skupině byla kalkulována 0) také spočítali skeletální poměr přínosu a rizika léčby denosumabem, který činil 281 pro AFF a 40 pro ONJ. Na základě uvedené analýzy lze uzavřít, že desetiletý skeletální poměr přínosu a rizika skóruje pro denosumab.
Rozhodování v první léčebné
linii
V současné době se tedy v první léčebné linii rozhodujeme u pacientů starších 70 let, zda zvolíme denosumab, či bisfosfonáty. Při rozhodovacím procesu musíme zvážit několik faktorů.
Indikace – denzitometricky prokázaná osteoporóza – je u naprosté většiny našich pacientů (obvykle pacientek) splněna pro obě skupiny, tedy pro denosumab (v tomto případě je z hlediska úhrady třeba splnit věkové kritérium či přítomnost fraktury) [1] i bisfosfonáty [6‒9].
Problém může nastat při hodnocení kontraindikací. Zatímco hypokalcemie a přecitlivělost jako kontraindikace platí pro obě skupiny, podávání všech bisfosfonátů je limitováno stupněm renální funkce. Používání bisfosfonátů není doporučeno při clearance kreatininu nižší než 30‒35 ml/min [6‒9], denosumab lze předepisovat pacientům zcela bez ohledu na stupeň renální funkce, resp. tíži chronického onemocnění ledvin (tj. stupně 1‒5), a to včetně dialyzovaných nemocných s určitou opatrností vzhledem k možnému riziku rozvoje hypokalcemie. U perorálních bisfosfonátů je navíc třeba pátrat po výskytu onemocnění jícnu a ověřit, zda je pacient schopen vydržet alespoň 30 minut ve vzpřímené poloze [6,7,9].
Zásadní rozdíl je však v toleranci. Zatímco denosumab je obvykle velmi dobře snášen, s nízkým výskytem nežádoucích účinků, podávání bisfosfonátů (zvlášť perorálních) je spojeno s častějším vznikem nezávažných nežádoucích účinků, zejména gastrointestinálních (horní dyspeptický syndrom), podávání perorálních i intravenózních bisfosfonátů pak s tzv. flu like syndromem (chřipkovými příznaky po užití) [6‒9]. Z několika studií s denosumabem vyplynulo podezření na možné vyšší riziko rozvoje infekcí močových cest. Recentně publikovaná metaanalýza zahrnující data z 33 studií však neprokázala zvýšené riziko jakékoliv infekce při léčbě denosumabem ve srovnání s jakýmkoliv komparátorem (relativní riziko [RR] 1,03; 95% interval spolehlivosti [CI] 0,99‒1,06) ani zvýšené riziko úmrtí v souvislosti s infekcí (RR 0,50; 95% CI 0,20‒1,23) či zvýšené riziko rozvoje sepse (RR 0,50; 95% CI 0,17‒1,45) [10].
Výskyt závažných nežádoucích účinků v podobě AFF a ONJ, které jsou obávanou, naštěstí však velmi vzácnou komplikací především dlouhodobé antiresorpční léčby, je v zásadě srovnatelný u bisfosfonátů i denosumabu [11].
Pravděpodobně kombinace častějšího výskytu nezávažných, leč pro pacienta obtěžujících nežádoucích účinků s pravidelným týdenním (případně měsíčním) rituálem při užívání perorálních bisfosfonátů vede k výrazně nižší adherenci k léčbě ve srovnání s denosumabem. Například ve zkříženě uspořádané dvouleté studii DAPS (Denosumab Adherence Preference Satisfaction), v níž randomizovali 250 postmenopauzálních žen s osteoporózou k roční léčbě denosumabem a k následné roční léčbě alendronátem či vice versa, byla terapie denosumabem spojena s významně nižší non adherencí ve srovnání s alendronátem (11,9 % vs. 23,4 % první rok a 7,5 % vs. 36,5 % druhý rok), přičemž adherence byla definována jako aplikace injekce denosumabu po šesti měsících, resp. užití více než 80 % předepsaných tablet alendronátu. Poměry rizik pro non adherenci a non perzistenci, s definicí perzistence jako dvě dávky denosumabu během roku a více než dvě dávky alendronátu v posledním měsíci s dokončením léčby, statisticky významně favorizovaly denosumab (p < 0,05). Většina pacientů (92,4 %) preferovala injekční léčbu [12].
Rozsáhlá britská studie s více než 72 000 pacientkami srovnávala adherenci a perzistenci různých typů antiosteoporotické léčby (denosumab, intravenózní a perorální bisfosfonáty, selektivní modulátory estrogenových receptorů, stroncium, parathormon). Perzistence v léčbě denosumabem za 24 měsíců činila 64 % ve srovnání s 23 %, resp. 24 % u perorálních/intravenózních bisfosfonátů [13].
Obdobně větší adherenci a perzistenci při léčbě denosumabem ve srovnání s perorálními bisfosfonáty prokázala rozsáhlá metaanalýza [14]. Současně potvrdila nákladovou efektivitu (či dokonce šetření nákladů) u pacientů starších 75 let, u pacientů s anamnézou fraktur, s nižším T skóre a s četnějšími rizikovými faktory zlomenin, kteří byli léčeni denosumabem (ve srovnání s bisfosfonáty).
Na lepší adherenci se jistě podílí to, že pacient vnímá léčbu jako nutnou, méně se jí obává a dává jí přednost. Denosumab ve srovnání s alendronátem byl pacienty vnímán jako léčba nutnější, vyvolávající menší obavy a výrazně více preferovaná [12,15].
Adherence neznamená pouze to, jak přesně dle doporučení pacient léčbu užívá. Máme k dispozici studie, které prokázaly, že lepší adherence k antiosteoporotické léčbě je spojena s nižší mortalitou. Vztahem mezi antiosteoporotickou léčbou a mortalitou se zabývala např. rozsáhlá tchajwanská studie s více než 13 000 pacienty staršími 65 let. Studie ukázala, že roční, tříletá a pětiletá mortalita byla významně nižší u pacientů, kteří byli s osteoporózou léčeni, ve srovnání s pacienty bez léčby (RR celkové mortality léčené skupiny 0,63; 95% CI 0,58–0,68; p < 0,0001). Při porovnání léčených pacientů (s dobrou versus špatnou adherencí) bylo riziko celkové mortality významně nižší u nemocných s dobrou adherencí (poměr rizik [HR] 0,41; 95% CI 0,32–0,51; p < 0,0001). Mortalita neléčených prakticky odpovídala mortalitě pacientů sice léčených, ovšem s nedostatečnou adherencí [16].
Profesor Lakatos publikoval velmi zajímavá maďarská celonárodní data cílená na vztah mezi compliance s antiosteoporotickou léčbou a rizikem fraktury. Obecně měli pacienti s dobrou compliance o 43 % nižší riziko fraktury ve srovnání s pacienty s non compliance. Nemocní, kteří dobře adherovali k injekční antiosteoporotické léčbě, měli riziko fraktury nižší dokonce o 56 % (pacienti s perorální léčbou o 40 %) [17].
U denosumabu je optimální z hlediska léčebného efektu dodržovat doporučené intervaly mezi jednotlivými dávkami (tj. šest měsíců), jak potvrdila recentně publikována práce [18]. V této studii byl za dobrou adherenci označen interval mezi injekcemi ≤ 7 měsíců. Pokud byl denosumab podáván v delších intervalech, došlo k významně menšímu vzestupu denzity kostního minerálu (bone mineral density, BMD) v oblasti bederní páteře i proximálního femuru.
Srovnáváme li denosumab a bisfosfonáty, nelze se vyhnout klíčové otázce, která ze dvou antiresorpčních léčebných strategií je účinnější na zvýšení BMD a v redukci rizika fraktur. Na toto téma byla recentně publikována metaanalýza 10 relevantních studií zahrnující 5 361 pacientů. Denosumab zvýšil BMD ve srovnání s bisfosfonáty o 1‒1,4 % ve všech vyšetřovaných lokalizacích (bederní páteř, celkový proximální femur, krček; vše p < 0,001) za 12 měsíců i za 24 měsíců (rozdíl vzestupu 1,19‒1,74 %; p < 0,001). Rozdíl ve výskytu fraktur byl po roce léčby nevýznamný ve všech relevantních studiích, po 24 měsících vedla terapie denosumabem v jedné studii ke statisticky významně nižšímu výskytu osteoporotických fraktur (ve srovnání s alendronátem; RR 0,51; 95% CI 0,27‒0,97). K definitivní odpovědi, hlavně na otázku rozdílu v redukci fraktur, bude však třeba delších a rozsáhlejších studií [19].
Denzitometrické cíle léčby
Dosud nedořešeným a stále diskutovaným tématem s malou oporou v evidenci jsou denzitometrické cíle léčby osteoporózy, které by byly spojeny s nižším rizikem výskytu fraktur. Pracovní skupina American Society for Bone and Mineral Research and the United States National Osteoporosis Foundation (ASBMR NOF) doporučovala dosažení T skóre více než ‒2,5 [20]. Autorský kolektiv pod vedením profesora Ferrariho analyzoval data ze studie FREEDOM a z její sedmileté extenze. Incidence nonvertebrálních fraktur byla nižší u žen, které při léčbě dospěly k vyššímu T skóre s dosažením plateau mezi ‒2 a ‒1,5, nezávisle na věku a prevalentních vertebrálních frakturách. Vyššího T skóre po léčbě snáze dosáhly ženy s vyšší vstupní hodnotou. Studie podporuje stanovení konkrétních denzitometrických cílů při léčbě denosumabem, neboť terapií dosažené T skóre představuje silný indikátor rizika zlomenin [21].
Délka léčby
Zásadní rozdíl mezi denosumabem
a bisfosfonáty je také v délce léčby. Ačkoliv máme
u denosumabu i bisfosfonátů k dispozici desetiletá
data, bisfosfonáty podáváme obvykle 3‒5 let a poté ‒
vzhledem k mechanismu účinku ‒ tuto léčbu přerušujeme
(tzv. drug holiday) za pokračující substituce vápníku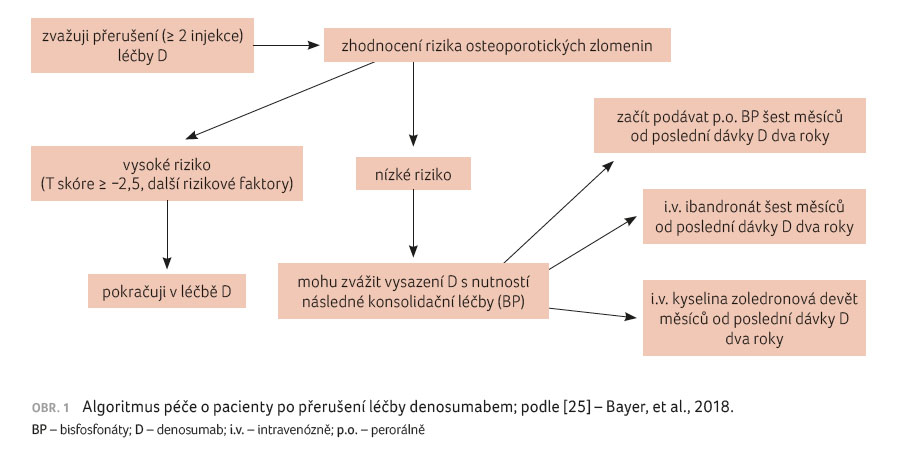 a vitaminu D a klinické a denzitometrické monitorace
pacienta [22]. Denosumab se ve srovnání s bisfosfonáty
v kosti nedeponuje a 12‒18 měsíců po přerušení
léčby dochází k významnému vzestupu kostní remodelace
s rizikem poklesu BMD a nárůstu počtu mnohočetných
vertebrálních fraktur (především u jedinců s prevalentní
zlomeninou těla obratle) [23]. Léčba denosumabem by proto měla
být dlouhodobá. Pokud je z nějakého důvodu nutné léčbu
přerušit, ukazují výsledky menších studií na nezbytnost
navázání léčby bisfosfonáty (sekvenční neboli
konsolidační terapie [24]). Společnost pro metabolická onemocnění
skeletu navrhla algoritmus péče o tyto pacienty (obr. 1)
[25].
a vitaminu D a klinické a denzitometrické monitorace
pacienta [22]. Denosumab se ve srovnání s bisfosfonáty
v kosti nedeponuje a 12‒18 měsíců po přerušení
léčby dochází k významnému vzestupu kostní remodelace
s rizikem poklesu BMD a nárůstu počtu mnohočetných
vertebrálních fraktur (především u jedinců s prevalentní
zlomeninou těla obratle) [23]. Léčba denosumabem by proto měla
být dlouhodobá. Pokud je z nějakého důvodu nutné léčbu
přerušit, ukazují výsledky menších studií na nezbytnost
navázání léčby bisfosfonáty (sekvenční neboli
konsolidační terapie [24]). Společnost pro metabolická onemocnění
skeletu navrhla algoritmus péče o tyto pacienty (obr. 1)
[25].
Závěr
Dle současně nastavené úhrady v první linii léčby osteoporózy zvažujeme, zda podávat bisfosfonáty, či denosumab (u osob nad 70 let). V rámci rozhodovacího procesu bychom měli vzít v úvahu indikace, kontraindikace a toleranci léčby, která zásadním způsobem ovlivňuje adherenci s jasným vlivem na prognózu pacienta. Zatímco účinnost denosumabu a bisfosfonátů je minimálně srovnatelná (s náznakem lepší efektivity denosumabu), minimální kontraindikace a významně vyšší adherence k léčbě favorizují denosumab. Zásadně odlišná je však délka léčby vyplývající z mechanismu účinku ‒ v případě denosumabu dlouhodobá s nutností konsolidační fáze po přerušení ve srovnání s drug holiday u bisfosfonátů.
Seznam použité literatury
- [1] SPC Prolia. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/prolia‑epar‑product‑information_cs.pdf [navštíveno 15. 11. 2020]
- [2] Prolia. Informace o úhradě. Dostupné na: http://www.sukl.cz/modules/medication/detail.php?code=0167653&tab=prices [navštíveno 15. 11. 2020]
- [3] Bone HG, Wagman RB, Brandi ML, et al. 10 years of denosumab treatment in postmenopausal women with osteoporosis: results from the phase 3 randomised FREEDOM trial and open‑label extension. Lancet Diabetes Endocrinol 2017; 5: 513‒523.
- [4] Vittinghoff E, McCulloch CE, Woo C, Cummings SR. Estimating long‐term effects of treatment from placebo‐controlled trials with an extension period, using virtual twins. Statist Med 2010; 29: 1127‒1136.
- [5] Ferrari S, Lewiecki EM, Butler PW, et al. Favorable skeletal benefit/risk of long‑term denosumab therapy: A virtual‑twin analysis of fractures prevented relative to skeletal safety events observed. Bone 2020; 134: 115287.
- [6] SPC Fosamax. Dostupné na: https://www.sukl.cz; fosamax‑70‑mg‑1x‑tydne‑spc.pdf [navštíveno 15. 11. 2020]
- [7] SPC Bonviva. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/bonviva‑epar‑product‑information_cs.pdf [navštíveno 15. 11. 2020]
- [8] SPC Aclasta. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/aclasta‑epar‑product‑information_cs.pdf [navštíveno 15. 11. 2020]
- [9] SPC Risendros. Dostupné na: https://www.sukl.cz; risendros‑spc.pdf [navštíveno 15. 11. 2020]
- [10] Diker‑Cohen T, Rosenberg D, Avni T, et al. Risk for Infections During Treatment With Denosumab for Osteoporosis: A Systematic Review and Meta‑analysis. J Clin Endocrinol Metab 2020; 105: 1641–1658.
- [11] Chandran T, Venkatachalam I. Efficacy and safety of denosumab compared to bisphosphonates in improving bone strength in postmenopausal osteoporosis: a systematic review. Singapore Med J 2019; 60: 364‒378.
- [12] Freemantle N, Satram‑Hoang S, Tang E, et al. Final results of the DAPS (Denosumab Adherence Preference Satisfaction) study: a 24‑month, randomized, crossover comparison with alendronate in postmenopausal women. Osteoporos Int 2012; 23: 317–326.
- [13] Morley J, Moayyeri A, Ali L, et al. Persistence and compliance with osteoporosis therapies among postmenopausal women in the UK Clinical Practice Research Datalink. Osteoporos Int 2020; 31: 533–545.
- [14] Morizio P, Burkhart JI, Ozawa S. Denosumab: A Unique Perspective on Adherence and Cost‑effectiveness Compared With Oral Bisphosphonates in Osteoporosis Patients. Ann Pharmacother 2018; 52: 1031‒1041.
- [15] Kendler D, Chines A, Clark P, et al. Bone Mineral Density After Transitioning From Denosumab to Alendronate. J Clin Endocrin Metab 2020; 105: e255‒e264.
- [16] Yu S, Cheng JS, Chen YC, et al. Adherence to anti‑osteoporosis medication associated with lower mortality following hip fracture in older adults: a nationwide propensity score‑matched cohort study. BMC Geriatr 2019; 19: 290.
- [17] Lakatos P, Toth E, Kovács E, et al. Compliance Protects Against Fracture in Postmenopausal Women with Osteoporosis in Hungary. ECCEO 2013. Dostupné na: https://www.researchgate.net/publication/267024248 [navštíveno 15. 11. 2020]
- [18] Lyu H, Zhao SS, Yoshida K, et al. Delayed Denosumab Injections and Bone Mineral Density Response: An Electronic Health Record‑based Study. J Clin Endocrin Metab 2020; 105: 1435‒1444.
- [19] Lyu H, Jundi B, Xu C, et al. Comparison of Denosumab and Bisphosphonates in Patients With Osteoporosis: A Meta‑Analysis of Randomized Controlled Trials. J Clin Endocrinol Metab 2019; 104: 1753–1765.
- [20] Cummings SR, Cosman F, Lewiecki EM, et al. Goal‐Directed Treatment for Osteoporosis: A Progress Report From the ASBMR‐NOF Working Group on Goal‐Directed Treatment for Osteoporosis. J Bone Miner Res 2017; 32: 3‒10.
- [21] Ferrari S, Libanati C, Lin CJF, et al. Relationship Between Bone Mineral Density T‑Score and Nonvertebral Fracture Risk Over 10 Years of Denosumab Treatment. J Bone Miner Res 2019; 34: 1033‒1040.
- [22] Rosa J, Palička V, Horák P, et al. Neúčinnost a selhání léčby osteoporózy. Stanovisko SMOS. Osteolog Bull 2017; 2: 51‒55.
- [23] Popp AW, Zysset PK, Lippuner K. Rebound‑associated vertebral fractures after discontinuation of denosumab ‒ from clinic and biomechanics. Osteoporos Int 2016; 27: 1917–1921.
- [24] Horne AM, Mihov B, Reid IR. Bone loss after romosozumab/denosumab: Effects of bisphosphonates. Calcif Tissue Int 2018; 103: 55‒61.
- [25] Bayer M, Horák P, Palička V, et al. Dlouhodobá léčba denosumabem a její přerušení: odborné stanovisko pracovní skupiny SMOS ČLS JEP. Clin Osteol 2018; 23: 32–37.