Dlouhodobý efekt a bezpečnost secukinumabu v terapii ankylozující spondylitidy – kazuistické sdělení
Souhrn
Ciferská H. Dlouhodobý efekt a bezpečnost secukinumabu v terapii ankylozující spondylitidy – kazuistické sdělení. Remedia 2023; 33: 36–39.
Ankylozující spondylitida (AS) je chronické zánětlivé revmatické onemocnění, které typicky postihuje axiální skelet a je spojeno se strukturálními změnami zachycenými zobrazovacími metodami (magnetickou rezonancí, rentgenovým snímkem). Zánětlivá bolest zad patří k typickým příznakům AS. Včasná diagnóza spojená s adekvátní léčbou a režimovými opatřeními vede k dosažení remise, či alespoň nízké aktivity onemocnění a zabraňuje rozvinutí nevratných změn axiálního skeletu. Secukinumab je plně humánní monoklonální protilátka proti interleukinu 17A. Tento cytokin hraje klíčovou roli v patogenezi AS a je dobrým terapeutickým cílem. Secukinumab prokázal svou dobrou účinnost a bezpečnost v programu studií MEASURE 1–4 zaměřených na populaci pacientů s AS. Kazuistické sdělení mladého pacienta s AS dokumentuje dlouhodobý přínos a adherenci k terapii secukinumabem.
Klíčová slova: ankylozující spondylitida – biologická léčba – interleukin 17.
Summary
Ciferska H. Long‑term effect and safety of secukinumab in the therapy of ankylosing spondylitis – a case study. Remedia 2023; 33: 36–39.
Ankylosing spondylitis (AS) is a chronic inflammatory rheumatic disease, typically affecting the axial skeleton, associated with structural changes on imaging (magnetic resonance, X‑ray). Inflammatory back pain is a typical AS symptom. Timely diagnosis, adequate therapy and lifestyle changes may all lead to remission or at least low disease activity, preventing irreversible changes of the axial skeleton. Secukinumab is a fully human monoclonal antibody against interleukin 17A. This cytokine plays a key role in AS pathogenesis, therefore representing a good therapeutic target. Secukinumab has shown both good effectiveness and safety in MEASURE 1‑4 trials including AS patients. Our case study concerning a young AS patient documents the long‑term effects of secukinumab therapy and adherence to it.
Key words: ankylosing spondylitis – biological therapy – interleukin 17.
Úvod
Axiální spondyloartritida (axSpA) je chronické zánětlivé revmatické onemocnění postihující muskuloskeletální aparát a často provázené celou řadou různorodých orgánových manifestací. U nemocných se spondyloartritidou se mohou objevit periferní artritida, entezitida, daktylitida nebo extramuskulární orgánové projevy (uveitida, psoriáza, idiopatické střevní záněty). Zastřešující pojem axSpA zahrnuje celou řadu pacientů s radiografickým průkazem sakroiliitidy (radiografická axSpA, r‑axSpA, také nazývaná ankylozující spondylitida, AS) nebo bez radiografického průkazu sakroiliitidy (neradiografická axSpA, nr‑axSpA) [1]. Jejich závažnost i terapeutický přístup k nim jsou obdobné včetně farmakologické i nefarmakologické léčby.
Včasná a účinná léčba spojená s režimovými opatřeními představuje první krok ke kontrole zánětlivých projevů AS, k prevenci nevratných strukturálních změn skeletu a rozvoje komorbidit. První linii terapie reprezentují nesteroidní antirevmatika (NSA), teprve při jejich selhání je doporučována biologická terapie, eventuálně terapie cílenými syntetickými léky ze skupiny inhibitorů Janus kináz (JAKi). Kromě již etablovaných inhibitorů tumor nekrotizujícího faktoru (TNFi) přibyly nově v doporučeních inhibitory interleukinu 17 (IL‑17i) a JAKi (obr. 1) [1]. Vyšší hladiny IL‑17 byly zjištěny v séru u pacientů s AS [2,3].![OBR. 1 Doporučení ASAS-EULAR pro léčbu axiální spondyloartritidy (aktualizace 2022); podle [1] – Ramiro, et al, 2023. OBR. 1 Doporučení ASAS-EULAR pro léčbu axiální spondyloartritidy (aktualizace 2022); podle [1] – Ramiro, et al, 2023.](https://www.remedia.cz/1-23-37-photo-pg-971-367-365-.png)
Secukinumab má schopnost selektivní vazby na IL‑17A, což vede k inhibici interakce s receptorem pro IL‑17. Přínos secukinumabu u pacientů s AS vychází z předpokladu potlačení zvýšené exprese IL‑17 v subchondrální kostní dřeni intervertebrálních kloubů a tím v zabránění vzniku lokálního zánětu vedoucího k nevratným změnám skeletu. Doporučená dávka secukinumabu je 150 mg aplikovaná subkutánně (s.c.) s doporučenou indukční dávkou v týdnu 0, 1, 2, 3 a 4 následovaná měsíční udržovací dávkou 150 mg, eventuálně na základě terapeutické odpovědi lze dávku navýšit na 300 mg. Secukinumab je kontraindikován při známé alergické reakci na některé složky podávaného přípravku, dále u závažné infekce, včetně tuberkulózy. Přípravek není dosud určen těhotným ženám. V průběhu léčby se nedoporučuje podávat živé vakcíny a pacienti by měli být očkováni před zahájením biologické léčby [4,5].
Doklady o bezpečnosti a účinnosti z klinického programu MEASURE
Klinické studie fáze III MEASURE 1–4 sledovaly účinnost a bezpečnost secukinumabu v terapii pacientů s AS. Data získaná z klinického hodnocení MEASURE 1–3 doložila efekt s.c. podávaného secukinumabu v dávce 150 mg a následné extenze prokázaly přetrvávající účinek i po 52. týdnu sledování. Efekt secukinumabu byl prokázán nejen u pacientů naivních k biologické léčbě (bDMARDs, biologické chorobu modifikující antirevmatické léky), ale také u nemocných s AS, kteří byli již v minulosti léčeni TNFi [6–8].
MEASURE 1 byla randomizovaná, dvojitě zaslepená studie s následným prodloužením sledující pacienty s AS, kteří dostali úvodní intravenózní dávku secukinumabu 10 mg/kg v týdnech 0, 2 a 4 následovanou 75 mg nebo 150 mg secukinumabu s.c. každé čtyři týdny. Efekt secukinumabu byl patrný již v prvních týdnech podávání ve všech sledovaných parametrech: skórovacích systémech aktivity nemoci, laboratorních ukazatelích a ukazatelích hodnocených pacienty. Dlouhodobý efekt secukinumabu byl dokumentován čtyř‑ a pětiletými daty získanými z extenze studie (tab. 1). Rovněž bezpečnostní data byla uspokojivá. MEASURE 1 byla první studií, která demonstrovala kromě efektu i dlouhodobou bezpečnost secukinumabu v dávce 150 mg po čtyřech letech a následně i po pěti letech [9–11].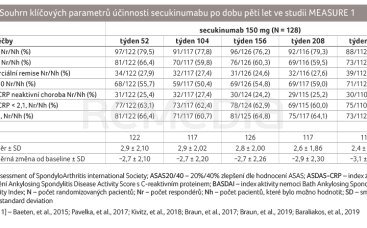
MEASURE 2 byla pětiletá studie, která na rozdíl od MEASURE 1 neměla úvodní intravenózní dávku a secukinumab byl podáván pouze s.c. MEASURE 3 měla obdobné úvodní intravenózní schéma, které bylo následováno s.c. aplikací v dávce 150 mg a 300 mg každé čtyři týdny. MESURE 4 měla ramena se zahajovací dávkou a bez ní s následným s.c. podáváním.
Studie MEASURE 1 dosáhla primárního cílového ukazatele, kterým byla terapeutická odpověď ASAS20 (20% zlepšení dle Assessment of SpondyloArthritis international Society) v týdnu 16; této odpovědi dosáhlo ve skupině s dávkou secukinumabu 150 mg 61 % sledovaných. Dalším sledovaným parametrem studie MEASURE 1 byl vliv secukinumabu na radiografickou progresi. V týdnu 208 nebyla zaznamenána radiografická progrese u 78,9 % pacientů dostávajících secukinumab v dávce 150 mg a u 78,6 % ve skupině s dávkou 75 mg.
Ve studii MEASURE 2 dosáhla požadovaných výsledků dávka 150 mg secukinumabu s.c. Obdobných výsledků bylo dosaženo i ve sledovaných sekundárních cílových ukazatelích jak v poklesu hodnot zánětlivých parametrů, tak v terapeutické odpovědi hodnocené pacientskými ukazateli. Secukinumab prokázal dobrou perzistenci na léčbě, a to i po pěti letech terapie se srovnatelnými daty z týdne 52 pro dávku 150 mg secukinumabu.
MEASURE 3 potvrdila efekt secukinumabu v týdnu 52; odpovědi ASAS20 dosáhlo 74,3 % osob při dávce 300 mg secukinumabu a 69,7 % při dávce 150 mg. Rovněž bylo dosaženo sekundárních cílů, které byly v programu MEASURE obdobné.
Program studií MEASURE sledoval kromě efektu i bezpečnostní profil secukinumabu, který se rámcově nevymykal ostatním bDMARDs. Nejčastějšími dokumentovanými nežádoucími účinky byly infekce horních cest dýchacích, bolesti hlavy a průjem. Tabulka 2 shrnuje výskyt nežádoucích příhod v průběhu programu studií MEASURE [6–11].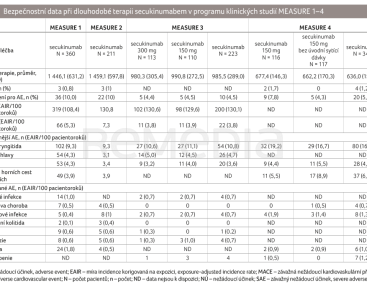
Kazuistika
Třiadvacetiletý pacient byl referován na naše pracoviště pro plíživě narůstající bolesti v oblasti dolní poloviny zad a kyčelních kloubů. Obtíže započaly v 18 letech, bolesti byly zprvu připisovány extrémní fyzické zátěži v rámci sportovní aktivity. Režimová opatření spojená s klidovým režimem a podáním konvenčních analgetik byla bez efektu, tělesný klid naopak obtíže výrazně zhoršoval. Pacient byl buzen bolestí dolní poloviny zad nad ránem. Kvůli narůstajícím bolestem kyčelních kloubů byla ortopedem provedena MRI kyčelních kloubů s průkazem oboustranné synovitidy. Vzhledem k pozitivitě HLA‑B27 a relativně uspokojivému efektu NSA bylo vysloveno podezření na spondyloartritidu. Pacient byl odeslán k revmatologickému vyšetření. Anamnesticky byla přítomna dlouhodobá zánětlivá bolest zad a kyčelních kloubů s odpovídajícím omezením hybnosti páteře. Byl doplněn rentgenový snímek sakroiliakálních kloubů, kde byla popsána oboustranná sakroiliitida. Laboratorně byla vstupně přítomna elevace hodnot C‑reaktivního proteinu (CRP) 11 mg/l. Pacient splnil klasifikační kritéria ASAS pro AS. Vstupní aktivita hodnocená indexem BASDAI (Bath Ankylosing Spondylitis Disease Activity Index) dosahovala 4,5. Byla provedena změna NSA z ibuprofenu na diklofenak. Pacient byl edukován o svém onemocnění a režimových opatřeních. Kontrolní sonografické vyšetření prokázalo regresi koxitidy, normalizaci zánětlivých parametrů a pokles BASDAI na 1,3. Nicméně i přes terapii NSA a rehabilitační léčbu došlo k opětovnému nárůstu obtíží, byla provedena změna NSA na celekoxib. Ten měl ale pouze přechodný krátkodobý efekt. Objevila se znovu výrazná bolest v oblasti kyčlí. Sonograficky byla potvrzena recidiva koxitidy, která patří k závažné manifestaci SpA. Rovněž došlo ke zvýšení hodnoty CRP na 26 mg/l s korespondujícím postupným nárůstem aktivity nemoci až na BASDAI 6,3. Pacient byl indikován k zahájení biologické léčby secukinumabem. Remise onemocnění byla patrná již po úvodním zahajovacím schématu. Došlo k sonografické regresi koxitidy, poklesu zánětlivých parametrů a k ústupu klinických obtíží. Pacient je nyní již pět let léčen secukinumabem. Efekt terapie je stabilní. Nebyl zaznamenán vážnější relaps AS. Nebyly zaznamenány závažné nežádoucí účinky, pouze ojedinělé virové infekty horních cest dýchacích, covid‑19 dosud pacient neprodělal. Rovněž kontrolní rentgenové snímky nevykazovaly progresi a nález byl stacionární. Pacient nevynechal ani jednu dávku po celou dobu léčby secukinumabem.
Závěr
Secukinumab byl prvním inhibitorem IL‑17A schváleným pro terapii AS. Jedná se o bDMARD s dobrým účinkem a přijatelným bezpečnostním profilem, jak bylo dokumentováno klinickými studiemi programu MEASURE. Kazuistika prezentuje mladého nemocného, u něhož byla zahájena včasná terapie secukinumabem s navozením remise a dobrou adherencí k terapii, která trvala pět let a byla provázena minimálními nežádoucími účinky v podobě ojedinělých respiračních infektů. Secukinumab byl zařazen jako další bDMARD pro terapii SpA dle recentních doporučení ASAS-EULAR.
Podpořeno projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 023728 (Revmatologický ústav).
Literatura
[1] Ramiro S, Nikiphorou E, Sepriano A, et al. ASAS‑EULAR recommendations for the management of axial spondyloarthritis: 2022 update. Ann Rheum Dis 2023; 82: 19–34.
[2] Miossec P. Update on interleukin‑17: a role in the pathogenesis of inflammatory arthritis and implication for clinical practice. RMD Open 2017; 3: e000284.
[3] Speeckaert R, Lambert J, Grine L, et al. The many faces of interleukin‑17 in inflammatory skin diseases. Br J Dermatol 2016; 175: 892–901.
[4] Loricera J, Galíndez‑Aguirregoikoa E, Blanco R. Safety of secukinumab for the treatment of active ankylosing spondylitis. Expert Opin Drug Saf 2021; 20: 627–634.
[5] Souhrn údajů o přípravku Cosentyx. Dostupné na: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_Product_Information/human/003729/WC500183129.pdf (navštíveno 15. 1. 2023).
[6] Baeten D, Sieper J, Braun J, et al.; MEASURE 1 Study Group; MEASURE 2 Study Group. Secukinumab, an Interleukin‑17A Inhibitor, in Ankylosing Spondylitis. N Engl J Med 2015; 373: 2534–2548.
[7] Pavelka K, Kivitz A, Dokoupilova E, et al. Efficacy, safety, and tolerability of secukinumab in patients with active ankylosing spondylitis: a randomized, double‑blind phase 3 study, MEASURE 3. Arthritis Res Ther 2017; 19: 285.
[8] Kivitz AJ, Wagner U, Dokoupilova E, et al. Efficacy and Safety of Secukinumab 150 mg with and Without Loading Regimen in Ankylosing Spondylitis: 104‑week Results from MEASURE 4 Study. Rheumatol Ther 2018; 5: 447–462.
[9] Braun J, Baraliakos X, Deodhar A, et al. MEASURE 1 study group. Effect of secukinumab on clinical and radiographic outcomes in ankylosing spondylitis: 2‑year results from the randomised phase III MEASURE 1 study. Ann Rheum Dis 2017; 76: 1070–1077.
[10] Braun J, Baraliakos X, Deodhar A, et al. Secukinumab shows sustained efficacy and low structural progression in ankylosing spondylitis: 4‑year results from the MEASURE 1 study. Rheumatology (Oxford) 2019; 58: 859–868.
[11] Baraliakos X, Braun J, Deodhar A, et al. Long‑term efficacy and safety of secukinumab 150 mg in ankylosing spondylitis: 5‑year results from the phase III MEASURE 1 extension study. RMD Open 2019; 5: e001005.