Emicizumab v prevenci krvácení u pacientů s hemofilií A – první zkušenosti u dospělých pacientů
Souhrn:
Smejkal P. Emicizumab v prevenci krvácení u pacientů s hemofilií A – první zkušenosti u dospělých pacientů. Remedia 2020; 30: 166–172.
Možnost použít v profylaktické léčbě u pacientů s hemofilií A a s inhibitorem koagulačního faktoru VIII (FVIII) a též u pacientů bez inhibitoru bispecifickou monoklonální protilátku emicizumab mimikující funkci FVIII je výrazným přínosem v péči o tyto problematické případy. Článek podává stručný přehled charakteristiky emicizumabu, jeho účinnosti a bezpečnosti a prezentuje kazuistiky dvou pacientů s inhibitorem FVIII a jednoho pacienta bez inhibitoru, kteří jsou profylakticky léčeni emicizumabem. Všechny kazuistiky jsou potvrzením dosavadních příznivých literárních zkušeností.
Summary:
Smejkal P. Emicizumab in the prevention of bleeding in patients with haemophilia – first experience in adult patients. Remedia 2020; 30: 166–172.
The ability to use the bispecific monoclonal antibody emicizumab mimicking FVIII function in prophylactic treatment in patients with haemophilia A and factor VIII inhibitor (FVIII) as well as in patients without FVIII inhibitor is a significant benefit in the management of these problematic cases. The article gives a brief review of the characteristics of emicizumab, its efficacy and safety, and presents case reports of two patients with FVIII inhibitor and one without inhibitor prophylactically treated with emicizumab, confirming the positive literature experience to date.
Key words: emicizumab, HAVEN study, bleeding, laboratory monitoring
Úvod
Hemofilie A je vrozená krvácivá choroba s velmi nepříznivým vlivem na zdravotní stav pacienta. Defekt koagulačního faktoru VIII (FVIII), především u těžké formy hemofilie s koncentrací FVIII < 1 %, je provázen častým kloubním a svalovým krvácením vedoucím až k invaliditě. V dnešní době je standardem léčby profylaktická aplikace koncentrátů FVIII u všech těžkých a případně i středně těžkých (FVIII 1‒5 %) forem hemofilie A. Tímto způsobem lze předejít většině spontánních krvácivých epizod a krvácení do mozku. Je však třeba intravenózní (i.v.) přístup k aplikacím koncentrátu FVIII několikrát týdně, což je v raném věku problematické. Navíc u zhruba 20‒30 % pacientů s těžkou formou hemofilie A dochází po aplikaci koncentrátů FVIII k rozvoji inhibitoru FVIII (aloprotilátky proti FVIII), který následně znemožňuje prostou substituci FVIII a pacient musí být léčen při krvácení nebo profylakticky přípravky s bypassovou aktivitou, což je rekombinantní aktivovaný faktor VII (rFVIIa) nebo protrombinový komplex s aktivovaným FVII (aPCC) [1]. Tato léčba je oproti koncentrátům FVIII několikanásobně dražší, a přitom méně účinná.
O emicizumabu teoreticky
Humanizovaná bispecifická monoklonální protilátka emicizumab nahrazuje funkci FVIII propojením aktivovaného faktoru IX (FIXa) s jeho substrátem faktorem X (FX). Ve srovnání s FVIII má emicizumab desetkát nižší afinitu k FIXa a šestkrát nižší afinitu k FX [2]. Na druhé straně se jedná o trvalou aktivaci hemostatických procesů, která není závislá na aktivaci FVIII trombinem vzniklým po iniciační fázi hemokoagulace. Dochází tak k jistému rozvratu fyziologických spínacích mechanismů hemostázy. Z výše uvedených faktů vyplývá, že emicizumab je vhodným lékem k profylaxi krvácení u pacientů s hemofilií A s inhibitorem FVIII i bez inhibitoru. Jeho velkou výhodou pak je to, že imunoglobulin lze podávat subkutánně (s.c.), a to s frekvencí 1× týdně až 1× za čtyři týdny [3]. Dávkování emicizumabu doporučené výrobcem bylo zvoleno tak, aby koagulační potenciál při plazmatické koncentraci emicizumabu 30–50 µg/ml odpovídal aktivitě FVIII přibližně 10–15 % [4]. Doposud ale nebyl nalezen způsob měření efektu emicizumabu, který by mohl být porovnatelný s fyziologickou koncentrací FVIII. Řečeno jinak, nelze přesně stanovit, jaké hodnotě FVIII odpovídá u konkrétního pacienta dosažená koncentrace emicizumabu, a přesnou odpověď nám nedají ani globální testy hemostázy jako generace trombinu či tromboelastografické vyšetření vzhledem k odlišnému efektu emicizumabu na rozdíl od FVIII: vazba na jiná místa FIX; nerozlišuje mezi FIX a FIXa a FX a FXa; není vazba na von Willebrandův faktor, který lokalizuje FVIII v místě porušení endotelu; neváže se na fosfolipidy; jeho efekt není na rozdíl od FVIIIa regulován [2].
Doporučené dávkování emicizumabu je čtyři opakování dávky 3 mg/kg s.c. 1× týdně a pak poloviční dávka 1× týdně, nebo stejná dávka 1× za dva týdny nebo dvojnásobná dávka 1× za čtyři týdny [3]. U prvních dvou dávkovacích režimů bylo dosaženo plazmatické koncentrace emicizumabu před podáním další dávky v průměru kolem 50 µg/ml již pátý týden léčby [5,6], u režimu s aplikací každé čtyři týdny po třech měsících pak koncentrace kolem 40 µg/ml [7]. Pokud je pacient léčen profylaktickou aplikací koncentrátu FVIII, je doporučeno první týden aplikace emicizumabu v této profylaxi pokračovat, ale aplikace přípravků s bypassovou aktivitou by měla být přerušena minimálně 24 hodin před prvním podáním emicizumabu [3].
Přehled o účinnosti a bezpečnosti emicizumabu lze získat ze studií HAVEN 1‒4 a STASEY. Ve studii HAVEN 1 u pacientů ve věku nad 12 let s inhibitorem FVIII v různých ramenech studie byl počet krvácivých epizod ročně (annualized bleeding rate, ABR) vyžadujících léčbu 2,9, resp. 3,3 a zcela bez krvácení vyžadujících léčbu bylo 63 %, resp. 71 % pacientů [5]. Ve studii HAVEN 2 s dětskými pacienty s inhibitorem vyžadovalo léčbu pouze 0,4 ABR a 95 % pacientů nevyžadovalo léčbu krvácení přípravky s bypassovou aktivitou, i když zcela bez krvácení bylo „jen“ 65 % pacientů [8]. Ve studii HAVEN 3 u nemocných ve věku nad 12 let bez inhibitoru FVIII vyžadovalo léčbu koncentrátem FVIII v různých větvích 1,5, respektive 1,3 ABR a zcela bez krvácení vyžadujícího léčbu bylo 56 %, resp. 63 % pacientů [6]. Ve studii HAVEN 4 s pacienty ve věku nad 12 let s inhibitorem FVIII i bez něj léčených režimem 6 mg/kg každé čtyři týdny byl počet ABR 4,5, léčených ABR 2,4 a bez krvácení bylo 29 % pacientů a bez krvácení vyžadujících léčbu pak 56 % pacientů [7]. Ve studii STASEY u nemocných starších 12 let s inhibitorem FVIII léčbu krvácení nevyžadovalo 80 % pacientů [9]. Ve studiích HAVEN 1‒4 byl přitom pozorován příznivý efekt délky léčby emicizumabem na vzrůstající počet pacientů bez krvácení vyžadujícího léčbu: počet pacientů nevyžadujících léčbu krvácení narostl 73.‒96. týden léčby emicizumabem na 88,6 % oproti 70,8 % v počátku léčby v týdnu 1‒24 a obdobně i počet pacientů bez spontánního krvácení narostl z 80,7 % na 94,3 % [10].
Z uvedeného vyplývá, že ne všechna krvácení při profylaktické léčbě emicizumabem vyžadují léčbu přípravky s bypassovou aktivitou či koncentrátem FVIII a obdobně toto platí i pro malé chirurgické výkony provedené u pacientů ve studiích HAVEN 1‒4, z nichž 65,6 % bylo bez další léčby a v pooperačním období pouze 9,2 % z nich vyžadovalo terapii [10].
Při léčbě emicizumabem nejenže vidíme výrazný pokles počtu krvácivých epizod oproti profylaxi přípravky s bypassovou aktivitou (o 79 % dle studie HAVEN 1) [5] i oproti profylaxi FVIII (o 68 % dle studie HAVEN 3) [6], ale především je dosaženo výrazného počtu pacientů zcela bez krvácení, jak je uvedeno výše, což přesahuje podíl nemocných bez krvácení i při použití koncentrátů FVIII s prolongovaným biologickým poločasem [11,12].
Nejčastějším nežádoucím účinkem emicizumabu je lokální reakce v místě vpichu (22 % pacientů dle HAVEN 1‒4). Ze závažných nežádoucích účinků nutno upozornit na riziko rozvoje trombotické mikroangiopatie (3 % dle HAVEN 1) a trombózy (2 % dle HAVEN 1) [5,13], které byly vázané na současnou léčbu aPCC v dávce > 100 U/kg/den a trvající více než 24 hodin [5]. Léčba krvácení pomocí aPCC by proto měla být použita až v nejzazším případě a dávka by neměla překročit 50 U/kg a denní dávka 100 U/kg, pacient by měl být zároveň léčen za hospitalizace a monitorace možného rozvoje trombotické mikroangiopatie [3,14]. Léčba emicizumabem nemá vliv na titr inhibitoru FVIII. Z 398 účastníků studií HAVEN byly protilátky proti emicizumabu detekovány u 14 (3,5 %), z toho polovina byla tranzientních. Pouze ve třech případech (0,75 %) měly protilátky neutralizující charakter a u jednoho z těchto pacientů bylo v léčbě emicizumabem pokračováno, aniž by se během 48 týdnů sledování objevilo krvácení vyžadující léčbu [15].
Z praktického hlediska je nutné zmínit, že již po první dávce emicizumabu dochází k normalizaci aktivovaného parciálního tromboplastinového času (aPTT) a obdobně jsou ovlivněny i všechny testy založené na aPTT (stanovení koagulačních faktorů VIII, IX, XI, XII jednofázovou metodou), včetně detekce titru inhibitoru FVIII. Z tohoto důvodu je nutno při léčbě emicizumabem hodnotu FVIII a inhibitor FVIII monitorovat chromogenní metodou s bovinními reagencii. Hodnotu emicizumabu lze monitorovat jednofázovým testem FVIII nebo chromogenním testem FVIII s lidskými reagencii kalibrovaným na emicizumab [16].
O emicizumabu prakticky
Na našem pracovišti jsme dosud léčbu emicizumabem zahájili u tří pacientů, u nichž tato léčba představovala výrazný medicínský přínos a minimálně u jednoho z nemocných rovněž snížila náklady na terapii.
Kazuistika 1
Pacient, ročník 1975, s těžkou hemofilií A, s mutací v genu pro FVIII c.1310 11 del. G, s negativní rodinnou anamnézou hemofilie. Rozvoj inhibitoru FVIII po appendektomii v roce 1989, s dohledatelným titrem inhibitoru FVIII 80 BU/ml z roku 1991, s chronickou hepatitidou C, s relapsem po léčbě pegylovaným interferonem a ribavirinem.
Pacient byl léčen tzv. on demand (aplikace chybějícího srážlivého faktoru bezprostředně po vzniku krvácení) aPCC a od roku 2000 i rFVIIa, se 7‒12 krvácivými epizodami vyžadujícími léčbu ročně (ABR). Následně narůstal počet ABR na 22‒28, v roce 2007 na 40 a 2008 na 61. V roce 2007 jsme po tři měsíce vyzkoušeli profylaktickou léčbu rFVIIa 120 µg/kg 1× denně, která snížila měsíční frekvenci krvácení ze 6,7 na 3,7. O rok později jsme profylakticky podávali stejnou dávku rFVIIa 2× denně a efekt byl opět jen částečný, měsíční frekvence krvácení poklesla z osmi na čtyři. Při léčbě pouze rFVIIa od roku 2007 docházelo k postupnému snížení titru inhibitoru ze 67 na 5 BU/ml. Byla zvažována imunotolerance, ale nakonec pacient přešel do péče Ústavu hematologie a krevní transfuze v Praze a v roce 2009 mu byly implantovány náhrady obou kolenních kloubů, s následnou redukcí krvácení na přibližně jednou měsíčně a s jen epizodickou několikatýdenní profylaktickou aplikací rFVIIa během rehabilitace.
V roce 2015 se pacient vrátil do péče našeho pracoviště a pro nárůst krvácení na 27 epizod v období 5‒12/2015 byla zahájena trvalá profylaktická léčba rFVIIa, zpočátku měsíc 100 µg/kg denně, pak pět měsíců obden a nakonec dlouhodobě 2× týdně. Při této léčbě měl pacient v roce 2016 a 2017 ABR 6 a 8, s celkovou spotřebou rFVIIa 1 829 mg a 1 393 mg. Došlo k poklesu hodnot inhibitoru na 1,4 BU/ml. V této době byla bezinterferonovým režimem vyléčena hepatitida C.
V roce 2018 jsme se pokusili o imunotoleranci (immune tolerance induction, ITI) protokolem dle Beutelové (FVIII, rituximab, mykofenolát, kortikoidy); po této neúspěšné snaze však titr inhibitoru FVIII stoupl až na 9 426 BU/ml, s nutností následného navýšení profylaxe rFVIIa na 95‒105 µg/kg denně. Za rok 2018 bylo léčeno 11 krvácení. Následně byla profylaxe změněna na aPCC 85 U/kg obden až 75 U/kg každé tři dny a za první kvartál roku 2019 pacient při této léčbě krvácel dvakrát.
Na začátku dubna 2019 byla zahájena profylaktická léčba
emicizumabem ve standardním týdenním režimu s udržovací
dávkou 150 mg týdně. Koncentrace emicizumabu byla poprvé
změřena po devíti týdnech terapie a činila 57,2 μg/ml.
Obdobná hodnota, která uvádí i titry inhibitoru FVIII
a výsledky generace trombinu v plazmě chudé
na trombocyty (platelet poor plasma, PPP), kdy peak trombinu byl
většinou lehce subnormální a celková generace trombinu
(plocha pod křivkou AUC) byla až na jednu výjimku v normě,
pak byla naměřena i v průběhu následujících sedmi
měsíců (tab. 1).
Pro srovnání jsou uvedeny výsledky generace trombinu při
předchozí léčbě pacienta aPCC či rFVIIa.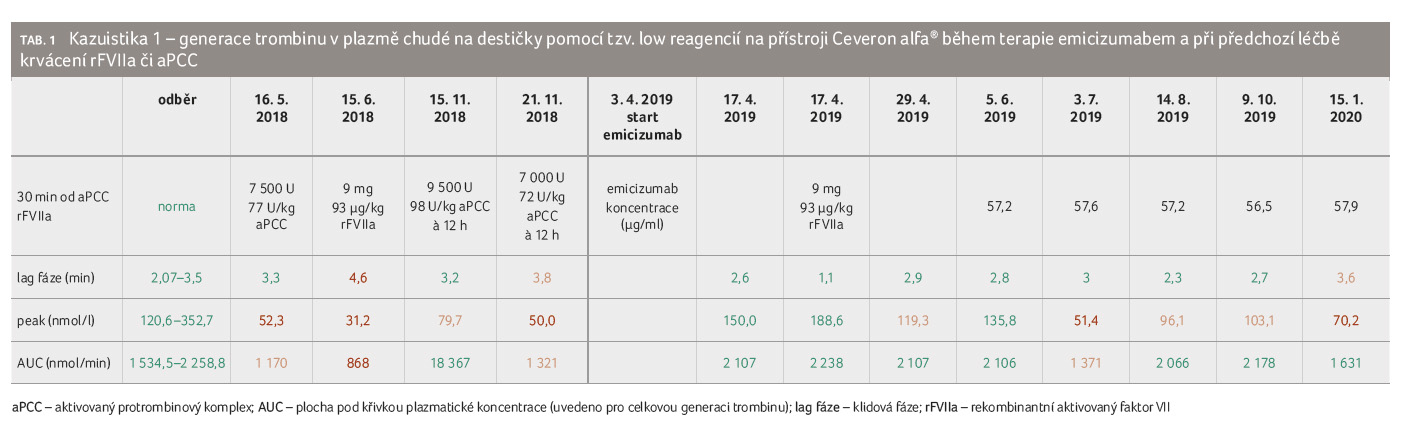
Během 11,5 měsíce léčby emicizumabem pacient sám doma léčil krvácení dvakrát jednorázovou dávkou rFVIIa 100 µg/kg: vždy se jednalo o krvácení do kloubu, z toho jednou o potraumatické (v čekárně mu do kolena narazil jiný pacient). Na druhé straně jednou při cestě z kontroly pacient v autobuse pociťoval příznaky počínajícího krvácení do kotníku, ale do návratu domů symptomy ustoupily a nemocný rFVIIa nepodal. Před extrakcí periferního intravenózního centrálního katétru (peripherally inserted central catheter, PICC) 14. den léčby emicizumabem jsme podali jednu dávku rFVIIa 93 µg/kg, s průběhem bez krvácivých komplikací. Rozdíl v generaci trombinu před aplikací rFVIIa a po ní byl minimální (tab. 1). U tohoto pacienta náklady na profylaktickou aplikaci emicizumabu byly obdobné či nižší než předchozí profylaktická léčba rFVIIa nebo aPCC a další úsporu přinesl pokles počtu léčených ABR na přibližně čtvrtinu. Při profylaxi přípravky s bypassovou aktivitou v letech 2016–2018 činil počet ABR 6, 8, 11 a při terapii emicizumabem dvě za 11,5 měsíce.
Kazuistika 2
Pacient, ročník 1975, těžká hemofilie A s delecí intronu 22, také negativní rodinná anamnéza hemofilie. Inhibitor diagnostikován v roce 1977, high responder. V roce 1987 při krvácení do patní kosti pokus o ITT plazmaferézami s imunosupresí cyklofosfamidem a prednisonem, dosaženo poklesu titru inhibitoru z 54 na 9 BU/ml. V letech 2000‒2007 byla 1‒3 krvácení ročně léčena aPCC či rFVIIa. V roce 2010 byla vyléčena hepatitida C. V letech 2008‒2018 činil počet léčených ABR většinou 1‒3 a po tři roky pacient neudával žádné krvácení. V tomto období se však třikrát jednalo o velmi závažné krvácení do svalstva vyžadující aplikaci rFVIIa: 403,2 mg, 432 mg a jednou krvácení recidivovalo po léčbě 215 mg rFVIIa a následně při nízkém titru inhibitoru FVIII 2,6 BU/ml byl nemocný léčen koncentrátem FVIII 340 000 U a následně krátkodobou profylaxí aPCC celkem 200 000 U. V první polovině roku 2019 byla provedena extrakce 15 zubů vyžadující aplikaci 112 mg rFVIIa a léčena tři rozsáhlá krvácení pomocí 608 mg rFVIIa a 170 000 U aPCC. U pacienta byla vhodná následná profylaktická léčba, pro niž jsme zvolili emicizumab, který jsme začali aplikovat od začátku srpna 2019 ve standardním týdenním režimu.
Při této terapii je pacient dosud v průběhu 7,5 měsíce
bez krvácení, i když generace trombinu byla nižší oproti
prvnímu nemocnému, resp. bylo dosaženo normalizace AUC, avšak ne
peaku (vrcholové koncentrace) trombinu. Koncentrace emicizumabu
u pacienta během její 5,5měsíční monitorace postupně
narůstala (tab. 2).
U tohoto pacienta jsou sice náklady na léčbu
emicizumabem vyšší než průměrné náklady za posledních
11 let, ale předpokládáme, že zabráníme vzniku život
ohrožujících krvácivých epizod, které se u pacienta
objevily za posledních 11 let celkem tři a léčba každé
z nich stála více než 10 000 000 korun.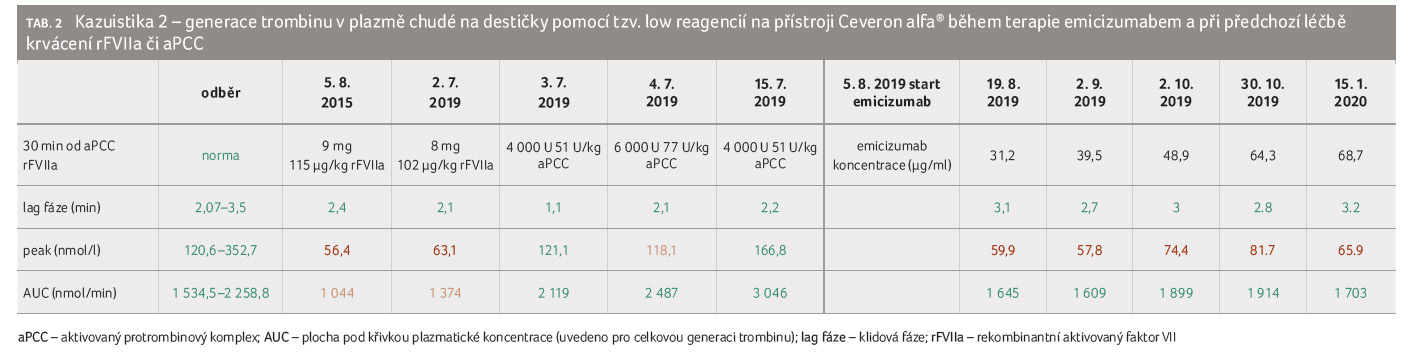
Kazuistika 3
Pacient, ročník 1980, těžká hemofilie A, bez hemofilie v rodině, bez inhibitoru, léčba on demand. V roce 2014 implantace protézy pravého kolenního kloubu, pak krátkodobá profylaxe. V témže roce při léčbě on demand devastující subdurální hematom s následkem těžké pravostranné hemiparézy a expresivní fatické poruchy. Následně profylaktická aplikace FVIII obden s trough level (koncentrace před podáním další dávky) FVIII nad 2 %, ale při této léčbě nastalo intracerebrální krvácení, po němž následovala profylaktická aplikace FVIII denně cílená na trough level zprvu převyšující 12 % a poté 5 %. Při této profylaxi byl pacient bez další recidivy krvácení do centrálního nervového systému a počet ABR činil 0‒1.
Pro nutnost denní aplikace FVIII byl u pacienta od roku
2015 celkem pětkrát zaveden PICC, dvakrát port a jedenkrát
tunelizovaný centrální venózní katétr (central venous catheter,
CVC), vždy s nutností extrakce pro infekční komplikace.
Následně při nemožnosti zavedení CVC byl nemocný léčen vyšší
dávkou rurioktokog alfa pegolu (Adynovi) – dvakrát týdně
4 000 U střídavě s 6 000 U a u příslušné
zdravotní pojišťovny bylo zažádáno o úhradu emicizumabu
(hrazen pouze pro pacienty s hodnotou inhibitoru FVIII > 5
BU/ml), která byla schválena. Léčba emicizumabem byla zahájena
na konci září 2019 v režimu 3 mg/kg 1× týdně
celkem čtyřikrát a následně stejná dávka každé dva
týdny. Během necelé půlroční léčby emicizumabem je pacient
bez krvácení, včetně pádu z invalidního vozíku na hlavu
(negativní CT CNS). Během druhého měsíce léčby emicizumabem
byla provedena extrakce jednoho zubu po jednorázové aplikaci
4 000 U přípravku Adynovi se současným podáváním
tranexamové kyseliny po dobu osmi dnů od extrakce v dávce
3× 1,5 g perorálně. Pro prosakování z lůžka byla
5. a 7. den po extrakci aplikována další dávka
Adynovi – 2 000 U, resp. 4 000 U. Koncentrace emicizumabu
u tohoto pacienta postupně narůstá, ale generace trombinu
zůstává přibližně stejná – subnormální AUC a snížený
peak trombinu (tab. 3).
Léčba emicizumabem je u tohoto nemocného sice přibližně
dvojnásobně nákladnější než aplikace Adynovi dvakrát týdně,
tento režim byl však bez CVC dlouhodobě neudržitelný.
Předpokládáme, že emicizumab přináší pacientovi vyšší
ochranu proti krvácení než substituce FVIII s trough level
FVIII převyšující 5 %.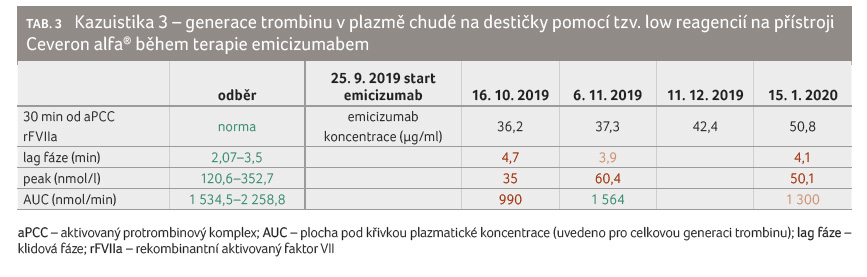
Závěr
U našich tří pacientů jsme nezaznamenali žádný nežádoucí účinek emicizumabu. Pokud bychom hodnotili efekt emicizumabu obdobně jako ve studii HAVEN 1 po dobu 24 týdnů, pak během prvních 24 týdnů terapie jsme nezaznamenali žádné krvácení vyžadující léčbu (včetně pádu na hlavu). Jeden pacient dvakrát léčil krvácení jednorázovou dávkou rFVIIa v druhém půlroce léčby, z toho jedno krvácení bylo potraumatické. U nemocného bez inhibitoru FVIII bylo nutné substituovat zubní extrakci standardním způsobem – FVIII má vyšší afinitu k FIXa a FX než emicizumab a jeho efekt se tak emicizumabem pravděpodobně nepotencuje, na rozdíl od pacienta s inhibitorem FVIII, kde k zástavě krvácení stačila jednorázová dávka rFVIIa 93 mg/kg. Hodnocení léčby emicizumabem je u našich pacientů zatím pouze orientační vzhledem ke krátké době sledování – v průměru 35 týdnů.
Seznam použité literatury
- [1] Srivastava A, Brewer AK, Mauser‑Bunschoten EP, et al. Guidelines for the management of hemophilia. Haemophilia 2013; 19: e1–e47.
- [2] Lenting PJ, Denis CV, Christophe OD. Emicizumab, a bispecific antibody recognizing coagulation factors IX and X: how does it actually compare to factor VIII? Blood 2017; 130: 2463–2468.
- [3] SPC Hemlibra. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/hemlibra‑epar‑product‑information_cs.pdf
- [4] Shima M, Hanabusa H, Taki M, et al. Factor VIII‑mimetic function of humanized bispecific antibody in hemophilia A. N Engl J Med 2016; 374: 2044–2053.
- [5] Oldenburg J, Mahlangu JN, Kim B, et al. Emicizumab prophylaxis in hemophilia A with inhibitors. N Engl J Med 2017; 377: 809–818.
- [6] Mahlangu J, Oldenburg J, Paz‑Priel I, et al. Emicizumab prophylaxis in patients who have hemophilia a without inhibitors. N Engl J Med 2018; 379: 811–822.
- [7] Pipe SW, Shima M, Lehle M, et al. Efficacy, safety, and pharmacokinetics of emicizumab prophylaxis given every 4 weeks in people with haemophilia A (HAVEN 4): a multicentre, open‑label, non‑randomised phase 3 study. Lancet Haematol 2019; 6: e295‒e305.
- [8] Young G, Sidonio RF, Liesner R, et al. HAVEN 2 updated analysis: multicenter, open‑label, phase 3 study to evaluate efficacy, safety and pharmacokinetics of subcutaneous administration of emicizumab prophylaxis in pediatric patients with hemophilia a with inhibitors. Blood 2017; 130(Suppl 1): 85.
- [9] Jiménez‑Yuste V, Klamroth R, Castaman G, et al. A Single‑Arm, Multicentre, Open‑Label, Phase III Clinical Trial to Evaluate the Safety and Tolerability of Prophylactic Emicuzumab in Persons with Haemophilia A (PwHA) with FVIII Inhibitors (STASEY): Interim Analysis Results. ISTH 2019, oral presentation OC 60.3.
- [10] Hrdličková R. Emicizumab v léčbě hemofilie A – co zaznělo na ISTH 2019. Remedia 2019; 29: 82‒84.
- [11] Mahlangu J, Powell JS, Ragni MV, et al. Phase 3 study of recombinant factor VIII Fc fusion protein in severe hemophilia A. Blood 201; 123: 317–325.
- [12] Konkle BA, Stasyshyn O, Chowdary P, et al. Pegylated, full‑length, recombinant factor VIII for prophylactic and on‑demand treatment of severe hemophilia A. Blood 2015; 126: 1078‒1085.
- [13] Mahlangu J. Emicizumab for the prevention of bleeds in hemophilia A. Expert Opin Biol Ther 2019; 19: 753–761.
- [14] Collins PW, Liesner R, Makris M, et al. Treatment of bleeding episodes in haemophilia A complicated by a factor VIII inhibitor in patients receiving Emicizumab. Interim guidance from UKHCDO Inhibitor Working Party and Executive Committee. Haemophilia 2018; 24: 344–347.
- [15] Paz‑Priel I, Chang T, Asikanius E, et al. Immunogenity of emicizumab in people with hemophilia A: results from the HAVEN 1‒4 studies. Blood 2018; 132(Suppl1): 633‒633.
- [16] Müller J, Pekrul I, Pötzsch B, et al. Laboratory Monitoring in Emicizumab‑Treated Persons with Hemophilia A. Thromb Haemost 2019; 119: 1384‒1393.