Inhibitory Janus kináz napříč indikacemi
Evropský revmatologický kongres EULAR 2023 se konal 31. května až 3. června v italském Miláně. Satelitní sympozium společnosti Pfizer upřelo svoji pozornost na lékovou skupinu inhibitorů Janus kináz (JAK), která obohatila možnosti léčby řady diagnóz, a na různé aspekty léčby inhibitory JAK.
Inhibitory JAK na pomezí revmatologie a gastroenterologie
Jaká je spojitost mezi střevem, klouby a páteří? V první části setkání panel odborníků zkoumal management léčby pacientů se spondyloartritidou (SpA) a zánětlivým onemocněním střev (IBD) pohledem různých odborností. Kde jsou epidemiologické, patofyziologické a klinické průsečíky těchto diagnóz a jejich léčby? Přítomní odborníci diskutovali své zkušenosti a úspěchy multidisciplinárního přístupu k terapii těchto pacientů. Pozornost byla upřena na doklady pro použití inhibitorů JAK u pacientů trpících ankylozující spondylitidou (AS), psoriatickou artritidou (PsA) a ulcerózní kolitidou (UC) a na zkušenosti s léčbou.
Neopomenutelná spojitost mezi SpA a IBD
Doktorka Ramiro (Leiden University, Nizozemsko), která sympoziu předsedala a ujala se prvního sdělení, v úvodu upozornila na fakt, že SpA představuje u pacientů s IBD nejčastější extraintestinální manifestaci, je přítomna odhadem u 10–39 % nemocných [1]. Bylo doloženo, že u Crohnovy choroby (CD) je prevalence sakroiliitidy, AS a periferní SpA vyšší než v případě ulcerózní kolitidy (UC) [2]. Na druhou stranu zhruba 60 % nemocných se SpA trpí IBD (10 %) nebo subklinickým zánětem střev (50 %) [3]. Za rizikové faktory jsou v tomto případě považovány: mužské pohlaví, mladší věk, vyšší aktivita nemoci, omezená hybnost páteře, časný nástup obtíží či přítomnost radiografické sakroiliitidy. Data ze švédského registru ukazují, že kumulativní incidence SpA se s trváním IBD zvyšuje (poměr rizik [HR] pro stanovení diagnózy SpA 7,15, 95% interval spolehlivosti [CI] 6,60–7,75) [4], a britská data dokládají, že je tomu stejně i v opačném sledu (HR pro stanovení diagnózy IBD 3,3, 95% CI 2,3–4,8) [5]. Přítomnost obou diagnóz je u pacientů obvykle spojena s vyšší aktivitou nemoci, vyšší zátěží pro pacienta, zhoršenou fyzickou funkcí a provází ji užívání biologických i konvenčních syntetických chorobu modifikujících antirevmatických léků (DMARDs), systémových i topických intestinálních kortikosteroidů a neopioidních analgetik ve vyšší míře [6].
Hodnoty běžných klinických markerů ukazují na společnou patofyziologii obou onemocnění; vzplanutí IBD i SpA je spojeno se zvýšením hodnot C‑reaktivního proteinu (CRP) i fekálního kalprotektinu [3]. Na osu „střevo‑klouby“ je třeba pohlížet komplexně. Na zvýšení propustnosti střev se podílejí genetické faktory (např. HLA‑B27), faktory prostředí (kouření, stres, znečištění prostředí, strava), imunologické změny i střevní dysbióza a vedou k aktivaci imunitních buněk, produkci cytokinů, stimulaci chronického zánětu a k migraci leukocytů ze střeva směrem ke kloubům [7]. Tyto spojitosti mezi axiální SpA, PsA a IBD jsou podkladem pro cílení léčby na klíčové signalizační dráhy zánětu: dráhu tumor nekrotizujícího faktoru (TNF), interleukinů (IL) 23/IL‑17 a dráhu JAK‑STAT. Doktorka Ramiro nicméně připomněla, že v klinickém hodnocení s inhibitory IL‑23 (ustekinumab, risankizumab) nebylo u pacientů s axiální SpA dosaženo primárních cílů, pravděpodobným vysvětlením zde může být aktivace IL‑17 nezávisle na IL‑23 [8]. U inhibitorů IL‑17 (secukinumab, brodalumab) byla v randomizovaných klinických studiích pozorována exacerbace CD/UC [9]. Co se týče managementu pacientů s konkomitantním výskytem IBD, PsA a axiální SpA, odkázala doktorka Ramiro na aktuální doporučení GRAPPA 2021 [9,10].
Interdisciplinární přístup v péči o pacienty se SpA a IBD
S dalším sdělením vystoupila doktorka Lianne Gensler (University of California, San Francisco, USA). Nad kazuistikou pacientky přítomní odborníci diskutovali palčivá témata odrážející klinickou praxi.
Žena, 21 let, povoláním tanečnice, udává dva roky trvající subakutní, intermitentní bolesti v oblasti hýždí a dolních zad spojené s určitými pohyby. Ranní ztuhlost neudává, ale uvádí noční bolest zhruba kolem třetí hodiny ranní. Negativní anamnéza uveitidy, IBD a psoriázy, ale syndrom dráždivého tračníku (před třemi lety provedena kolonoskopie). Bez pozitivní rodinné anamnézy stran SpA a souvisejících diagnóz. Laboratorní vyšetření dokládá pozitivitu HLA‑B27, sedimentace (ESR) 15 mm/h, CRP 4,1 mg/l. Dle muskuloskeletálního vyšetření bez daktylitid, T/SJ 0/0, citlivost entezí +L5S1, větší pravý trochanter, mSchober = 3 cm (10→13 cm). Přítomny gastrointestinální (GI) symptomy, výsledky kolonoskopie normální, došlo k symptomatickému zlepšení. Vysloveno podezření na diagnózu IBD v souvislosti s AS. Prostřednictvím tzv. PROs (patient reported outcomes) zaznamenána vysoká aktivita onemocnění (BASDAI 6,4, BASFI 8,1, Patient global 7, ASDAS‑CRP 3,4), bez jakékoliv předchozí diagnózy. Na základě radiografického i magnetorezonančního zobrazení (MRI) vyslovena diagnóza AS.
Přítomní dále diskutovali, která je nejlepší strategie pro screening IBD a postižení kloubů u pacientů s axiální SpA a IBD. Doktor Silvio Danese (Vita‑Salute San Raffaele University, Milán, Itálie) z pohledu gastroenterologa považuje za významný marker, který by měl být revmatology detekován, fekální kalprotektin ukazující na přítomnost zánětu. Nicméně upozornil na možnou fluktuaci hodnot, kterou je třeba vzít v potaz (jakási šedá zóna v rozmezí hodnot 50–150 mg/kg). V případě postižení ilea je dle něj důležité ultrazvukové vyšetření tenkého střeva.
Hodnota fekálního kalprotektinu u naší pacientky byla mírně zvýšena (80 mg/kg), v té době užívá nesteroidní antiflogistika (NSAID). Pacientka byla odeslána na kolonoskopii svědčící pro mírnou UC (bez terapie), podávání NSAID bylo upraveno dle konzultace s gastroenterologem na inhibitor COX‑2 (cyklooxygenázy 2). O čtyři měsíce později hospitalizována pro závažné vzplanutí UC. U pacientky byla zahájena kortikoterapie a léčba inhibitorem TNF (infliximabem). Po šesti týdnech se u ní rozvinula plaková psoriáza. O měsíc později byla zahájena léčba tofacitinibem (10 mg BID), po třech měsících terapie bylo dosaženo remise (bez symptomů postižení páteře, kloubů, normální hodnoty zánětlivých markerů, ASDAS < 1,3, bez PsA a GI symptomů). Přítomní diskutovali otázku, kdy u nemocných s AS/PsA a IBD zvážit zahájení navazující léčby či switch na navazující léčbu a kdy/zda je možné dávku léčiva redukovat. Dr. Silvio Danese upozornil na potřebu dosažení hluboké remise doložené histologicky, která je obvyklá u poměrně malého podílu pacientů. Zdůraznil potřebu mezioborové spolupráce a vyzdvihl ze svého pracoviště vlastní pozitivní zkušenost s pravidelnou diskusí mezi revmatologem, gastroenterologem a dermatologem nad závažnými případy pacientů.
Data o účinnosti a bezpečnosti inhibitorů JAK
Tofacitinib a upadacitinib jsou aktuálně jedinými schválenými inhibitory JAK pro terapii PsA a AS. Účinnost tofacitinibu (5 mg BID) u pacientů s AS prokázala studie fáze III [11]. Zmírnění aktivity nemoci oproti placebu bylo doloženo v 16. týdnu, primárního cílového ukazatele ASAS 20 (20% zlepšení dle kritérií Assessment in SpondyloArthritis international Society) dosáhlo 56 % vs. 29 % pacientů, stejně jako redukce dalších sekundárních ukazatelů (odpovědi ASAS 40 – 41 % vs. 13 % pacientů, zmírnění bolesti zad, únavy a zlepšení skóre ASDAS). Účinnost tofacitinibu u pacientů s PsA dokumentovala přednášející výsledky studie OPAL Broaden [12] a OPAL Beyond [13]. Z pohledu gastroenterologie účinnost a bezpečnost tofacitinibu a upadacitinibu v léčbě pacientů se středně závažnou až závažnou UC potvrzuje klinický program hodnocení OCTAVE (Induction 1 a 2, Sustain) s dosažením rychlé remise v týdnu 8 a setrvalou účinností po dobu 52 týdnů [14].
Souhrnná bezpečnostní data tofacitinibu ukazují na nízkou incidenci nežádoucích účinků zvláštního zájmu (jako jsou například velké kardiovaskulární příhody [MACE], žilní tromboembolismus [VTE] či malignity) napříč indikacemi, mírně zvýšený výskyt závažných infekcí, oportunních infekcí či herpes zoster byl zaznamenán u pacientů s revmatoidní artritidou (RA) a UC [14].
Doktorka Ramiro připomněla výsledky studie ORAL Surveillance, jejímž cílem bylo zhodnotit bezpečnost tofacitinibu ve dvou dávkách (5 mg a 10 mg BID) a non‑inferioritu oproti inhibitoru TNF v populaci pacientů s RA zatížených zvýšeným kardiovaskulárním rizikem [15]. Jedná se o jedinou studii svého druhu uskutečněnou ve skupině inhibitorů JAK. Zařazeni byli pacienti s aktivní RA navzdory léčbě metotrexátem ve věku ≥ 50 let s alespoň jedním dalším kardiovaskulárním rizikem (n = 4 362). Non‑inferiorita tofacitinibu oproti inhibitoru TNF nebyla v případě MACE a malignit prokázána.
Pro které pacienty by tedy mohly inhibitory JAK jako léčebná volba představovat vyšší riziko? Doktorka Gensler komentovala schválená opatření Evropské lékové agentury pro použití inhibitorů JAK v indikacích AS, PsA a UC. Inhibitory JAK by měly být u následujících skupin pacientů použity pouze v případě, že k dispozici není žádná další léčebná alternativa: pacienti ve věku ≥ 65 let, kuřáci či pacienti s dlouhodobým kouřením v anamnéze, pacienti s aterosklerotickým kardiovaskulárním onemocněním či jiným kardiovaskulárním rizikovým faktorem v anamnéze, pacienti se zvýšeným rizikem malignity. Opatrnost při použití je doporučena rovněž u pacientů se známými rizikovými faktory VTE.
Post hoc analýza ORAL Surveillance poukazuje na nutnost individualizovaného zhodnocení poměru přínos/riziko při rozhodování o léčbě tofacitinibem. Analýza doložila, že u pacientů mladších 65 let, kteří nikdy nekouřili, nebylo zaznamenáno vyšší riziko nežádoucích účinků léčby tofacitinibem oproti inhibitoru TNF [16].
Přednášející na závěr shrnula, že inhibitory JAK, tofacitinib a upadacitinib, představují účinnou modalitu léčby pro pacienty trpící AS, PsA a UC, vyznačují se rychlým nástupem účinku, definovaným bezpečnostním profilem a potřebnou implementací dostupných bezpečnostních dat. Aktivita nemoci, charakteristiky pacienta a poměr přínosu a rizika by měly být předmětem sdíleného rozhodování o léčbě.
Kteří pacienti s revmatoidní artritidou jsou vhodní pro léčbu inhibitory JAK?
Léková skupina inhibitorů JAK za posledních 10 let rozšířila možnosti léčby revmatologických i souvisejících gastroenterologických a dermatologických diagnóz. Na poznatky o účinnosti inhibitorů JAK u pacientů s RA s různými demografickými charakteristikami a na bezpečnostní data, která se týkají různých podskupin pacientů a mohou pomoci identifikovat ty více či méně rizikové, se podrobněji zaměřilo druhé sympozium. Předsedal mu profesor Roberto Caporali (University of Milan, Itálie).
Data o účinnosti inhibitorů JAK u pacientů s RA
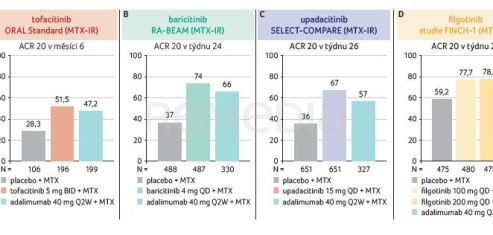 Doktorka Grace Wright (Association of Women in Rheumatology, New York, USA) připomněla, že účinnost a bezpečnost inhibitorů JAK byly studovány v rozsáhlém klinickém programu a dále probíhají poautorizační klinické studie hodnotící bezpečnost léčby v dlouhodobém horizontu. V randomizovaných klinických studiích fáze III prokázaly inhibitory JAK v léčbě pacientů s RA srovnatelnou účinnost s inhibitory TNF (graf 1A–D), hodnoceno dle odpovědi ACR 20 (20% zlepšení dle kritérií American College of Rheumatology). Studie s jednotlivými léčivy není možné mezi sebou přímo srovnávat z důvodu rozdílného uspořádání, metodiky i zařazených skupin pacientů. Přednášející potvrdila, že obdobných účinků bylo dosaženo i ve zmírnění bolesti na škále VAS (Visual Analogue Scale) a únavy dle škály FACIT‑F (Functional Assessment of Chronic Illness Therapy‑Fatigue).
Doktorka Grace Wright (Association of Women in Rheumatology, New York, USA) připomněla, že účinnost a bezpečnost inhibitorů JAK byly studovány v rozsáhlém klinickém programu a dále probíhají poautorizační klinické studie hodnotící bezpečnost léčby v dlouhodobém horizontu. V randomizovaných klinických studiích fáze III prokázaly inhibitory JAK v léčbě pacientů s RA srovnatelnou účinnost s inhibitory TNF (graf 1A–D), hodnoceno dle odpovědi ACR 20 (20% zlepšení dle kritérií American College of Rheumatology). Studie s jednotlivými léčivy není možné mezi sebou přímo srovnávat z důvodu rozdílného uspořádání, metodiky i zařazených skupin pacientů. Přednášející potvrdila, že obdobných účinků bylo dosaženo i ve zmírnění bolesti na škále VAS (Visual Analogue Scale) a únavy dle škály FACIT‑F (Functional Assessment of Chronic Illness Therapy‑Fatigue).
Doktorka Wright položila otázku, jaká jiná data vedle výsledků randomizovaných klinických studií (RCT) mohou ovlivnit klinické rozhodnutí o léčbě a jaká je jejich hodnota.
S touto problematikou dále navázal doktor Eduardo Mysler (Organización Medica de Investigación, Buenos Aires, Argentina). Evidence z reálné klinické praxe (real-world evidence, RWE) doplňuje data získaná v RCT a poskytuje údaje o dlouhodobé léčbě u pacientů v praxi. Odlišné jsou sledované populace pacientů – soubor pacientů v RCT má předem specifikované charakteristiky, předem stanovený počet i určitou předpokládanou motivaci ke spolupráci; RWE naproti tomu zahrnuje rozsáhlejší a rozmanitější skupinu pacientů, s řadou dalších komorbidit, užívanou medikací i různými dalšími charakteristikami. Cílem přísné metodiky RCT je poskytnout v prospektivním, randomizovaném uspořádání kontrolovaná a standardizovaná data oproti observačním studiím. Období hodnocení je zpravidla kratší. Naproti tomu RWE zahrnuje obvykle větší a rozmanitější soubory pacientů sledovaných delší časové období, s daty získávanými prospektivně i retrospektivně, ale nedostatečně standardizovanými. Jejich hlavním zdrojem jsou registry. RCT představují zlatý standard k získání primárních dat o účinnosti a bezpečnosti léčby, RWE jsou doplňujícím nástrojem, který poskytuje údaje o dlouhodobé účinnosti a bezpečnosti léčby v klinické praxi. I zde jsou užívány různé nástroje, které by měly pomoci redukovat selekční bias.
Doktor Mysler na výsledcích až osmiletého sledování léčby tofacitinibem, které dokládají setrvalý efekt léčby na zmírnění projevů a známek RA, prezentoval limitace dlouhodobých extenzí studií. Mezi ně patří absence placebové kontrolní větve a určité zkreslení v důsledku populace pacientů, jejíž velikost se zmenšuje a zůstávají zejména pacienti s dobrou odpovědí na léčbu a její dobrou snášenlivostí. Jedná se o běžný jev týkající se všech léčiv a prospektivní data ze švýcarského registru SCQM naproti tomu dokládají pro tofacitinib signifikantně vyšší podíl pacientů s RA setrvávajících na léčbě oproti inhibitorům TNF (HR 1,29, 95% CI 1,14–1,47) a žádný významný rozdíl v četnosti ukončení léčby při porovnání s ostatními biologickými DMARDs s jiným mechanismem účinku (HR 1,09, 95% CI 0,96–1,24) [17].
Jaké doklady o použití inhibitorů JAK u různých podskupin pacientů s RA máme k dispozici? Tyto údaje poskytují často post hoc či poolované analýzy. Jejich limitací může být, že nejsou prespecifikované a svou podstatou explorativní, mohou generovat určité hypotézy, ale neposkytnou kauzální souvislosti. Nedostatečná může být i jejich statistická významnost. V případě poolovaných analýz mohou být zahrnuti pacienti ze studií s různou délkou trvání a primárními cíli, nežádoucí účinky zvláštního zájmu nemusejí být v tomto případě specificky předdefinované a mít rozdílnou míru posuzování.
Naproti tomu analýzy podskupin studují efekt léčby u pacientů s různými charakteristikami, což je velmi důležité a může přinést klíčové informace pro rozhodování o léčbě v praxi. Věk, rasa, pohlaví, BMI, sérotyp, kuřácká anamnéza, užívání kortikoidů či anamnéza kardiovaskulárních onemocnění – všechny tyto a mnohé další charakteristiky mohou mít vliv na účinnost a bezpečnost podávané léčby. Mezi nemodifikovatelné parametry pro léčbu patří séropozitivita/séronegativita, věk či kuřáctví v anamnéze; mezi ovlivnitelné faktory můžeme zařadit BMI či konkomitantní užívání kortikosteroidů. Přednášející se v další části zaměřili na jednotlivé faktory.
![GRAF 2A, B Efekt léčby tofacitinibem u séronegativních a séropozitivních pacientů; podle [18] – Bird, et al., 2019. A – pacienti dosahující v měsíci 3 remise; B – pacienti dosahující v měsíci 3 nízké aktivity nemoci BID – 2× denně; anti‑CCP – protilátky proti cyklickému citrulinovanému peptidu; DAS 28 (ESR) – ukazatel aktivity nemoci Disease Activity Score (Erythrocyte Sedimentation Rate); RF – revmatoidní faktor GRAF 2A, B Efekt léčby tofacitinibem u séronegativních a séropozitivních pacientů; podle [18] – Bird, et al., 2019. A – pacienti dosahující v měsíci 3 remise; B – pacienti dosahující v měsíci 3 nízké aktivity nemoci BID – 2× denně; anti‑CCP – protilátky proti cyklickému citrulinovanému peptidu; DAS 28 (ESR) – ukazatel aktivity nemoci Disease Activity Score (Erythrocyte Sedimentation Rate); RF – revmatoidní faktor](https://www.remedia.cz/photo-pg-1141---.jpg) Post hoc analýzy studií fáze III s tofacitinibem (ORAL Step, ORAL Scan, ORAL Solo, ORAL Sync, ORAL Standard) dokládají jeho účinnost u pacientů séronegativních i séropozitivních (graf 2A, B) [18]. Účinnost u séropozitivních i séronegativních pacientů dokládají post hoc analýzy i v případě dalších inhibitorů JAK [19–22].
Post hoc analýzy studií fáze III s tofacitinibem (ORAL Step, ORAL Scan, ORAL Solo, ORAL Sync, ORAL Standard) dokládají jeho účinnost u pacientů séronegativních i séropozitivních (graf 2A, B) [18]. Účinnost u séropozitivních i séronegativních pacientů dokládají post hoc analýzy i v případě dalších inhibitorů JAK [19–22].
![GRAF 3 Porovnání účinnosti léčby tofacitinibem ve skupině pacientů mladších 65 let a ve věku ≥ 65 let; podle [23] – Curtis, et al., 2017. ACR 20/50/70 – 20%/50%/70% zlepšení dle American College of Rheumatology; BID – 2× denně; PR – poměr pravděpodobnosti, probability ratio GRAF 3 Porovnání účinnosti léčby tofacitinibem ve skupině pacientů mladších 65 let a ve věku ≥ 65 let; podle [23] – Curtis, et al., 2017. ACR 20/50/70 – 20%/50%/70% zlepšení dle American College of Rheumatology; BID – 2× denně; PR – poměr pravděpodobnosti, probability ratio](https://www.remedia.cz/photo-pg-1142---.jpg) Dalším důležitým faktorem pro léčbu je věk. Dr. Wright prezentovala výsledky poolované post hoc analýzy, která potvrdila srovnatelnou účinnost tofacitinibu ve skupině pacientů mladších 65 let či starších (≥ 65 let), graf 3 [23], a opět i pro další zástupce skupiny inhibitorů JAK [21,22,24].
Dalším důležitým faktorem pro léčbu je věk. Dr. Wright prezentovala výsledky poolované post hoc analýzy, která potvrdila srovnatelnou účinnost tofacitinibu ve skupině pacientů mladších 65 let či starších (≥ 65 let), graf 3 [23], a opět i pro další zástupce skupiny inhibitorů JAK [21,22,24].
![GRAF 4 Účinnost tofacitinibu v subpopulaci kuřáků a nekuřáků; podle [25] – Kremer, et al., 2013. BID – 2× denně; DAS 28 (ESR) – ukazatel aktivity nemoci Disease Activity Score (Erythrocyte Sedimentation Rate); Q2W – každé dva týdny GRAF 4 Účinnost tofacitinibu v subpopulaci kuřáků a nekuřáků; podle [25] – Kremer, et al., 2013. BID – 2× denně; DAS 28 (ESR) – ukazatel aktivity nemoci Disease Activity Score (Erythrocyte Sedimentation Rate); Q2W – každé dva týdny](https://www.remedia.cz/photo-pg-1144---.jpg) Jak poznamenal dr. Mysler, kuřáctví patří mezi faktory neovlivnitelné (v anamnéze) i faktory ovlivnitelné (aktuální). Na výsledcích další poolované post hoc analýzy doložil účinnost tofacitinibu v subpopulaci kuřáků i nekuřáků [25], graf 4, a obdobně v případě baricitinibu [26].
Jak poznamenal dr. Mysler, kuřáctví patří mezi faktory neovlivnitelné (v anamnéze) i faktory ovlivnitelné (aktuální). Na výsledcích další poolované post hoc analýzy doložil účinnost tofacitinibu v subpopulaci kuřáků i nekuřáků [25], graf 4, a obdobně v případě baricitinibu [26].
![GRAF 5 Srovnatelná účinnost tofacitinibu při konkomitantní kortikoterapii a bez ní; podle [27] – Schoeman, 2018. BID – 2× denně; csDMARD – konvenční syntetický chorobu modifikující antirevmatický lék, conventional synthetic disease‑modifying antirheumatic drug; DAS 28 (ESR) – ukazatel aktivity nemoci Disease Activity Score (Erythrocyte Sedimentation Rate) GRAF 5 Srovnatelná účinnost tofacitinibu při konkomitantní kortikoterapii a bez ní; podle [27] – Schoeman, 2018. BID – 2× denně; csDMARD – konvenční syntetický chorobu modifikující antirevmatický lék, conventional synthetic disease‑modifying antirheumatic drug; DAS 28 (ESR) – ukazatel aktivity nemoci Disease Activity Score (Erythrocyte Sedimentation Rate)](https://www.remedia.cz/photo-pg-1143---.jpg) Konkomitantní kortikoterapie ovlivňuje účinnost i bezpečnost léčby a je třeba poznamenat, že u těchto pacientů se onemocnění může chovat odlišně. Výsledky post hoc analýzy, která zahrnula data ze šesti studií fáze III, nepotvrdily vliv užívání kortikoidů na efekt léčby tofacitinibem, graf 5 [27].
Konkomitantní kortikoterapie ovlivňuje účinnost i bezpečnost léčby a je třeba poznamenat, že u těchto pacientů se onemocnění může chovat odlišně. Výsledky post hoc analýzy, která zahrnula data ze šesti studií fáze III, nepotvrdily vliv užívání kortikoidů na efekt léčby tofacitinibem, graf 5 [27].
![GRAF 6 Porovnání účinnosti léčby dle indexu tělesné hmotnosti; podle [28] – Aletaha, et al., 2022. BID – 2× denně; BMI – index tělesné hmotnosti, body mass index; DAS 28 (ESR) – ukazatel aktivity nemoci Disease Activity Score (Erythrocyte Sedimentation Rate) GRAF 6 Porovnání účinnosti léčby dle indexu tělesné hmotnosti; podle [28] – Aletaha, et al., 2022. BID – 2× denně; BMI – index tělesné hmotnosti, body mass index; DAS 28 (ESR) – ukazatel aktivity nemoci Disease Activity Score (Erythrocyte Sedimentation Rate)](https://www.remedia.cz/photo-pg-1145---.jpg) Při sledování účinnosti léčby napříč různými kategoriemi BMI rovněž nebyl zaznamenán výrazný rozdíl v účinnosti terapie, graf 6 [28].
Při sledování účinnosti léčby napříč různými kategoriemi BMI rovněž nebyl zaznamenán výrazný rozdíl v účinnosti terapie, graf 6 [28].
Přednášející v závěru shrnuli, že inhibitory JAK mají, jak doložily RCT v krákodobém horizontu, v obecné populaci pacientů s RA účinnost srovnatelnou s inhibitory TNF. Efekt léčby v dlouhodobějším horizontu dokládají extenze studií i data z reálné praxe. Inhibitory JAK jsou účinné napříč různými subpopulacemi pacientů.
Pacienti s vysokým versus nízkým rizikem nežádoucích účinků při léčbě inhibitory JAK
Profesorka Maya H Buch (University of Manchester, Spojené království) se v poslední prezentaci zaměřila na bezpečnostní aspekty léčby tofacitinibem. Zdrojem pro rozhodování jsou zejména data z uskutečněných RCT, poautorizační studie ORAL Surveillance a RWE. Výše již byly zmíněny limitace jednotlivých způsobů sledování.
Mezi nejběžnější nežádoucí účinky léčby tofacitinibem, které byly zaznamenány v průběhu tříměsíčního období kontrolovaného placebem v rámci RCT, patřily infekce horních cest dýchacích, nazofaryngitida, průjem, bolest hlavy a hypertenze [14]. V případě vybraných nežádoucích účinků zvláštního zájmu při léčbě inhibitory JAK byl mírně vyšší výskyt zaznamenán u závažných infekcí a herpes zoster. Integrovaná bezpečnostní data inhibitorů JAK vycházejí z údajů z poolovaných RCT.
Profesorka Buch dále popsala uspořádání a výsledky studie ORAL Surveillance zmíněné výše. Připomněla, že se jednalo o studii sledující populaci se zvýšeným podílem rizikových pacientů z hlediska kardiovaskulárních onemocnění a jedná se v tomto směru o jedinečnou studii. Oproti inhibitoru TNF byla numericky vyšší míra výskytu zaznamenána pro MACE (0,98/100 pacientoroků vs. 0,73/100 pacientoroků) a pro malignity (1,13/100 pacientoroků vs. 0,77 /100 pacientoroků) [16]. Mezi rizikové faktory, které na základě výsledků ORAL Surveillance zvyšují relativní riziko léčby tofacitinibem oproti inhibitorům TNF, patří věk, kouření a anamnéza aterosklerotických kardiovaskulárních onemocnění. Nedávné výsledky post hoc analýzy studie FINCH‑4 s filgotinibem rovněž ukazují na vyšší incidenci MACE, VTE a malignit ve skupině seniorních pacientů (v tomto případě ≥ 75 let) [28].
Profesorka Buch v závěru shrnula, že všechna dosud získaná data pomáhají objasnit bezpečnostní profil léčby a konkretizovat jej pro rozhodování o léčbě.
Literatura
[1] Fragoulis GE, Liava C, Daoussis D, et al. Inflammatory bowel diseases and spondyloarthropathies: From pathogenesis to treatment. World J Gastroenterol 2019; 25: 2162–2176.
[2] Karreman MC, Luime JJ, Hazes JMW, et al. The Prevalence and Incidence of Axial and Peripheral Spondyloarthritis in Inflammatory Bowel Disease: A Systematic Review and Meta‑analysis. J Crohn Colitis 2017; 11: 631–642.
[3] Gracey E, Vereecke L, McGovern D, et al. Revisiting the gut‑joint axis: links between gut inflammation and spondyloarthritis. Nat Rev Rheumatol 2020; 16: 415–433.
[4] Shrestha S, Brand JS, Järås J, et al. Association Between Inflammatory Bowel Disease and Spondyloarthritis: Findings from a Nationwide Study in Sweden. J Crohns Colitis 2022; 16: 1540–1550.
[5] Stolwijk C, van Tubergen A, Castillo‑Ortiz JD, Boonen A. Prevalence of extra‑articular manifestations in patients with ankylosing spondylitis: a systematic review and meta‑analysis. Ann Rheum Dis 2015; 74: 65–73.
[6] Redeker I, Siegmund B, Ghoreschi K, et al. The impact of extra‑musculoskeletal manifestations on disease activity, functional status, and treatment patterns in patients with axial spondyloarthritis: results from a nationwide population‑based study. Ther Adv Musculoskelet Dis 2020; 12: 1759720X20972610.
[7] Felice C, Dal Buono A, Gabbiadini R, et al. Cytokines in Spondyloarthritis and Inflammatory Bowel Diseases: From Pathogenesis to Therapeutic Implications. Int J Mol Sci 2023; 24: 3957.
[8] Ritchlin C, Adamopoulos IE. Axial spondyloarthritis: new advances in diagnosis and management. BMJ 2021; 372: m4447.
[9] Coates LC, Soriano ER, Corp N, et al. Group for Research and Assessment of Psoriasis and Psoriatic Arthritis (GRAPPA): updated treatment recommendations for psoriatic arthritis 2021. Nat Rev Rheumatol 2022; 18: 465–479.
[10] Ramiro S, Nikiphorou E, Sepriano A, et al. ASAS‑EULAR recommendations for the management of axial spondyloarthritis: 2022 update. Ann Rheum Dis 2023; 82: 19–34.
[11] Deodhar A, Sliwinska‑Stanczyk P, Xu H, et al. Tofacitinib for the treatment of ankylosing spondylitis: a phase III, randomised, double‑blind, placebo‑controlled study. Ann Rheum Dis 2021; 80: 1004–1013.
[12] Mease P, Hall S, FitzGerald O, et al. Tofacitinib or Adalimumab versus Placebo for Psoriatic Arthritis. N Engl J Med 2017; 377: 1537–1550.
[13] Gladman D, Rigby W, Azevedo VF, et al. Tofacitinib for Psoriatic Arthritis in Patients with an Inadequate Response to TNF Inhibitors. N Engl J Med 2017; 377: 1525–1536.
[14] Souhrn údajů o přípravku Xeljanz. Dostupné na: https://www.sukl.cz
[15] Ytterberg S, Bhatt DL, Mikuls TR, et al. Cardiovascular and Cancer Risk with Tofacitinib in Rheumatoid Arthritis. N Engl J Med 2022; 386: 316–326.
[16] Kristensen LE, Danese S, Yndestad A, et al. Identification of two tofacitinib subpopulations with different relative risk versus TNF inhibitors: an analysis of the open label, randomised controlled study ORAL Surveillance. Ann Rheum Dis 2023; doi:10.1136/ard‑2022‑223715.
[17] Finckh A, Tellenbach C, Herzog, et al. Comparative effectiveness of antitumour necrosis factor agents, biologics with an alternative mode of action and tofacitinib in an observational cohort of patients with rheumatoid arthritis in Switzerland. RMD Open 2020; 6: e001174.
[18] Bird P, Hall S, Nash P, et al. Treatment outcomes in patients with seropositive versus seronegative rheumatoid arthritis in Phase III randomised clinical trials of tofacitinib. RMD Open 2019; 5: e000742.
[19] Rubbert‑Roth A, Sparks J, Constantin A, et al. Impact of serologic status on clinical responses to upadacitinib or abatacept in patients with rheumatoid arthritis and prior inadequate response to biologic DMARDs: sub‑group analysis from the phase 3 SELECT‑Choice Study. Ann Rheum Dis 2022; 81: 1302–1303.
[20] Kalunian K, Genovese M, Gottenberg JE, et al. A Subgroup Analysis of the Efficacy of Filgotinib in Demographic and Clinical Subgroups of Patients with Refractory Rheumatoid Arthritis. Arthritis Rheumatol 2019; 71(Suppl 10): 845–847.
[21] Genovese MC, Kremer JM, Kartman CE, et al. Response to baricitinib based on prior biologic use in patients with refractory rheumatoid arthritis. Rheumatology (Oxford) 2018; 57: 900–908.
[22] A Moderate to Severe Rheumatoid Arthritis Study (RA‑BEACON). https://clinicaltrials.gov/study/NCT01721044
[23] Curtis JR, Schulze‑Koop H, Takiya L, et al. Efficacy and safety of tofacitinib in older and younger patients with rheumatoid arthritis. Clin Exp Rheumatology 2017; 35: 390–400.
[24] Weinblatt M, Mysler E, Ostor A, et al. Impact of baseline demographics and disease activity on outcomes in patients with rheumatoid arthritis receiving upadacitinib. Ann Rheum Dis 2020; 79: 653–654.
[25] Kremer JM, GreenBerg JD, Turesson C, et al. Effects of smoking status on response to treatment with tofacitinib in patients with rheumatoid arthritis. ACR Abstract Supplement 2013 Annual Meeting: Abstr. Nr. 1418.
[26] Curtis J, Emery P, Burmester, et al. Effects of smoking on baricitinib efficacy in patients with rheumatoid arthritis: pooled analysis from two phase 3 clinical trials. Ann Rheum Dis 2017; 76: Poster Nr. 244.
[27] Schoeman CC, van der Heijde D, Burmester GR, et al. Effect of Glucocorticoids on the Clinical and Radiographic Efficacy of Tofacitinib in Patients with Rheumatoid Arthritis: A Posthoc Analysis of Data from 6 Phase III Studies. J Rheumatol 2018; 45: 177–187.
[28] Aletaha D, Westhovens R, Combe B, et al. Efficacy and safety of filgotinib in patients aged ≥ 75 years: a post hoc subgroup analysis of the FINCH long‑term extension (LTE) study. Ann Rheum Dis 2022; 81: 612–613.