Niraparib v udržovací léčbě ovariálního karcinomu již od první linie
Ovariální karcinom zaujímá celosvětově místo na přední příčce úmrtnosti mezi gynekologickými nádory. Velká část případů je diagnostikována až v pokročilém stadiu. Primární léčba sestává z chirurgické cytoredukce a následné chemoterapie. Bohužel až u 85 % pacientek s pokročilým nádorem vaječníků dochází k rekurenci onemocnění [1].
Cílem studie bylo zhodnotit účinnost a bezpečnost podávání niraparibu jako udržovací léčby pacientek s nově diagnostikovaným pokročilým karcinomem ovarií s vysokým rizikem relapsu, které byly citlivé na předchozí chemoterapii založenou na platině.
Primárním cílovým ukazatelem studie bylo PFS u pacientek s deficitem homologní rekombinace a v celkové populaci pacientek. Klíčovým sekundárním cílovým ukazatelem bylo celkové přežití (overall survival, OS). Dále byly sledovány čas do následné léčby, PFS2 (definováno jako čas od randomizace do progrese, zatímco pacientka dostávala následnou protinádorovou léčbu), farmakokinetické parametry, tzv. výsledky hlášené pacienty (patient reported outcomes, PRO) a nežádoucí účinky.
V protokolu studie PRIMA byl
zhruba po dvou letech proveden dodatek, ve kterém byla
uplatněna individualizovaná dávka niraparibu dle tělesné
hmotnosti a výchozího počtu trombocytů. Pacientkám
s tělesnou hmotností ≥ 77 kg a výchozím
počtem trombocytů ≥ 150 000/μl byl podáván
niraparib v dávce 300 mg (3× 100mg tobolky jednou
denně), zatímco pacientky s výchozí tělesnou
hmotností < 77 kg nebo s výchozím počtem
trombocytů < 150 000/μl dostávaly 200 mg niraparibu
(2× 100mg tobolky jednou denně) [4]. Použití
individualizované počáteční dávky snížilo výskyt nežádoucích
účinků [5].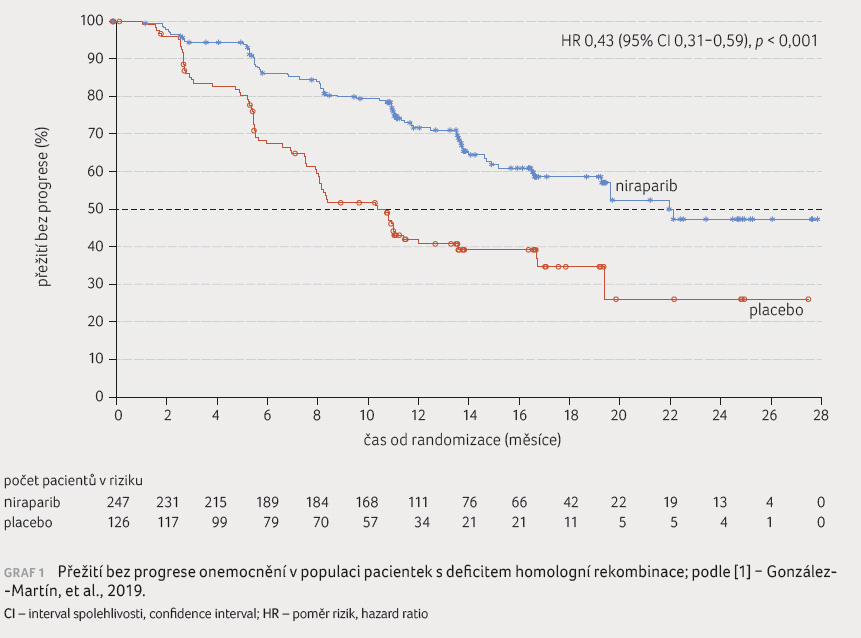
Medián PFS u pacientek s deficitem homologní rekombinace byl ve skupině niraparibu 21,9 měsíce vs. 10,4 měsíce v placebové větvi (HR pro progresi nemoci nebo smrt 0,43; 95% CI 0,31−0,59; p < 0,001), graf 1. V celkové populaci činil medián PFS 13,8 měsíce ve skupině niraparibu vs. 8,2 měsíce ve skupině placeba (HR 0,62; 95% CI 0,50−0,76; p < 0,001), graf 2.
Dle interim analýzy byla v celkové
populaci pacientek pravděpodobnost OS po 24 měsících
ve skupině léčené niraparibem 84 % oproti 77 %
v placebové skupině (HR 0,70; 95% CI 0,44−1,11). V populaci
s deficitem homologní rekombinace dosahovala pravděpodobnost
OS po 24 měsících ve skupině s niraparibem 91 %
a 85 % ve skupině s placebem (HR 0,61; 95% CI
0,27−1,39)‚ u populace pacientek bez deficitu homologní
rekombinace 81 % ve skupině s niraparibem a 59 %
v placebové skupině (HR 0,51; 95% CI 0,27–0,97) [1].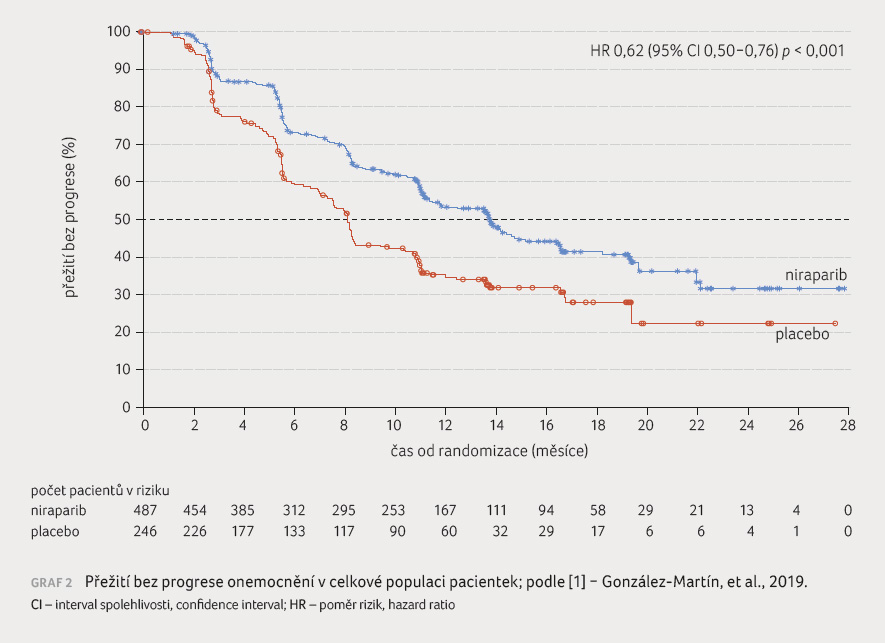
Riziko progrese onemocnění nebo úmrtí
dle podskupin pacientek ukazuje graf 3. V prespecifikované
explorativní analýze bylo demonstrováno významné prodloužení
PFS při léčbě niraparibem u všech poskupin pacientek bez
ohledu na stav biomarkerů (mutace BRCA a status homologní
rekombinace). V podskupině pacientek s deficitem homologní
rekombinace a mutací BRCA představoval medián PFS
ve skupině s niraparibem 22,1 měsíce vs. 10,9 měsíce
u placeba; v podskupině bez mutace BRCA byl medián PFS
ve skupině léčené niraparibem 19,6 měsíce vs. 8,2 měsíce
ve skupině, která dostávala placebo. U podskupiny
pacientek se schopností homologní rekombinace představoval medián
PFS 8,1 měsíce ve skupině niraparibu vs. 5,4 měsíce
v placebové větvi [1].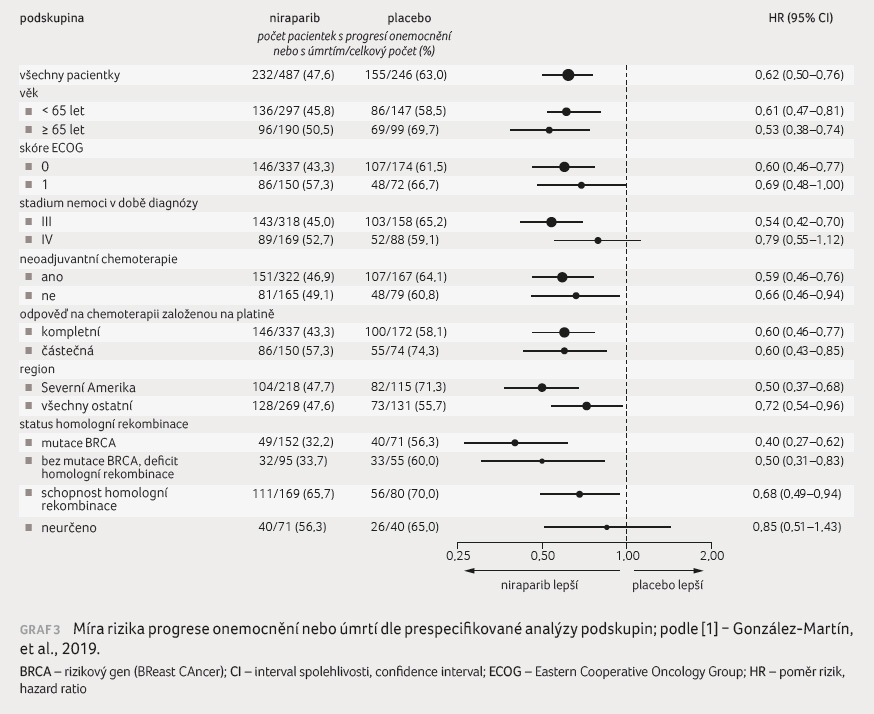
Při hodnocení bezpečnosti léčby byly jako nejčastější nežádoucí účinky stupně 3 a vyššího ve skupině léčené niraparibem zaznamenány anémie (31 % pacientek), trombocytopenie (28,7 %) a neutropenie (12,8 %). Redukce dávky niraparibu byla provedena u 70,9 % pacientek. Kvůli výskytu nežádoucích účinků vysadilo léčbu 12,0 % pacientek ve skupině niraparibu oproti 2,5 % ve skupině placeba [1], což je srovnatelné s jinými inhibitory PARP.
Indikace niraparibu
Niraparib (přípravek Zejula) je aktuálně indikován [4] v monoterapii
k udržovací léčbě dospělých pacientek s pokročilým high grade epiteliálním karcinomem vaječníků (stadia FIGO III a IV), vejcovodů nebo s primárním karcinomem peritonea, které úplně nebo částečně odpověděly na dokončenou první linii chemoterapie založené na platině;
k udržovací léčbě dospělých pacientek s rekurentním a na léčbu platinou senzitivním high grade serózním epiteliálním karcinomem vaječníků, vejcovodů nebo primárním karcinomem peritonea, které odpovídají (úplná nebo částečná odpověď) na chemoterapii založenou na platině.
Udržovací léčba niraparibem v obou indikacích je zanesena do Modré knihy [6].
Dávkování
Niraparib je dostupný ve formě tvrdých tobolek, které se podávají celé perorálně jednou denně bez závislosti na jídle.
V indikaci udržovací léčby první linie ovariálního karcinomu se počáteční dávka volí na základě tělesné hmotnosti pacientky a výchozího počtu trombocytů. U pacientek s hmotností ≥ 77 kg a počtem trombocytů ≥ 150 000/µl je doporučeno zahájit léčbu dávkou 300 mg niraparibu (3 tobolky Zejula). U pacientek s hmotností nižší než 77 kg a/nebo počátečním počtem trombocytů nižším než 150 000/µl je doporučena dávka 200 mg (2 tobolky Zejula).
V případě rekurentního karcinomu vaječníků je jako počáteční dávka indikováno 300 mg niraparibu [4].
Možnost modifikace dávky
Výskyt nežádoucích účinků je
možné zvládat díky možnosti úpravy dávkování. Při výskytu
nežádoucích účinků je možné léčbu přerušit, a to
na maximálně 28 dní. Pokud se stav pacientky upraví, je
možné v léčbě pokračovat a případně reagovat
redukcí denní dávky (tab. 1).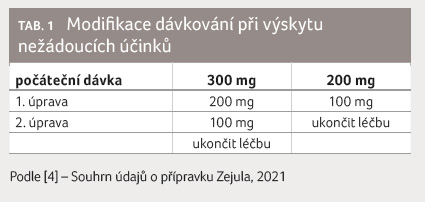
Bezpečnost léčby
Bezpečnostní profil přípravku je dobře popsán [4]. Ze závažných nežádoucích účinků byly u pacientek léčených niraparibem hlášeny nejčastěji hematologické nežádoucí účinky (trombocytopenie, anémie, neutropenie). Díky možnosti přerušit léčbu a modifikovat dávkování jsou nežádoucí účinky obvykle zvládnutelné. Roli hraje také individualizovaná dávka niraparibu podle tělesné hmotnosti a výchozího počtu trombocytů, která výskyt těchto nežádoucích účinků redukovala. Postup modifikace dávkování podrobně uvádí Souhrn údajů o přípravku Zejula [4].
Hematologické nežádoucí účinky pozorované při léčbě niraparibem byly zaznamenány zejména v úvodní fázi léčby. Doporučuje se proto během prvního měsíce léčby každý týden sledovat kompletní krevní obraz a dle potřeby upravit dávkování. Po prvním měsíci se doporučuje sledovat kompletní krevní obraz každý měsíc a poté nadále v pravidelných intervalech [4].
V souvislosti s léčbou byl zaznamenán také výskyt hypertenze. Během prvních dvou měsíců je doporučeno monitorovat krevní tlak jednou týdně, dále po dobu prvního roku jednou měsíčně a pak pravidelně během další léčby (možné i domácí monitorování pacientem). Hypertenze je obvykle dostatečně korigována použitím standardní antihypertenzní léčby, případně s úpravou dávkování přípravku [4].
Shrnutí
Prognóza pacientek s pokročilým karcinomem ovarií není pozitivní. Proto je cílem udržovací terapie prodloužení období přežití bez progrese, což také oddaluje nutnost další linie chemoterapie i nástup rezistence na platinu [7]. Léčba niraparibem s perorálním podáváním a dávkováním jednou denně umožňuje zachovat dobrou kvalitu života pacientek a díky účinnosti u nádorů bez ohledu na status mutace genů BRCA a homologní rekombinace rozšiřuje indikaci inhibitorů PAPR pro širší spektrum pacientek.
Seznam použité literatury
- [1] González‑Martín A, Pothuri B, Vergote I, et al. for PRIMA/ENGOT‑OV26/GOG‑3012 Investigators. Niraparib in patients with newly diagnosed advanced ovarian cancer. N Engl J Med 2019; 381: 2391−2402.
- [2] Chovanec J, Náležinská M, Jelenek G. Nová léčiva v terapii ovariálního karcinomu aneb proč zůstává základem primární radikální výkon. Postgraduální medicína 2016; 18: 10−16.
- [3] Mirza MR, Monk BJ, Herrstedt J, et al. for the ENGOT‑OV16/NOVA Investigators. Niraparib maintenance therapy in platinum‑sensitive, recurrent ovarian cancer. N Engl J Med 2016; 375: 2154−2164.
- [4] Souhrn údajů o přípravku Zejula. Dostupné na https://www.sukl.cz.
- [5] Mirza MR, González‑Martín A, Graybill, W, et al. Evaluation of an individualized starting dose of niraparib in the PRIMA/ENGOT‑OV26/GOG‑3012 Study. American Society of Clinical Oncology (ASCO) Congress; 29–31 May 2020. Poster 221.
- [6] Maintenance terapie niraparibem. Modrá kniha České onkologické společnosti. Masarykův onkologický ústav, Brno. Od 1. 3. 2021 v platnosti 27. aktualizace. Dostupné na: https://www.linkos.cz/lekar‑a‑multidisciplinarni‑tym/personalizovana‑onkologie/modra‑kniha‑cos/aktualni‑vydani‑modre‑knihy/
- [7] Hanker LC, Loibl S, Burchardi N, et al. The impact of second to sixth line therapy on survival of relapsed ovarian cancer after primary taxane/platinum‑based therapy. Ann Oncol 2012; 23: 2605–2612.