Pětiletá data posílila vedoucí postavení sekukinumabu v léčbě spondyloartritid
Společnost Novartis představila v rámci loňské výroční konference American College of Rheumatology/Association of Rheumatology Health Professionals (ACR/ARHP) v Chicagu pětiletá data z probíhajících extenzí studií fáze III FUTURE 1 a MEASURE 1 se sekukinumabem (Cosentyx) u pacientů trpících psoriatickou artritidou (PsA) a ankylozující spondylitidou (AS). Výsledky těchto sledování prokazují rychlé a trvalé zmírnění symptomů obou onemocnění při léčbě sekukinumabem i jeho jedinečné postavení v dlouhodobé komplexní péči napříč indikacemi.
Nová dlouhodobá data ze studií
FUTURE 1 a MEASURE 1 potvrzují setrvalou účinnost
sekukinumabu v terapii PsA a AS po dobu pěti let
[1,2]. V klinické studii FUTURE 1 dosáhlo 83 %, resp. 94 %
pacientů trpících PsA výrazného zlepšení v případě
entezitidy, resp. daktylitidy. Více než 80 % nemocných, kteří
byli zařazeni do extenzí obou klinických hodnocení,
dokončilo pětiletou terapii [1,2]. Tato data odpovídají rovněž
výsledkům studie SCULPTURE, v níž dvě třetiny pacientů
referovaly při léčbě sekukinumabem nulový dopad svého kožního
onemocnění na kvalitu života během pětiletého sledování
[3].
Psoriatická artritida i ankylozující spondylitida znamenají pro nemocné velkou zátěž vzhledem ke svému chronickému a progredujícímu průběhu a mohou významně poznamenat pohyblivost a celkovou kvalitu života pacientů. Terapie sekukinumabem v tomto případě nabízí dlouhotrvající účinnost a příznivý bezpečnostní profil. Sekukinumab je monoklonální protilátka s vysokou afinitou k interleukinu 17A (IL 17A), který představuje klíčový cytokin v imunopatogenezi a rozvoji spondyloartritidy a PsA.
Dvouletá multicentrická,
randomizovaná, placebem kontrolovaná studie fáze III FUTURE 1
hodnotila bezpečnost sekukinumabu u pacientů s PsA [4].
Klinické sledování zahrnulo 606 nemocných s aktivní PsA,
jimž byl sekukinumab podáván subkutánně v dávce 75 mg
nebo 150 mg. Primárním cílovým ukazatelem bylo hodnocení
sekukinumabu oproti placebu ve vztahu k počtu pacientů,
kteří ve 24. týdnu dosáhli při léčbě odpovědi ACR 20
(kritérium 20% zlepšení podle American College of Rheumatology).
Od 16. týdne byli pacienti v placebovém rameni
rerandomizováni k podávání sekukinumabu v dávce 75 mg
a 150 mg buď v týdnu 16, nebo v týdnu
24 v závislosti na klinické odpovědi [4]. Celkem
460 nemocných bylo zařazeno do tříleté extenze
navazující na dvouleté studijní sledování [1]. Více než
80 % pacientů, kteří se hodnocení účastnili, dokončilo
pětiletou terapii sekukinumabem. Ten prokázal setrvalé zlepšení
příznaků PsA po dobu pěti let (odpovědi ACR 20 dosáhlo
67,9 % pacientů s dávkou 150 mg sekukinumabu a 77,2 %
pacientů s dávkou 75 mg, odpovědi ACR 50 pak 52,7 %
nemocných s dávkou 150 mg a 51,2 % nemocných
s dávkou 75 mg sekukinumabu), včetně téměř kompletního
vymizení entezitidy (83 % osob) a daktylitidy (94 %
osob). Bylo zaznamenáno zvýšení účinnosti sekukinumabu při
eskalaci dávky na 150 mg nebo 300 mg v průběhu
studie – celkem 86/236 (36,4 %) pacientům s léčbou
150 mg sekukinumabu byla dávka zvýšena na 300 mg, zatímco
u 180/221 (81,4 %) pacientů léčených 75 mg sekukinumabu
byla dávka eskalována na 150/300 mg [1], graf 1A, B.
Lék byl nemocnými velmi dobře tolerován a jeho bezpečnostní
profil byl v souladu s předchozími hlášeními.
Bezpečnost byla vyjádřena jako ukazatel EAIR (exposure adjusted
incidence rate)/100 pacientoroků pro všechny pacienty (n = 587),
kteří obdrželi jednu nebo více dávek studijní medikace.
Ukazatel EAIR u vybraných nežádoucích příhod při léčbě
sekukinumabem činil v případě vážných infekcí 1,8,
ulcerativní kolitidy 0,04, Crohnovy choroby 0,1 a velké
kardiovaskulární příhody (MACE) 0,5 [1].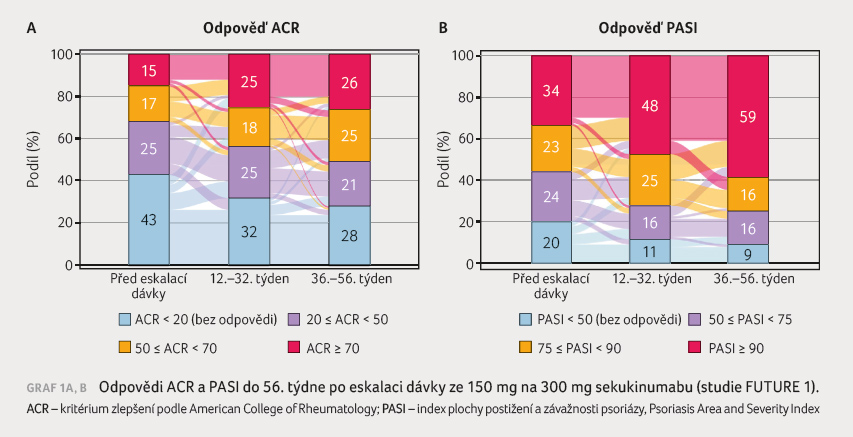
Dvouletá multicentrická,
randomizovaná, placebem kontrolovaná studie fáze III MEASURE 1
hodnotila účinnost a bezpečnost sekukinumabu u pacientů
trpících aktivní AS [5]. Primární cílové ukazatele hodnotily
superioritu sekukinumabu v porovnání s placebem
v 16. týdnu u pacientů, kteří dosáhli nejméně
20% zlepšení odpovědi ASAS 20 (kritérium 20% zlepšení podle
Assessment of Spondyloarthritis International Society) [6].
Od 16. týdne byli nemocní v placebové větvi
rerandomizováni k podávání sekukinumabu v dávce 75 mg
nebo 150 mg na základě odpovědi ASAS 20 –
non respondéři byli k léčbě sekukinumabem převedeni
v týdnu 16 a respondéři v týdnu 24 [5,7]. Celkem
290 z 371 nemocných dokončilo studijní sledování a 274
osob bylo zařazeno do následné tříleté extenze [2,5,7].
Z pacientů zařazených do tohoto rozšířeného
sledování jich pětiletou léčbu sekukinumabem dokončilo více
než 80 %; 56 % nemocných léčených 75 mg sekukinumabu byla
od 168. týdne dávka zvýšena na 150 mg.
K trvalému zlepšení v odpovědích ASAS 20 a ASAS
40 došlo během pětiletého hodnocení ve všech dávkových
kohortách (graf 2). Ve skupinách, v nichž
došlo k eskalaci dávky, bylo v 72. týdnu
zaznamenáno u odpovědi ASAS 20 v případě 75 mg
sekukinumabu 74% zlepšení a v případě 150 mg
sekukinumabu 82% zlepšení [2]. Sekukinumab prokázal ve studii
MEASURE 1 trvalou účinnost v terapii AS zahrnující zmírnění
symptomů onemocnění, zlepšení fyzického stavu a zlepšení
ob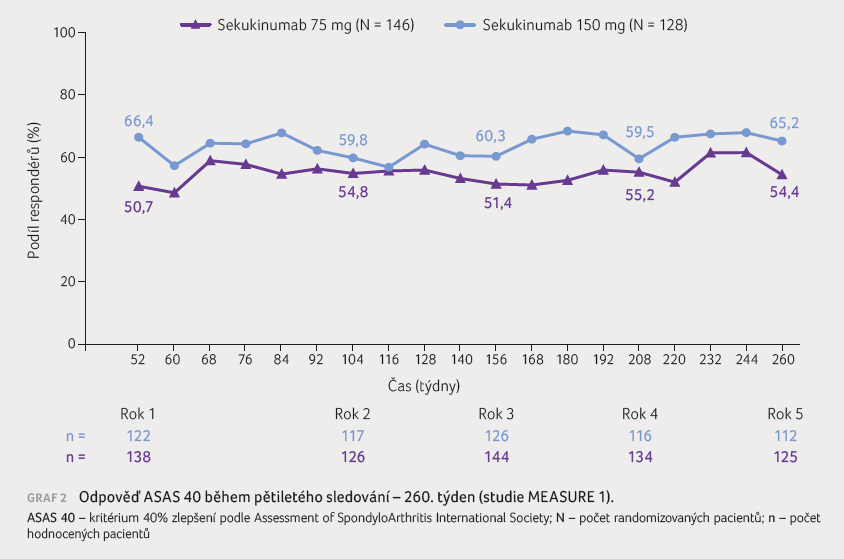 jektivních známek zánětu během pěti let. Větší efekt léčby
byl zaznamenán u pacientů, u nichž byla dávka
sekukinumabu zvýšena ze 75 mg na 150 mg. Lék byl
nemocnými s AS dobře tolerován i při dlouhodobém
užívání bez výskytu nežádoucích reakcí a jeho
bezpečnostní profil byl v souladu s předchozími
hlášeními [5]. Ukazatel EAIR u vybraných nežádoucích
příhod při léčbě sekukinumabem činil v případě
ulcerativní kolitidy 0,1, Crohnovy choroby 0,6, uveitidy 1,8
a u malignit a nespecifických nádorů 0,5 [2].
jektivních známek zánětu během pěti let. Větší efekt léčby
byl zaznamenán u pacientů, u nichž byla dávka
sekukinumabu zvýšena ze 75 mg na 150 mg. Lék byl
nemocnými s AS dobře tolerován i při dlouhodobém
užívání bez výskytu nežádoucích reakcí a jeho
bezpečnostní profil byl v souladu s předchozími
hlášeními [5]. Ukazatel EAIR u vybraných nežádoucích
příhod při léčbě sekukinumabem činil v případě
ulcerativní kolitidy 0,1, Crohnovy choroby 0,6, uveitidy 1,8
a u malignit a nespecifických nádorů 0,5 [2].
Data z dlouhodobého pokračování
klinické studie fáze III (SCULPTURE) hodnotící
účinnost v léčbě psoriázy prokázala setrvalou míru
zlepšení stavu kůže po dobu pěti let [3]. Výsledky
studie SCULPTURE potvrdily udržení terapeutického efektu
prostřednictvím indexu PASI 90 a PASI 100 (Psoriasis Area
and Severity Index) u pacientů se středně těžkou
a těžkou formou ložiskové psoriázy. Téměř
u 100 % pacientů, kteří dosáhli PASI 90 nebo PASI
100 v základní studii (jeden rok léčby), byl tento efekt
zachován až do konce pátého roku terapie, kdy byli sledováni
(graf 3). V prvním
roce bylo do extenze zařazeno 168 nemocných a na konci
pátého roku dokončilo celkem 126 nemocných terapii sekukinumabem
v dávce 300 mg (1 za čtyři
týdny). Odpovědi PASI 75/90/100 v prvním roce léčby
(88,9 %/68,5 %/43,8 %) přetrvaly do pátého roku
(88,5 %/66,4 %/41 %). Rovněž odpověď DLQI 0/1 hodnotící
kvalitu života (Dermatology Life Quality Index) byla trvalá
po celou dobu sledování (v prvním roce 72,7 %, v pátém
roce 65,5 %). Sekukinumab si zachoval příznivý bezpečnostní
profil bez kumulativních nebo neočekávaných
nežádoucích reakcí [3].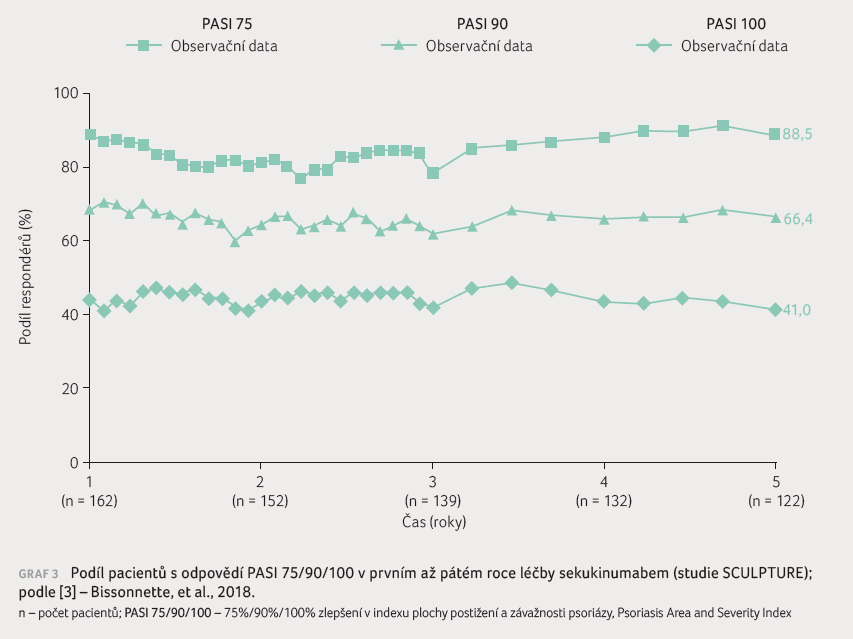
Pětiletá data z dlouhodobého pokračování klinické studie fáze III tak posílila dosavadní pozitivní poznatky o dlouhodobém účinku sekukinumabu i o jeho bezpečnostních ukazatelích.
Redakčně zpracovala PhDr. Nikola Homolová Richtrová
Seznam použité literatury
- [1] Mease PJ, Kavanaugh A, Reimold A, et al. Secukinumab provides sustained improvements in the signs and symptoms in psoriatic arthritis: final 5 year efficacy and safety results from a phase 3 trial. 2018 ACR/ARHP Annual Meeting. Abstract 2568. Dostupné na: https://acrabstracts.org/abstract/secukinumab‑provides‑sustained‑improvements‑in‑the‑signs‑and‑symptoms‑in‑psoriatic‑arthritis‑final‑5‑year‑efficacy‑and‑safety‑results‑from‑a‑phase‑3‑trial/
- [2] Baraliakos X, Braun J, Deodhar AA, et al. Long‑term evaluation of secukinumab in ankylosing spondylitis: 5 year efficacy and safety results from a phase 3 trial. 2018 ACR/ARHP Annual Meeting. Abstract L13. Dostupné na: https://acrabstracts.org/abstract/long‑term‑evaluation‑of‑secukinumab‑in‑ankylosing‑spondylitis‑5‑year‑efficacy‑and‑safety‑results‑from‑a‑phase‑3‑trial/
- [3] Bissonnette R, Luger T, Thaçi D, et al. Secukinumab demonstrates high sustained efficacy and a favorable safety profile in patients with moderate to severe psoriasis through 5 years of treatment (SCULPTURE Extension Study). J Eur Acad Dermatol Venereol 2018; 39: 1507‒1514.
- [4] Mease PJ, McInnes IB, Kirkham B, et al. Secukinumab inhibition of interleukin‑17A in patients with psoriatic arthritis. N Engl J Med 2015; 373: 1329‒1339.
- [5] Braun J, Baraliakos X, Deodhar AA, et al. Effect of secukinumab on clinical and radiographic outcomes in ankylosing spondylitis: 2‑year results from the randomised phase III MEASURE 1 study. Ann Rheum Dis 2017; 76: 1070‒1077.
- [6] Baeten D, Sieper J, Braun J, et al. Secukinumab, interleukin‑17A inhibition in ankylosing spondylitis. N Engl J Med 2015; 373: 2534‒2548.
- [7] Braun J, Baraliakos X, Deodhar AA, et al. Secukinumab demonstrates low radiographic progression and sustained efficacy through 4 years in patients with active ankylosing spondylitis. 2017 ACR/ARHP Annual Meeting. Abstract 3L. Dostupné na: https://acrabstracts.org/abstract/secukinumab‑demonstrates‑low‑radiographic‑progression‑and‑sustained‑efficacy‑through‑4‑years‑in‑patients‑with‑active‑ankylosing‑spondylitis/