Praktický pohled na intenzifikaci inzulinové léčby pomocí injekční terapie fixní kombinací liraglutidu a degludeku
Souhrn:
Iniciace inzulinoterapie je spojena s častým oddalováním. Mezi hlavní bariéry zahájení inzulinové léčby patří obava z hypoglykemie, ze vzestupu tělesné hmotnosti, strach z inzulinu, obavy ze složité injekční techniky aplikace, z nutnosti častějšího selfmonitoringu glykemií glukometrem a s tím související obava ze snížení kvality života. Stejně jako inicializace léčby inzulinem bývá problémem i intenzifikace léčby bazálním inzulinem při nedosažení cílových hodnot kompenzace. Rozhodnutí o použití inzulinu by mělo vycházet z komplexního posouzení problematiky pacienta. V současné době je kromě intenzifikace léčby bazálním inzulinem přidáním dalšího inzulinu, většinou krátkodobě působícího v režimu bazál‑bolus, výhodná kombinační injekční léčba přidáním agonisty receptoru pro GLP‑1. Dnes je navíc dostupná cestou jedné aplikace fixní kombinace obou složek, což významně zlepšuje adherenci pacientů s diabetem k terapii.
Key words: insulin − GLP‑1 receptor agonist − combination injection therapy − intensification.
Summary:
The initiation of insulin therapy is frequently delayed. The leading barriers in the initiation process of insulin therapy include concerns regarding hypoglycaemia, weight gain, insulin, complications with injection technique, need for more frequent self‑monitoring of glucose and concerns regarding the related decrease in quality of life. The initiation of insulin therapy is problematic, just as the intensification of basal insulin therapy when the target values of compensation are not met. The decision on the use of insulin should be based on a comprehensive assessment of the patient situation. Currently, in addition to intensifying basal insulin therapy with second insulin, mostly short‑acting, in the basal–bolus regimen, another beneficial combination injection treatment is the addition of GLP‑1 receptor agonist. Moreover, one application of a fixed combination of both components is available today which significantly improves the adherence of patients with diabetes to the therapy.
Úvod
Správně vedená terapie antidiabetiky zlepšuje prognózu pacienta s diabetem, neboť snižuje riziko vývoje chronických komplikací [1]. Nejčastější indikací k léčbě pacienta inzulinem je neuspokojivá kompenzace diabetu při léčbě kombinací perorálních antidiabetik. U osob s diabetes mellitus (DM) 2. typu to podle dat z observačních studií bývá ve většině případů bazální inzulinový analog, kterým je inzulinová léčba zahajována. Je známo, že zahájení inzulinoterapie je spojeno s častým oddalováním v řádu let i přes zjevnou indikaci [2]. Mezi hlavní bariéry zahájení inzulinové léčby patří obava z hypoglykemie, ze vzestupu tělesné hmotnosti, strach z inzulinu, obavy ze složité injekční techniky aplikace, z nutnosti častějšího selfmonitoringu glykemií glukometrem a s tím související obava ze snížení kvality života. Rozhodnutí o použití inzulinu by mělo vycházet z komplexního posouzení problematiky pacienta, které by mělo zahrnout nejen kompenzaci diabetu vyjádřenou hodnotou glykovaného hemoglobinu (HbA1c), ale i výskyt hypoglykemií, jejich časovou distribuci během dne, znalost lačné a postprandiální glykemie, vývoj tělesné hmotnosti pacienta a samozřejmě také jeho spolupráci v léčbě. Stejně jako inicializace léčby inzulinem bývá i intenzifikace této terapie významně zpožděna, např. retrospektivní analýza dat z registru diabetiků z Velké Británie ukázala, že v 60 % případů nedošlo po dobu tří let k indikované intenzifikaci u osob léčených bazálním inzulinem a perorálním antidiabetikem [3].
V situaci, kdy bylo po zahájení léčby bazálním inzulinovým analogem a po nastavení jeho adekvátní dávky dosaženo cílové glykemie nalačno, ale úroveň dlouhodobé kompenzace vyjádřená hodnotou HbA1c nebyla optimální, je potřeba učinit rozhodnutí, jakou cestou intenzifikovat [4]. V observačních studiích je podíl těchto pacientů ze všech léčených bazálním inzulinem (většinou v kombinaci s perorálními antidiabetiky) asi 30 %. Přidání dalšího perorálního antidiabetika, často trojkombinační terapie perorálními antidiabetiky a inzulinem, nebývá již v této situaci efektivní, snad s výjimkou přidání inhibitoru přenašeče pro glukózu a sodík (sodium glucose co transporter 2, SGLT2).
Nabízí se intenzifikace stávající léčby bazálním inzulinem přidáním dalšího inzulinu (prandiálního nebo náhrada premixovanou směsí inzulinových analog) či kombinace s agonistou receptoru pro glukagonu podobný peptid 1 (GLP 1R). Zatímco bazální inzulin potlačuje nedostatečně suprimovanou jaterní glukoneogenezi, inhibuje glykogenolýzu v játrech během noci a vede tak dominantně k ovlivnění glykemie nalačno, agonista GLP 1R upravuje poruchu přítomnou typicky u pacientů s DM 2. typu, tedy nedostatečný inkretinový efekt. Glukózo dependentně stimuluje sekreci inzulinu po perorálním příjmu sacharidů, proto významněji ovlivňuje postprandiální glykemii [5]. Do regulace plazmatické koncentrace glukózy je zapojena celá řada orgánů a tkání a trendem v léčbě diabetu je snaha o ovlivnění více cest najednou, v našem případě to bude zejména tvorba glukózy v játrech bazálním inzulinem a zvýšení sekrece endogenního inzulinu. A navíc, jak agonista GLP 1R, tak bazální inzulin mají potenciál k obnovení a zvýšení endogenní sekrece inzulinu, zejména při podání v časných fázích diabetu. Současně se potencují pozitivní vlastnosti obou léků a redukují negativa, agonista GLP 1R neutralizuje dopad inzulinu na tělesnou hmotnost a riziko vzniku hypoglykemie.
V současné době má tato kombinační injekční léčba mj. výhodu v dostupnosti fixní kombinace. Možnost aplikace obou antidiabetik pomocí jednoho aplikátoru má dopad na adherenci pacientů k farmakoterapii. Víme, že podání jedné tablety denně, stejně jako při subkutánní aplikaci, je spojeno s vyšší adherencí, než je tomu v případě podání dvou či více dávek, přičemž platí nepřímá úměra mezi počtem denních dávek a adherencí, jak ukazují data z řady retrospektivních studií u velkého počtu pacientů s DM 2. typu. Přidanou hodnotou aktuálně dostupné fixní kombinace ultradlouze působícího inzulinu degludek a agonisty GLP 1R liraglutidu je prokázaný protektivní účinek liraglutidu na kardiovaskulární morbiditu a mortalitu a příznivé ovlivnění albuminurie u osob s DM 2. typu zařazených do studie LEADER [6]. Inzulin degludek ve studii DEVOTE prokázal kardiovaskulární bezpečnost [7].
Kazuistika
Kazuistika níže popisuje příběh pacientky narozené v roce 1964, u které byl DM 2. typu diagnostikován v rámci vyšetření před operací katarakty v roce 2010. Pacientka byla od začátku léčena metforminem, který byl titrován postupně do celkové denní dávky 2,5 g. Vstupní hodnota HbA1c v roce 2010 před zahájením antidiabetické terapie byla 65 mmol/mol. V době manifestace diabetu byla diagnostikována diabetická senzomotorická polyneuropatie dolních končetin, jinak pacientka neměla žádné další chronické komplikace. Metforminem byla léčena v monoterapii téměř dva roky a při nedosažení cílových hodnot HbA1c (58 mmol/mol) byl přidán inhibitor dipeptidylpeptidázy 4 (DPP 4) s poklesem hodnot HbA1c na 52 mmol/mol. Nicméně v roce 2015 byl pro opětovné zhoršení kompenzace (HbA1c 56 mmol/mol) přidán inhibitor SGLT2 s dobrým efektem (HbA1c 50 mmol/mol).
V osobní anamnéze pacientky byla arteriální hypertenze, dg. 2009, hyperlipoproteinemie, dg. 2010, chronická obstrukční plicní nemoc, dg. 2013, pacientka byla po cholecystektomii pro cholecystolitiázu před mnoha lety, po operaci fraktury kotníku levé dolní končetiny po pádu. K výše uvedeným antidiabetikům užívala následující chronickou medikaci: perindopril 10 mg, amlodipin 5 mg, indapamid 1,25 mg, atorvastatin 20 mg a tiotropium bromid. V rodině byl dokumentován výskyt diabetu u matky i otce. Ve vstupním vyšetření byla hmotnost 79 kg při výšce 159 cm, což odpovídá indexu tělesné hmotnosti (BMI) 31,5 kg/m2. Krevní tlak byl 136/79 mm Hg, srdeční frekvence 98/min. V té době byly výsledky laboratorních vyšetření následující: HbA1c 65 mmol/mol, glykemie nalačno 11,5 mmol/l, poměr albumin/kreatinin z ranního vzorku moče 5,9 mg/mmol, odhadovaná glomerulární filtrace (eGFR podle MDRD) 1,42 ml/s, LDL cholesterol 2,44 mmol/l, HDL cholesterol 1,1 mmol/l, triglyceridy 2,9 mmol/l, TSH (tyreotropní hormon) 1,125 mIU/l, moč chemicky a močový sediment byly bez významné patologie. Vývoj hodnot HbA1c v souvislosti s revizemi antidiabetik je uveden výše.
Pacientka během sledování od
roku 2010 snížila tělesnou hmotnost do roku 2016
na 74 kg (dokumentovaný pokles o 5 kg), přičemž
největší pokles byl zaznamenán během roku 2015, kdy byl
do trojkombinační terapie přidán inhibitor SGLT2. Pacientka
neprováděla selfmonitoring glykemií, přestože měla glukometr
k dispozici a byla edukována k měření. Koncem roku
2016 bylo při pravidelné kontrole v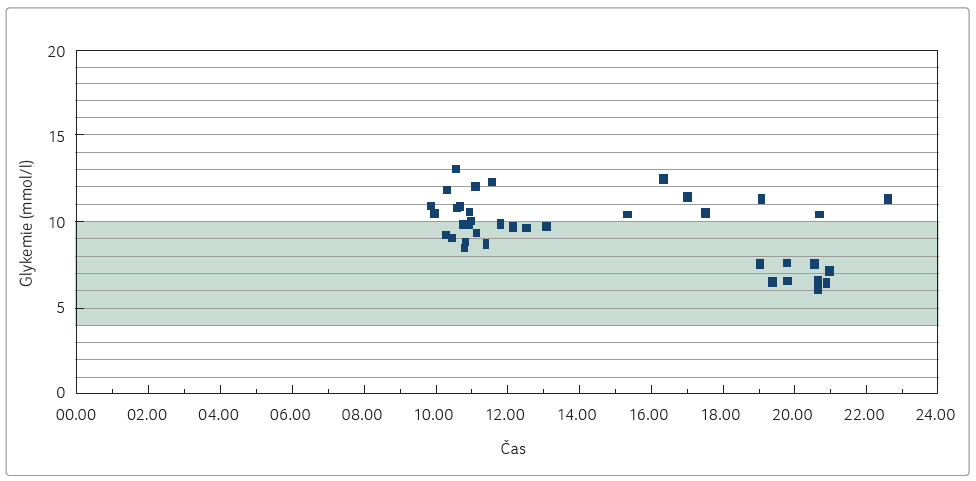 diabetologické ambulanci
přes zavedenou trojkombinační terapii perorálními antidiabetiky
(metformin, inhibitor DPP 4 a inhibitor SGLT2) zjištěno
zhoršení hodnot HbA1c na 59 mmol/mol. Pacientka
byla reedukována v selfmonitoringu glykemií a na další
časnou kontrolu přinesla glukometr k analýze hodnot. Záznamy
potvrdily zejména vysoké glykemie nalačno (graf 1).
diabetologické ambulanci
přes zavedenou trojkombinační terapii perorálními antidiabetiky
(metformin, inhibitor DPP 4 a inhibitor SGLT2) zjištěno
zhoršení hodnot HbA1c na 59 mmol/mol. Pacientka
byla reedukována v selfmonitoringu glykemií a na další
časnou kontrolu přinesla glukometr k analýze hodnot. Záznamy
potvrdily zejména vysoké glykemie nalačno (graf 1).
V klinické praxi je právě
analýza dat získaná strukturovaným selfmonitoringem glykemií
důležitá k identifikaci hlavního problému u konkrétního
pacienta. Jednak je plazmatická koncentrace glukózy nalačno
v průměru zhruba 10 mmol/l projevem nedostatečně utlumené
noční glukoneogeneze v játrech a dále v průběhu
dne nedochází k žádnému zlepšení, spíš jsou glykemie
celkově ještě vyšší. Žádné hypoglykemie u pacientky
nebyly dokumentovány. Z neinzulinových antidiabetik druhé
volby byly již podávány inhibitor DPP 4 a SGLT2. Nabízel
by se agonista GLP 1R, ovšem účinnost ve smyslu snížení
vysokých plazmatických koncentrací glukózy nalačno nedosahuje
efektu bazálního inzulinu při tak vysokých glykemiích, jaké
byly u pacientky. K přijetí navrhované terapie bazálním
analogem v jedné denní dávce večer pomohlo detailní
vysvětlení situace, v dalším průběhu samozřejmě také
individuální i skupinová edukace. Zahajovací dávka byla
kalkulována z tělesné hmotnosti zhruba 0,2 IU/kg a postupně
titrována k dosažení ranní cílové glykemie kolem 6 mmol/l.
Došlo ke zlepšení hodnot HbA1c na 50 mmol/mol.
Postupně byla nastavena dávka 38 IU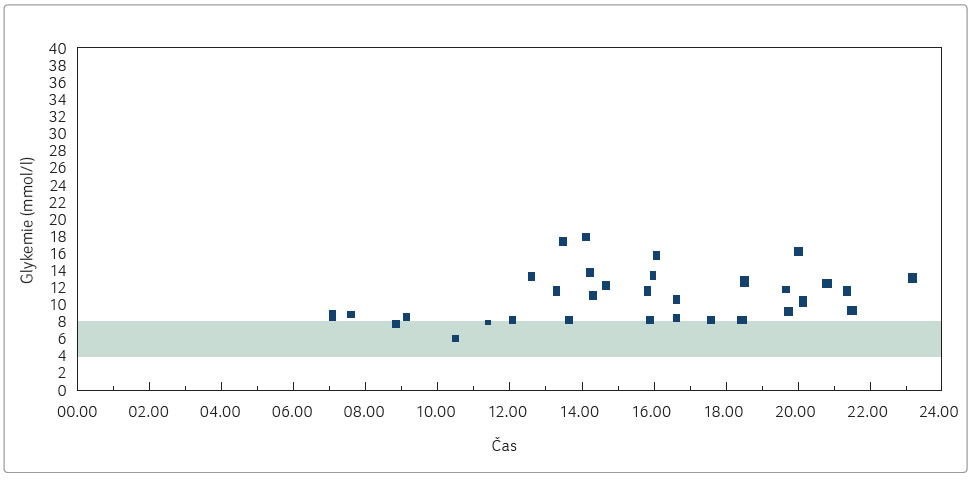 inzulinu detemir 1× denně,
kombinace perorálních antidiabetik byla ponechána. Vzestup tělesné
hmotnosti nebyl velký, nemocná přibrala asi 1 kg. Takto byla
léčena do dubna 2017, došlo opět ke zhoršení
dlouhodobé kompenzace, hodnota HbA1c byla 56 mmol/mol.
inzulinu detemir 1× denně,
kombinace perorálních antidiabetik byla ponechána. Vzestup tělesné
hmotnosti nebyl velký, nemocná přibrala asi 1 kg. Takto byla
léčena do dubna 2017, došlo opět ke zhoršení
dlouhodobé kompenzace, hodnota HbA1c byla 56 mmol/mol.
Ze záznamů selfmonitoringu glykemií pacientky je zřejmé, že příčinou neuspokojivé hodnoty HbA1c byly nadále nedostatečně korigované vzestupy glykemie po jídle, proto se náhrada agonistou GLP 1R jevila jako optimální volba (graf 2). V dubnu 2017 byla zahájena terapie inzulinem a agonistou GLP 1R ve fixní kombinaci degludek/liraglutid, která byla aplikována 1× denně subkutánně.
Léčba byla zahájena podáním 16 dávkovacích jednotek přípravku. Dávkovací jednotka odpovídá jedné IU inzulinu degludek (IDeg) a 0,036 mg liraglutidu. Titrace probíhala po 1 dávkovací jednotce obden. Dávka byla postupně titrována dle doporučeného algoritmu k cílové glykemii nalačno, která byla u pacientky stanovena na asi 5,0−6,0 mmol/l.
Kromě dosažení lepších výsledků
dlouhodobé kompenzace diabetu, poklesu HbA1c
na hodnotu 46 mmol/mol v srpnu 2017, došlo
k poklesu tělesné hmotnosti o 4 kg (tab. 1). Spolupráce je při jednoduchém a bezpečném
flexibilním dávkovacím schématu bezproblémová.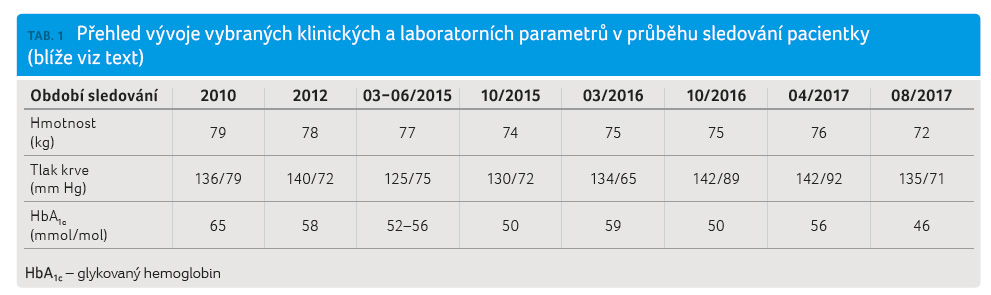
Diskuse
Studie DUAL I rozsáhlého klinického programu DUAL měla za cíl zhodnotit účinnost a bezpečnost fixní kombinace degludek/liraglutid (Xultophy) oproti jednotlivým komponentám. Kombinační léčba byla lepší v řadě aspektů než terapie jednotlivými komponentami. Do této prospektivní randomizované studie bylo zařazeno asi 1 600 pacientů s DM 2. typu dosud neléčených inzulinem, kteří byli randomizováni v poměru 2 : 1 : 1 do tří paralelních větví, jednak k léčbě fixní kombinací, jednak k podávání degludeku a jednak k podávání samotného liraglutidu [8].
Ve studii DUAL I byla zahajovací dávka Xultophy 10 jednotek, stejně jako dávka degludeku a stejně jako degludek byla i dávka přípravku Xultophy titrována na základě průměrné glykemie nalačno za tři dny k cílové hodnotě mezi 4−5 mmol/l. Liraglutid byl titrován o 0,6 mg 1× týdně do dávky 1,8 mg s.c. 1× denně. Doba podání nebyla pevně stanovena, ale musel být dodržován interval mezi jednotlivými injekcemi. Zatímco konečná dávka samotného degludeku byla 62 jednotek na konci sledování, dávka degludeku v kombinovaném přípravku byla nižší, 39 jednotek. Liraglutid tak snížil spotřebu inzulinu. Fixní kombinace snížila více hodnotu HbA1c oproti léčbě jak degludekem, tak liraglutidem. Efekt na lačnou glykemii byl jasně výraznější u kombinace oproti liraglutidu, minimální rozdíl oproti samotnému degludeku souvisí s titračním algoritmem, kdy k dosažení podobné cílové hodnoty glykemie nalačno bylo potřeba použít významně vyšší dávku degludeku samotného. Zatímco ve fixní kombinaci se dávka degludeku od 26. týdne nezvyšovala – zůstala na 39 jednotkách a bylo dosaženo glykemie 5,7 mmol/l nalačno −, tak u samostatně aplikovaného degludeku musela být titrována až do dávky 62 jednotek k dosažení glykemie nalačno 6,0 mmol/l. To dokládá potenciál liraglutidu ovlivňovat i glykemii nalačno. Co se postprandiálních glykemií týče, po každém z hlavních jídel byl vzestup glykemie při podávání fixní kombinace menší díky liraglutidu. Rozdíl oproti degludeku samotnému byl statisticky signifikantní. Použití fixní kombinace bylo spojeno s redukcí rizika potvrzené hypoglykemie kdykoliv v průběhu studie oproti užití degludeku až o třetinu. Výskyt nežádoucích účinků liraglutidu na gastrointestinální trakt, zejména nauzey, byl nižší při podávání kombinace, a to z důvodu pozvolnější titrace dávky kombinovaného přípravku.
Na letošní konferenci American Diabetes Association v San Diegu byly prezentovány výsledky studie DUAL VII, která hodnotila účinnost a bezpečnost fixní kombinační terapie Xultophy (IDegLira) oproti režimu bazál bolus kombinací inzulinu glargin 100 IU/ml a inzulinu aspart [9]. Celkem 506 zařazených pacientů s DM 2. typu z 12 zemí bylo randomizováno v poměru 1 : 1 a léčeno po dobu 26 týdnů. Do studie byli zařazeni pacienti se vstupní hodnotou HbA1c 53−86 mmol/mol léčení metforminem a inzulinem glargin v dávkách 20−50 IU denně. Pacienti buď pokračovali v léčbě glarginem, který byl dále titrován k cílové glykemii nalačno, a k tomu byl přidán prandiální inzulin aspart (iniciální dávka byla 4 jednotky s titrací dle postprandiální glykemie), nebo byli léčeni fixní kombinací Xultophy jednou denně (iniciální dávka byla 16 jednotek aplikovaných kdykoliv během dne). Během studie měli pacienti při léčbě kombinací Xultophy v rámci selfmonitoringu glykemií glukometrem stanovit glykemii 1 denně a pacienti léčení režimem bazál bolus 4 denně. Za 26 týdnů došlo ke srovnatelnému poklesu hodnot HbA1c (−1,48 % dle DCCT při podávání Xultophy vs. −1,46 % dle DCCT při podávání kombinace glargin/aspart; p < 0,0001). Zhruba dvě třetiny pacientů v každé skupině dosáhly HbA1c < 53 mmol/mol. Ve skupině léčené přípravkem Xultophy bylo tohoto poklesu dosaženo aplikací poloviční celkové denní dávky inzulinu (40 jednotek versus 84 jednotek; p < 0,0001). Výskyt hypoglykemií byl také signifikantně nižší ve skupině léčené Xultophy (19,8 % versus 52,6 %, p < 0,0001). U pacientů léčených Xultophy došlo k redukci tělesné hmotnosti v průměru o téměř 1 kg za 26 týdnů léčby, zatímco při léčbě režimem bazál bolus ke zvýšení hmotnosti o průměrných 2,6 kg (p < 0,0001). Celkově tedy ve skupině léčené Xultophy dosáhlo cílových hodnot HbA1c nižších než 53 mmol/mol bez zvýšení hmotnosti a současně bez dokumentované hypoglykemie 38 % osob, zatímco ve skupině léčené intenzifikovaným inzulinovým režimem to bylo jen asi 6 % osob.
Závěr
Kombinační léčba fixní kombinací degludek/liraglutid naplňuje požadavky na moderní antidiabetikum a léčbu, významná účinnost je spojena s bezpečností, s příznivým ovlivněním tělesné hmotnosti a s jednoduchostí podávání v jedné aplikaci denně. Při předpokladu dlouhodobé účinnosti související s potenciálem příznivě ovlivnit betabuňky pankreatu se vše může pozitivně promítnout do spokojenosti pacienta s léčbou.
Seznam použité literatury
- [1] UK Prospective Diabetes Study (UKPDS) Group. Intensive blood‑glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). Lancet 1998; 352: 837–853.
- [2] Curtis B, Lage MJ. Glycemic control among patients with type 2 diabetes who initiate basal insulin: a retrospective cohort study. J Med Econ 2014; 17: 21−23.
- [3] Blak BT, Smith HT, Hards M, et al. Optimization of insulin therapy in patients with type 2 diabetes mellitus: beyond basal insulin. Diabet Med 2012; 29: e13−20.
- [4] Frias PF, Frias JP. New Basal Insulins: a Clinical Perspective of Their Use in the Treatment of Type 2 Diabetes and Novel Treatment Options Beyond Basal Insulin. Curr Diab Rep 2017; 17: 91.
- [5] Levin P, Fan T, Song X, et al. Comparing clinical outcomes and costs for different treatment intensification approaches in patients with type 2 diabetes uncontrolled on basal insulin: adding glucagon‑like peptide‑1 receptor agonists vs adding rapid‑acting insulin or increasing basal insulin dose. Endocr Pract 2017 doi: 10.4158/EP171769.OR. [Epub ahead of print].
- [6] Marso SP, Daniels GH, Brown‑Frandsen K, et al. Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med 2016; 375: 311−322.
- [7] Marso SP, McGuire DK, Zinman B, et al. Efficacy and Safety of Degludec versus Glargine in Type 2 Diabetes. N Engl J Med 2017; 377: 723−732.
- [8] Gough SC, Bode B, Woo V, et al. Efficacy and safety of a fixed‑ratio combination of insulin degludec and liraglutide (IDegLira) compared with its components given alone: results of a phase 3, open‑label, randomised, 26‑week, treat‑to‑target trial in insulin‑naive patients with type 2 diabetes. Lancet Diabetes Endocrinol 2014; 2: 885−893.
- [9] Billings LK, Doshi A, Gouet D, et al. Efficacy and Safety of Insulin Degludec/Liraglutide (IDegLira) vs Basal–bolus Therapy in Patients with Type 2 Diabetes (T2D): DUAL VII Trial (NCT02420262). Oral presentation 136‑OR, presented at the 77th Annual Scientific Sessions of the American Diabetes Association (ADA), San Diego, USA. 10 June 2017.