Siponimod v léčbě sekundárně progresivní roztroušené sklerózy – příběh z praxe
Souhrn:
Recmanová E. Siponimod v léčbě sekundárně progresivní roztroušené sklerózy – příběh z praxe. Remedia 2022; 32: 174–178.
Roztroušená skleróza (RS) je chronické zánětlivé autoimunitní onemocnění centrálního nervového systému vedoucí bez léčby k závažné invaliditě mladých dospělých. Terapie zaznamenává v posledních letech výrazný pokrok. Sekundárně progresivní RS (SP‑RS) představuje druhou nejčastější formu RS. Zatímco pro relabující‑remitující formu RS (RR‑RS) máme k dispozici neustále se rozšiřující paletu protizánětlivých léčiv, efektivní lék pro SP‑RS dlouho chyběl. Siponimod je selektivní modulátor sfingosin‑1‑fosfátových (S1P) receptorů, který byl úspěšně testován jak u RR‑RS, tak u sekundární progrese. Jde o první perorální lék schválený pro použití při sekundární progresi, u nějž bylo prokázáno, že zpomaluje klinicky potvrzenou progresi. Je to dáno jak jeho schopností procházet hematoencefalickou bariérou, tak vazbou na S1P receptory v mozku, a tedy schopností působit na neurodegenerativní procesy spojené s progresí invalidity u RS, nejen pouze na děje zánětlivé. Účinnost a bezpečnost siponimodu byly testovány ve studii EXPAND. Bezpečnost siponimodu se v zásadě neliší od dosud schválených přípravků této skupiny, modulátorů S1P receptorů. Kazuistika prezentuje případ pacienta léčeného siponimodem v reálné klinické praxi.
Summary:
Recmanova E. Siponimod in treating secondary‑progressive multiple sclerosis – a story from practice. Remedia 2022; 32: 174–178.
Multiple sclerosis (MS) is a chronic inflammatory autoimmune disease of the central nervous system, leading to substantial disability in young adults if untreated. There has been tremendous progress in the treatment over recent years. Secondary‑progressive MS (SP‑MS) is the second most common form of MS. While many approved drugs are indicated for relapsing‑remitting MS (RR‑MS), effective treatment for SP‑MS was lacking. Siponimod is a selective modulator of sphingosine‑1‑phosphate (S1P) receptors successfully investigated in RR‑MS and SP‑MS. It is the first approved oral medication in the secondary progression that showed a statistically significant decrease in disability progression. It is administered for its ability to cross the blood‑brain barrier and bind the S1P receptors in the brain, and influence neurodegenerative processes, which are responsible for disability progression in multiple sclerosis. The efficacy and safety of siponimod were evaluated in the EXPAND trial. The safety of siponimod corresponds to the safety of other registered drugs in this class, the S1P receptor modulators. We present a case report of a patient treated with siponimod in real‑life clinical practice.
Key words: multiple sclerosis, secondary progression, siponimod.
Úvod
Roztroušená skleróza (RS) je chronické zánětlivé demyelinizační a neurodegenerativní onemocnění centrálního nervového systému (CNS). U 85 % pacientů začíná relabujícím remitujícím průběhem (RR RS), který je charakterizován atakami (nebo relapsy), jež se střídají s obdobími remise. Délka remise je individuální, k dalšímu relapsu může dojít za půl roku nebo za patnáct let. Po překročení určité míry poškození nervové tkáně se neurologický deficit stává trvalým, dochází k vyčerpání rezerv CNS a k přechodu do sekundárně progresivní RS (SP RS). Přesný moment přechodu nelze jednoznačně určit z důvodu neexistence přesné hranice mezi RR RS a SP RS, diagnóza se stanovuje retrospektivně. Podle Browna a kol. se až u 80 % neléčených pacientů s RR RS rozvíjí po 15–20 letech trvání nemoci SP RS. Progresivní forma je charakterizována progresí neurologického deficitu a nárůstem disability [1,2]. Pacienti se SP RS zažívají podstatný dopad onemocnění na své každodenní činnosti a na schopnost pracovat.
Terapie RS zaznamenala v posledních letech výrazný pokrok. Zatímco v devadesátých letech minulého století se výzkum zaměřoval především na RR RS, nyní je velká pozornost věnována i progresivním formám. Dnes již máme k dispozici první léčivé přípravky pro léčbu jak primárně progresivní RS, tak i sekundárně progresivní RS.
Sekundárně progresivní roztroušená
skleróza
Sekundárně progresivní RS představuje po relabující remitující formě celosvětově druhou nejčastější formu RS. U pacientů s RR RS převládá zánětlivá aktivita s poškozením myelinu, je porušena hematoencefalická bariéra (HEB) a imunitní buňky migrují z periferní krve do CNS. V progresivní fázi RS dochází zejména k energetickému vyčerpání nervových buněk, postupnému zániku axonů a neuronů a k uzavření zánětu za HEB, čímž jsou možnosti ovlivnění omezené. Zatímco v úvodní fázi RR RS pozorujeme dobrý efekt současných chorobu modifikujících léků (disease modifying drugs, DMDs), u progresivní formy převládá neurodegenerace nad zánětem, proti němuž jsou DMDs namířeny [3].
Zachytit konverzi do SP RS je
v klinické praxi velmi obtížné, protože přesný moment
přechodu nelze jednozačně určit. Průběh onemocnění je
individuální a značně klinicky variabilní, dosud
neexistují jasná klinická, zobrazovací či imunologická kritéria
pro určení bodu přechodu. Stanovení diagnózy je proto
problematické, intuitivní a diagnóza se stanovuje
retrospektivně na základě kontinuálního nárůstu
disability po relabujícím průběhu choroby [4]. Dlouhodobé
studie ukazují, že u 70 % pacientů je stanovena diagnóza
SP RS až při hodnotě na Expanded Disability Status Scale
(EDSS) ≥ 6,0. Ovšem 76 % pacientů má rozpoznatelnou
progresi již při EDSS ≤ 3,0 (obr. 1) [5].
V praxi to znamená, že od první návštěvy, kdy lékař
pojme podezření na progresi, do první návštěvy
s jasnou diagnózou SP RS uběhnou 3–4 roky. Je to
dáno opatrností lékařů v důsledku velké psychologické
zátěže spojené s oznámením diagnózy SP RS pacientovi
a donedávna i s nedostatkem relevantních léčebných
možností. Období tzv. diagnostické nejistoty bylo popsáno u 70 %
pacientů [6].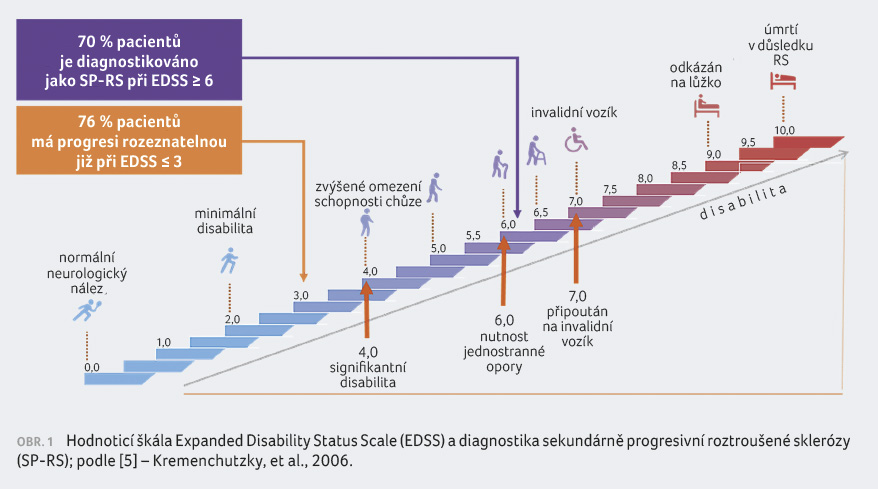
Mezi nepříznivé prognostické faktory, které mohou být předzvěstí dřívější konverze do SP RS, patří doba trvání nemoci, vyšší věk, mužské pohlaví, vysoká četnost relapsů po nástupu choroby, neúplné zotavení z první ataky, multisymptomatická klinická manifestace včetně míšní symptomatiky, lokalizace lézí infratentoriálně, vyšší míra mozkové atrofie, kouření, nízká koncentrace vitaminu D [7]. Pro pacienty s jistou diagnózou SP RS bývají typické snížená schopnost chůze s potřebou jednostranné nebo oboustranné opory, kognitivní poruchy, patologická únava, poruchy vyjadřování, zhoršení vizuálních funkcí a funkce horních končetin, deprese, bolest, sfinkterová dysfunkce, omezení sociálních kontaktů, zvýšená závislost na péči rodiny, nižší zaměstnanost a vyšší četnost hospitalizací [8].
Žádná definice SP RS nebyla až dosud všeobecně akceptována. Na základě rozsáhlé analýzy dat z registru MSBase s cílem časnější identifikace sekundární progrese byla jako nejvíce vyhovující identifikována definice, kdy pacient splňuje následující parametry: progrese disability o 1 stupeň na škále EDSS u pacientů s hodnotou ≤ 5,5 nebo o 0,5 stupně u pacientů s hodnotou ≥ 6,0 bez přítomnosti relapsů, s minimální hodnotou EDSS 4,0 a s postižením pyramidového funkčního systému dosahujícím minimálně stupně 2. Nutností je potvrzená progrese disability za tři měsíce včetně postižení pyramidových funkcí. Tato definice umožnila stanovit diagnózu SP RS o tři roky dříve, než by byla běžně stanovena lékařem [9].
Po dlouhou dobu představovala SP RS nepříjemné téma, protože jediné, co mohli lékaři pacientům ještě donedávna nabídnout, byly symptomatická léčba a intenzivní rehabilitace. Situace se změnila s příchodem siponimodu – prvního a zatím jediného schváleného léku v indikaci SP RS, u nějž je prokázáno, že zpomaluje klinicky potvrzenou progresi nemoci.
Siponimod – první terapie
hrazená v léčbě aktivní sekundárně progresivní RS
V březnu 2020 byl americkým Úřadem pro kontrolu potravin a léčiv (Food and Drug Administration, FDA) schválen perorální přípravek siponimod k léčbě SP RS s aktivitou onemocnění, v České republice je hrazen ze zdravotního pojištění od 1. února 2021.
Siponimod je selektivní modulátor sfingosin 1 fosfátových (S1P) receptorů. Na rozdíl od svého předchůdce fingolimodu je siponimod druhou generací S1P modulátorů specificky ovlivňujících jen receptory S1P1 a S1P5 exprimované na buňkách imunitního systému a CNS. Funkční antagonismus siponimodu vůči S1P1 snižuje výstup lymfocytů z lymfatických tkání a jejich počet v periferní krvi. Tím je omezen přestup lymfocytů do CNS. Navíc je siponimod lipofilní substancí přestupující HEB, a přímo v CNS tak ovlivňuje zánětlivé procesy. Preklinická data ukazují, že může mít neuroprotektivní efekt podporující remyelinizaci a omezující synaptickou neurodegeneraci [10].
Účinnost a bezpečnost siponimodu byly zkoumány v rozsáhlé randomizované, dvojitě zaslepené studii EXPAND. Léčba siponimodem vedla v porovnání s placebem k redukci rizika tříměsíční i šestiměsíční potvrzené progrese disability (confirmed disability progression, CDP) o 21 %, resp. 26 %. Dále došlo ke statisticky signifikantnímu poklesu roční míry relapsů (annualized relapse rate, ARR) o 55 % oproti placebu i ke snížení celkové míry mozkové atrofie. Ještě výraznější byl efekt siponimodu ve skupině pacientů s aktivní SP RS (definovaných jako pacienti s relapsem během dvou let před vstupem do studie a/nebo s přítomností gadolinium enhancujících T1 lézí na začátku studie). U této kategorie byl čas nástupu tříměsíční a šestiměsíční CDP zpožděn o 31 %, resp. 37 % oproti placebu a hodnota potvrzených relapsů byla redukována o 46 % v porovnání s placebem. Bylo dosaženo i zpomalení nárůstu atrofie na magnetické rezonanci (MR) mozku, statisticky významného snížení rizika zhoršení kognitivních funkcí a zlepšení v testu SDMT (Symbol Digit Modalities Test) [11,12].
Siponimod v současné době představuje jedinou perorální terapii specificky indikovanou pro pacienty s aktivní SP RS. Podle platných indikačních kritérií je hrazen u dospělých pacientů se SP RS se vstupní hodnotou EDSS 4,0–6,5 s prokázanou progresí disability minimálně o 1 bod na škále EDSS při vstupním skóre EDSS ≤ 5,5 nebo s nárůstem o 0,5 bodu u pacientů s EDSS ≥ 6,0. Minimální doba trvání progrese disability je stanovena na šest měsíců nezávisle na relapsech. Aktivita nemoci je definována relapsem během posledních dvou let a/nebo zánětlivou aktivitou na MR mozku (tj. gadolinium enhancující T1 léze nebo nová a/nebo zvětšující se T2 léze).
Ke kontraindikacím léčby patří kromě hypersenzitivity na léčivou látku syndrom imunodeficience, progresivní multifokální leukoencefalopatie či kryptokoková meningitida v anamnéze, aktivní maligní onemocnění, těžké poruchy jaterních funkcí. Siponimodem nesmějí být léčeni ani pacienti se srdečním postižením – atrioventrikulární blokádou II. a vyššího stupně, sinoatriální blokádou, sick sinus syndromem, v období šesti měsíců po prodělaném infarktu myokardu, s nestabilní anginou pectoris, s dekompenzovaným srdečním selháním či pacienti s prodělaným iktem. Podávání je rovněž kontraindikováno u těhotných žen [13].
Kazuistika
Kazuistika uvádí případ 71leté ženy bez rodinné zátěže stran RS. Před diagnózou RS se pacientka s ničím neléčila, nebyla sledována pro žádná onemocnění. Pacientka má čtyři děti, všechny jsou zdravé.
První potíže kompatibilní s RS se objevily v roce 1987, pociťovala parestezie dolních končetin a závratě při chůzi. V té době bylo povědomí o RS nízké a vyšetření MR nedostupné, potíže pacientky tedy zůstaly přehlíženy. První podezření na RS bylo vysloveno v roce 1992, kdy vyhledala lékaře pro zhoršený vizus na pravém oku a bolesti při pohybu bulbem. Potíže byly zhodnoceny jako retrobulbární neuritida pravého oka. Anamnesticky pacientka překonala do této doby již čtyři ataky. Byla doplněna MR mozku s obrazem vícečetných demyelinizačních ložisek, která svým tvarem a rozložením imponovala jako postižení při RS. Pacientka byla přeléčena taperem kortikosteroidů a byla u ní stanovena diagnóza RS – relabující remitující forma. Na další klinickou kontrolu se dostavila až v roce 2008. V té době ji k lékaři přivedly dva roky progredující porucha chůze se zakopáváním o pravou dolní končetinu, poruchy rovnováhy, sfinkterové potíže, únava a poruchy soustředění. Objektivně dominovala spastická paraparéza s pravostrannou převahou, imperativní mikce a postižení zadních provazců míšních (ladička akrálně na dolních končetinách vlevo 3/8, vpravo 1/8), chůze spasticko ataktická s chůzovým intervalem kolem 300 metrů, což odpovídá EDSS 4,5. MR mozku ukázala mnohočetná splývavá ložiska supra i infratentoriálně, periventrikulárně charakteru black holes („černých děr“) a jedno gadolinium enhancující ložisko v centrum semiovale. V krční míše byl v úrovni C5/6 zvýšený signál v zadních provazcích. V mozkomíšním moku byl cytologický nález v normě, izoelektrická fokusace prokázala sedm nekorespondujících oligoklonálních IgG pásů se sérem v alkalické oblasti. Nemocná byla přeléčena intravenózními kortikosteroidy (celke
m 5 g metylprednisolonu), ale stav se již neupravil. Vzhledem k minimálnímu léčebnému efektu kortikosteroidů, nálezu na MR mozku a pokračujícímu nárůstu disability bez atak dospěla pacientka do sekundárně progresivní formy. Byla u ní zahájena léčba azatioprinem v dávce 100 mg/den perorálně. Tato léčba vedla ke stabilizaci on
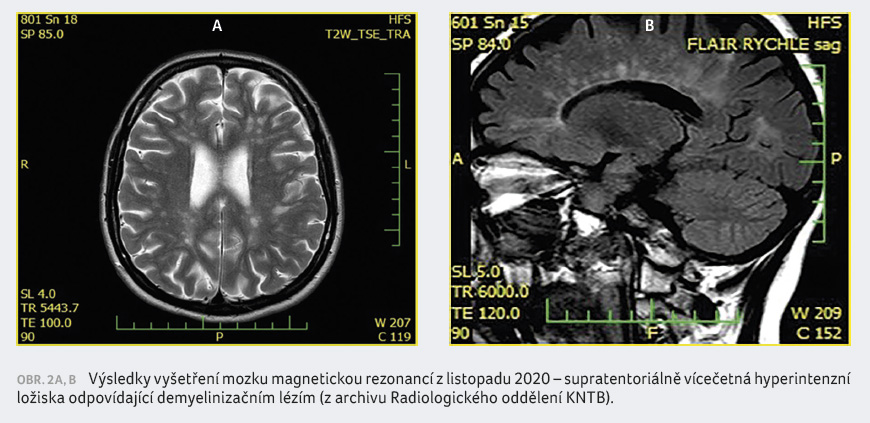
emocnění do roku 2019. V roce 2020 byla pacientka po změně bydliště poprvé vyšetřena v našem centru pro demyelinizační nemoci ve Zlíně. Od roku 2019 došlo ke zkrácení vzdálenosti, kterou byla pacientka schopna ujít, na 100 metrů, což odpovídá EDSS 5,5. Kontrolní MR prokázala progresi demyelinizačních ložisek supratentoriálně (obr. 2A, B). Vzhledem k progresi EDSS o 1 stupeň bez přítomnosti relapsu a progresi na MR mozku byla u pacientky naplněna indikační kritéria pro léčbu siponimodem a tato byla zahájena v březnu 2021.
Před zahájením léčby jsme ukončili léčbu azatioprinem, bylo nutné stanovit genotyp CYP2C9, podle kterého se indikuje udržovací dávka siponimodu. U naší pacientky byl prokázán genotyp *1/*1 s cílovou dávkou 2 mg/den. Kromě běžného laboratorního vyšetření je třeba před zahájením léčby siponimodem u pacientů stanovit přítomnost protilátek proti viru varicella zoster (VZV), jež byly u naší pacientky ověřeny. Při jejich negativitě je indikováno očkování proti VZV před počátkem léčby siponimodem. Po zahájení léčby pravidelně kontrolujeme krevní tlak, jaterní testy a hodnoty lymfocytů v krvi. S odstupem 3–4 měsíců provádíme oční vyšetření k vyloučení makulárního edému. Jednou ročně je vhodné provést kožní vyšetření k vyloučení kožních nádorů (zejména bazaliomu).
V dubnu 2021 se stav pacientky zhoršil. Dostavila se na kontrolu pro slabost dolních končetin, vzdálenost 100 m byla schopna ujít pouze s oporou hole, na EDSS progredovala na hodnotu 6,0. Byla přeléčena 3 g metylprednisolonu intravenózně s malým efektem. Kontrolní MR mozku byla bez progrese. Zhoršení neurologického deficitu jsme připisovali rychlému ukončení letité imunosupresivní léčby a azatioprin jsme vrátili dočasně do medikace v redukované dávce 50 mg/den. Během následujících tří měsíců byl azatioprin vysazen úplně. Stav pacientky se stabilizoval na původní hodnotu na EDSS 5,5. Pacientka je s novou léčbou spokojena, při poslední kontrole v lednu 2022 udávala zmírnění únavy a zvýšení soběstačnosti v běžných denních aktivitách, ujde 100 m bez opory hole (EDSS 5,5).
Závěr
Navzdory výraznému pokroku v terapii sekundárně progresivní roztroušené sklerózy zůstává tento subtyp hůře terapeuticky ovlivnitelný vzhledem k absenci neuroprotektivní léčby. Zásadní je zkrátit období diagnostické nejistoty na minimum a snažit se průběh nemoci i v této fázi co nejvíce zpomalit. Současné terapeutické možnosti spolu s důslednou symptomatickou léčbou mohou vést k udržení přijatelné kvality života a co nejdelší nezávislosti pacienta. Nadějí pro tuto skupinu pacientů je siponimod, který vede k jejich ochraně před budoucí invalidizací.
Seznam použité literatury
- [2] Brown JWL, Coles A, Horakova D, et al. Association of initial disease‑modifying therapy with later conversion to secondary progressive multiple sclerosis. JAMA 2019; 321: 175–187.
- [3] Sospedra M, Martin R. Immunology of multiple sclerosis. Semin Neurol 2016; 36: 115–127.
- [4] Oh J, Alikhani K, Bruno T, et al. Diagnosis and management of secondary progressive multiple sclerosis: time for change. Neurodegener Dis Manag 2019; 9: 301–317.
- [5] Kremenchutzky M, Rice GP, Baskerville J, et al. The natural history of multiple sclerosis: a geographically based study 9: observations on the progressive phase of the disease. Brain 2006; 129: 584–594.
- [6] Katz Sand I, Krieger S, Farrel C, et al. Diagnostic uncertainty during the transition to secondary progressive multiple sclerosis. Mult Scler 2014; 20: 1654–1657.
- [7] Larochelle C, Uphaus T, Prat A, et al. Secondary progression in multiple sclerosis: neuronal exhaustionor distinct pathology? Trends Neurosci 2016; 39: 325–339.
- [8] Scalfari A, Neuhaus A, Daumer M, et al. Onset of secondary progressive phase and long‑term evolution of multiple sclerosis. J Neurol Neurosurg Psychiatry 2014; 85: 67–75.
- [9] Lorscheider J, Buzzard K, Jokubaitis, et al. Defining secondary progressive multiple sclerosis. Brain J Neurol 2016; 139: 2395–2405.
- [10] Chun J, Giovannoni G, Hunter SF. Sphingosine 1‑phosphate receptor modulator therapy for multiple sclerosis: differential downstream receptor signalling and clinical profile effects. Drugs 2021; 81: 207–231.
- [11] Kappos L, Bar‑Or A, Cree BAC, et al. Siponimod versus placebo in secondary progressive multiple sclerosis (EXPAND): a double‑blind, randomised, phase 3 study [published correction appears in Lancet. 2018 Nov 17; 392: 2170]. Lancet 2018; 391: 1263‒1273.
- [12] Gold R, Kappos L, Bar‑Or A, et al. Efficacy of siponimod in secondary progressive multiple sclerosis patients with active disease: the EXPAND study subgroup analysis. Poster 750 presented at: 35th Congress of the European Committee for Treatment and Research in Multiple Sclerosis; September 11‒13, 2019; Stockholm, Sweden.
- [13] SPC Mayzent. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/mayzent‑epar‑product‑information_cs.pdf.