Studie BENEDICT (The BErgamo NEphrologic DIabetes Complication Trial)
Východiskem studie BENEDICT bylo zjistit, zda inhibitory angiotenzin konvertujícího enzymu (ACEI) a nedihydropyridinové blokátory kalciových kanálů (NDHP-BKK) samotné nebo v kombinaci zabrání vzniku nefropatie u pacientů s diabetem 2. typu, hypertenzí a normoalbuminurií [1, 2]. Diabetici 2. typu s mikroalbuminurií (MAU) jsou více než vývojem chronického selhání ledvin ohroženi fatálními kardiovaskulárními komplikacemi [3]. Dříve provedené studie prokázaly schopnost ACEI a NDHP-BKK snížit MAU či manifestní proteinurii u diabetických pacientů s hypertenzí [4, 5].
Metodika
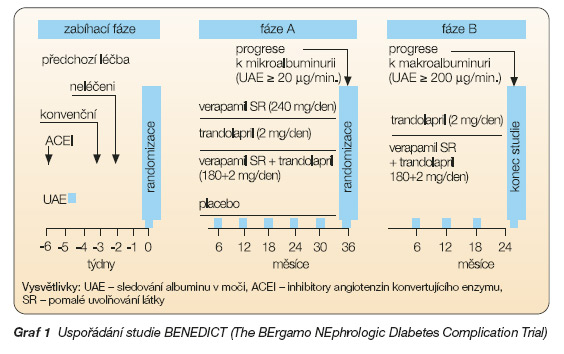
Uspořádání studie BENEDICT
Studie byla rozčleněna do 2 fází sledujících možnosti primární a sekundární prevence diabetické nefropatie (graf 1). Úkolem fáze A, ukončené v roce 2004 [6], bylo u normoalbuminurických hypertenzních diabetiků 2. typu během tří let posoudit vliv ACEI trandolaprilu, NDHP-BKK verapamilu SR, kombinace verapamilu SR s trandolaprilem a placeba na vznik MAU. Fáze B během dvou následujících roků porovnává účinek trandolaprilu a jeho kombinace s verapamilem SR na snížení progrese do makroalbuminurie (klinické proteinurie) u jedinců, u kterých během fáze A vznikla MAU.
Fáze A studie BENEDICT
Multicentrická prospektivní randomizovaná dvojitě slepá, placebem kontrolovaná studie u 1 204 hypertenzních pacientů s diabetem 2. typu a normoalbu- minurií – doba sledování 3 roky. Vstupní charakteristiky pacientů: věk 62,3 Î 8,1 roků, BMI 29,1 Î 4,7 kg/m2, krevní tlak 150,8 Î 14,1/87,5 Î 7,6 mm Hg, albuminurie 5,32 (4,00–9,36) mg/min, glykovaný hemoglobin 5,8 Î 1,4 %. Perorálními antidiabetiky bylo léčeno 55 %, inzulinem 12 % a zbytek pacientů byl pouze na dietě.
V zabíhacím období (vysazení léků ovlivňujících systém renin-angiotenzin 6 týdnů a NDHP-BKK 3 týdny před zahájením studie) byli pacienti randomizováni k léčbě buď verapamilem SR 240 mg denně, nebo trandolaprilem 2 mg denně, či kombinací trandolaprilu (2 mg) s verapamilem SR (180 mg) denně, anebo k užívání placeba.
K dosažení cílového krevního tlaku 120/80 mm Hg bylo umožněno přidat další antihypertenziva v následujícím pořadí : 1) hydrochlorothiazid či furosemid; 2) doxazosin, prazosin, clonidin, methyldopu nebo b-blokátory (v případě jejich specifických indikací a nepřítomnosti kontraindikací); 3) minoxidil nebo DHP-BKK s dlouhodobým účinkem.
Pacienti pokračovali v zavedené léčbě diabetu (doporučený cílový glykovaný hemoglobin < 7 %), neomezovali v dietě sůl ani bílkoviny.
Vstupní a vylučovací kritéria
Vstupní – věk ≥ 40 roků, hypertenze = krevní tlak ≥≥130/85 mm Hg (nebo antihypertenzní léčba nezbytná k jeho snížení pod 130/85 mm Hg), diabetes mellitus 2. typu trvající ≤≤ 25 let, albuminurie < 20 mg/ min ve 2 ze 3 po sobě jdoucích sterilních nočních močových vzorcích, sérová koncentrace kreatininu < 133 mmol/l.
Vylučovací – pacienti s glykovaným hemoglobinem > 11 %, přítomnost nediabetického onemocnění ledvin, stavy se specifickými indikacemi či kontraindikacemi ACEI či NDHP-BKK [2].
Cíle studie
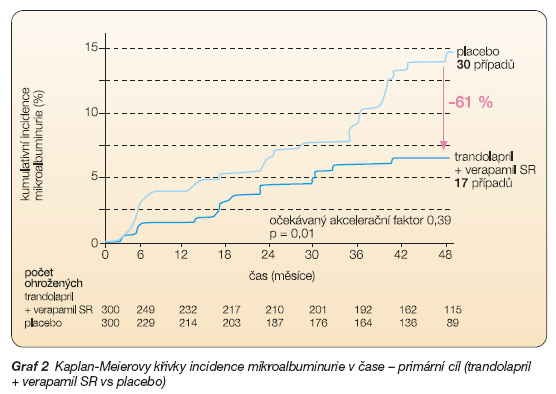
Primární cíl – vznik perzistující MAU (≥ 20 mg/min ve 2 ze 3 po sobě jdoucích nočních vzorcích s potvrzením nálezu ve dvouměsíčním odstupu) ve skupinách pacientů léčených kombinací trandolapril + verapamil SR a užívajících placebo.
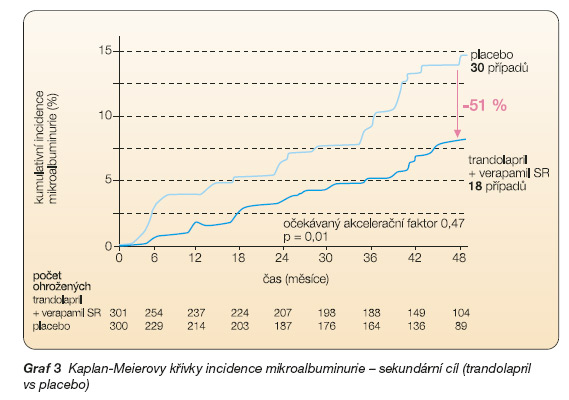
Sekundární cíl – vznik perzistující MAU ve skupinách pacientů léčených samotným trandolaprilem nebo verapamilem SR ve srovnání s pacienty na placebu.
Výsledky studie
Po střední době sledování 3,6 roku se perzistující MAU vyvinula u 5,7 % (17/300) pacientů léčených kombinací trandolapril + verapamil SR (graf 2),
u 6 % (18/301) léčených samotným trandolaprilem (graf 3), u 11,9 % (36/303) léčených samotným verapamilem SR a u 10 % (30/300) pacientů na placebu.
Rozdíl mezi trandolaprilem (či kombinací trandolapril + verapamil SR) a placebem (nebo verapamilem SR) byl zřejmý již po 3 měsících léčby. Očekávaný akcelerační faktor (vyjadřující porovnání účinku dvou léčebných režimů na zrychlení či zpomalení progrese onemocnění ) byl 0,39 při kombinací trandolaprilu + verapamilu SR ve vztahu k placebu (p = 0,01), 0,47 při srovnání trandolaprilu a placeba (p = 0,01) a 0,83 mezi verapamilem SR a placebem (p = 0,54). U osob léčených trandolaprilem se vyvinula MAU ve srovnání s pacienty užívajícími placebo (či verapamil SR) po více než dvojnásobné době. Statisticky významný rozdíl v incidenci perzistující MAU byl zjištěn mezi pacienty léčenými ACEI a bez nich (p = 0,001), zatímco rozdíl mezi NDHP-BKK a bez nich byl nevýznamný. Krevní tlak dosažený léčbou byl u pacientů léčených trandolaprilem a kombinací trandolaprilu s verapamilem SR srovnatelný (139 Î 12/81 Î 6 mm Hg, resp. 139 Î 10/80 Î 6 mm Hg) a byl statisticky významně nižší (p ≤ ≤0,002) než u pacientů na placebu či léčených verapamilem SR (142 Î 12/83 Î 6 mm Hg, resp. 141 Î 10/82 Î 6 mm Hg).
Tolerance léčby
Léčba podávaná během studie BENEDICT byla dobře tolerovaná. Během sledování zemřelo celkem 12 osob, z toho 5 na kardiovaskulární onemocnění (1 léčen trandolaprilem, 1 verapamilem, 3 na placebu). Nefatální závažné vedlejší účinky se v průběhu studie objevily celkem u 23 % pacientů. Kardiovaskulárních příhod bylo 48 a objevily se přibližně u 4 % nemocných ve všech skupinách. K přerušení léčby a vyřazení ze studie došlo u 13 (1 %) osob – u 11 z nich byl důvodem kašel (u 5 při kombinaci trandolaprilu s verapamilem SR, u 4 při léčbě trandolaprilem a 2 na placebu), u zbylých 2 porucha vedení srdečního vzruchu – SA blok s junkčním rytmem (při kombinaci trandolapril + verapamil SR) a AV blok II. stupně (při léčbě verapamilem SR). Žádný pacient nebyl vyřazen ze studie pro akutní zhoršení funkce ledvin nebo pro hyperkalémii. Ve všech skupinách nebyly pozorovány významnější změny hodnoty glomerulární filtrace.
Závěr pro klinickou praxi
Z ukončené fáze A studie BENEDICT je zřejmé, že u pacientů s diabetem 2. typu, hypertenzí, normoalbuminurií a normální renální funkcí léčba ACEI trandolaprilem v kombinaci s verapamilem SR nebo samotným trandolaprilem významně snížila riziko vývoje MAU. Renoprotektivní účinek inhibice ACE nebyl podstatně zvýšen přidáním NDHP-BKK. Vliv trandolaprilu na oddálení vzniku MAU byl výraznější, než by odpovídalo malému rozdílu v krevním tlaku mezi sledovanými skupinami.
Studie BENEDICT je výjimečná v tom, že jde o první klinickou studii, která prokázala preventivní účinek ACEI na vývoj MAU u hypertenzních normoalbuminurických diabetiků 2. typu. Nespornou výhodou ACEI oproti ostatním antihypertenzivům je nefroprotektivní účinek, který potlačením vzniku či oddálením vývoje MAU (primární prevence diabetické nefropatie) vede ke snížení rizika jak kardiovaskulárních komplikací, tak i rozvoje manifestní diabetické nefropatie a terminálního selhání ledvin.
Seznam použité literatury
- [1] Ruggenenti P, Remuzzi G, on behalf of the Bergamo Diabetic Nephropathy Study Group. Primary prevention on renal failure in diabetic patients: The Bergamo Nephrologic Diabetes Complication Trial J Hypertens 1998; 16 (suppl 1): S95–S97.
- [2] BENEDICT Group. The Bergamo Nephrologic Diabetes Complications Trial (BENEDICT): design and baseline characteristics. Control Clin Trial 2003; 24: 442–461.
- [3] Parving HH, Maeuer M, Ritz E. Diabetic nephropathy. In: Brenner BM, ed. Brenner & Rector´s The Kidney. 7th ed. Vol. 2. Philadelphia: Saunders 2004; 1777–1818.
- [4] Bakris GL, Weir MR, DeQuatro V, and McMahon FG. Effects of an ACE inhibitor/calcium antagonist combination on proteinuria in diabetic nephropathy. Kidney Int 1998; 54: 1283–1289.
- [5] Kloke HJ, Brnaten AJ, Huysmans FT, Wetzels JF. Antihypertensive treatment of patients with proteinuric renal diseases: Risks or benefits of calcium channel blockers? Kidney Int 1998; 53: 1559–1573.
- [6] Ruggenenti P, Fassi A, Parvano Ilieva A, et al. Preventing microalbuminuria in type 2 diabetes. N Engl J Med 2004; 351: 1941–1951.