Studie PROactive Sekundární prevence makrovaskulárních příhod u pacientů s diabetes mellitus 2. typu
Pacienti s diabetem mají oproti nediabetické populaci vyšší riziko mikrovaskulárních a makrovaskulárních onemocnění a kratší očekávanou délku života přibližně o 25 %, způsobenou zejména vyšší kar-diovaskulární (KV) mortalitou. Riziko koronární nemoci je 2–4krát vyšší než v nediabetické populaci, riziko kardiovaskulárních komplikací u diabetiků je stejné jako u pa-cientů, kteří prodělali akutní infarkt myokardu. Bylo prokázáno, že intenzivní kontrola diabetu významně ovlivňuje incidenci mikrovaskulárních komplikací (retinopatie a nefropatie), nicméně nebyl prokázán podstatný vliv na riziko makrovaskulárních komplikací nebo celkové mortality. Studie UKPDS (United Kingdom Prospective Diabetes Study) zjistila významné snížení rizika KV onemocnění a celkové mortality u pacientů s nadváhou léčených metforminem.
Pioglitazon patří mezi thiazolidindiony (inzulinové senzitizéry; agonisté jaderných PPAR-g-receptorů – Peroxisome-Proliferator Activated Receptors – g-receptory aktivované proliferátory peroxizomů) schválené pro léčbu diabetu 2. typu. Účinek pioglitazonu je dán zejména zvýšením citlivosti k inzulinu v játrech, svalech, tukové tkáni a ovlivňuje rovněž dyslipidémii asociovanou s inzulinovou rezistencí (zvyšuje koncentrace HDL cholesterolu, snižuje koncentrace triglyceridů a mění velikost LDL částic na méně aterogenní). Thiazolidindio-ny zpomalují progresi aterosklerózy ve stěně cév – inhibují migraci a proliferaci buněk hladké svaloviny, snižují zánět ve stěně cévní (měřeno jako hladiny CRP), zmenšují tloušťku komplexu intimy-medie karotických tepen a snižují hladiny inhibitoru aktivátoru plazminogenu-1 (PAI-1). Z výše uvedeného vyplývá, že pioglitazon může zpomalit progresi KV onemocnění.
Studie PROactive (The PROspective pioglitAzone Clinical Trial In macroVascular Events) byla uskutečněna s cílem zjistit, zda pioglitazon snižuje KV morbiditu a mortalitu u pacientů s diabetem 2. typu, včetně ověření bezpečnosti a tolerability této látky [1, 2].
Metodika
Uspořádání studie: dvojitě zaslepená placebem kontrolovaná studie, ve které byl pioglitazon přidán k běžné terapii. Nábor pacientů (pracoviště primární péče i specializovaná nemocniční oddělení) se konal od května 2001 do dubna 2002 (konec studie leden 2005).
Sledovaná populace: osoby ve věku 35–75 let s hodnotami glykovaného he-moglobinu A1c (HbA1c) převyšující 6,5 % i přes dietní opatření, případně kombinovaná s podáváním perorálních antidiabetik a inzulinu. Zároveň měly tyto osoby vysoké riziko makrovaskulárního onemocnění definované splněním jednoho nebo více z následujících kritérií: infarkt myokardu (IM) nebo mozková příhoda nejméně 6 měsíců před vstupem do studie, perkutánní koronární intervence nebo koronární arteriální bypass nejméně 6 měsíců před náborem do studie; akutní koronární syndrom nejméně 3 měsíce před náborem do studie; objektivně potvrzená koronární arteriální nemoc nebo periferní arteriální obstrukční nemoc dolních končetin.
Vylučovací kritéria: diabetes mellitus 1. typu, monoterapie inzulinem, plánovaná koronární nebo periferní revaskularizace, symptomatické srdeční selhávání (NYHA ≥ 2), ischemické vředy, gangréna nebo klidová bolest dolních končetin; hemodialýza, koncentrace alaninaminotransferázy (ALT) ≥≥ 2,5krát horní hranice normálu.
Pacienti byli randomizováni k aktivní léčbě pioglitazonem, nebo k podávání placeba současně s dosud podávanou terapií. Během prvního měsíce byl pioglitazon užíván v dávce 15 mg, druhý měsíc 30 mg a dále v dávce 45 mg/den s cílem léčit pacienta nejvyšší tolerovatelnou dávkou. Na základě snášenlivosti se mohla dávka pohybovat v rozmezí 15–45 mg. Snahou bylo udržet koncentrace HbA1c< 6,5 % odpovídající doporučením IDF (IDF – Mezinárodní federace diabetu; International Diabetes Federation European Guidelines).
Kontroly pacientů se konaly během prvních dvou měsíců každý měsíc, další rok po dvou měsících a dále v intervalu 3 měsíců (vyšetřovány: životní funkce; tělesná hmotnost; EKG; vzorky krve: HbA1c, triglyceridy, HDL cholesterol, LDL cholesterol, ALT, AST, celkový bilirubin, ALP, kreatinin; vzorky moči – albuminurie); monitorovány byly nepříznivé události, které byly klasifikovány jako život ohrožující a méně závažné. Vyšetřovány byly zejména symptomy hypoglykémie, srdečního selhávání, edému v nepřítomnosti srdečního selhávání a nežádoucí účinky vedoucí k přerušení podávání pioglitazonu.
Primární cíl (složený)
Zahrnuty byly úmrtí z jakékoliv příčiny, nefatální IM (včetně němého), mozková příhoda, akutní koronární syndrom, endovas-kulární nebo chirurgický zákrok na koronárních arteriích nebo arteriích dolních končetin, amputace nad kotníkem.
Sekundární cíle
a) ‑složený – úmrtí z jakékoliv příčiny, nefatální IM (vyjma němého) a mozková příhoda;
b) ‑incidence jednotlivých komponent primárního cíle.
Analýza dat: analýza podle původního léčebného záměru (intention-to-treat); Kaplanova-Meierova analýza přežívání; test interakcí, modely lineární a logistické regrese [2].
Výsledky
Do studie bylo zařazeno 5238 pa-cientů (pioglitazon n = 2605, placebo n = 2633). 16 % pacientů ze skupiny lé-čené pioglitazonem a 17 % ze skupiny, která dostávala placebo, opustilo terapii před ukončením studie nebo úmrtím. Pa-cienti byli průměrně sledováni 34,5 měsíce. Výchozí charakteristiky byly srovnatelné pro obě skupiny, průměrný věk všech osob byl 61,8 let, medián doby uplynulé od diagnózy diabetu byl 8 let. Při randomizaci užívalo 62 % subjektů metformin a tentýž počet užíval deriváty sulfonylurey v monoterapii nebo v kombinaci s jinou léčbou, více než 30 % pacientů bylo léčeno inzulinem a navzdory vstupním kritériím mělo 0,2 % pacientů monoterapii inzulinem. Pioglitazon byl dobře tolerován a na konci 2. měsíce užívalo 89 % pacientů dávku 45 mg a poté tuto maximální dávku užívalo 93 % osob. Compliance byla v obou skupinách větší než 95%.
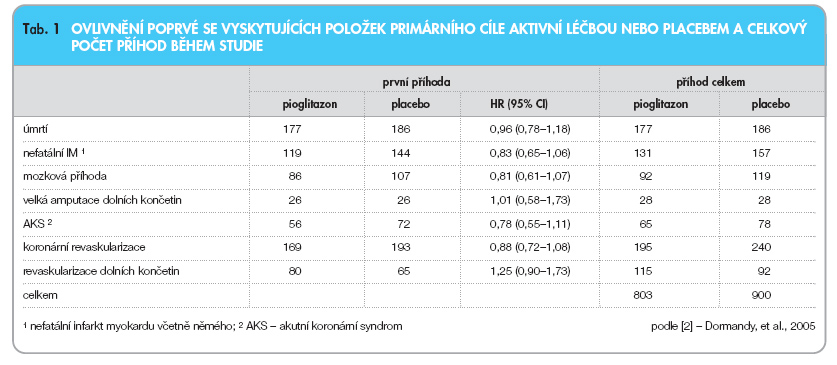
Alespoň jedné příhody z kombinovaného primárního cíle dosáhlo nevýznamně méně pacientů léčených pioglitazonem než ve skupině placeba (HR = 0,90; 95% CI: 0,80–1,02; p = 0,095). Ve skupině pioglitazonu se vyskytlo 803 příhod z kompozitního primárního cíle (z nich se 514 objevilo poprvé) a ve skupině pla-ceba 900, přičemž 572 z nich bylo diagnostikováno poprvé (tab. 1).
Alespoň jedné příhody z hlavního sekundárního cíle (úmrtí z jakékoliv příčiny, nefatální IM nebo mozková příhoda) dosáhlo významně méně pacientů ze skupiny pioglitazonu (HR = 0,84; 95% CI: 0,72–0,98; p = 0,027). Ve skupině pioglitazonu bylo zaznamenáno 127 KV úmrtí (ve skupině placeba 136) a 50 úmrtí z nekardiovaskulárních příčin (ve skupině placeba rovněž 50). Pioglitazon podáva-ný 1000 pacientům po dobu 3 let zabrání 21 prvním epizodám IM, mozkové příhody nebo úmrtí.
Změny současně podávané medika-ce byly srovnatelné v obou skupinách. Významné byly pouze u pacientů léčených metforminem a inzulinem. Významně více pacientů ze skupiny placeba bylo oproti výchozímu stavu léčeno inzulinem na konci studie (ve skupině pioglitazonu o 2,7 %, ve skupině placeba o 12,4 % subjektů; p < 0,0001). Významně se změnila i expozice metforminu (ve skupině pioglitazonu bylo léčeno o 3,1 % pacientů méně oproti počtu léčených na začátku studie, zatímco ve skupině placeba se zvýšila expozice o 1,8 %; p = 0,0001).
Významně byly ovlivněny hodnoty HbA1c (pioglitazon: -0,8 %; placebo -0,3 %; p < 0,0001), triglyceridů (pioglitazon -11,4 %; placebo 1,8 %; p < 0,0001), HDL cholesterolu (pioglitazon 19,0 %; placebo 10,1 %; p < 0,0001). Ačkoliv se hodnoty LDL cholesterolu během terapie zvýšily oproti placebu (7,2 % vs 4,9 %; p = 0,003), byl dosažen větší pokles poměru LDL/HDL cholesterol (pioglitazon -9,5% vs placebo -4,2 %; p < 0,0001). Srovnatelné byly změny mikroalbuminurie v obou skupinách. Krevní tlak na konci studie byl mírně, ale signifikantně nižší ve skupině aktivně léčené (medián změn systolického tlaku byl 3 mmHg vs 0 mmHg; p = 0,03).
Bezpečnost léčby: Závažné nežádoucí příhody během studie se vyskytly u 46 % pacientů léčených pioglitazonem a u 48 % pacientů, jimž bylo podáváno placebo (p = 0,110). Srdeční selhání se vyskytlo častěji ve skupině pioglitazonu (11 % vs 8,0 %; p < 0,0001), a to jak srdeční selhání vyžadující hospitalizaci (6 % vs 4 %; p = 0,007), tak hospitalizaci nevyžadující (5 % vs 3 %; p = 0,003). Úmrtí zapříčiněné srdečním selháním bylo v obou skupinách srovnatelné (1% v obou skupinách; p = 0,634). U 903 pacientů se vyskytl edém během studie bez přítomného srdečního selhání (562 pioglitazon vs 341 placebo). Symptomy hypoglykémie se objevily u 28 % pacientů ze skupiny pioglitazonu a u 20 % pacientů ze skupiny placeba (p < 0,0001), nicméně hypoglykémie vyžadující nemocniční ošetření se mezi skupinami nelišila (19 vs 11 pacientů; p = 0,14). Méně pa-cientů léčených pioglitazonem vyžadovalo hospitalizaci (44 % vs 46 %). Nebyl rozdíl v celkové incidenci nádorových onemocnění (4 % v obou skupinách). Častěji se ve skupině pioglitazonu vyskytla pneumonie (1 % vs 2 %; p = 0,047). Nebyla zaznamenána akutní hepatotoxicita. Zvýšení ALT na více než trojnásobek horní hranice normy se objevilo u 20 pacientů ze skupiny pioglitazonu a u 33 ze skupiny placeba. Hodnoty kreatininu byly v průběhu studie konstantní. Rozdíly ve změnách tělesné hmotnosti byly během studie významné (p < 0,0001). Ve skupině pioglitazonu byl pozorován průměrný váhový přírůstek o 3,6 kg (změna hmotnosti -30 až +29 kg), zatímco ve skupině placeba bylo dosaženo snížení tělesné hmotnosti v průměru o 0,4 kg (-36 až +33 kg) [2].
Závěr
Pioglitazon nesignifikantně snížil incidenci souhrnného primárního cíle (úmrtí, nefatální IM, mozková příhoda, akutní koronární syndrom, amputace dolních končetin, koronární revaskularizace nebo revaskulariza-ce dolních končetin), významně snížil riziko hlavního sekundárního cíle (úmrtí, nefatální IM, mozková příhoda) u diabetiků 2. typu s vysokým kardiovaskulárním rizikem. Ve skupině pioglitazonu byla zaznamenána vyšší incidence srdečního selhání a edému nezapříčiněného srdečním selháním. Zvýšení tělesné hmotnosti bylo vyšší ve skupině pioglitazonu [2].
Seznam použité literatury
- [1] Charbonnel B, Dormandy J, Erdmann E, et al. On behalf of the PROactive study group. The Prospective PioglitAzone Clinical Trial In macro-Vascular Events (PROactive). Diabetes Care 2004; 27: 1647–1653.
- [2] Dormandy JA, Charbonnel B, Eckland DJA, et al. Secondary prevention of macrovascular events in patiens with type 2 diabetes in the PROactive Study (PROspective pioglitAzone Clinical Trial In macroVascular Events): a randomised controlled trial. Lancet 2005; 366: 1279–1289.