Terapie inhibitory Janus kináz šitá na míru
Sympozium společnosti Pfizer zaměřené na individualizovanou léčbu inhibitory Janus kináz bylo součástí Letního revmatologického sympozia, které se konalo ve dnech 23.–25. června 2022 v hotelu Element v jihočeském Lipně nad Vltavou. Pořadatelem akce byla Česká revmatologická společnost ČLS JEP a jejím organizátorem Congress Prague. Uvedenému firemnímu sympoziu předsedal profesor MUDr. Jiří Vencovský, DrSc., z Revmatologického ústavu v Praze.
Sympozium společnosti Pfizer zaměřené
na individualizovanou léčbu inhibitory Janus kináz bylo
součástí Letního revmatologického sympozia, které se konalo
ve dnech 23.–25. června 2022 v hotelu Element
v jihočeském Lipně nad Vltavou. Pořadatelem akce byla Česká
revmatologická společnost ČLS JEP a jejím organizátorem
Congress Prague. Uvedenému firemnímu sympoziu předsedal profesor
MUDr. Jiří Vencovský, DrSc., z Revmatologického
ústavu v Praze.
Pacient, který nechce nebo nemůže užívat metotrexát
Managementem pacientů, kteří odmítají léčbu metotrexátem (MTX) nebo ji netolerují, se ve svém příspěvku zabýval profesor MUDr. Karel Pavelka, DrSc., (Revmatologický ústav, Praha). Metotrexát představuje stále nejvíce užívaný antirevmatický chorobu modifikující lék (disease modifying antirheumatic drug, DMARD). Například podle doporučení Evropské ligy proti revmatismu (EULAR) pro léčbu revmatoidní artritidy (RA) z roku 2019 [1] má být u pacienta po stanovení diagnózy zahájena léčba MTX, pokud k ní nejsou kontraindikace. Znamená to tedy předpoklad léčby MTX téměř u všech nemocných, kde je to možné. Tento první krok daného schématu u většiny pacientů postačuje, u části nemocných však není uvedeným postupem dosaženo žádoucího efektu. V tomto případě je stanoveno přidat ke stávající léčbě MTX biologický DMARD (bDMARD) nebo inhibitor Janus kináz (JAK). Práce Emeryho a kol. zkoumající užitečnost kombinace MTX s biologickými nebo cílenými léky (targeted synthetic DMARD, tsDMARD) dospěla k závěru o jednoznačném prospěchu tohoto postupu u pacientů s RA [2]. Přínos kombinace MTX + bDMARD nebo MTX + tsDMARD může vysvětlovat to, že MTX zmírňuje zánět, zvyšuje biologickou dostupnost léku (infliximab, abatacept) a snižuje tvorbu protilátek proti léku. Zároveň však podávání kombinace s MTX zvyšuje riziko farmakokinetických interakcí a může vést k vyššímu výskytu infekcí.
Bezpečnost léčby metotrexátem
Dlouhodobou bezpečnost léčby MTX podává systematický přehled 88 studií zahrnující období více než 12 let léčby [3]. Práce mj. doložila, že toxicita MTX je srovnatelná se sulfasalazinem, zlatem nebo antimalariky (interval přerušení léčby u MTX 10–37 %, u sulfasalazinu 17–52 %, u zlata 22–64 % a u antimalarik 10–14 %). Ze specifických nežádoucích účinků se při léčbě MTX vyskytly pneumonitida (15/3 463 pacientů – 0,43 %), cytopenie (5,2 %), pancytopenie (1,14 %), závažné infekce (8,3 % během 3,5 roku, 79 % během praxe prvních dvou let), výskyt lymfomů byl zvýšen pouze v jedné studii.
Při léčbě MTX je nutné zohlednit následující bezpečnostní aspekty: antikoncepce pro obě pohlaví, kontraindikace pro kojení, kontraindikace očkování živými vakcínami, přerušení léčby při závažných infekcích, není nutné přerušit léčbu MTX před chirurgickou procedurou. Po expozici žen MTX během prvního trimestru bylo zjištěno 5–10% riziko rozvoje kongenitálních anomálií. Alarmující je, že méně než dvě třetiny žen a polovina mužů v reprodukčním věku léčených MTX používaly antikoncepci [4–6].
K nejčastějším příčinám výskytu nežádoucích účinků v praxi a k nejčastějším příčinám předávkování patří dávkování denně místo týdně, akumulace léku u pacientů s renální insuficiencí a lékové interakce, které byly přehlédnuty. Následky nežádoucích účinků při předávkování MTX se zabývala práce Viala a kol., která zahrnula 74 pacientů léčených MTX. Definicí předávkování byla 2× vyšší dávka než plánovaná nebo kumulativní dávka MTX > 30 mg týdně. Celkem 70/74 pacientům byl MTX podáván denně, v průměrné dávce 9,6 ± 4,1 mg. Studie shrnula tyto následky: 18 % pacientů bylo asymptomatických, 82 % symptomatických; 62 % mělo závažné nežádoucí účinky; 14 % osob zemřelo (11.–45. den po poslední dávce MTX) [7].
Problém představuje léčba MTX ve stáří. Účinnost MTX je u jedinců mladších než 65 let a starších než 65 let let srovnatelná, eliminace MTX je přímo úměrná míře glomerulární filtrace. U starších jedinců je doporučeno začít 75% dávkou a je nutná těsná monitorace pacientů s chronickým onemocněním ledvin a není doporučeno podání MTX pacientům ve vysokém stadiu chronického respiračního onemocnění.
Léčba tofacitinibem v kombinaci a v monoterapii
Z armamentária bDMARDs nebo tsDMARDs, které máme k dispozici, jsou pro monoterapii bez MTX podle doporučení EULAR první volbou inhibitory interleukinu 6 (IL 6) nebo inhibitory JAK, druhou volbou pak adalimumab, etanercept, certolizumab, naopak infliximab, rituximab, abatacept a golimumab nejsou pro monoterapii vhodné [1].
Studie zaměřené na monoterapii
inhibitory JAK shrnuje tabulka 1 [8–12].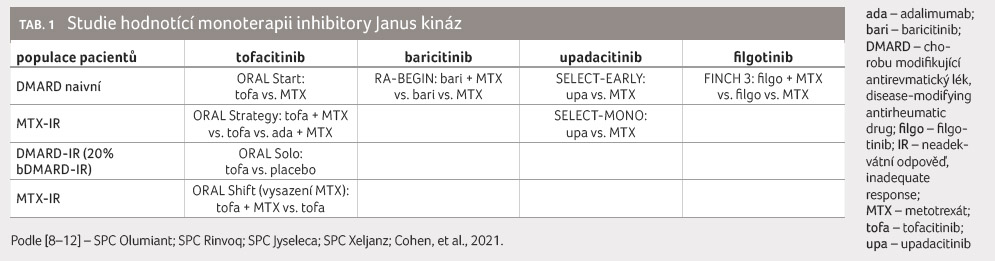
V případě inhibitoru JAK tofacitinibu proběhla studie ORAL Start, kde byla srovnávána léčba tofacitinibem u naivních pacientů oproti léčbě MTX. Další klinické hodnocení ORAL Strategy porovnávalo kombinaci tofacitinib + MTX vs. tofacitinib vs. kombinace adalimumab + MTX; studie ORAL Solo léčbu tofacitinibem oproti placebu; studie ORAL Shift léčbu kombinací tofacitinib + MTX (s možností vysazení MTX) oproti tofacitinibu. ORAL Strategy byla často diskutována, neboť jde o non inferiorní studii, v níž výsledky léčby tofacitinibem v kombinaci s MTX nebyly horší než výsledky léčby adalimumabem v kombinaci s MTX. Non inferiorita nebyla prokázána v případě primárního cílového ukazatele účinnosti u monoterapie tofacitinibem. Monoterapie ale udržela stejný efekt jako kombinace s MTX v případě nízké aktivity onemocnění [13]. Výsledky studie ORAL Solo potvrdily zmírnění aktivity onemocnění i zlepšení funkce u pacientů léčených tofacitinibem v monoterapii [14]. ORAL Shift sledovala pacienty původně léčené tofacitinibem s MTX, kdy při dosažení stavu nízké aktivity onemocnění byla léčba MTX u poloviny nemocných ukončena a podíl osob, které udržely nízkou aktivitu choroby, zůstal srovnatelný v obou větvích (s MTX a s ukončením léčby MTX) [15]. Také v rámci otevřené dlouhodobé extenze studie nebyl zaznamenán rozdíl v setrvání v monoterapii tofacitinibem a v jeho kombinaci s MTX [16]. Výsledky nové studie z reálné klinické praxe se opírají o velkou databázi USA – u pacientů, kteří byli dlouhodobě léčeni kombinací tofacitinibu a MTX, byla léčba MTX po dosažení stavu nízké aktivity choroby přerušena, avšak účinnost přetrvávala [17]. Data amerického registru CORRONA doložila podobnou účinnost tofacitinibu v monoterapii oproti kombinaci tofacitinib + MTX a oproti inhibitoru tumor nekrotizujícího faktoru (TNF) + MTX [18]. Švýcarský otevřený registr SCQM (Swiss Clinical Quality Management in Rheumatic Diseases) ukázal výsledky setrvání v monoterapii a v kombinační léčbě tofacitinibem a bDMARD (inhibitor TNF a bDMARD s jiným mechanismem účinku [bDMARD OMA] – abatacept, tocilizumab). Setrvání v léčbě inhibitorem TNF bylo významně redukováno v případě monoterapie, setrvání v léčbě bDMARD OMA a tofacitinibem se významně nelišilo při monoterapii ve srovnání s kombinovanou terapií [19]. Údaje z českého registru ATTRA prokázaly asociaci mezi vstupními parametry a léčebnou odpovědí po šesti měsících terapie tofacitinibem definovanou jako nízká aktivita onemocnění (DAS28 ESR ≤ 3,2), přičemž MTX nebyl jedním z faktorů zaručujících dosažení nízké aktivity nemoci [20].
Shrnutí
- kontraindikace podání MTX: závažná jaterní onemocnění, renální onemocnění, plicní fibróza (?), cytopenie
- časná a pozdní intolerance
- závažné nežádoucí účinky: nejčastěji předávkování, také lékové interakce
- přání pacienta neužívat MTX, pouze 50 % nemocných užívá MTX podle ordinace lékaře
- obavy z hepatotoxicity (alkohol), obtíže s antikoncepcí, chemický lék (lékové intolerance)
Závěry a doporučení
Při vynucené monoterapii RA doporučuje EULAR léčbu inhibitory IL 6 nebo inhibitory JAK [1]. Účinnost tofacitinibu v monoterapii byla prokázána ve čtyřech studiích – ORAL Start, ORAL Strategy, ORAL Solo a ORAL Shift. Registry CORRONA a ATTRA ukazují stejnou účinnost a setrvání v léčbě při monoterapii tofacitinibem ve srovnání s kombinací s MTX.
Pacient s únavou
Na únavu u pacientů s RA se zaměřila MUDr. Šárka Forejtová z téhož pracoviště. Únava vzniká jako důsledek interakcí mezi různými biologickými, psychologickými a behaviorálními faktory. Je to stav vznikající obvykle po periodě duševní nebo fyzické aktivity, který se vyznačuje úbytkem pracovní schopnosti a snížením účinnosti vykonané práce. Obvykle je doprovázen pocitem nevýkonnosti, ospalosti nebo podrážděnosti. U zdravých lidí je únava dočasným a normálním fenoménem. Pokud je však spojena s chorobou, může trvat i přes adekvátně dlouho trvající odpočinek nebo spánek. Rozlišujeme různé typy únavy, např. mentální, fyzickou, nedostatek motivace atd. [21–23].
Únava se vyskytuje nejméně u tří čtvrtin pacientů s RA. Přibližně 50 % z nich uvádí na vizuální analogové škále (VAS) intenzitu únavy > 5 z 10. Asi 40–70 % pacientů s RA trpí těžkou únavou. Výskyt únavy při onemocnění RA je 4–8× vyšší než v obecné populaci, kde se jedná o 10 % [24–30]. Důsledkem zvýšené únavy jsou poruchy nálady, únava ovlivňuje pocit pohody a sociální aspekty života, znemožňuje provádět běžné denní aktivity, snižuje fyzickou aktivitu i pracovní výkon, zapříčiňuje finanční ztráty na individuální, rodinné i společenské úrovni.
Vliv zánětu
Zvýšení aktivity prozánětlivých signálů na periferii i v CNS vede k poruše motivace, spánku, ke kognitivním dysfunkcím, anxietě, depresím a zvýšení stresu. Dysregulace prozánětlivých cytokinů (IL 1, IL 1β, TNF, IL 6, IFNγ) a jejich receptorů narušuje fyziologickou rovnováhu, a přispívá tak ke vzniku únavy i ke změnám v chování. Primární mechanismus aktivace IL 1β probíhá skrze aktivaci inflamazomů – např. NLRP3 (intracelulární signální komplexy proteinů v buňkách s jádrem včetně neuronů, astrocytů, mikroglií a perivaskulárních makrofágů). Inflamazomy jsou zahrnuty do modulace chování, spánku, kognitivních funkcí, anxiety a deprese. U pacientů s RA, systémovým lupus erythematodes (SLE), ankylozující spondylitidou (AS), Sjögrenovým syndromem, idiopatickými střevními záněty atd. dochází k hyperaktivaci inflamazomů s následnými změnami v chování a náladách [23,31].
Poruchy spánku a cirkadiánního rytmu
U autoimunitních onemocnění se často vyskytují poruchy spánku. Spánková deprivace se může uplatnit v etiologii onemocnění, jako je SLE. Revmatoidní artritida, AS, SLE a systémová sklerodermie jsou spojeny se zvýšeným výskytem spánkové apnoe [32–34]. V případě RA a psoriatické artritidy byl prokázán zvýšený výskyt syndromu neklidných nohou [35]. Rovněž u autoimunitních onemocnění se častěji vyskytuje chronický únavový syndrom/myalgická encefalomyelitida [36]. Melatonin je látka, která prokazuje protizánětlivé a antioxidační účinky a má vliv také na únavu u SLE [37].
Faktory vývoje únavy a očekávání od léčby
Faktory přispívající ke vzniku
únavy přibližuje obrázek 1 [38]. Některé práce
prokázaly rovněž vliv inhibitorů cyklooxygenázy 2 (COX 2)
na rozvoj únavy u nemocných s RA [39].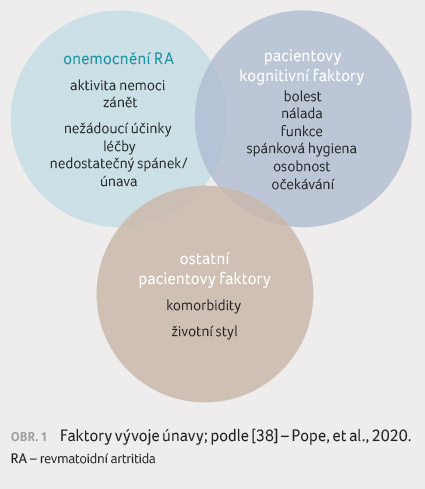
V některých případech může dojít k tomu, že se úplně neshodují očekávání lékaře a očekávání pacienta. Jako lékaři se snažíme o to, aby se zmírnila bolest, aby se snížil počet oteklých kloubů a zlepšily se laboratorní parametry. Pacienti naopak kladou důraz na to, aby netrpěli bolestí, aby měli lepší funkčnost, a jedním z důležitých faktorů je právě zmírnění únavy a zlepšení spánku [40]. Aktivita RA zpravidla vede ke zvýšené únavě, naopak snížení aktivity nemoci neznamená vždy zmírnění únavy, neboť zde hrají roli rovněž chronická bolest, poruchy spánku, fibromyalgie, deprese atd. [41,42].
Monitorování únavy
Pro monitorování únavy jsou k dispozici různé škály a různé dotazníky: VAS, funkční dotazník hodnocení terapie chronických onemocnění – únava (FACIT F), krátký dotazník – doména vitality (SF 36), škála dopadu únavy (FIS) se 13 položkami, čtyřbodová Likertova stupnice (4 = bez únavy, 0 = velmi unavený) nebo multidimenzionální stupnice únavy (MAF) se 16 položkami [43].
Léčba únavy u revmatoidní artritidy
Možnosti léčby únavy u RA
shrnuje tabulka 2 [38].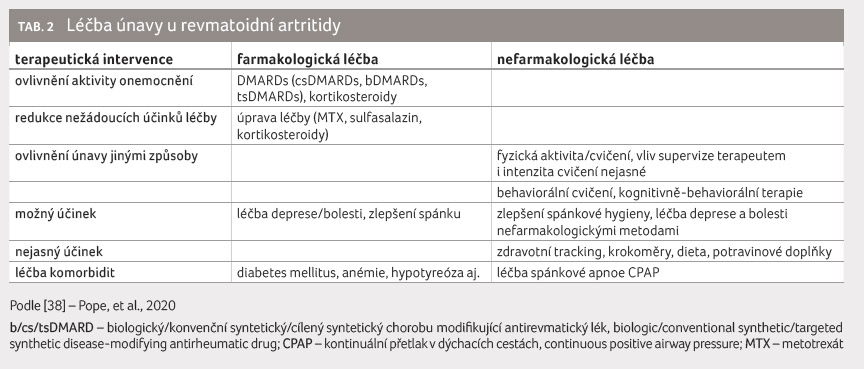
Práce Crampa a kol. sledovala vliv nefarmakologické intervence (fyzická aktivita, psychosociální intervence) na pomoc lidem při dlouhodobém trvání subjektivního pocitu únavy [44]. Jiná metaanalýza hodnotící vliv nefarmakologické léčby na únavu u pacientů s RA prokázala mírný, ale signifikantní vliv pro šest druhů fyzické aktivity. Cvičení zahrnovalo plavání, dynamický silový trénink, jógu a nízkozátěžový aerobik (evidence důkazů hodnocena jako střední). Při hodnocení únavy na stupnici od 0 do 100 si obě intervence vedly lépe než kontrolní skupina [45].
Také ve studiích ORAL Solo, ORAL
Sync, ORAL Standard, ORAL Scan a ORAL Step s tofacitinibem
bylo dosaženo zmírnění únavy při měření dotazníkem FACIT F
[14,46–51]. V letošním roce vyšla post hoc analýza
studií fáze III hodnotící vliv léčby tofacitinibem na únavu,
spánek a kvalitu života pacientů s RA pomocí FACIT F,
Medical Outcomes Study – Sleep Scale (MOS SS), SF 36
(souhrn duševní a fyzické složky), graf 1A, B [52].
V analýze byl zaznamenán signifikantní pokles aktivity nemoci
po třech měsících podávání v porovnání s placebem,
ale při hodnocení únavy na základě dotazníku FACIT F
i spánkové škály docházelo k významnějšímu
zlepšení u pacientů léčených tofacitinibem ve srovnání
s placebem, ale i s adalimumabem. Rovněž u SF 36
došlo k signifikantnímu zlepšení u pacientů léčených
tofacitinibem [52].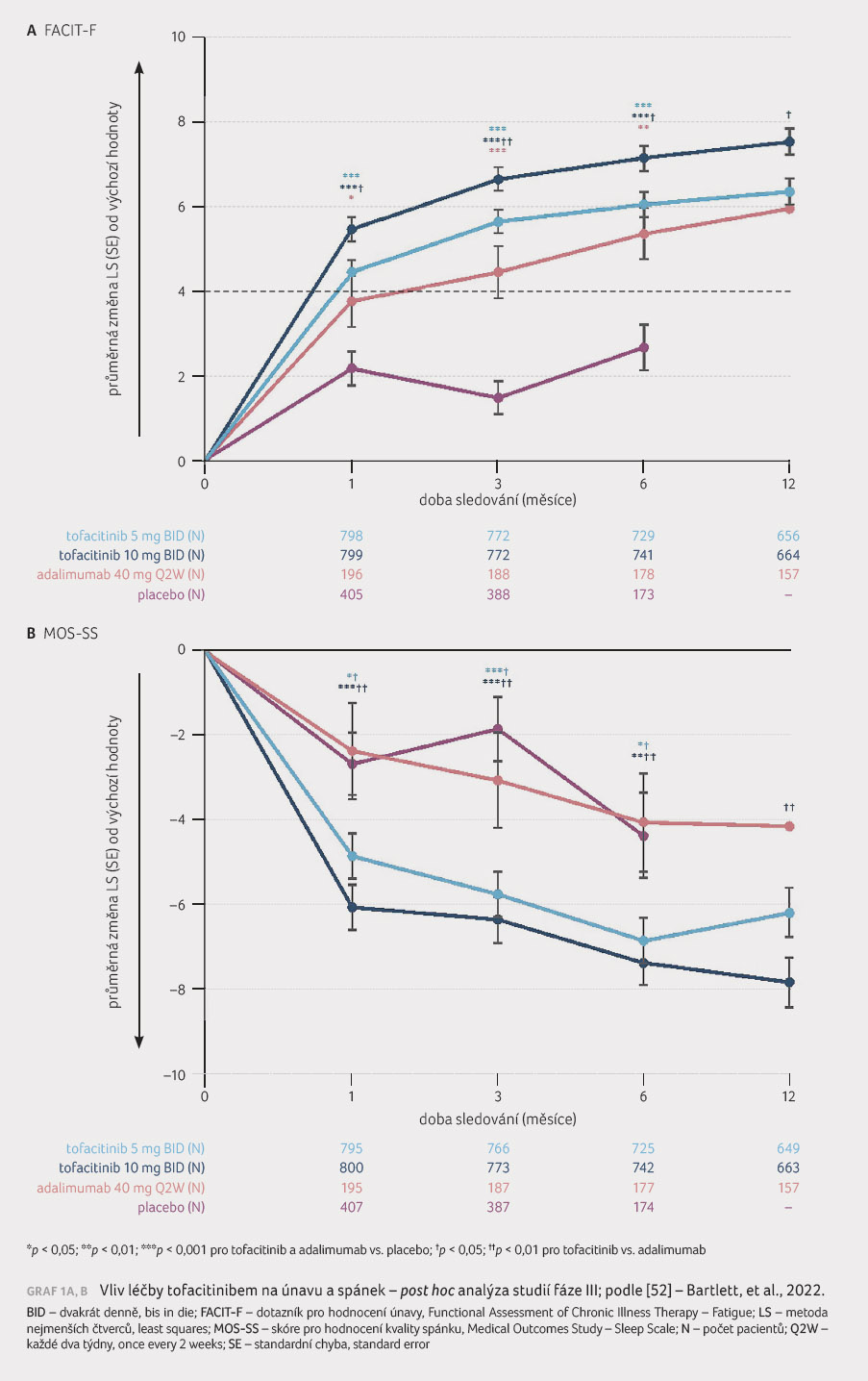
Závěr
Pacientem hlášené výsledky zahrnující cíle a perspektivy nemocného mohou přinášet rozdílné informace a jiné pohledy, než je hodnocení provedené lékařem. Dopad únavy na kvalitu života u pacientů s RA může být významný; únava je spojena s poklesem funkčnosti, horším duševním stavem, vyšší úrovní interpersonálního stresu a může ztížit zvládnutí dalších příznaků RA [45,53,54]. Data ze studií s tofacitinibem prokazují větší vliv na zmírnění únavy při léčbě tofacitinibem v porovnání s placebem, po 12 měsících podávání bylo v některých aspektech doloženo větší zmírnění únavy i v porovnání s adalimumabem [47,50,51].
Kterou strategii zvolit po selhání prvního inhibitoru TNF?
„Účelem sympozia je shrnout, pro které pacienty by mohla být léčba inhibitory JAK vhodnější. Selháním terapie inhibitory TNF se zabýváme proto, že jsou stále nejčastěji užívanými cílenými léky v první linii po selhání konvenčních syntetických DMARDs (csDMARDs),“ uvedl své sdělení MUDr. Heřman Mann, Ph.D., rovněž z Revmatologického ústavu v Praze. Dle dat dánského registru DANBIO dostávalo inhibitor TNF 70,2 % pacientů, dle švýcarského registru SCQM RA 79,8 % osob, dle německého registru RABBIT 69,9 % osob a dle českého registru ATTRA 93,6 % pacientů (v letech 2012–2018) [55,56]. U 30–40 % nemocných musí být léčba prvním inhibitorem TNF ukončena.
Důvody pro ukončení léčby inhibitorem TNF jsou: 1. primární selhání (léčba nikdy nezačne fungovat), 2. sekundární selhání (léčba funguje, ale po určité době přestane), 3. částečná odpověď na léčbu, 4. nežádoucí účinky. I třetí důvod by měl lékaře nabádat ke změně, podle registru ATTRA se však stále ukazuje, že je řada pacientů, kteří dlouhodobě pokračují v léčbě s pouze částečnou odpovědí. Vzhledem k dostupné paletě léků bychom měli usilovat o to, aby pacienti dosahovali kompletní odpovědi.
Co lze udělat po selhání prvního inhibitoru TNF
Při nedostatečné odpovědi na první
inhibitor TNF můžeme: 1. eskalovat dávku (podloženo daty
v případě infliximabu a adalimumabu); 2. optimalizovat
léčbu csDMARD (máme dobrá data pro kombinaci biologické léčby
a MTX, lze tedy zaměnit stávající lék za MTX atp.); 3.
změnit na jiný inhibitor TNF (tzv. cycle); 4. změnit
na bDMARD s jiným mechanismem účinku (tzv. swap); 5.
změnit na tsDMARD (obr. 2) [57].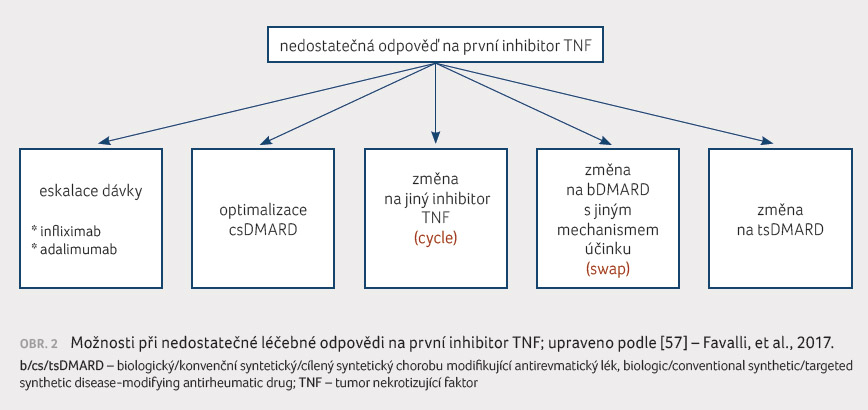
Klinické studie a data z reálné praxe
Výsledky klinických hodnocení zaměřených na účinnost léčby po selhání inhibitoru TNF jsou bez ohledu na mechanismus účinku léku podobné (GO AFTER s golimumabem, ATTAIN s abataceptem, REFLEX s rituximabem, RADIATE s tocilizumabem, ORAL Step s tofacitinibem, RA BEACON s baricitinibem). Přibývají nová data, např. metaanalýza publikovaných studií z roku 2021, která zahrnula devět randomizovaných kontrolovaných hodnocení a 16 observačních studií. Analyzované studie byly podle autorů velmi heterogenní a hodnocení výsledků probíhalo pomocí tří různých bayesiánských statistických modelů. Na základě modelu s pevnými efekty bylo nasazení léčby s jiným mechanismem účinku spojeno s klinicky významně vyšší pravděpodobností dosažení odpovědi ACR 50 (50% zlepšení podle kritérií American College of Rheumatology; poměr šancí [OR] 1,35) než léčba druhým inhibitorem TNF. Tato strategie je spojena s nižší pravděpodobností ukončení léčby z jakéhokoliv důvodu (OR 0,53). Na základě statistické analýzy se pravděpodobnost, že nasazení cílené léčby s jiným mechanismem účinku je výhodnější než léčba druhým inhibitorem TNF, pohybovala v rozmezí 70–90 % [58].
Máme k dispozici také údaje z reálné klinické praxe v podobě analýzy amerických databází, kde 10 442 nemocných bylo po léčbě prvním inhibitorem TNF, 63,5 % dostalo léčbu druhým inhibitorem TNF a 36,5 % léčivo s jiným mechanismem účinku – tyto údaje reflektují i reálnou klinickou praxi v Evropě. V analýze byla hodnocena frekvence změn cílené léčby, délka setrvání v léčbě a náklady na ni. Nemocní převedení na léčivo s jiným mechanismem účinku byli významně starší a měli více komorbidit. Setrvání v léčbě bylo významně delší u pacientů, kteří byli léčeni přípravkem s jiným mechanismem účinku, ve srovnání s druhým inhibitorem TNF (medián 605 dní vs. 489 dní; p < 0,001). Na druhou stranu léčba druhým inhibitorem TNF je spojena s nižšími náklady ve srovnání s léčbou přípravky s jiným mechanismem účinku [59].
Z reálné klinické praxe vychází i sledování 740 pacientů z USA léčených inhibitorem TNF a poté buď druhým inhibitorem TNF, nebo tofacitinibem. V obou případech byly setrvání v léčbě a délka léčby delší, pokud pacienti po inhibitoru TNF dostali tofacitinib [60].
Analýza dat z reálné klinické praxe v Koreji má podobu teplotní mapy, která ukazuje pravděpodobnost selhání léčby po změně na jiný lék. Nasazení léčiva s jiným mechanismem účinku zde bylo spojeno s nižším rizikem selhání léčby – dobré výsledky byly zaznamenány především pro tocilizumab a tofacitinib. Uvedená analýza zahrnula přes 8 000 pacientů se séropozitivní RA léčených bDMARD nebo tofacitinibem v letech 2014–2019 [61].
Doporučení EULAR a ACR
Podle doporučení EULAR z roku 2019 může být po selhání léčby inhibitorem TNF pacient léčen přípravkem s jiným mechanismem účinku nebo druhým inhibitorem TNF. Autoři změnou pořadí možností léčby ve větě naznačují, že nasazení léčiva s jiným mechanismem účinku je zřejmě spojeno s vyšší účinností než léčba druhým inhibitorem TNF [1]. Rovněž v nových doporučeních je znění tohoto bodu stejné. Podle doporučení ACR z roku 2021 je po selhání léčby bDMARD nebo tsDMARD podmíněně doporučeno nasazení léčiva s jiným mechanismem účinku. Autoři zároveň zdůrazňují, že toto konkrétní doporučení je založeno na důkazech nižší úrovně [62].
Shrnutí
Po selhání prvního inhibitoru TNF lze volit druhý inhibitor TNF nebo léčivo s jiným mechanismem účinku. Přibývá důkazů o lepší účinnosti druhé strategie. Volba musí být individuální na základě sdíleného rozhodnutí a může odrážet i jiná hlediska než jen účinnost (komorbidity, cenu, aplikační formu atd.).
Redakčně zpracovala PhDr. Nikola Homolová Richtrová