Afatinib – nový ireverzibilní tyrozinkinázový inhibitor v klinické praxi
Karcinom plic je v České republice u mužů nádorem s nejvyšší mortalitou. U žen pak zaujímá z hlediska mortality třetí místo. Většina nemocných je diagnostikována ve stadiu neresekabilním, lokálně pokročilém či metastazujícím (stadium IIIB–IV). Nemalobuněčný karcinom představuje 80 % všech karcinomů plic. V současné době se i v léčbě plicní rakoviny uplatňuje přístup personalizované medicíny. V případě potvrzené aktivační mutace receptoru pro epidermální růstový faktor (epidermal growth factor receptor – EGFR), v době diagnostiky tumoru, se doporučuje u pacientů se stadiem IV zahájit léčbu tyrozinkinázovými inhibitory (tyrosine kinase inhibitor – TKI).
Afatinib patří mezi TKI druhé generace. Je prokázána jeho efektivita jak u senzitivních běžných mutací, tak rovněž u mutací méně častých, a to i těch, které jsou na léčbu standardními TKI první generace rezistentní (T790). Nežádoucí účinky jsou podobné jako u TKI první generace a jsou zvládnutelné podpůrnou terapií, deeskalací či přerušením léčby.
Úvod
V České republice je u mužů karcinom plic nejčastější příčinou úmrtí, u žen pak třetí nejčastější příčinou mortality na zhoubné nádory. Incidence bronchogenního karcinomu plic má stále vzrůstající tendenci, jakkoliv mortalita mírně klesá [1]. Ročně zaznamenáváme přes 6000 nových případů onemocnění. Dle typu nádoru představují více než 80 % případů nemalobuněčné karcinomy plic (non-small cell lung cancer – NSCLC). Šanci na déletrvající přežití má především nemocný v nižším klinickém stadiu, kdy přichází v úvahu provedení radikálního chirurgického výkonu. V době diagnóz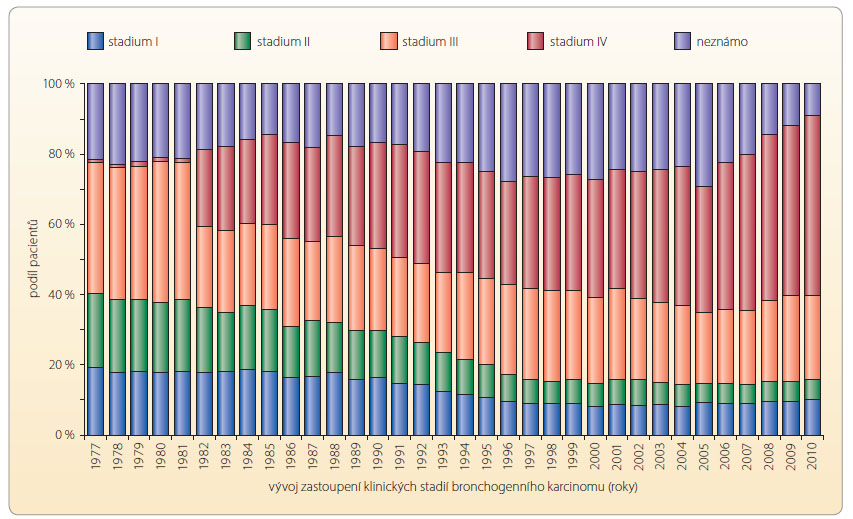 y převažují, u nás i ve světě, neresekabilní, lokálně pokročilá či metastazující klinická stadia klasifikovaná jako IIIB–IV, viz graf 1. Nemocní s těmito vyššími stadii onemocnění mají naději na 5leté přežití významně nižší – 5 % a méně [2]. Nejnověji je s ohledem na optimalizaci léčby propagován přístup personalizované medicíny – léčby šité na míru pro konkrétního pacienta. Iniciální diagnostika se nezaměřuje jen na podtyp NSCLC, ale i na biologický profil buněk daného nádoru. V současné době se provádí standardně testování průkazu aktivační mutace receptoru pro epidermální růstový faktor (epidermal growth factor receptor, EGFR) u generalizovaných neskvamózních NSCLC. Aktivační mutace v nádorové buňce představuje „řídící“ mutaci, která dává jednoznačnou selektivní výhodu růstu nádorovým buňkám (na rozdíl od „cestující“ mutace). Aktivační mutace EGFR má za následek nekontrolovatelný nádorový růst a metastazování, a to v důsledku zvýšení buněčné proliferace a inhibice apoptózy. Léčba inhibitory EGFR tento efekt blokuje. Tam, kde je v případě metastatického či rekurentního onemocnění prokázána aktivační mutace EGFR, je doporučena léčba inhibitory EGFR v první linii [3]. Častější výskyt mutací je zaznamenáván především u pacientů s adenokarcinomy, u nekuřáků, žen a asijské populace. Aktivační mutace EGFR se v kavkazské populaci vyskytují v méně než 10 %. K nejčastějším mutacím EGFR patří delece na exonu 19 a dále bodová mutace L858R na exonu 21, které dohromady představují více než 90 % možných typů mutací EGFR. Ostatní mutace lze označit za sporadické [4].
y převažují, u nás i ve světě, neresekabilní, lokálně pokročilá či metastazující klinická stadia klasifikovaná jako IIIB–IV, viz graf 1. Nemocní s těmito vyššími stadii onemocnění mají naději na 5leté přežití významně nižší – 5 % a méně [2]. Nejnověji je s ohledem na optimalizaci léčby propagován přístup personalizované medicíny – léčby šité na míru pro konkrétního pacienta. Iniciální diagnostika se nezaměřuje jen na podtyp NSCLC, ale i na biologický profil buněk daného nádoru. V současné době se provádí standardně testování průkazu aktivační mutace receptoru pro epidermální růstový faktor (epidermal growth factor receptor, EGFR) u generalizovaných neskvamózních NSCLC. Aktivační mutace v nádorové buňce představuje „řídící“ mutaci, která dává jednoznačnou selektivní výhodu růstu nádorovým buňkám (na rozdíl od „cestující“ mutace). Aktivační mutace EGFR má za následek nekontrolovatelný nádorový růst a metastazování, a to v důsledku zvýšení buněčné proliferace a inhibice apoptózy. Léčba inhibitory EGFR tento efekt blokuje. Tam, kde je v případě metastatického či rekurentního onemocnění prokázána aktivační mutace EGFR, je doporučena léčba inhibitory EGFR v první linii [3]. Častější výskyt mutací je zaznamenáván především u pacientů s adenokarcinomy, u nekuřáků, žen a asijské populace. Aktivační mutace EGFR se v kavkazské populaci vyskytují v méně než 10 %. K nejčastějším mutacím EGFR patří delece na exonu 19 a dále bodová mutace L858R na exonu 21, které dohromady představují více než 90 % možných typů mutací EGFR. Ostatní mutace lze označit za sporadické [4].
Inhibitory EGFR
EGFR je jedním ze skupiny transmembránových receptorů patřících k tzv. rodině receptorů ErbB, viz obr. 1. Patří k ní čtyři obdobné receptory označované jako EGFR (ErbB1), HER2 (ErbB2), ErbB3 a ErbB4 [5]. Tyto receptory se skládají ze tří základních částí – domény vázající ligand (mimo ErbB2), transmembránového úseku a tyrozinkinázové domény (mimo ErbB3) [6]. Po navázání ligandu dojde k dimerizaci receptorů a k následné autofosforylaci molekul asociovaných k tyrozinkinázové doméně a poté k aktivaci 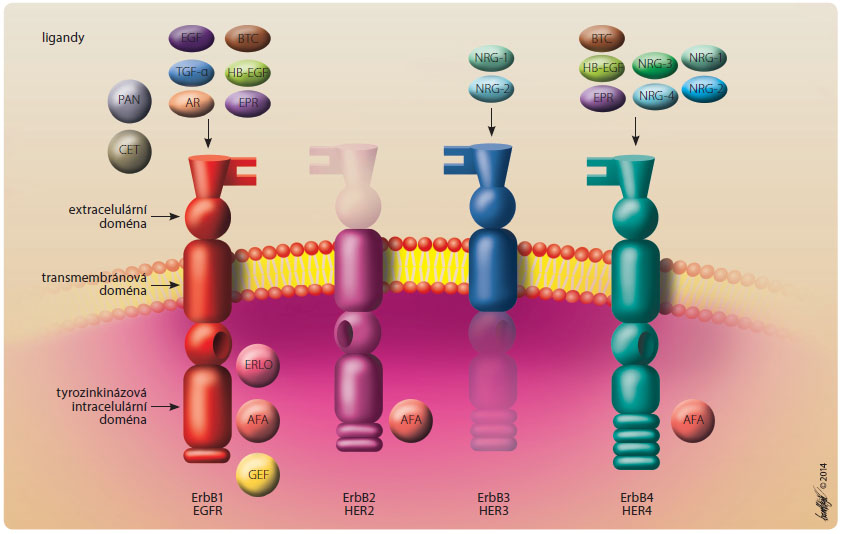 celé řady drah vedoucích k onkogenezi [6].V současné době máme k dispozici již několik přípravků, které způsobují blokaci EGFR. K inhibitorům EGFR první generace patří erlotinib a gefitinib. Jejich účinnost u nemocných s mutací EGFR (EGFR-M+) v první linii léčby byla prokázána randomizovanými klinickými studiemi, které dokládají prodloužení času do progrese onemocnění (progression free survival – PFS) ve srovnání se standardní chemoterapií. V panasijské studii IPASS s gefitinibem došlo k prodloužení PFS o 3,2 měsíce, ve studii EURTAC s erlotinibem o 4,5 měsíce. Avšak data ohledně celkového přežití (overall survival – OS) nebyla pro chemoterapeutické režimy signifikantní, což se přičítá především značnému zkříženému uspořádání (cross-over) daných studií [7, 8]. Nicméně i přesto byl, při jejich výrazně nižší celkové toxicitě, podávání per os a zlepšení PFS, jejich klinický přínos jednoznačný. Závažný problém pak představuje postupný vznik rezistence k této léčbě, kde hraje dominantní roli vznik sekundární mutace EGFR označené jako T790M [9].
celé řady drah vedoucích k onkogenezi [6].V současné době máme k dispozici již několik přípravků, které způsobují blokaci EGFR. K inhibitorům EGFR první generace patří erlotinib a gefitinib. Jejich účinnost u nemocných s mutací EGFR (EGFR-M+) v první linii léčby byla prokázána randomizovanými klinickými studiemi, které dokládají prodloužení času do progrese onemocnění (progression free survival – PFS) ve srovnání se standardní chemoterapií. V panasijské studii IPASS s gefitinibem došlo k prodloužení PFS o 3,2 měsíce, ve studii EURTAC s erlotinibem o 4,5 měsíce. Avšak data ohledně celkového přežití (overall survival – OS) nebyla pro chemoterapeutické režimy signifikantní, což se přičítá především značnému zkříženému uspořádání (cross-over) daných studií [7, 8]. Nicméně i přesto byl, při jejich výrazně nižší celkové toxicitě, podávání per os a zlepšení PFS, jejich klinický přínos jednoznačný. Závažný problém pak představuje postupný vznik rezistence k této léčbě, kde hraje dominantní roli vznik sekundární mutace EGFR označené jako T790M [9].
Proto byly hledány cesty, jak danou situaci zlepšit. Jednou z nich je i vývoj druhé generace EGFR TKI, k níž patří právě afatinib. První generace inhibitorů EGFR představovala reverzibilní blokátory této signální dráhy, kdežto afatinib patří k prvním ireverzibilním blokátorům rodiny ErbB.
Afatinib
Afatinib je silný selektivní a ireverzibilní blokátor ErbB, který se podává jednou denně perorálně. Má prokázanou účinnost jak u běžných mutací EGFR, tak i u mutací rezistentních (T790). Afatinib se váže kovalentní vazbou na tyrozinkinázovou doménu receptorů 1, 2, 4 a ireverzibilně blokuje všechny homo- i heterodimery v rámci členů rodiny ErbB [10]; ErbB3 nemá tyrozinkinázovou doménu a je inhibován nepřímo inhibicí ostatních členů rodiny.
Studie LUX-Lung 1–8
Přínos podávání afatinibu je doložen klinickými studiemi u pacientů s histologicky potvrzeným NSCLC stadia IIIB–IV s prokázanou aktivační mutací EGFR. Záměrem tohoto sdělení není podat přehled všech studií s afatinibem, proto se zastavíme jen u těch nejdůležitějších dat a údajů. LUX-Lung 1 [11] byla randomizovaná, dvojitě zaslepená studie fáze IIb/III, která srovnávala afatinib v kombinaci s nejlepší podpůrnou léčbou (Best Supportive Care – BSC) proti placebu v kombinaci s BSC. Medián PFS představoval ve skupině, kde byli pacienti s EGFR M+ léčeni afatinibem, 3,3 měsíce, zatímco ve skupině s podáváním placeba pouze jeden měsíc. Studie neprokázala prodloužení celkového přežití ve skupině s afatinibem (10,8 měsíce) ve srovnání se skupinou s placebem (12,0 měsíců). Nebylo tedy dosaženo primárního cíle studie, což bylo zřejmě dáno ná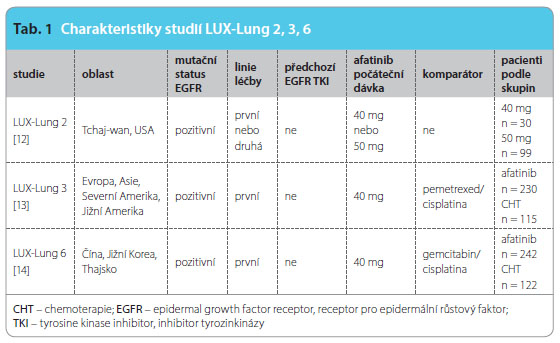 slednou léčbou v obou ramenech, ale ve skupině s afatinibem bylo doloženo prodloužení PFS a zmírnění symptomů (kašel, bolest a dušnost) a celkové zlepšení kvality života (Quality of Life – QoL). Cílem studie LUX-Lung 2 [12], se 129 zařazenými pacienty, bylo ověřit účinnost (celkový počet odpovědí, Overall Response Rate – ORR) a bezpečnost afatinibu u nemocných po selhání chemoterapie či u pacientů chemonaivních. Byla podávána dvojí síla afatinibu, 40 mg a 50 mg. Afatinib prokázal účinnost u sporadických i častých mutací; ORR byl 61 %. Tento výsledek nebyl ovlivněn pohlavím, rasou, dávkováním (40 mg vs. 50 mg) ani linií léčby (první vs. druhá linie). Medián PFS činil 10,1 měsíce, kdy delší PFS představoval výsledek v první linii léčby u pacientů s častými mutacemi. Medián OS dosáhl 24,8 měsíce. Nejčastějšími nežádoucími účinky byly, stejně jako ve studii LUX-Lung 1, průjmy a rash. Potvrzení účinnosti afatinibu ve studii LUX-Lung 2 u pacientů s častými i sporadicky se vyskytujícími mutacemi EGFR se stalo odrazovým můstkem k uspořádání robustních studií LUX-Lung 3 a LUX-Lung 6, viz tab. 1.
slednou léčbou v obou ramenech, ale ve skupině s afatinibem bylo doloženo prodloužení PFS a zmírnění symptomů (kašel, bolest a dušnost) a celkové zlepšení kvality života (Quality of Life – QoL). Cílem studie LUX-Lung 2 [12], se 129 zařazenými pacienty, bylo ověřit účinnost (celkový počet odpovědí, Overall Response Rate – ORR) a bezpečnost afatinibu u nemocných po selhání chemoterapie či u pacientů chemonaivních. Byla podávána dvojí síla afatinibu, 40 mg a 50 mg. Afatinib prokázal účinnost u sporadických i častých mutací; ORR byl 61 %. Tento výsledek nebyl ovlivněn pohlavím, rasou, dávkováním (40 mg vs. 50 mg) ani linií léčby (první vs. druhá linie). Medián PFS činil 10,1 měsíce, kdy delší PFS představoval výsledek v první linii léčby u pacientů s častými mutacemi. Medián OS dosáhl 24,8 měsíce. Nejčastějšími nežádoucími účinky byly, stejně jako ve studii LUX-Lung 1, průjmy a rash. Potvrzení účinnosti afatinibu ve studii LUX-Lung 2 u pacientů s častými i sporadicky se vyskytujícími mutacemi EGFR se stalo odrazovým můstkem k uspořádání robustních studií LUX-Lung 3 a LUX-Lung 6, viz tab. 1.
LUX-Lung 3 [13] byla multicentrická randomizovaná studie fáze III porovnávající terapeutický účinek u pacientů s adenokarcinomem s mutací EGFR v první linii léčby. Srovnáván byl afatinib s chemoterapií představovanou dubletem cisplatina a pemetrexed, která je v současné době nejúčinnějším způsobem léčby adenokarcinomu. Primárním ![Graf 2 Čas do progrese při podávání afatinibu ve srovnání s podáváním chemoterapie ve studii LUX-Lung 3 v celém souboru pacientů; podle [20] – Yang, et al., 2012. PFS – progression free survival, čas do progrese; CI – konfidenční interval, interval spolehlivosti; HR – hazard ratio, poměr rizik; cis/pem – cisplatina/pemetrexed](https://www.remedia.cz/photo-a-29698---.jpg) cílem byl PFS, sekundárními pak ORR, DCR (Disease Control Rate, míra kontroly onemocnění), OS, zmírnění symptomů u pacientů a doba odpovědi na léčbu. Studie byla jedinečná nejen prospektivním výběrem všech pacientů s EGFR M+, ale i jejich počtem (345 nemocných) a též porovnáváním se šesti cykly léčby kombinací pemetrexed plus cisplatina. V této vyváženě balancované studii představovaly časté mutace (tj. delece na exonu 19 a bodová mutace L858R) takřka 90 % případů. Primární cíl studie, tedy PFS, byl splněn u pacientů jako celku i ve všech podskupinách, kdy doba do progrese byla ve srovnání s režimem chemoterapie prodloužena o 4,4 měsíce (11,1 měsíce vs. 6,7 měsíce), viz graf 2. V předem plánované podskupině nemocných s častými mutacemi pak došlo k prodloužení dokonce o 6,7 měsíce (13,6 měsíce vs. 6,9 měsíce), viz graf 3. ORR byl u afatinibu více než zdvojen (56 % vs. 23 %) a 90 % pacientů s léčbou afatinibem vykazovalo alespoň stabilizaci tumoru. Medián doby odpovědi na léčbu byl stanoven na 11,1 měsíce u afatinibu a 5,5 měsíce u chemoterapie. Doba kontroly choroby pak činila 13,6 měsíce (afatinib) versus 8,1 měsíce (chemoterapie). Medián OS nebyl při první analýze výsledků znám. U sporadických mutací byla účinnost afatinibu značně nižší a byla odlišná případ od případu, na druhou stranu těchto pacientů bylo do studie zařazeno málo, a proto nebylo možné učinit zásadnější závěry. Studie přinesla pozitivní výsledek i v ovlivnění symptomů a QoL, kdy ve srovnání s chemoterapií byl afatinib lepší v
cílem byl PFS, sekundárními pak ORR, DCR (Disease Control Rate, míra kontroly onemocnění), OS, zmírnění symptomů u pacientů a doba odpovědi na léčbu. Studie byla jedinečná nejen prospektivním výběrem všech pacientů s EGFR M+, ale i jejich počtem (345 nemocných) a též porovnáváním se šesti cykly léčby kombinací pemetrexed plus cisplatina. V této vyváženě balancované studii představovaly časté mutace (tj. delece na exonu 19 a bodová mutace L858R) takřka 90 % případů. Primární cíl studie, tedy PFS, byl splněn u pacientů jako celku i ve všech podskupinách, kdy doba do progrese byla ve srovnání s režimem chemoterapie prodloužena o 4,4 měsíce (11,1 měsíce vs. 6,7 měsíce), viz graf 2. V předem plánované podskupině nemocných s častými mutacemi pak došlo k prodloužení dokonce o 6,7 měsíce (13,6 měsíce vs. 6,9 měsíce), viz graf 3. ORR byl u afatinibu více než zdvojen (56 % vs. 23 %) a 90 % pacientů s léčbou afatinibem vykazovalo alespoň stabilizaci tumoru. Medián doby odpovědi na léčbu byl stanoven na 11,1 měsíce u afatinibu a 5,5 měsíce u chemoterapie. Doba kontroly choroby pak činila 13,6 měsíce (afatinib) versus 8,1 měsíce (chemoterapie). Medián OS nebyl při první analýze výsledků znám. U sporadických mutací byla účinnost afatinibu značně nižší a byla odlišná případ od případu, na druhou stranu těchto pacientů bylo do studie zařazeno málo, a proto nebylo možné učinit zásadnější závěry. Studie přinesla pozitivní výsledek i v ovlivnění symptomů a QoL, kdy ve srovnání s chemoterapií byl afatinib lepší v![Graf 3 Čas do progrese při podávání afatinibu ve srovnání s podáváním chemoterapie ve studii LUX-Lung 3 ve skupině s častými mutacemi; podle [20] – Yang, et al., 2012. PFS – progression free survival, čas do progrese; CI – konfidenční interval, interval spolehlivosti; HR – hazard ratio, poměr rizik; cis/pem – cisplatina/pemetrexed](https://www.remedia.cz/photo-a-29699---.jpg) e všech hodnocených ohledech a statistické významnosti dosáhl u symptomů kašle, dušnosti a bolesti a rovněž v hodnocení celkové kvality života. Počet nežádoucích účinků (Adverse Events – AEs) stupně 3 a více byl v obou ramenech obdobný (49 % při podávání afatinibu, 48 % při podávání chemoterapie). Mezi nejčastější nežádoucí účinky spojené s léčbou afatinibem patřil průjem, rash, stomatitidy a paronychie, chemoterapie byla naopak nejčastěji spojena s nechutenstvím, únavou, nauzeou/zvracením a myelosupresí. Preventivní/léčebná opatření (pro afatinib viz níže), jejichž cílem bylo omezit AEs, zahrnovala případnou redukci dávky; léčba musela být ukončena pouze u nevelkého počtu nemocných (8 % pacientů ze skupiny dostávající afatinib, 12 % ze skupiny chemoterapie). Tato studie, kdy afatinib prokázal svoji účinnost v první linii léčby u pacientů s adenokarcinomem a senzitivní mutací EGFR, byla podkladem pro jeho registraci v řadě zemí světa.
e všech hodnocených ohledech a statistické významnosti dosáhl u symptomů kašle, dušnosti a bolesti a rovněž v hodnocení celkové kvality života. Počet nežádoucích účinků (Adverse Events – AEs) stupně 3 a více byl v obou ramenech obdobný (49 % při podávání afatinibu, 48 % při podávání chemoterapie). Mezi nejčastější nežádoucí účinky spojené s léčbou afatinibem patřil průjem, rash, stomatitidy a paronychie, chemoterapie byla naopak nejčastěji spojena s nechutenstvím, únavou, nauzeou/zvracením a myelosupresí. Preventivní/léčebná opatření (pro afatinib viz níže), jejichž cílem bylo omezit AEs, zahrnovala případnou redukci dávky; léčba musela být ukončena pouze u nevelkého počtu nemocných (8 % pacientů ze skupiny dostávající afatinib, 12 % ze skupiny chemoterapie). Tato studie, kdy afatinib prokázal svoji účinnost v první linii léčby u pacientů s adenokarcinomem a senzitivní mutací EGFR, byla podkladem pro jeho registraci v řadě zemí světa.
LUX-Lung 6 [14] je otevřená randomizovaná studie fáze III u asijských pacientů s pokročilým adenokarcinomem s mutací EGFR. Byla porovnávána účinnost afatinibu a chemoterapie ve složení gemcitabin–cisplatina v první linii léčby. Primárním cílem byl PFS, mezi sekundární cíle patřily QoL, OS či ORR. Mezi účastníky studie převládali, vzhledem k častějšímu výskytu EGFR M+, nekuřáci a ženy. Studie byla dobře vyvážena mezi obě větve. Afatinib prokázal jednoznačné prodloužení PFS ve srovnání s chemoterapií (11,0 měsíce vs. 5,6 měsíce, hazard ratio – HR = 0,26), a to i ve všech podskupinách (na základě věku, pohlaví, kuřácké historie a typu mutace EGFR); ORR se zvýšil téměř třikrát – z 23 % při podávání chemoterapie na 67 % při podávání afatinibu. Data týkající se OS nejsou nyní ještě vyhodnocena. Afatinib ve srovnání s užitou chemoterapií též významně zvýšil kvalitu života nemocných z hlediska projevů, jako je kašel, dušnost i bolest, které se při užívání afatinibu zmírnily. Celková QoL byla pacienty hodnocena též jako významně lepší. Ačkoliv průjem a rash patřily mezi časté komplikace léčby, celkový počet všech nežádoucích účinků stupně III/IV byl signifikantně nižší při užití afatinibu ve srovnání s chemoterapií (36 % vs. 60 %). Rovněž počet pacientů, kteří ukončili léčbu kvůli nežádoucím účinkům, byl výrazně vyšší při podávání chemoterapie než při podávání afatinibu (40 % vs. 5,9 %). Afatinib tak obdobně jako ve studii LUX-Lung 3 prokázal svůj přínos ve srovnání s chemoterapií v první linii léčby, a to nejen v prodloužení doby do progrese a v lepší odpovědi na léčbu, ale především i v hodnocení kvality života pacientů.
LUX-Lung 7 [15] je studie porovnávající head to head účinnost afatinibu a gefitinibu v první linii léčby u nemocných s EGFR M+. Byl dokončen příjem pacientů do studie, která v současné době probíhá.LUX-Lung 8 [16] porovnává head to head účinnost afatinibu a erlotinibu u pacientů s dlaždicovým NSCLC léčených po progresi, k níž došlo při léčbě standardním platinovým dubletem. V současné době probíhá příjem pacientů do studie.
Afatinib v klinické praxi
Dávkování afatinibu
Afatinib je podáván perorálně v jedné ranní dávce, obvyklá dávka je 40 mg. Lék by neměl být užíván společně se stravou, s ohledem na jeho vstřebávání nesmí být potrava konzumována nejméně 3 hodiny před užitím afatinibu a nejméně jednu hodinu po něm. Doporučuje se zapít lék nesycenou vodou. Pokud si pacient zapomene vzít dávku ráno, může ji užít i později, pokud ovšem nezbývá do podání následující dávky méně než 8 hodin. Pokud ano, doporučuje se tuto zapomenutou dávku vynechat.
Je-li lék dobře tolerován, lze dávku zvýšit na 50 mg/den, při této dávce byla prokázána vyšší účinnost. Dávky vyšší než 50 mg/den již nebyly přínosem v porovnání účinnosti a nežádoucích účinků. Při nutnosti redukce dávky lze užít též síly léku 30 mg a 20 mg (nižší dávka již postrádá léčebný efekt). Většina nežádoucích účinků je dobře zvladatelná podpůrnou léčbou, eventuálně deeskalací či přerušením podávání. Není doporučeno jakýmkoliv způsobem zasahovat, pokud intenzita nežádoucího účinku dosahuje stupně 0–1 CTCAE (Common Terminology Criteria for Adverse Events). Doporučuje se redukovat dávku, jakmile nežádoucí reakce dosáhne stupně 2 s intolerancí léku, či stupně 3 a více, dále pokud diarrhoea stupně 2 trvá déle než 48 hodin, rash stupně 2 déle než 7 dní. Dávku snižujeme o 10 mg, postupně, až na dávku 20 mg. Pokud nemocný netoleruje ani dávku 20 mg, zvažuje se přerušení léčby afatinibem do doby, než nežádoucí účinek poklesne na stupeň 0–1 [17].
Interakce afatinibu
Afatinib není metabolizován enzymy cytochromu P450 (není jejich induktorem ani inhibitorem), a proto se lékové interakce, k nimž tímto mechanismem dochází, neuplatňují. Afatinib představuje substrát pro P-gp (P-glykoprotein; efluxní transmembránovou pumpu); jeho plazmatické koncentrace mohou být proto ovlivněny užitím jak inhibitorů, tak induktorů P-gp. Mezi silné inhibitory P-gp patří cyklosporin, erythromycin, ketokonazol, itrakonazol, chinidin, ritonavir, verapamil, takrolimus, amiodaron; mezi silné induktory P-gp se řadí především třezalka tečkovaná, dále rifampicin, karbamazepin a fenytoin. Současná léčba silnými induktory P-gp může snížit expozici vůči afatinibu. Při léčbě afatinibem by tyto léky neměly být podávány [18].
Podpůrná léčba jednotlivých nežádoucích účinků
V přehledu jsou uvedeny specifické léčebné postupy pro jednotlivé nežádoucí účinky [19]; pokud tyto nejsou zvladatelné podpůrnou léčbou, doporučuje se snížení dávky afatinibu či přerušení léčby tímto přípravkem – viz výše.
Diarrhoea
Průjmy se objevují zejména v prvních 6 týdnech od zahájení léčby afatinibem. V případě průjmu je nezbytná dostatečná hydratace spolu s použitím protiprůjmových léků. Doporučován je např. loperamid s eskalací dávky do maximálního dávkování. Pacient by měl mít protiprůjmový lék k dispozici, aby mohl léčbu zahájit při prvních známkách průjmu. Léčba by měla být podávána ještě 12 hodin po zklidnění střevní peristaltiky.
Rash, akné
Stejně jako při podávání jiných EGFR TKI, objevují se i při léčbě afatinibem kožní nežádoucí reakce. Většinou se v souvislosti s léčbou afatinibem objevuje rash, akné mírného až středního stupně, vzhledu erytému a akneiformní vyrážky. Kožní nežádoucí reakce se mohou zhoršovat pobytem na slunci; pacienti by měli užívat ochranný oděv, krémy s vyšším faktorem a sluneční brýle. Časná intervence s užitím emoliencií, místních kortikosteroidů, antibiotik většinou umožní pokračování léčby afatinibem. V případě těžkých puchýřnatých, bulózních a exfoliativních změn je doporučeno přerušení léčby afatinibem či její ukončení.
Paronychie, infekce nehtu, nehtového lůžka
K terapii paronychií je doporučována aplikace roztoku např. dusičnanu stříbrného a v případě infekce přidání antibiotické léčby dle citlivosti ze stěrů. Těžší případy mohou být důvodem k přerušení léčby.
Stomatitidy
Stomatitidy mohou být léčeny solnými výplachy, lokálními anestetiky či analgetiky v závislosti na preferencích pacienta. Těžší průběh vyžaduje redukci dávek či přerušení terapie afatinibem.
Závěr
Afatinib je nový ireverzibilní inhibitor tyrozinkinázové aktivity receptorů rodiny ErbB. Vykazuje aktivitu vůči častým, ale i sporadickým mutacím, včetně mutací, které jsou rezistentní na léčbu TKI první generace (gefitinib, erlotinib). Profil nežádoucích účinků je podobný jako u inhibitorů první generace, většinou je mírného a středního stupně a je dobře zvladatelný podpůrnou léčbou, eventuálně deeskalací dávky či přerušením terapie.
Seznam použité literatury
- [1] Ústav zdravotnických informací a statistiky ČR, Národní zdravotnický informační systém (NZIS), Národní onkologický registr (NOR), [20. 12. 2007], dostupné z http://www.uzis.cz/info.php?article=368&mnu_id=7300
- [2] Mountain CF. The international system for staging lung cancer. Semin Surg Oncol 2000; 18: 106–115.
- [3] Vyzula a kol. Modrá kniha České onkologické společnosti, dostupné z: http://www.linkos.cz/informace-pro-praxi/modra-kniha/. Navštíveno 7. března 2014.
- [4] Sharma SV, Bel DW, Settleman J, et al. Epidermal growth factor receptor mutations in lung cancer. Nat Rev Cancer 2007; 7: 169–181.
- [5] Wang SC, Hung MC. Nuclear translocation of the epidermal growth factor receptor family membrane tyrosine kinase receptors. Clin Cancer Res 2009; 15: 6484–6489.
- [6] Hynes NE, et al. ERBB receptors and cancer: the complexity of targeted inhibitors. Nat Rev Cancer 2005; 5: 341–354.
- [7] Mok TS, Wu YL, Thongprasert S, et al. Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma. N Eng J Med 2009; 361: 947–957.
- [8] Gridelli C, Rossi A. EURTAC first-line phase III randomized study in advanced non-small cell lung cancer: Erlotinib works also in European population. J Thorac Dis 2012; 4: 219–220.
- [9] Ohashi K, Maruvka YE, Michr F, et al. Epidermal growth factor receptor tyrosine kinase inhibitor-resistant disease. J Clin Oncol 2013; 31: 1070–1080.
- [10] Solca F, Meyer R. Inactivation of the EGR signaling pathway by BIBW 2992. A time course analysis. 28-02 30 November 2002.
- [11] http://clinicaltrials.gov/ct2/show/NCT00656136.
- [12] http://clinicaltrials.gov/ct2/show/NCT00525148.
- [13] http://clinicaltrials.gov/ct2/show/NCT00949650.
- [14] http://clinicaltrials.gov/ct2/show/NCT01121393.
- [15] http://clinicaltrials.gov/ct2/show/NCT01466660.
- [16] http://clinicaltrials.gov/ct2/show/NCT01523587.
- [17] Yap TA, Vidal L, Adam J, et al. Phase I trial of the irreversible EGFR and HER2 kinase inhibitor BIBW 2992 in patients with advanced solid tumors. J Clin Oncol 2010; 28: 3965–3972.
- [18] Afatinib (BIBW 2992) in Patients With Advanced HER2-Positive Trastuzumab-Refractory Advanced Esophagogastric Cancer, dostupné z: http://www.cancer.gov/clinicaltrials/search/view?cdrid=724726&-version=HealthProfessional. Navštíveno 30. března 2014.
- [19] European Medicines Agency. Giotrif (afatinib): EU summary of product characteristics. http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_-_Product_Information/human/002280/WC500152392.pdf. Navštíveno 30. března 2014.
- [20] Yang JCH, Schuler M, Yamamoto N, et al. LUX-Lung 3: a randomized, open-label, Phase III study of afatinib vs cisplatin/pemetrexed as 1st-line treatment for patients with advanced adenocarcinoma of the lung harboring EGFR-activating mutations. J Clin Oncol 2012; 30 (suppl; abstr LBA7500).