Aktuality z Evropského revmatologického kongresu 2018
Ve dnech 13.‒16. června 2018 se v Amsterdamu konal výroční kongres Evropské ligy proti revmatismu (European League Against Rheumatism, EULAR). Jedná se o vrcholnou vědeckou událost evropské revmatologie. Letošního kongresu se účastnilo celkem 14 700 odborníků z řad lékařů, ale i nelékařských zdravotnických pracovníků a pacientských organizací ze 120 zemí světa. Vědecký program zařadil prezentace příspěvků pečlivě vybraných z celkového množství 5 050 zaslaných abstrakt.
Současný prezident EULAR profesor Johannes W. J. Bijlsma z Utrechtu (Nizozemsko) představil při slavnostním zahájení priority a hlavní body strategie EULAR v letech 2018‒2023. První prioritou je zvýšení kvality péče o revmatické pacienty. EULAR a jeho pracovní skupiny připravují již řadu let doporučené postupy pro diagnostiku i léčbu muskuloskeletálních onemocnění. Velká část z nich již byla publikována, nové se připravují a starší doporučení jsou pravidelně aktualizována. Další prioritou je edukace, tedy vzdělávání zaměřené na lékaře, zdravotnické pracovníky i pacienty s muskuloskeletálními chorobami napříč evropskými zeměmi. Následným bodem je inovace prezentace nových poznatků a výměna informací a zkušeností, zde se EULAR snaží o posun od velkých přednášek směrem ke komornějším, interaktivním sekcím s cílenější tematikou. Podobně jako v letech minulých pokračuje EULAR v podpoře výzkumu revmatických a muskuloskeletálních onemocnění. Liga působí i na úrovni Evropské unie nebo Světové zdravotnické organizace.
V odborném programu zazněla opět řada nových poznatků s úzkým vztahem k běžné klinické praxi a prezentovány byly i další doporučené postupy EULAR.
Nová klasifikační kritéria
EULAR/ACR pro systémový lupus erythematodes
Návrh nových klasifikačních kritérií pro systémový lupus erythematodes (SLE) představila poprvé odborné veřejnosti doktorka Sindhu Johnson z kanadského Toronta. Jedná se o výsledek mezinárodní spolupráce pracovních skupin EULAR a Americké koleje revmatologů (American College of Rheumatology, ACR).
Kritéria zahrnují sedm klinických
domén a tři domény imunologické (tab. 1). Základní podmínkou pro diagnózu SLE je pozitivita
antinukleárních protilátek alespoň v titru 1 : 80
na HEp 2 (human epithelial type 2) buňkách (nebo
ekvivalent při užití jiné metody); kritéria jsou splněna při
získání nejméně 10 bodů, přičemž znak se nepočítá, pokud
je pro něj jiné pravděpodobnější vysvětlení, např. infekce.
Pokud jsou přítomny dva znaky z jedné domény, počítá se
pouze vyšší hodnota. Pro splnění kritéria postačí výskyt
příznaku jednou, stejně tak není nutné, aby byly příznaky
přítomny současně. Nově byla do kritérií přidána
horečka, kterou však nelze započítat, jestliže má zjevně jinou
příčinu. Pro diagnózu SLE nyní nově postačí průkaz lupusové
nefritidy třídy III a IV s pozitivitou antinukleárních
protilátek (ANA). Navržená kritéria byla testována
na neselektovaném souboru pacientů se systémovým lupusem
z 23 klinických center (celkem bylo zařazeno 1 160 pacientů
se SLE a 1 058 bez této diagnózy) a vyznačovala se
vysokou senzitivitou (96,12 %) i specificitou (94,43 %).
V obou těchto parametrech nová kritéria převyšují
stávající užívaná klasifikační kritéria SLICC (Systemic
Lupus Collaborating Clinics) z roku 2012.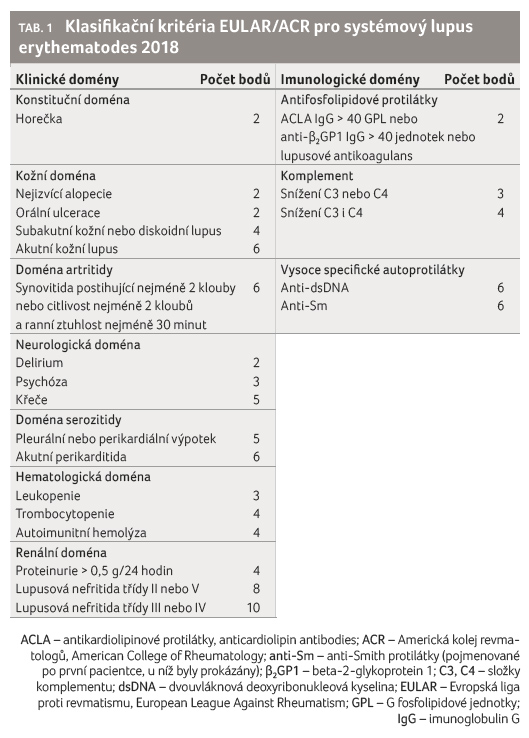
Bezpečnost a imunitní odpověď
na očkování proti herpes zoster u pacientů se SLE
Doktor Chi Chiu Mok se spoluautory (Hongkong) provedli prospektivní, randomizovanou, dvojitě zaslepenou, placebem kontrolovanou studii bezpečnosti a imunologické odpovědi na očkování proti herpes zoster (Zostavax). Sledováno bylo celkem 90 pacientů se SLE s nízkou aktivitou onemocnění (skóre SLEDAI < 6) a se stabilizovanou imunosupresivní terapií nejméně po dobu šesti měsíců; vyloučeni byli pouze nemocní s vyššími dávkami imunosupresiv, léčení cyklofosfamidem nebo biologickou terapií. U očkovaných pacientů byly po šesti týdnech od vakcinace zjištěny dle očekávání signifikantně vyšší titry protilátek proti viru varicella zoster (4,16 vs. 3,32; p < 0,001) než před očkováním. U očkovaných nemocných titry vzrostly průměrně o 59,8 %, zatímco u kontrolní skupiny se titr významně nezměnil (rozdíl ‒2,1 % oproti průměrné vstupní hodnotě). U osob s vakcinací bylo pozorováno celkem 21 nežádoucích účinků (oproti šesti případům u kontrol), žádný z nich nebyl závažný. Po vakcinaci se častěji vyskytovaly mírné kožní reakce v místě injekce, méně často artralgie, pocit zvýšené teploty, případně jiné, běžné nespecifické nežádoucí účinky očkování. Mírná exacerbace SLE byla pozorována u dvou očkovaných pacientů a u jednoho z kontrolní skupiny. Vakcinace proti herpes zoster je tedy u stabilizovaných nemocných se SLE bezpečná a vede k signifikantnímu vzestupu titru příslušných protilátek.
Doporučení EULAR pro užití
glukokortikoidů u revmatických onemocnění
Profesor Frank Buttergereit z univerzitní nemocnice Charité v Berlíně shrnul současné pohledy na užití glukokortikoidů (GK) v terapii různých revmatických onemocnění. Zdůraznil jak významné pozitivní účinky a vlastnosti GK, jako jsou silné protizánětlivé působení, imunosupresivní efekt a velmi rychlý nástup účinku, tak i spektrum jejich obávaných nežádoucích účinků, jako jsou GK indukovaná osteoporóza, steroidní myopatie, edémy, poruchy lipidového a glycidového metabolismu, katarakta a glaukom.
Glukokortikoidy se v současné době doporučují u revmatoidní artritidy (RA) při zahájení terapie syntetickými konvenčními chorobu modifikujícími antirevmatickými léky (conventional synthetic disease modifying antirheumatic drugs, csDMARDs). Mají na rozdíl od csDMARDs rychlý nástup účinku a přinesou rychlou úlevu v období do nástupu účinku chorobu modifikující terapie. Při změně léčby ‒ např. při zahájení biologické terapie nebo terapie cílenými syntetickými DMARDs (targeted synthetic disease modifying antirheumatic drugs) ‒ není podání GK nezbytně nutné. Jakmile to klinický stav dovolí, je třeba dávky GK postupně redukovat a v ideálním případě ukončit jejich podávání úplně.
Glukokortikoidy jsou stále lékem první volby u revmatické polymyalgie. Lze je v této indikaci užít v monoterapii, bez DMARDs. Iniciální dávka je zpravidla 12,5‒25 mg prednizonu nebo ekvivalentu a po zlepšení stavu a normalizaci laboratorních parametrů zánětu je možné za několik týdnů zahájit pozvolné snižování až na dávku 10 mg denně, poté se tempo redukce zvolňuje.
Bezpečnost léčby závisí na dávce GK, délce jeho podávání i na kumulativní dávce. Terapie GK je bezpečná, resp. její přínos převyšuje potenciální nežádoucí účinky, pokud trvá 3‒6 měsíců a užíváme nízké dávky (do 5 mg prednizonu denně), s výjimkou komorbidit (zejména diabetu a kardiovaskulárních onemocnění). Dávky nad 10 mg prednizonu denně dlouhodobě již posunují poměr ve prospěch nežádoucích účinků, a neměly by proto být užívány standardně. Dávky v rozmezí 5‒10 mg denně jsou akceptovatelné a u většiny nemocných mohou být bezpečné. Riziko výskytu nežádoucích účinků zvyšuje věk nemocného, kouření, abúzus alkoholu a malnutrice. Protektivními faktory jsou naopak časná diagnóza, nízká aktivita nemoci, nízká kumulativní dávka GK a kratší trvání léčby. Autoři uzavírají, že při výskytu nežádoucích účinků GK hrají významnou roli nejen dávky, ale též přítomné rizikové faktory.
Biologická léčba RA a riziko
infekcí
Doktorka Meghna Jani a profesor John D. Isaacs z Newcastlu ve Velké Británii prezentovali zajímavá data o výskytu infekcí u pacientů s RA ve vztahu ke koncentraci biologického léku. Ve dvou britských registrech biologické léčby byli prospektivně sledováni pacienti s RA včetně stanovení koncentrací biologického léku na počátku léčby a po třech, šesti a 12 měsících. Celkem bylo hodnoceno 703 osob, z toho 104 bylo léčeno tocilizumabem, ostatním byly podávány inhibitory tumor nekrotizujícího faktoru alfa (TNFα). Pětina pacientů současně užívala GK. U nemocných s vysokými koncentracemi biologika bylo pozorováno celkem 229 infekcí, u nízkých hodnot jen 63 případů. I po adjustaci na věk, pohlaví, užívání metotrexátu a skóre aktivity měli pacienti s vyššími koncentracemi biologika celkový výskyt infekcí o 51 % vyšší. Počet závažných infekcí (nutnost léčby antibiotiky, nutnost hospitalizace, úmrtí) však byl v obou skupinách podobný, stejně tak spektrum infekcí. Nejčastěji se jednalo o infekce dolních cest dýchacích, horních cest dýchacích, uroinfekce a kožní infekce. Autoři uzavírají, že pacienti s RA s vysokými sérovými koncentracemi biologika mají signifikantně vyšší riziko výskytu infekcí v porovnání s pacienty s normálními nebo nízkými hodnotami příslušného léku, a proto by dle jejich názoru měl lékař po dosažení setrvalé remise zvážit redukci biologika, ev. zkontrolovat koncentraci léku.
Glukokortikoidy, biologická léčba
a infekční komplikace po implantaci kloubních náhrad
u nemocných s RA
Doktor Michael D. George z Filadelfie (USA) se věnoval intenzivně diskutované problematice infekčních komplikací u pacientů s RA po implantaci kloubních náhrad. Předložil retrospektivní analýzu dat souboru 11 021 nemocných s RA, kteří byli před operací léčeni biologickou terapií. Z nich 43 % bylo současně léčeno GK. Infekční komplikace byly u jednotlivých léků přibližně stejně časté (6,6‒8,5 %), rehospitalizace byla nutná u 4,8‒6,8 % pacientů. Rozvoj periprotetických infekcí byl podobný s výjimkou tocilizumabu, u nějž byl zaznamenán trojnásobný výskyt. Ve druhé analýze rizika vzniku infekcí v závislosti na souběžné terapii GK bylo zjištěno zvýšené riziko stoupající s dávkou GK. U skupiny pacientů s dávkou větší než 10 mg prednizonu denně byl tedy počet infekčních komplikací při srovnání s pacienty bez GK dvojnásobný a riziko rehospitalizace vzrostlo u této skupiny o 50 %. Ze sledování autoři vyvozují, že nejvyšší riziko vzniku infekčních komplikací po implantaci kloubních náhrad představují GK v dávce vyšší než 10 mg prednizonu (nebo ekvivalentu).
Inhibitory TNFα v kombinaci
s nesteroidními antirevmatiky efektivně brzdí rentgenovou
progresi u AS
Doktorka Lianne S. Gensler ze San Franciska (USA) významně přispěla se svými kolegy do diskuse k problematice zpomalení rentgenové progrese u ankylozující spondylitidy (AS) při biologické léčbě. Autoři zhodnotili v retrospektivní analýze rentgenovou progresi u skupiny 519 pacientů s AS po dobu čtyř let pomocí skóre mSASSS (modified Stoke Ankylosing Spondylitis Spine Score). Rentgenové snímky byly prováděny každých šest měsíců. Podobně jako v jiných pracích autoři po dvou ani po čtyřech letech nepozorovali u nemocných léčených inhibitory TNFα při srovnání s kontrolami bez biologické léčby žádný rozdíl ve smyslu zpomalení rentgenové progrese. Nicméně souběžná terapie nesteroidními antirevmatiky (NSA) již k signifikantnímu zpomalení rentgenové progrese vedla. Po dvou letech bylo skóre mSASSS u pacientů léčených nízkými dávkami NSA nižší o 1,25 a při léčbě vysokými dávkami dokonce o 3,31 oproti pacientům bez NSA. Nejvýraznější byl efekt celekoxibu (rozdíl 3,98). Po čtyřech letech byly rozdíly ještě výraznější, přičemž nejvyšší rozdíl skóre mSASSS byl shledán u kombinace inhibitorů TNFα s celekoxibem (4,69) a byl statisticky signifikantní. Autoři vyvozují, že účinek této kombinace není aditivní, ale synergický, s ohledem na skutečnost, že žádný z léků v monoterapii k efektivnímu zpomalení rentgenové progrese nevedl. Dalším zajímavým zjištěním je, že efekt různých NSA v této indikaci evidentně není srovnatelný a jistě vyžaduje další zkoumání včetně prospektivních, randomizovaných studií s různými NSA a jejich odlišnými dávkami.
Vliv přerušení terapie bisfosfonáty
na riziko fraktur
Doktor Kenneth G. Saag z amerického Birminghamu přinesl zajímavý příspěvek stran dopadu přerušení terapie bisfosfonáty na riziko vzniku patologických fraktur. Terapie bisfosfonáty je v klinické praxi po několika letech často přerušována z bezpečnostních důvodů, resp. z obavy před nežádoucími účinky dlouhodobé kontinuální terapie, jako jsou atypické fraktury nebo osteonekróza čelisti. Autoři zpracovali v rozsáhlé analýze data celkem 153 236 žen léčených bisfosfonáty po dobu nejméně tří let s alespoň 80% adherencí k terapii; ženy s jiným typem léčby (denosumab, hormonální substituční terapie) byly vyloučeny. Jednalo se o populaci starších žen s průměrným věkem 79 let a mediánem doby léčení bisfosfonáty 5,5 roku. Celkem 40 % pacientek přerušilo léčbu na nejméně šest měsíců a z nich pouze 13 % s terapií znovu začalo. U žen s přerušením na 1‒2 roky bylo riziko fraktury krčku stehenní kosti zvýšeno o 20 % oproti ženám bez přerušení léčby; u žen, které přerušily léčbu na 2‒3 roky, bylo toto riziko dokonce o 40 % vyšší, avšak bylo srovnatelné s pacientkami, které přerušily terapii bisfosfonáty na tři roky a více. U podskupiny žen s prevalentní frakturou zapříčiněnou osteoporózou vedlo přerušení terapie na více než dva roky k dvojnásobnému zvýšení rizika vzniku fraktury.
Léčba inhibitory kontrolních bodů
a revmatická onemocnění
Velmi zajímavé poznatky o vlivu léčby inhibitory kontrolních bodů na autoimunitní onemocnění prezentovala Alice Tison z Brestu (Francie). Autoři se zaměřili na skupinu pacientů s preexistujícím autoimunitním onemocněním, u nichž byla indikována protinádorová léčba inhibitory kontrolních bodů. Sledovali celkem 112 pacientů s různými autoimunitními chorobami (psoriatická artritida, RA, spondyloartritidy, idiopatické střevní záněty). Před zahájením léčby mělo pouze 33 % osob aktivní onemocnění na počátku a jen 21 % užívalo imunosupresivní terapii (nejčastěji GK a metotrexát). Léčba inhibitory kontrolních bodů vedla k exacerbaci autoimunitního onemocnění u 42 % pacientů, přičemž u třetiny případů se jednalo o vzplanutí klinicky závažné. Zajímavé je zjištění, že přítomnost samotného autoimunitního onemocnění neovlivňovala účinnost protinádorové terapie ‒ odpověď na léčbu byla srovnatelná u pacientů s preexistujícím autoimunitním onemocněním a bez něj a dosahovala 48 % u melanomu a 54 % u nemalobuněčného karcinomu plic. Ještě zajímavější je pozorování, že nemocní s exacerbací autoimunitního onemocnění nebo s imunitně navozenými nežádoucími účinky měli lepší odpověď na terapii i signifikantně lepší prognózu – delší čas do progrese nádorového onemocnění i dobu celkového přežití. Pokud ovšem byli nemocní s exacerbací léčeni imunosupresivy, tento pozitivní efekt terapie se vytratil. Autoři ve své práci potvrzují, že protinádorová terapie inhibitory kontrolních bodů představuje riziko vzniku exacerbace preexistujícího autoimunitního onemocnění a toto vzplanutí překvapivě zlepšuje průběh nádorového onemocnění. Imunosupresivní terapie však uvedený prospěch eliminuje. Vyvození závěrů je dle autorů prozatím předčasné a sami zatím žádný jednoznačný postup nedoporučují. Avšak naznačují, že opatrné snížení nebo ukončení imunosupresivní léčby u inaktivních nemocných před zahájením terapie inhibitory kontrolních bodů může mít své racionální opodstatnění. Autoři dále míní, že odpověď na tento typ protinádorové terapie je u nemocných s preexistujícím autoimunitním onemocněním velmi dobrá a samotné autoimunitní onemocnění by tedy nemělo představovat její kontraindikaci. Nemocní s autoimunitními chorobami by proto neměli být z léčby inhibitory kontrolních bodů předem vylučováni.