Aktualizace doporučení ASAS-EULAR pro léčbu axiální spondyloartritidy
Souhrn
Hušáková M. Aktualizace doporučení ASAS-EULAR pro léčbu axiální spondyloartritidy. Remedia 2023; 33: 10–20.
Axiální spondyloartritida (axSpA) je chronické zánětlivé onemocnění. Zánětlivé změny axiálního a periferního pohybového systému a možné extramuskuloskeletální manifestace vedou k utrpení z bolesti, horším funkčním schopnostem, omezené mobilitě a práceschopnosti, což má za následek sníženou kvalitu života. V současné době lze však toto onemocnění léčit a docílit remise. K tomu jsou k dispozici léčebné metody jak nefarmakologické, tak stále se rozvíjející portfolio farmakologických přípravků. Skupina ASAS-EULAR vydala v roce 2022 update doporučení, jak přistupovat k nemocnému s axSpA ve světle nových léčebných možností. Do terapie tak přichází individualizace přístupu k nemocnému – a to na podkladě jak základního projevu axSpA (dominujícího axiálního nebo periferního postižení), přítomnosti extramuskuloskeletálních manifestací, tak i přítomnosti komorbidit. Doporučení ASAS-EULAR 2022 upravují v terapii axSpA aplikaci chorobu modifikujících léčiv – biologických (inhibitorů tumor nekrotizujícího faktoru a interleukinu 17) i cílených syntetických (inhibitorů Janus kináz).
Klíčová slova: axiální spondyloartritida – doporučení ASAS-EULAR – individualizace léčby – extramuskuloskeletální manifestace – DMARD.
Summary
Husakova M. ASAS‑EULAR recommendations for the treatment of axial spondylarthritis: an update. Remedia 2023; 33: 10–20.
Axial spondylarthritis (axSpA) is a chronic inflammatory disease. Inflammatory changes of the axial and peripheral musculoskeletal system and possible extra‑musculoskeletal manifestations may cause debilitating pain, functional disability, limited mobility, and missed days at work, i.e. may diminish the quality of life. Currently, this disease can be treated and remission achieved, using both non‑pharmacological and ever widening portfolio of pharmacological approaches. In 2022, ASAS‑EULAR issued an update concerning the recommendations for the treatment of axSpA, respecting the new treatment possibilities. Tailored therapy thus enters our approach to the patient, based on the main axSpA symptoms (dominantly axial versus peripheral), presence of extra‑musculoskeletal manifestations, and comorbidities. ASAS‑EULAR 2022 recommendations adjust the axSpA therapy with respect to disease‑modifying drugs and both biological (inhibitors of tumor‑necrosis factor and interleukin 17) and targeted synthetic agents (Janus kinase inhibitors).
Key words: axial spondylarthritis – ASAS‑EULAR recommendations – tailored therapy – extra‑musculoskeletal manifestations – DMARD.
Úvod
Axiální spondyloartritida (axSpA) je chronické zánětlivé onemocnění, které se manifestuje především postižením axiálního pohybového systému, jako je zánět křížokyčelních kloubů (sakroiliakální klouby, SIK) nebo páteře, který může progredovat do strukturálních změn [1]. Vedle axiálního postižení nebývá neobvyklá zánětlivá afekce periferního skeletu s klinickým obrazem artritidy, entezitidy nebo daktylitidy anebo postižení mimo pohybový systém, které souborně nazýváme extramuskuloskeletálními manifestacemi (extra‑musculoskeletal manifestations, EMMs). EMMs se mohou vyvinout před diagnózou, v době diagnózy i v průběhu onemocnění a spočívají v zánětlivém postižení gastrointestinálního traktu pod obrazem idiopatických střevních zánětů (ulcerózní kolitidy nebo Crohnovy nemoci) u 5-10 % nemocných, v postižení kůže - psoriázy - u přibližně 10 %, a/nebo v nejčastější EMM, akutní přední uveitidě, která je spjata s HLA‑B27 pozitivitou a objevuje se zhruba u 25 % nemocných [1,2]. Axiální spondyloartritida zahrnuje dva obrazy. Skupina s rozvinutým strukturálním postižením, radiografickou sakroiliitidou, nazývaná radiografická axSpA (r‑axSpA), odpovídá současně definici modifikovaných newyorských kritérií pro ankylozující spondylitidu (AS) [3]. U obrazu nemoci bez radiograficky detekovatelných strukturálních změn na SIK, avšak s přítomností projevů spondyloartritidy a suspekcí na onemocnění, lze zánětlivou afekci SIK detekovat pomocí zobrazení magnetickou rezonancí (MRI) [4]. Tato skupina je dle klasifikace ASAS (Assessment of Spondyloarthritis international Society) označována jako neradiografická (nr‑axSpA) [5,6]. Skupina nr‑axSpA reprezentuje časnou fázi onemocnění a někteří z pacientů mohou dále progredovat do r‑axSpA. Současné znalosti ukazují, že obě skupiny jsou obdobné, co se týká klinického průběhu, tíže onemocnění, přítomnosti komorbidit a odpovědi na léčbu včetně terapie pomocí biologických chorobu modifikujících antirevmatických léků (biologic disease‑modifying antirheumatic drugs, bDMARDs) [7-9].
Aktualizace doporučení pro léčbu axSpA z roku 2022 (dále Doporučení 2022) skupinou ASAS-EULAR (European Alliance of Associations for Rheumatology) určuje jednotný komplexní léčebný přístup pro obě skupiny axSpA. Pro správné vytvoření Doporučení 2022 byl systematizován přehled vědeckých prací tematicky zaměřených na farmakologickou léčbu biologickými přípravky a na léčbu pomocí nefarmakologických modalit nebo farmakologických nebiologických přípravků u axSpA [10]. Nejmarkantnější rozdíl oproti starším doporučením z roku 2016 [11], z nichž nová Doporučení 2022 vycházejí, spočívá v charakteru stratifikace přístupu k léčbě na úvodní fázi, farmakologickou první a druhou volbu a využití nových farmakologických léčebných přípravků včetně jejich aplikace pro jednotlivé EMMs. V nových doporučeních nalezneme i úpravu hodnocení aktivity onemocnění a reflexi komorbidit, které se mohou na léčebné odpovědi podílet.
Doporučení ASAS-EULAR 2022 pro axSpA – nadřazené principy
Pět zásad má u nemocných s axSpA zastřešovat veškeré léčebné intervence, které budeme využívat ke zmírnění dopadů onemocnění a k dosažení remise onemocnění (tab. 1). Tyto zásady byly představeny již v doporučeních pro léčbu axSpA z roku 2016 [11]. Při vytváření recentních doporučení byla tato doporučení diskutována a vzhledem ke své aktuálnosti ponechána během hlasování beze změn. V tabulce 1 jsou tyto zásady uvedeny a v Doporučeních 2022 jsou řazeny pod písmeny. Je nutné si uvědomit, že ani jeden z těchto nadřazených principů nepřevyšuje ostatní, a je nutné dbát na každý z nich při rozhodování o léčbě nemocného. 
První zásada klade důraz na závažnost onemocnění a variabilitu klinických projevů včetně EMMs, které mohou negativně ovlivňovat život nemocných s axSpA. Mezioborová spolupráce ke zvládnutí onemocnění je nezbytná – revmatolog je však tím specialistou, který má celou péči o pacienta koordinovat.
Další zásada určuje cíl léčby nemocného s axSpA, a sice dosáhnout co nejlepší kvality života související se zdravím. Cestou k tomu je intervenovat ke snížení aktivity onemocnění, strukturálního poškození a ke zlepšení funkčních schopností nemocných – neboť tyto oblasti se u pacientů s axSpA nejvíce podílejí na výsledcích hodnocení vlastního zdraví [12,13]. Vzhledem k tomu, že je axSpA zánětlivé onemocnění a k dispozici je řada možností protizánětlivé terapie, má kontrola zánětu zaujímat přední místo v terapii axSpA. Redukce zánětu má dopad na snížení aktivity onemocnění, která je spjata se strukturálním poškozením a zhoršenou funkcí [14-16].
Třetí zásada spočívá v nezbytnosti kombinací metod nefarmakologické léčby a farmakologických možností pro optimální terapii.
Další zásadou v léčbě nemocných s axSpA je poskytnutí co nejlepší péče, přičemž rozhodnutí o léčbě má být založeno na společné dohodě mezi nemocným a revmatologem. Takový konsenzus má být podložen nejlepšími dostupnými vědeckými důkazy, zkušeností zdravotníka a preferencí pacienta.
Poslední zásada poukazuje na vysoké individuální, medicínské i sociální náklady, které by měly být zohledňovány při vedení terapie. Pro každého pacienta s axSpA znamená onemocnění utrpení a zátěž s nepříznivými dopady na produktivitu práce, a následně ekonomickou zátěž pro nemocného i členy jeho rodiny [17]. Sociální náklady spočívající ve zhoršené produktivitě práce a v pracovní neschopnosti, nákladech na nemocenské dávky a v nákladech na zdravotní péči vedou k ekonomické zátěži společnosti. Vedle sociálních nákladů se na ekonomické zátěži podílí i cena moderních léků [18]. Efektivní alokace omezených zdrojů umožní léčbu více pacientů. Revmatolog musí vždy dbát na zavedení co nejlepší péče (předchozí zásada) a úvahy o nákladech nemohou převážit nad nejlepší péčí. Nicméně při zvažování terapie by měly být využity oba dva principy (D a E). Pro klinickou praxi to znamená, že pokud je třeba učinit volbu mezi dvěma léky se srovnatelnou účinností a bezpečností, je doporučeno preferovat ten s nižšími náklady.
Doporučení ASAS-EULAR 2022 pro léčbu pacientů s axSpA – jednotlivá doporučení
V současné době ASAS-EULAR předkládá celkem 15 doporučení (tab. 2). Osm zůstává identických s doporučeními z roku 2016 (doporučení číslo 2, 3, 6, 7, 8, 13, 14 a 15), tři jsou s menšími úpravami (doporučení číslo 1, 4 a 5), dvě jsou významně změněna (9 a 12) a dvě doporučení jsou zcela nová (doporučení číslo 10 a 11). Každé doporučení obsahuje i vysvětlení daného postupu.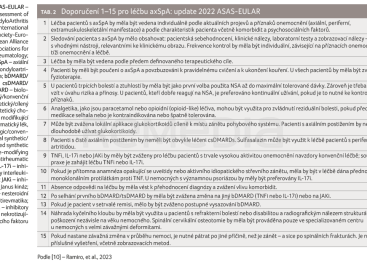
V recentních doporučeních byl zaveden algoritmus léčby nemocných s axSpA - léčbu axSpA lze rozdělit do tří fází (obr. 1). V první fázi je podstatné správné stanovení diagnózy a poté zavedené léčby, a to jak nefarmakologické, tak farmakologické – v první volbě nesteroidními antirevmatiky (NSA). Pokud je tato léčebná intervence nedostatečná, přecházíme do fáze II, kde postupujeme podle klinických manifestací onemocnění a dostáváme k dispozici účinné bDMARDs nebo cílené syntetické DMARDs (targeted synthetic DMARDs, tsDMARDs). Pokud ani tato fáze nevede ke kýženému úspěchu – dosažení remise nebo nízké aktivity onemocnění -, přecházíme do fáze III.
Doporučení 1: Léčba pacientů s axSpA by měla být vedena individuálně podle aktuálních projevů a příznaků onemocnění (axiální, periferní, extramuskuloskeletální manifestace) a podle charakteristik pacienta včetně komorbidit a psychosociálních faktorů.
Prvním krokem k zahájení jakékoliv léčebné intervence je stanovení diagnózy (obr. 1). Diagnóza axSpA by měla být klinická, založená na klinickém obraze a výsledcích zobrazovacích a laboratorních metod a diagnózu má vždy stanovit, eventuálně potvrdit revmatolog. V této fázi není pro běžnou klinickou praxi nutné charakterizovat pacienta pomocí kritérií ASAS, neboť detailní určení skupiny r‑axSpA a nr‑axSpA je nezbytné zejména pro jednolitost klinických studií.
Axiální spondyloartritida se může manifestovat pod různými obrazy – značná heterogenita onemocnění proto vyžaduje individuální přístup k léčbě, jejíž nedílnou komponentou je sdílené rozhodnutí lékaře s pacientem o vedení léčby. Revmatolog musí reflektovat přítomnost a závažnost rozdílných manifestací spondyloartritidy – axiální, periferní a EMMs. Malou úpravu v doporučení číslo 1 představuje nomenklatura EMMs (namísto původních extraartikulárních manifestací) - do EMMs spadá uveitida, psoriáza a/nebo idiopatické střevní záněty.![OBR. 1 Algoritmus léčby nemocných s axSpA; podle [10] – Ramiro, et al., 2023. ASDAS – Ankylosing Spondylitis Disease Activity Score; axSpA – axiální spondyloartritida; bDMARD OBR. 1 Algoritmus léčby nemocných s axSpA; podle [10] – Ramiro, et al., 2023. ASDAS – Ankylosing Spondylitis Disease Activity Score; axSpA – axiální spondyloartritida; bDMARD](https://www.remedia.cz/1-23-13-photo-pg-986-367-481-.png)
Doporučení 2: Sledování pacienta s axSpA by mělo obsahovat: pacientská sebehodnocení, klinické nálezy, laboratorní testy a zobrazovací nálezy – vše s vhodnými nástroji, relevantními ke klinickému obrazu. Frekvence kontrol by měla být individuální, závisející na příznacích onemocnění, tíži onemocnění a léčbě.
Monitorování onemocnění by mělo reflektovat klinické manifestace a aktivitu axSpA. Určení aktivity onemocnění je základním parametrem sledování onemocnění. Současná doporučení preferují index ASDAS (Ankylosing Spondylitis Disease Activity Score) s využitím jak subjektivních parametrů, tak objektivního markeru zánětu (C‑reaktivního proteinu, CRP) před dříve běžně využívaným, ryze subjektivním BASDAI (Bath Ankylosing Spondylitis Disease Activity Index) [19]. ASDAS je na rozdíl od samotného BASDAI spojen s formací syndesmofytů v longitudinálních studiích [14,20]. U ASDAS lze rovněž využívat cut‑off pro definování aktivity onemocnění a hodnocení léčebné odpovědi dle ASAS [21,22].
K dalším parametrům, které by měly být používány k monitoraci onemocnění, patří subjektivní hodnocení bolesti, únavy, ranní ztuhlosti, funkčních schopností (dle BASFI, Bath Ankylosing Spondylitis Functional Index) a dále hodnocení počtu oteklých kloubů, spinální mobility a přítomnosti/aktivity EMMs. Tato hodnocení by měla být provedena v úvodu onemocnění a dále alespoň jednou ročně [23]. V doporučeních figuruje i možnost využití nového indexu – ASAS HI (ASAS Health Index) [24], který není prozatím validován do češtiny a není závazný k hodnocení léčebné odpovědi v běžné klinické praxi.
Vedle klinických parametrů, dotazníků hodnocených pacienty a vedle indexu ASDAS lze k hodnocení aktivity využít i zobrazovací metody. MRI SIK a páteře může ukázat na probíhající zánět axiálního pohybového systému. Avšak úzký vzájemný vztah mezi klinickou aktivitou onemocnění a zánětlivými změnami na MRI sik a páteře byl zjištěn jen u mužů v longitudinální studii v kohortě DESIR [25,26]. Vzhledem k nákladům, které jsou spojeny s MRI, by měla být využita tato možnost ve sporných případech a v případech, kdy by aktivní zánětlivý proces vedl ke změně terapeutického rozhodnutí. Strukturální postižení pomocí radiografického zobrazení neukazuje aktivitu onemocnění, ale má jistou prognostickou hodnotu. Přítomnost syndesmofytů je spojena se zvýšeným rizikem progrese nebo s objevením se nových syndesmofytů [14,15,27,28]. Vzhledem k pomalé progresi má být radiografické zobrazení prováděno s minimálně dvouletým odstupem [27,29].
Doporučení 3: Léčba by měla být vedena podle předem definovaného terapeutického cíle.
Léčba k předem definovanému cíli je velmi dobře využita u revmatoidní artritidy. U axSpA byl představen treat‑to‑target (T2T) koncept s cílem dosáhnout remise nebo nízké aktivity onemocnění. Vzhledem ke vztahu ASDAS k progresi onemocnění se zdá být smysluplné dosažení tohoto cíle v léčbě axSpA. Studie TICOSPA, prozatím jediná klinická studie sledující účinnost T2T postupu (kontroly každé čtyři týdny) oproti běžné péči (kontroly každých 12 týdnů), nedosáhla svého primárního cíle, jímž bylo zlepšení ASAS HI alespoň o 30 % [30]. Řady sekundárních cílů v týdnu 48 však bylo dosaženo a pacienti v T2T rameni studie dosáhli častěji odpovědi ASAS40, ASAS20 i BASDAI50 při současné bezpečnosti léčby [30]. Proto doporučení 3 zdůrazňuje, že léčba k cíli by měla být brána jako vodítko, a to zejména v případech, pokud jsou lékař i pacient přesvědčeni o přítomnosti reziduální zánětlivé aktivity.
Doporučení 4: Pacienti by měli být poučeni o axSpA a povzbuzováni k pravidelnému cvičení a k ukončení kouření. U všech pacientů by měla být zvážena fyzioterapie.
Doporučení 4 se týká nefarmakologické léčby. Všichni pacienti by měli být poučeni o svém onemocnění, aby se stali aktivním partnerem při vedení terapie. Poučení by mělo obsahovat informace o nemoci, projevech a jejich rozpoznání, průběhu onemocnění, možnostech terapie a prognóze.
Pohybová léčba je základním pilířem léčby axSpA. Pohybová léčba – zejména supervidovaná skupinová fyzioterapie - je účinnější než domácí cvičení [31]. Existuje řada metodik fyzioterapie a rovněž studie jsou heterogenní – nelze tedy jednoznačně podpořit jednu z metodik. Individuální vedení fyzioterapie by mělo být zváženo zejména u těch nemocných, kteří doma necvičí. Do termínu fyzioterapie by však neměly být přidávány nedostatečně testované metody a intervence komplementární nebo alternativní medicíny.
Poslední, ale podstatnou nefarmakologickou intervencí je edukace o nutnosti ukončení kouření. U kuřáků bylo zjištěno vyšší riziko zánětlivých změn páteře a progrese onemocnění [32-34]. Ačkoliv prozatím nebyla provedena studie hodnotící prospěch ukončení kouření u nemocných s axSpA, je vzhledem ke zdravotním rizikům nutné jeho ukončení doporučit.
Doporučení 5: U pacientů trpících bolestí a ztuhlostí by měla být jako první volba použita NSA až do maximální tolerované dávky. Zároveň je třeba vzít v úvahu rizika a přínosy. U pacientů, kteří dobře reagují na NSA, je kontinuální užívání vhodné pro zvládnutí příznaků.
Nesteroidní antirevmatika patří k první volbě farmakologické léčby axSpA (obr. 1). Svým protizánětlivým účinkem mohou být dostatečná ke zvládnutí aktivity a projevů onemocnění [35]. Kontinuální používání NSA by mělo být omezeno na dobu nutnou ke zvládnutí příznaků. Vzhledem k nežádoucím účinkům NSA by měla být dána přednost léčbě NSA na vyžádání, kdykoliv není nutné kontinuální dávkování. V literatuře existují protichůdné důkazy o vlivu NSA na zmírnění radiografické progrese [36-38]. Proto by mělo být rozhodnutí o kontinuálním podávání NSA založeno výlučně na zvládnutí aktivity onemocnění, a ne na možném, dostatečně neprokázaném vlivu na strukturální progresi.
Doporučení 6: Analgetika, jako jsou paracetamol nebo opioidní (opioid‑like) léčiva, mohou být využita pro zvládnutí reziduální bolesti, pokud předchozí medikace selhala nebo je kontraindikována nebo špatně tolerována.
Toto doporučení zůstává shodné s doporučením z roku 2016, neboť nejsou k dispozici nová data z klinických studií o užívání analgetik v léčbě axSpA. Dlouhodobé užívání analgetik není však doporučováno vzhledem k rizikům. Analgetika by měla být využita pouze u reziduální bolesti. Postupy pro léčbu bolesti u zánětlivých artropatií, včetně nefarmakologických postupů, jsou rozepsány v doporučeních EULAR z roku 2018 [39].
Doporučení 7: Může být zvážena lokální aplikace glukokortikoidů cíleně k místu zánětu pohybového systému. Pacienti s axiálním postižením by neměli dlouhodobě užívat glukokortikoidy.
Lokální aplikace glukokortikoidů k místu zánětu periferního pohybového systému, artritidy nebo entezitidy, je dle zkušeností u nemocných s axSpA účinná. Proto je lokální injekce glukokortikoidů doporučována, i když chybí evidence klinických studií (obr. 1). Dvě studie z konce 90. let minulého století ukazují pozitivní vliv lokální aplikace glukokortikoidů k SIK zejména na intenzitu bolesti [40,41]. Jejich problémem je metodika a malý počet pacientů, což může zkreslovat výsledky. Účinnost tohoto postupu (nejlépe lokální aplikace pod ultrasonografickou nebo radiografickou kontrolou) vyžaduje potvrzení ve studiích a lokální aplikace glukokortikoidů k SIK není vzhledem k nedostatečným datům jednoznačně doporučována.
U čistě axiálního postižení existují dvě studie s krátkodobým použitím systémových glukokortikoidů. Starší práce z roku 2014 ukazuje zlepšení BASDAI u skupiny s 50 mg prednisolonu denně oproti placebu [42] a rovněž ve studii COBRA‑AS bylo dosaženo primárního cíle BASDAI50 v týdnu 24 po přechodném podávání vyšších dávek prednisolonu u nemocných s čistě axiálním postižením [43]. Problémem obou studií je malý počet pacientů a prozatím nejsou k dispozici další data, která by tyto výsledky potvrzovala. Vzhledem k nežádoucím účinkům glukokortikoidů a chybějícím datům o účinnosti a bezpečnosti při dlouhodobém podávání není systémové podávání glukokortikoidů v léčbě čistě axiálního postižení axSpA doporučováno.
Doporučení 8: Pacienti s čistě axiálním postižením by neměli být obvykle léčeni konvenčními syntetickými DMARDs (conventional synthetic DMARDs, csDMARDs). Sulfasalazin může být využit k léčbě pacientů s periferní artritidou.
Při přípravě doporučení nebyly k dispozici nové studie, které by ukazovaly na účinnost a bezpečnost podávání csDMARDs u čistě axiálního postižení axSpA [10]. Starší práce ukazují neúčinnost sulfasalazinu, metotrexátu (MTX) i leflunomidu [44-46]. Nicméně starší studie nejsou metodicky jednotné. Nyní panuje shoda, že po selhání NSA u čistě axiálního postižení má přijít na řadu léčba bDMARDs nebo tsDMARDs – obě tyto možnosti jsou však ekonomicky náročné a nemusejí být vždy dostupné. Proto k vysvětlení tohoto doporučení patří i komentář, že csDMARDs nemají být za normálních okolností využity, ale může existovat výjimečná situace, kdy využity být mohou. Takováto výjimečná situace musí však vždy splňovat zásadu nejlepší možné léčby a sdíleného rozhodnutí o terapii mezi lékařem a pacientem.
U nemocných s axSpA a periferní artritidou (obr. 1) je léčba sulfasalazinem indikována, neboť je podpořena daty z Cochranovy databáze [44]. Léčba MTX však jako efektivní není zhodnocena u periferního postižení obdobně jako u axiálního postižení [45,46].
Doporučení 9: Inhibitory tumor nekrotizujícího faktoru (TNFi), interleukinu 17A (IL‑17Ai) nebo inhibitory Janus kináz (JAKi) by měly být navrženy do terapie pacientů s trvale vysokou aktivitou onemocnění navzdory konvenční léčbě; současná praxe je zahájit léčbu TNFi nebo IL‑17Ai.
Toto doporučení je výrazně změněno oproti roku 2016. Po selhání první volby farmakoterapie pomocí NSA, ev. sulfasalazinu se dostáváme do další fáze léčby axSpA (obr. 1, fáze II). U pacientů axSpA s vysokou aktivitou onemocnění by měla být zahájena léčba bDMARDs (TNFi nebo IL‑17Ai), při jejich selhání pak JAKi.
Obrázek 2 ukazuje kroky, jak by mělo probíhat zhodnocení, zda nemocný bude mít ze zavedení bDMARDs nebo tsDMARDs prospěch. Prvním krokem je správná diagnóza axSpA stanovená revmatologem. Po ní následují aspekty, které predikují dobrou léčebnou odpověď a mohou být vyžadovány od regulačních autorit (např. plátce zdravotní péče v naší republice). Nejsilnějším prediktorem odpovědi na léčbu TNFi je elevace CRP [47-49]. Druhým aspektem, který dobře predikuje léčebnou odpověď na TNFi, je přítomnost zánětlivých změn na MRI SIK [49–52]. Obojí – elevace CRP i zánětlivá afekce SIK - však musí souviset s axSpA a musejí být vyloučeny jiné příčiny. Posledním kritériem je přítomnost strukturálních změn SIK (odpovídající sakroiliitidě dle modifikovaných newyorských kritérií pro AS); tyto změny sice samy nepredikují léčebnou odpověď, ale jsou uvedeny z důvodu regulačního schválení léčby. Vzhledem k současným znalostem je doporučeno při rozhodování o eskalaci terapie dbát na elevaci CRP nebo přítomnost zánětlivých změn SIK bez ohledu na radiografický nález SIK [49-52].
Dalším krokem k hodnocení způsobilosti k zahájení léčby bDMARDs a tsDMARDs je určení, zda selhala dosavadní terapie. Jsou tím míněny nefarmakologické intervence u všech nemocných; u pacientů s čistě axiální axSpA pak selhání první volby (NSA v maximální tolerované dávce po dobu čtyř týdnů) [53] a u axSpA s periferním postižením i neúčinnost nebo netolerance sulfasalazinu (obr. 2).![OBR. 2 Zhodnocení způsobilosti k zahájení léčby bDMARD/ tsDMARD; podle [10] – Ramiro, et al., 2023. OBR. 2 Zhodnocení způsobilosti k zahájení léčby bDMARD/ tsDMARD; podle [10] – Ramiro, et al., 2023.](https://www.remedia.cz/1-23-14-photo-pg-987-418-639-.png)
Poslední dva kroky spočívají v hodnocení přetrvávající vysoké aktivity onemocnění, odpovídající ASDAS ≥ 2,1, a v pozitivním názoru revmatologa. Nicméně i zde by mělo dojít ke vzájemnému sdílenému rozhodnutí lékaře s pacientem. V dřívějších doporučeních byly pro hodnocení aktivity onemocnění akceptovány indexy BASDAI i ASDAS. V recentních doporučeních je z důvodů diskutovaných v doporučení 2 využit pouze index ASDAS.
Ve fázi II léčby axSpA jsou tedy k dispozici TNFi, IL‑17Ai a JAKi – u těchto léčiv byla prokázána účinnost a bezpečnost v klinických studiích [10,54]. Vzhledem k tomu, že nejsou k dispozici head‑to‑head studie, nelze určit, které z léčiv upřednostnit z hlediska účinnosti. U TNFi jsou k dispozici vedle originálních také biosimilární přípravky. Lze využít obojí možnost a při rozhodování, zda zvolit TNFi, biosimilární TNFi, nebo IL‑17Ai, by měl být brán v potaz nadřazený princip E.
Druhá část doporučení udává, že léčba by měla začínat TNFi nebo IL‑17Ai – toto doporučení je dáno delší dobou zkušeností s těmito léčivy, včetně jejich použití u multimorbidních nemocných. Recentní doporučení u IL‑17Ai se týkají pouze IL‑17Ai. Studie s duální inhibicí IL‑17A a IL‑17F pomocí bimekizumabu z fáze II byla zveřejněna s pozitivními daty [55], k závaznému doporučení je však nutno zajistit více informací ohledně bezpečnosti a účinnosti.
Data randomizovaných kontrolovaných studií pro JAKi byla k dispozici v době vytváření doporučení (1/2022) pouze pro r‑axSpA. Rovněž prozatím nejsou dostatečná data z observačních studií s JAKi a s jejich používáním v denní praxi. Proto jsou JAKi prozatím uvedeny jako další možnost v léčbě axSpA až po selhání TNFi a IL‑17Ai. Recentní informace ukazují na možné zvýšené riziko vzniku závažných kardiovaskulárních komplikací a malignit při porovnání s TNFi u skupiny nemocných s revmatoidní artritidou [56]. Tito pacienti byli starší 50 let a měli minimálně jeden rizikový faktor pro kardiovaskulární onemocnění a riziko bylo zvýšeno u nemocných starších 65 let [56]. Během vývoje byl zjištěn možný vztah mezi koncentracemi sérových lipidů a léčivem ze skupiny JAKi (tofacitinibem) [57,58]. U axSpA nejsou prozatím signály ohledně těchto rizik [10,59-61]. K možnému vysvětlení této diskrepance patří mladší věk nemocných s axSpA a profil jejich možných rizikových faktorů (méně komorbidit, nižší expozice glukokortikoidům), ale i kratší follow‑up. Prozatím tedy není jasné, zda se jedná o komplikace JAKi u revmatoidní artritidy nebo u části nemocných s revmatoidní artritidou, nebo o komplikace celé třídy JAKi. Dokud nebude k dispozici více bezpečnostních dat, je nutné léčbu JAKi u nemocných s axSpA starších 50 let s přítomností alespoň jednoho kardiovaskulárního rizikového faktoru nebo u nemocných starších 65 let přehodnotit.
Poslední poznámkou k doporučení 9 je hodnocení účinnosti terapie a jejího pokračování. Hodnocení by mělo nastat ve 12. týdnu aplikace TNFi nebo IL‑17Ai nebo JAKi. Pokud dojde ke snížení ASDAS ≥ 1,1 a současně revmatolog pozitivně hodnotí efekt léčby, je doporučeno pokračovat [21].
Doporučení 10: Pokud je přítomna anamnéza opakující se uveitidy nebo aktivního idiopatického střevního zánětu, měla by být v léčbě dána přednost monoklonálním protilátkám proti TNF. U nemocných s významnou psoriázou by měly být preferovány IL‑17Ai.
Toto je nové doporučení, které stratifikuje léčbu podle EMMs. U nemocných, kteří již prodělali uveitidu, jsou TNFi (infliximab, adalimumab, certolizumab pegol, golimumab) účinné v prevenci recidivy, u etanerceptu jsou k dispozici rozporuplné výsledky [62–66]. Data z registrů rovněž ukazují na skutečnost, že monoklonální protilátky mohou být efektivnější v prevenci flare uveitidy než etanercept nebo secukinumab [66,67]. U nemocných se současným aktivním idiopatickým střevním zánětem jsou kontraindikovány IL‑17Ai. Ačkoliv monoklonální protilátky (TNFi) jsou účinné rovněž při léčbě idiopatických střevních zánětů, etanercept se secukinumabem selhávají [68-72].
Vyšší účinnost IL‑17Ai (secukinumabu a ixekizumabu) než TNFi (adalimumab) na kožní symptomatologii byla prokázána ve dvou head‑to‑head studiích u nemocných s psoriázou [73,74]. Ačkoliv nejsou k dispozici přímá komparativní data u axSpA, lze z těchto studií čerpat a léčiva ze skupiny IL‑17Ai by měla být preferována u pacientů s axSpA a psoriázou.
Doporučení 11: Absence odpovědi na léčbu by měla vést k přehodnocení diagnózy a zvážení vlivu komorbidit.
Tímto novým doporučením začíná fáze III léčby axSpA. Jsou zde reflektovány chyby při diagnostice. Nesprávná diagnóza se může projevit nedostatečnou odpovědí na léčbu, kdežto dobrý efekt bDMARDs nebo JAKi ukazuje na správnou diagnózu a léčbu. Současný trend stanovení časné diagnózy má výhodu rozpoznání více pacientů s mírnějším onemocněním. U části těchto nemocných se však nemusejí objevit klasické příznaky, nálezy jsou méně jasné a může dojít k chybné diagnóze. Následkem může být nadměrná léčba [75].
Dále je třeba dbát na komorbidity - nemoci, jako jsou fibromyalgie, deprese nebo souběžná osteoartróza, mohou být spojeny s vyšší vnímanou aktivitou onemocnění, zejména v subjektivních hodnoceních pacientů [76-80]. Dopad komorbidit na hodnocení aktivity onemocnění by měl být brán v potaz již při zahájení terapie bDMARDs nebo JAKi. Pozitivní názor revmatologa, který bere v úvahu také komorbidity, musí být součástí jak v úvodu léčby, tak při pokračování terapie.
Doporučení 12: Po selhání prvního bDMARD/tsDMARD by mělo dojít ke změně na jiný bDMARD (TNFi nebo IL‑17Ai) nebo na JAKi.
V současné době máme k dispozici tři skupiny účinných bDMARDs/tsDMARDs. Pokud selže jeden z přípravků a nemocný stále splňuje kritéria k zavedení intenzivní léčby, mělo by dojít k záměně léku. Data týkající se účinnosti léčiv po předchozím selhání jsou však limitována. U TNFi data z observačních studií ukazují na účinnost - i když nižší - po selhání prvního TNFi [81]. Inhibitory IL‑17A jsou účinné u pacientů, u nichž selhala léčba TNFi, jejich efekt je však nižší než u TNFi naivních pacientů (přímé porovnání je k dispozici u secukinumabu) [54,82-86]. Data týkající se JAKi po selhání bDMARDs jsou z klinických studií limitována. Ze současných znalostí je patrné, že JAKi jsou účinné po selhání TNFi. Data o účinnosti JAKi po selhání IL‑17Ai nebo po selhání obou bDMARDs, TNFi i IL‑17Ai, nebyla v době tvorby doporučení k dispozici. Vzhledem k absenci dat je tedy doporučováno postupovat tak, jak bylo uvedeno v doporučení 9.
Doporučení 13: Pokud je pacient v trvalé remisi, mělo by být zváženo postupné vysazování bDMARD.
Stále více dat ukazuje, že přerušení terapie bDMARD vede k rozvoji flare, kdežto snižování dávky vede k udržení léčebné odpovědi [10,54,87-89]. Jedna zaslepená studie s certolizumabem u axSpA sledovala tři možnosti – pokračování versus snížení dávky versus zastavení léčby - a ukázala významně nižší riziko vzplanutí onemocnění při pokračování terapie nebo při snížení dávky [90]. Postupně vysazovat bDMARD lze pomocí snížení dávky nebo prodloužení intervalu podávání, přičemž druhá možnost je častější [54]. Pacienti, u nichž by mělo dojít k detrakci bDMARDs, jsou ti nemocní, kteří mají ustálenou (trvalou) remisi. Remise by měla být zhodnocena podle ASDAS (v pásmu remise nebo nízké aktivity onemocnění) a měla by trvat minimálně šest měsíců předtím, než detrakci zahájíme. Současná data však detrakci podporují pouze u TNFi. Z dalších přípravků byla provedena jedna studie s vysazením ixekizumabu, kdy došlo k významnému rozdílu u nemocných pokračujících v terapii oproti těm, kteří léčbu přerušili [90]. Data k JAKi zcela chybějí. Proto je doporučení omezeno na bDMARDs.
Doporučení 14: Náhrada kyčelního kloubu by měla být využita u pacientů s refrakterní bolestí nebo disabilitou a radiografickým nálezem strukturálního poškození nezávisle na věku nemocného. Spinální cervikální osteotomie by měla být prováděna pouze ve specializovaném centru u nemocných s velmi závažnými deformitami.
V chirurgických doporučeních nedošlo k žádným změnám a dále platí, že chirurgické intervence jsou spojeny se závažnějším průběhem axSpA. Postižení kyčlí se objevuje u více než třetiny nemocných s axSpA. V případě závažného postižení spojeného s destrukcí, zvláště u symptomatických pacientů, jsou nemocní indikováni k náhradě kyčelního kloubu nezávisle na věku [91]. U pacientů s těžkou a invalidizující deformitou páteře může být provedena spinální korektivní osteotomie. Vzhledem k náročnosti a rizikům zákroku je nutné sdílené rozhodnutí pacienta a lékaře a výkon se musí provádět na specializovaném pracovišti [92,93].
Doporučení 15: Pokud nastane závažná změna v průběhu nemoci, je nutné pátrat po jiné příčině, než je zánět – a sice po spinálních frakturách. Je nutné příslušné vyšetření, včetně zobrazovacích metod.
Poslední doporučení se týká náhlých, významných změn zdravotního stavu v průběhu onemocnění ve smyslu progrese bolestí zad. U nemocných s axSpA se častěji objevuje osteopenie a osteoporóza a zvláště u pacientů s ankylózou páteře může vést i malé trauma ke zlomeninám, které mohou mít horší průběh než u běžné populace [93]. Pokud panuje podezření na frakturu obratle, je nutné provést příslušná vyšetření – MRI a/nebo CT - a nálezy konzultovat se spondylochirurgem [94].
Diskuse
Současná doporučení ASAS-EULAR pro léčbu axSpA obsahují pět nadřazených zásad a 15 jednotlivých doporučení upravujících farmakologickou i nefarmakologickou léčbu.
V současné době jsou k dispozici nové možnosti léčby a nabízí se tak léčit podle individuálních potřeb pacienta (tab. 3). Ke dvěma skupinám léků, TNFi a IL‑17Ai, přibyla nová skupina – JAKi [10]. Data z rostoucích klinických zkušeností s IL‑17Ai podporují bezpečnost a účinnost secukinumabu i ixekizumabu u obou forem onemocnění (r‑axSpA i nr‑axSpA) [54], a tak má tato skupina již nezastupitelné místo v terapii axSpA. Nová doporučení reflektují i účinnost TNFi a IL‑17Ai v léčbě jednotlivých EMMs: IL‑17Ai jsou na podkladě řady studií s psoriázou a psoriatickou artritidou preferovány u nemocných s axSpA a psoriázou, TNFi pak u nemocných s recidivující uveitidou a idiopatickými střevními záněty.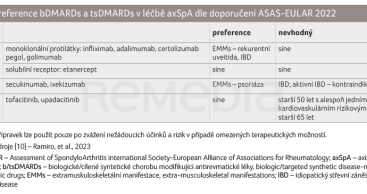
Inhibitory JAK představují novou terapeutickou možnost. V klinických studiích byla prokázána účinnost a bezpečnost tofacitinibu a upadacitinibu [10]. Obě léčiva byla testována v třetích fázích randomizovaných, dvojitě zaslepených kontrolovaných studií. Léčba tofacitinibem vedla signifikantně častěji k léčebné odpovědi na úrovni ASAS20 i ASAS40 u nemocných s aktivní AS v 16. týdnu oproti pacientům v placebové skupině (56,4 % vs. 29,4 % u ASAS20 a 40,6 % vs. 12,5 % u ASAS40) [95]. Do této studie bylo zařazeno také 23 % nemocných po selhání TNFi. Primárním cílem studie SELECT‑AXIS 1 bylo prokázat zlepšení na úrovni ASAS40 při léčbě upadacitinibem [96]. Do tohoto klinického hodnocení bylo randomizováno 187 pacientů s aktivní AS, kteří předtím nebyli léčeni bDMARDs. Ve 14. týdnu dosáhlo léčebné odpovědi ASAS40 52 % nemocných ve skupině s upadacitinibem a 26 % nemocných v placebové skupině (p = 0,0003). Nezávažné nežádoucí účinky byly hlášeny u 62 % nemocných v léčené skupině a u 55 % osob ve skupině s placebem. Závažné nežádoucí projevy, jako jsou infekce, herpes zoster, malignity nebo tromboembolické příhody, se neobjevily ani v jedné skupině [96]. Až po jednání o výsledných doporučeních byly zveřejněny výsledky studie SELECT‑AXIS 2 u nemocných s aktivní nr‑axSpA [97]. Randomizováno bylo celkem 313 pacientů (156 ve skupině s upadacitinibem a 157 v placebové skupině) a primární cílový ukazatel – léčebná odpověď na úrovni ASAS40 - byl hodnocen ve 14. týdnu. Významně vyšší počet nemocných dosáhl uvedeného cíle ve skupině s upadacitinibem v porovnání s placebovou skupinou – 45 % vs. 23 % (p < 0,0001). Výskyt nezávažných nežádoucích účinků se nelišil mezi oběma skupinami (48 % vs. 46 %), ve skupině s upadacitinibem bylo nutné lék vysadit u 3 % osob a v placebové skupině u 1 % osob. Výskyt závažných infekcí nebo herpes zoster byl obdobný v obou skupinách (1 %) a neobjevily se oportunní infekce, malignity nebo tromboembolické příhody [97]. Na základě těchto studií Evropská léková agentura (EMA) schválila použití upadacitinibu pro léčbu nr‑axSpA [98].
V literární review [99] k současným doporučením byla představena rovněž randomizovaná klinická studie fáze II TORTUGA s užitím inhibitoru JAK1 filgotinibu v léčbě aktivní AS po selhání standardní léčby a TNFi (pacientů, u nichž selhala léčba TNFi, bylo 9,5 %) [100]. U 116 pacientů s AS randomizovaných do skupiny s filgotinibem (n = 58) a placebem (n = 58) byl sledován primární cílový ukazatel – změna ASDAS ve 12. týdnu. U skupiny s filgotinibem poklesla hodnota ASDAS o 1,47, u placebové skupiny pouze o 0,57, s meziskupinovým rozdílem -0,85 (p < 0,0001). Stran bezpečnosti nebyl mezi skupinami zaznamenán významný rozdíl. Vysazení léčiva bylo nutné u tří pacientů - z důvodu pneumonie u skupiny s filgotinibem a z důvodu vysoké hodnoty kreatinkinázy u placebové skupiny [100]. Filgotinib není prozatím schválen k léčbě axSpA, dle EMA je určen k léčbě revmatoidní artritidy a ulcerózní kolitidy. Pro úplnost je k výčtu malých molekul ještě třeba zmínit selhání apremilastu v randomizované klinické studii fáze III u pacientů s AS naivních k léčbě bDMARDs [99,101].
V Doporučeních 2022 je kladen důraz na dodržování nadřazených principů – zásad, jak k nemocnému přistupovat. Důležitou novinkou je i využití indexu ASDAS k hodnocení aktivity onemocnění pro denní praxi a k rozhodování o léčbě. Pro zahájení terapie bDMARDs/tsDMARDs je kromě ostatních kritérií (obr. 2) vyžadováno ASDAS ≥ 2,1 a léčbu můžeme hodnotit jako úspěšnou, a tedy vhodnou k pokračování, pokud ASDAS klesne alespoň o 1,1. V neposlední řadě upozorňují doporučení ASAS-EULAR 2022 na nutnost správného stanovení diagnózy a sledování komorbidit, které mohou ovlivňovat léčebnou odpověď. Chybovost v obojím může vést k nedostatečné nebo naopak nadbytečné léčbě pacienta. Vzhledem k rozšiřování léčebných možností je nutné dbát na správnost indikací k zahájení léčby pomocí bDMARDs/tsDMARDs.
V roce 2021 byla vydána česká doporučení pro léčbu axSpA – v těchto doporučeních prozatím figuruje i index BASDAI a léčebně nejsou zahrnuty JAKi [102]. V běžné klinické praxi může index BASDAI pomoci klinikovi při rozhodování o léčbě, zvlášť pokud má k dispozici starší údaje a může je porovnávat. Vzhledem k podmínkám úhrad pro využití bDMARDs/tsDMARDs v léčbě axSpA je nutné v naší republice sledovat možnosti úhrady regulačními autoritami. Nicméně recentní doporučení ASAS‑EULAR 2022 lze využívat ke zlepšení péče o nemocné a k argumentaci pro autority při žádání o možnost využití těchto terapií.
Závěr
Závěrem lze shrnout, že doporučení ASAS-EULAR 2022 pro léčbu axSpA jsou komplexní – obsahují jak přístupy nefarmakologické léčby, tak reflektují nové poznatky z klinických studií a uvádějí je do praxe. Revmatologové a také další specialisté zabývající se léčbou axSpA dostávají do rukou návod, jak precizně nemocného léčit na podkladě individuální variability onemocnění. Vizí doporučení je, aby standardizovala a optimalizovala léčbu nemocných s axSpA a přispěla tak k jejich dobré kvalitě života a vedla k širšímu společenskému prospěchu díky lepší léčbě nemoci.
Literatura
[1] Navarro‑Compán V, Sepriano A, El‑Zorkany B, van der Heijde D. Axial spondyloarthritis. Ann Rheum Dis 2021; 80: 1511−1521.
[2] Sieper J, Poddubnyy D. Axial spondyloarthritis. Lancet 2017; 390: 73−84.
[3] Boel A, Molto A, van der Heijde D, et al. Do patients with axial spondyloarthritis with radiographic sacroiliitis fulfil both the modified New York criteria and the basdai axial spondyloarthritis criteria? Results from eight cohorts. Ann Rheum Dis 2019; 78: 1545−1549.
[4] Maksymowych WP. The role of imaging in the diagnosis and management of axial spondyloarthritis. Nat Rev Rheumatol 2019; 15: 657−672.
[5] Rudwaleit M, Khan MA, Sieper J. The challenge of diagnosis and classification in early ankylosing spondylitis: do we need new criteria? Arthritis Rheum 2005; 52: 1000−1008.
[6] Rudwaleit M, van der Heijde D, Landewé R, et al. The development of Assessment of SpondyloArthritis international Society classification criteria for axial spondyloarthritis (part II): validation and final selection. Ann Rheum Dis 2009; 68: 777−783. Erratum in: Ann Rheum Dis 2019; 78: e59.
[7] López‑Medina C, Ramiro S, van der Heijde D, et al. Characteristics and burden of disease in patients with radiographic and non‑radiographic axial Spondyloarthritis: a comparison by systematic literature review and meta‑analysis. RMD Open 2019; 5: e001108.
[8] Zhao SS, Ermann J, Xu C, et al. Comparison of comorbidities and treatment between ankylosing spondylitis and non‑radiographic axial spondyloarthritis in the United States. Rheumatology (Oxford) 2019; 58: 2025−2030.
[9] Landewé R, Braun J, Deodhar A, et al. Efficacy of certolizumab pegol on signs and symptoms of axial spondyloarthritis including ankylosing spondylitis: 24‑week results of a double‑blind randomised placebo‑controlled Phase 3 study. Ann Rheum Dis 2014; 73: 39−47.
[10] Ramiro S, Nikiphorou E, Sepriano A, et al. ASAS‑EULAR recommendations for the management of axial spondyloarthritis: 2022 update. Ann Rheum Dis 2023; 82: 19–34.
[11] van der Heijde D, Ramiro S, Landewé R, et al. 2016 update of the ASAS‑EULAR management recommendations for axial spondyloarthritis. Ann Rheum Dis 2017; 76: 978−991.
[12] Machado P, Landewé R, Braun J, et al. A stratified model for health outcomes in ankylosing spondylitis. Ann Rheum Dis 2011; 70: 1758−1764.
[13] Hirano F, van der Heijde D, van Gaalen FA, et al. Determinants of the patient global assessment of well‑being in early axial spondyloarthritis: 5‑year longitudinal data from the DESIR cohort. Rheumatology (Oxford) 2021; 60: 316−321.
[14] Ramiro S, van der Heijde D, van Tubergen A, et al. Higher disease activity leads to more structural damage in the spine in ankylosing spondylitis: 12‑year longitudinal data from the OASIS cohort. Ann Rheum Dis 2014; 73: 1455−1461.
[15] Landewé R, Dougados M, Mielants H, et al. Physical function in ankylosing spondylitis is independently determined by both disease activity and radiographic damage of the spine. Ann Rheum Dis 2009; 68: 863−867.
[16] Poddubnyy D, Protopopov M, Haibel H, et al. High disease activity according to the Ankylosing Spondylitis Disease Activity Score is associated with accelerated radiographic spinal progression in patients with early axial spondyloarthritis: results from the GErman SPondyloarthritis Inception Cohort. Ann Rheum Dis 2016; 75: 2114−2118.
[17] Boonen A, Mau W. The economic burden of disease: comparison between rheumatoid arthritis and ankylosing spondylitis. Clin Exp Rheumatol 2009; 27(4 Suppl 55): S112−117.
[18] Westhovens R, Annemans L. Costs of drugs for treatment of rheumatic diseases. RMD Open 2016; 2: e000259.
[19] van der Heijde D, Lie E, Kvien TK, et al. Assessment of SpondyloArthritis international Society (ASAS). ASDAS, a highly discriminatory ASAS‑endorsed disease activity score in patients with ankylosing spondylitis. Ann Rheum Dis 2009; 68: 1811−1818.
[20] Sepriano A, Ramiro S, Wichuk S, et al. Disease activity is associated with spinal radiographic progression in axial spondyloarthritis independently of exposure to tumour necrosis factor inhibitors. Rheumatology (Oxford) 2021; 60: 461−462.
[21] Machado P, Landewé R, Lie E, et al. Assessment of SpondyloArthritis international Society. Ankylosing Spondylitis Disease Activity Score (ASDAS): defining cut‑off values for disease activity states and improvement scores. Ann Rheum Dis 2011; 70: 47−53.
[22] Molto A, Gossec L, Meghnathi B, et al. ASAS‑FLARE study group. An Assessment in SpondyloArthritis International Society (ASAS)‑endorsed definition of clinically important worsening in axial spondyloarthritis based on ASDAS. Ann Rheum Dis 2018; 77: 124−127.
[23] Kiltz U, Landewé RBM, van der Heijde D, et al. Development of ASAS quality standards to improve the quality of health and care services for patients with axial spondyloarthritis. Ann Rheum Dis 2020; 79: 193−201.
[24] Kiltz U, van der Heijde D, Boonen A, et al. Development of a health index in patients with ankylosing spondylitis (ASAS HI): final result of a global initiative based on the ICF guided by ASAS. Ann Rheum Dis 2015; 74: 830−835.
[25] Navarro‑Compán V, Ramiro S, Landewé R, et al. Disease activity is longitudinally related to sacroiliac inflammation on MRI in male patients with axial spondyloarthritis: 2‑years of the DESIR cohort. Ann Rheum Dis 2016; 75: 874−878.
[26] Navarro‑Compán V, Ramiro S, Landewé R, et al. In patients with axial spondyloarthritis, inflammation on MRI of the spine is longitudinally related to disease activity only in men: 2 years of the axial spondyloarthritis DESIR cohort. Ann Rheum Dis 2018; 77: 470−472.
[27] Ramiro S, Stolwijk C, van Tubergen A, et al. Evolution of radiographic damage in ankylosing spondylitis: a 12 year prospective follow‑up of the OASIS study. Ann Rheum Dis 2015; 74: 52−59. Erratum in: Ann Rheum Dis 2015; 74: 1482.
[28] van Tubergen A, Ramiro S, van der Heijde D, et al. Development of new syndesmophytes and bridges in ankylosing spondylitis and their predictors: a longitudinal study. Ann Rheum Dis 2012; 71: 518−523.
[29] Spoorenberg A, de Vlam K, van der Heijde D, et al. Radiological scoring methods in ankylosing spondylitis: reliability and sensitivity to change over one year. J Rheumatol 1999; 26: 997−1002.
[30] Molto A, López‑Medina C, Van den Bosch FE, et al. Efficacy of a tight‑control and treat‑to‑target strategy in axial spondyloarthritis: results of the open‑label, pragmatic, cluster‑randomised TICOSPA trial. Ann Rheum Dis 2021; 80: 1436−1444.
[31] Dagfinrud H, Kvien TK, Hagen KB. Physiotherapy interventions for ankylosing spondylitis. In: The Cochrane database of systematic reviews, 2008: CD002822.
[32] Poddubnyy D, Haibel H, Listing J, et al. Baseline radiographic damage, elevated acute‑phase reactant levels, and cigarette smoking status predict spinal radiographic progression in early axial spondylarthritis. Arthritis Rheum 2012; 64: 1388−1398.
[33] Ramiro S, Landewé R, van Tubergen A, et al. Lifestyle factors may modify the effect of disease activity on radiographic progression in patients with ankylosing spondylitis: a longitudinal analysis. RMD Open 2015; 1: e000153.
[34] Nikiphorou E, Ramiro S, Sepriano A, et al. Do Smoking and Socioeconomic Factors Influence Imaging Outcomes in Axial Spondyloarthritis? Five‑Year Data From the DESIR Cohort. Arthritis Rheumatol 2020; 72: 1855−1862.
[35] Sieper J, Lenaerts J, Wollenhaupt J, et al. All INFAST Investigators. Efficacy and safety of infliximab plus naproxen versus naproxen alone in patients with early, active axial spondyloarthritis: results from the double‑blind, placebo‑controlled INFAST study, Part 1. Ann Rheum Dis 2014; 73: 101−107.
[36] Wanders A, van der Heijde D, Landewé R, et al. Nonsteroidal antiinflammatory drugs reduce radiographic progression in patients with ankylosing spondylitis: a randomized clinical trial. Arthritis Rheum 2005; 52: 1756−1765.
[37] Kroon F, Landewé R, Dougados M, van der Heijde D. Continuous NSAID use reverts the effects of inflammation on radiographic progression in patients with ankylosing spondylitis. Ann Rheum Dis 2012; 71: 1623−1629.
[38] Poddubnyy D, Rudwaleit M, Haibel H, et al. Effect of non‑steroidal anti‑inflammatory drugs on radiographic spinal progression in patients with axial spondyloarthritis: results from the German Spondyloarthritis Inception Cohort. Ann Rheum Dis 2012; 71: 1616−1622.
[39] Geenen R, Overman CL, Christensen R, et al. EULAR recommendations for the health professional's approach to pain management in inflammatory arthritis and osteoarthritis. Ann Rheum Dis 2018; 77: 797−807.
[40] Maugars Y, Mathis C, Vilon P, Prost A. Corticosteroid injection of the sacroiliac joint in patients with seronegative spondylarthropathy. Arthritis Rheum 1992; 35: 564−548.
[41] Luukkainen R, Nissilä M, Asikainen E, et al. Periarticular corticosteroid treatment of the sacroiliac joint in patients with seronegative spondylarthropathy. Clin Exp Rheumatol 1999; 17: 88−90.
[42] Haibel H, Fendler C, Listing J, et al. Efficacy of oral prednisolone in active ankylosing spondylitis: results of a double‑blind, randomised, placebo‑controlled short‑term trial. Ann Rheum Dis 2014; 73: 243−246.
[43] Mishra D, Dhir V, Naidu GSRSNK, et al. Efficacy of a step‑down regimen of oral prednisolone in axial spondyloarthritis: result of a double‑blind randomized controlled trial (COBRA‑AS Study). Rheumatology (Oxford) 2021; 60: 1932−1941.
[44] Chen J, Lin S, Liu C. Sulfasalazine for ankylosing spondylitis. In: The Cochrane database of systematic reviews, 2014: CD004800.
[45] Chen J, Lin S, Liu C. Methotrexate for ankylosing spondylitis. In: The Cochrane database of systematic reviews, 2013: CD004524.
[46] Haibel H, Brandt HC, Song IH, et al. No efficacy of subcutaneous methotrexate in active ankylosing spondylitis: a 16‑week open‑label trial. Ann Rheum Dis 2007; 66: 419−421.
[47] Arends S, Brouwer E, van der Veer E, et al. Baseline predictors of response and discontinuation of tumor necrosis factor‑alpha blocking therapy in ankylosing spondylitis: a prospective longitudinal observational cohort study. Arthritis Res Ther 2011; 13: R94.
[48] Glintborg B, Ostergaard M, Krogh NS, et al. Predictors of treatment response and drug continuation in 842 patients with ankylosing spondylitis treated with anti‑tumour necrosis factor: results from 8 years' surveillance in the Danish nationwide DANBIO registry. Ann Rheum Dis 2010; 69: 2002−2008.
[49] Sieper J, van der Heijde D, Dougados M, et al. Efficacy and safety of adalimumab in patients with non‑radiographic axial spondyloarthritis: results of a randomised placebo‑controlled trial (ABILITY‑1). Ann Rheum Dis 2013; 72: 815−822.
[50] Dougados M, van der Heijde D, Sieper J, et al. Symptomatic efficacy of etanercept and its effects on objective signs of inflammation in early nonradiographic axial spondyloarthritis: a multicenter, randomized, double‑blind, placebo‑controlled trial. Arthritis Rheumatol 2014; 66: 2091−2102.
[51] Sieper J, van der Heijde D, Dougados M, et al. A randomized, double‑blind, placebo‑controlled, sixteen‑week study of subcutaneous golimumab in patients with active nonradiographic axial spondyloarthritis. Arthritis Rheumatol 2015; 67: 2702−2712.
[52] Ciurea A, Kissling S, Bürki K, et al. Current differentiation between radiographic and non‑radiographic axial spondyloarthritis is of limited benefit for prediction of important clinical outcomes: data from a large, prospective, observational cohort. RMD Open 2022; 8: e002067.
[53] Dougados M, Simon P, Braun J, et al. ASAS recommendations for collecting, analysing and reporting NSAID intake in clinical trials/epidemiological studies in axial spondyloarthritis. Ann Rheum Dis 2011; 70: 249−251.
[54] Webers C, Ortolan A, Sepriano A, et al. Efficacy and safety of biological DMARDs: a systematic literature review informing the 2022 update of the ASAS‑EULAR recommendations for the management of axial spondyloarthritis. Ann Rheum Dis 2023; 82: 130−141.
[55] van der Heijde D, Gensler LS, Deodhar A, et al. Dual neutralisation of interleukin‑17A and interleukin‑17F with bimekizumab in patients with active ankylosing spondylitis: results from a 48‑week phase IIb, randomised, double‑blind, placebo‑controlled, dose‑ranging study. Ann Rheum Dis 2020; 79: 595−604. Erratum in: Ann Rheum Dis 2020; 79: e121. Erratum in: Ann Rheum Dis 2021; 80: e186.
[56] Ytterberg SR, Bhatt DL, Mikuls TR, et al. ORAL Surveillance Investigators. Cardiovascular and Cancer Risk with Tofacitinib in Rheumatoid Arthritis. N Engl J Med 2022; 386: 316−326.
[57] Charles‑Schoeman C, Fleischmann R, Davignon J, et al. Potential mechanisms leading to the abnormal lipid profile in patients with rheumatoid arthritis versus healthy volunteers and reversal by tofacitinib. Arthritis Rheumatol 2015; 67: 616−625.
[58] Charles‑Schoeman C, Gonzalez‑Gay MA, Kaplan I, et al. Effects of tofacitinib and other DMARDs on lipid profiles in rheumatoid arthritis: implications for the rheumatologist. Semin Arthritis Rheum 2016; 46: 71−80.
[59] van der Heijde D, Song IH, Pangan AL, et al. Effi cacy and safety of upadacitinib in patients with active ankylosing spondylitis (SELECT--AXIS 1): a multicentre, randomised, double-blind, placebo-controlled, phase 2/3 trial. Lancet 2019; 394: 2108−2117.
[60] Deodhar A, Sliwinska-Stanczyk P, Xu H, et al. Tofacitinib for the treatment of ankylosing spondylitis: a phase III, randomised, double-blind, placebo-controlled study. Ann Rheum Dis 2021; 80: 1004−1013.
[61] Deodhar A, van der Heijde D, Sieper J, et al. Safety and Effi cacy of Upadacitinib in Patients With Active Ankylosing Spondylitis and an Inadequate Response to Nonsteroidal Antiinfl ammatory Drug Therapy: One-Year Results of a Double-Blind, Placebo-Controlled Study and Open-Label Extension. Arthritis Rheumatol 2022; 74: 70−80.
[62] Braun J, Baraliakos X, Listing J, Sieper J. Decreased incidence of anterior uveitis in patients with ankylosing spondylitis treated with the anti-tumor necrosis factor agents infl iximab and etanercept. Arthritis Rheum 2005; 52: 2447−2451.
[63] van Denderen JC, Visman IM, Nurmohamed MT, et al. Adalimumab signifi cantly reduces the recurrence rate of anterior uveitis in patients with ankylosing spondylitis. J Rheumatol 2014; 41: 1843−1848.
[64] Rudwaleit M, Rosenbaum JT, Landewé R, et al. Observed Incidence of Uveitis Following Certolizumab Pegol Treatment in Patients With Axial Spondyloarthritis. Arthritis Care Res (Hoboken) 2016; 68: 838−844.
[65] Foster CS, Tufail F, Waheed NK, et al. Effi cacy of etanercept in preventing relapse of uveitis controlled by methotrexate. Arch Ophthalmol 2003; 121: 437−440.
[66] Sieper J, Koenig A, Baumgartner S, et al. Analysis of uveitis rates across all etanercept ankylosing spondylitis clinical trials. Ann Rheum Dis 2010; 69: 226−229.
[67] Lindström U, Bengtsson K, Olofsson T, et al. Anterior uveitis in patients with spondyloarthritis treated with secukinumab or tumour necrosis factor inhibitors in routine care: does the choice of biological therapy matter? Ann Rheum Dis 2021; 80: 1445−1452.
[68] Sandborn WJ, Hanauer SB, Katz S, et al. Etanercept for active Crohn’s disease: a randomized, double-blind, placebo-controlled trial. Gastroenterology 2001; 121: 1088−1094.
[69] Hueber W, Sands BE, Lewitzky S, et al. Secukinumab in Crohn’s Disease Study Group. Secukinumab, a human anti-IL-17A monoclonal antibody, for moderate to severe Crohn’s disease: unexpected results of a randomised, double-blind placebo-controlled trial. Gut 2012; 61: 1693−1700.
[70] Hanauer SB, Feagan BG, Lichtenstein GR, et al. ACCENT I Study Group. Maintenance infl iximab for Crohn’s disease: the ACCENT I randomised trial. Lancet 2002; 359: 1541−1549.
[71] Sandborn WJ, Hanauer SB, Rutgeerts P, et al. Adalimumab for maintenance treatment of Crohn’s disease: results of the CLASSIC II trial. Gut 2007; 56: 1232−1239.
[72] Adedokun OJ, Xu Z, Marano CW, et al. Pharmacokinetics and Exposure- response Relationship of Golimumab in Patients with Moderately- to-Severely Active Ulcerative Colitis: Results from Phase 2/3 PURSUIT Induction and Maintenance Studies. J Crohns Colitis 2017; 11: 35−46.
[73] McInnes IB, Behrens F, Mease PJ, et al. EXCEED Study Group. Secukinumab versus adalimumab for treatment of active psoriatic arthritis (EXCEED): a double-blind, parallel-group, randomised, active- controlled, phase 3b trial. Lancet 2020; 395: 1496−1505. Erratum in: Lancet 2020; 395: 1694.
[74] Mease PJ, Smolen JS, Behrens F, et al. SPIRIT H2H study group. A head-to-head comparison of the effi cacy and safety of ixekizumab and adalimumab in biological-naïve patients with active psoriatic arthritis: 24-week results of a randomised, open-label, blinded-assessor trial. Ann Rheum Dis 2020; 79: 123−131.
[75] Landewé RBM. Overdiagnosis and overtreatment in rheumatology: a little caution is in order. Ann Rheum Dis 2018; 77: 1394−1396.
[76] Zhao SS, Jones GT, Hughes DM, et al. Depression and anxiety symptoms at TNF inhibitor initiation are associated with impaired treatment response in axial spondyloarthritis. Rheumatology (Oxford) 2021; 60: 5734−5742.
[77] Zhao SS, Jones GT, Macfarlane GJ, et al. Association between comorbidities and disease activity in axial spondyloarthritis: results from the BSRBR-AS. Rheumatology (Oxford) 2021; 60: 3189−3198.
[78] Zhao SS, Radner H, Siebert S, et al. Comorbidity burden in axial spondyloarthritis: a cluster analysis. Rheumatology (Oxford) 2019; 58: 1746−1754.
[79] Gao R. Eff ects of fi bromyalgia on the disease activity and treatment of patients with axial spondyloarthritis. J Musculoskelet Neuronal Interact 2021; 21: 440−446.
[80] Moltó A, Etcheto A, Gossec L, et al. Evaluation of the impact of concomitant fi bromyalgia on TNF alpha blockers’ eff ectiveness in axial spondyloarthritis: results of a prospective, multicentre study. Ann Rheum Dis 2018; 77: 533−540.
[81] Lie E, van der Heijde D, Uhlig T, et al. Eff ectiveness of switching between TNF inhibitors in ankylosing spondylitis: data from the NOR-DMARD register. Ann Rheum Dis 2011; 70: 157−163.
[82] Braun J, Baraliakos X, Deodhar A, et al. MEASURE 1 study group. Eff ect of secukinumab on clinical and radiographic outcomes in ankylosing spondylitis: 2-year results from the randomised phase III MEASURE 1 study. Ann Rheum Dis 2017; 76: 1070−1077.
[83] Sieper J, Deodhar A, Marzo-Ortega H, et al. MEASURE 2 Study Group. Secukinumab effi cacy in anti-TNF-naive and anti-TNF-experienced subjects with active ankylosing spondylitis: results from the MEASURE 2 Study. Ann Rheum Dis 2017; 76: 571−592.
[84] van der Heijde D, Cheng-Chung Wei J, Dougados M, et al. COAST-V study group. Ixekizumab, an interleukin-17A antagonist in the treatment of ankylosing spondylitis or radiographic axial spondyloarthritis in patients previously untreated with biological disease-modifying anti-rheumatic drugs (COAST-V): 16 week results of a phase 3 randomised, double-blind, active-controlled and placebo-controlled trial. Lancet 2018; 392: 2441−2451.
[85] Deodhar A, Poddubnyy D, Pacheco-Tena C, et al. COAST-W Study Group. Effi cacy and Safety of Ixekizumab in the Treatment of Radiographic Axial Spondyloarthritis: Sixteen-Week Results From a Phase III Randomized, Double-Blind, Placebo-Controlled Trial in Patients With Prior Inadequate Response to or Intolerance of Tumor Necrosis Factor Inhibitors. Arthritis Rheumatol 2019; 71: 599−611.
[86] Pavelka K, Kivitz A, Dokoupilova E, et al. Effi cacy, safety, and tolerability of secukinumab in patients with active ankylosing spondylitis: a randomized, double-blind phase 3 study, MEASURE 3. Arthritis Res Ther 2017; 19: 285.
[87] Navarro-Compán V, Plasencia-Rodríguez C, de Miguel E, et al. Anti- TNF discontinuation and tapering strategies in patients with axial spondyloarthritis: a systematic literature review. Rheumatology (Oxford) 2016; 55: 1188−1194.
[88] Cantini F, Niccoli L, Cassarà E, et al. Duration of remission after halving of the etanercept dose in patients with ankylosing spondylitis: a randomized, prospective, long-term, follow-up study. Biologics 2013; 7: 1−6.
[89] Gratacós J, Pontes C, Juanola X, et al. REDES-TNF investigators. Non-inferiority of dose reduction versus standard dosing of TNF-inhibitors in axial spondyloarthritis. Arthritis Res Ther 2019; 21: 11.
[90] Landewé RB, van der Heijde D, Dougados M, et al. Maintenance of clinical remission in early axial spondyloarthritis following certolizumab pegol dose reduction. Ann Rheum Dis 2020; 79: 920−928. Erratum in: Ann Rheum Dis 2020; 79: e120.
[91] Lee SH, Lee GW, Seol YJ, et al. Comparison of Outcomes of Total Hip Arthroplasty between Patients with Ankylosing Spondylitis and Avascular Necrosis of the Femoral Head. Clin Orthop Surg 2017; 9: 263−269.
[92] Wang Y, Xue C, Song K, et al. Comparison of loss of correction between PSO and VCD technique in treating thoracolumbar kyphosis secondary to ankylosing spondylitis, a minimum 2 years follow-up. J Orthop Surg Res 2019; 14: 137.
[93] Van Royen BJ, De Gast A. Lumbar osteotomy for correction of thoracolumbar kyphotic deformity in ankylosing spondylitis. A structured review of three methods of treatment. Ann Rheum Dis 1999; 58: 399−406.
[94] Mandl P, Navarro-Compán V, Terslev L, et al. European League Against Rheumatism (EULAR). EULAR recommendations for the use of imaging in the diagnosis and management of spondyloarthritis in clinical practice. Ann Rheum Dis 2015; 74: 1327−1339.
[95] Deodhar A, Sliwinska-Stanczyk P, Xu H, et al. Tofacitinib for the treatment of ankylosing spondylitis: a phase III, randomised, double-blind, placebo-controlled study. Ann Rheum Dis 2021; 80: 1004−1013.
[96] van der Heijde D, Song IH, Pangan AL, et al. Effi cacy and safety of upadacitinib in patients with active ankylosing spondylitis (SELECT- -AXIS 1): a multicentre, randomised, double-blind, placebo-controlled, phase 2/3 trial. Lancet 2019; 394: 2108−2117.
[97] Deodhar A, Van den Bosch F, Poddubnyy D, et al. Upadacitinib for the treatment of active non-radiographic axial spondyloarthritis (SELECT-AXIS 2): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2022; 400: 369−379.
[98] Rinvoq (upadacitinib). Available: https://www.ema.europa.eu/en/ documents/overview/rinvoq-epar-medicine-overview_en-0.pdf [Accessed 29 Sep 2022].
[99] Ortolan A, Webers C, Sepriano A, et al. Effi cacy and safety of non-pharmacological and non-biological interventions: a systematic literature review informing the 2022 update of the ASAS/EULAR recommendations for the management of axial spondyloarthritis. Ann Rheum Dis 2023; 82: 142−152.
[100] van der Heijde D, Baraliakos X, Gensler LS, et al. Effi cacy and safety of fi lgotinib, a selective Janus kinase 1 inhibitor, in patients with active ankylosing spondylitis (TORTUGA): results from a randomised, placebo-controlled, phase 2 trial. Lancet 2018; 392: 2378−2387.
[101] Taylor PC, van der Heijde D, Landewé R, et al. A Phase III Randomized Study of Apremilast, an Oral Phosphodiesterase 4 Inhibitor, for Active Ankylosing Spondylitis. J Rheumatol 2021; 48: 1259−1267.
[102] Pavelka K, Výbor České Revmatologické Společnosti. Doporučení České revmatologické společnosti pro farmakologickou léčbu axiálních spondyloartiritd. Část I. Strategie léčby a farmakoterapie. Čes Revmatol 2021; 29: 5–19.