Alfakalcidol v léčbě osteoporózy
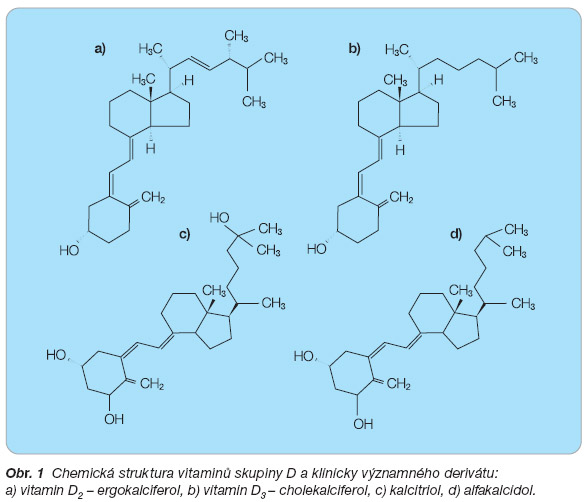
Alfakalcidol [1a(OH)D3] je jedním ze synteticky vyrobených prekurzorů kalcitriolu. Jedná se o systém označovaný jako prodrug, kdy aktivní látka vzniká z podaného léčiva metabolickou změnou, v tomto případě hydroxylací, přímo v organismu. Po perorálním užití a střevní absorpci je alfakalcidol automaticky hydroxylován v játrech a částečně také v osteoblastech na 1a(25(OH)2D3. Jeho unikátní biologické a farmakologické vlastnosti ho činí velmi zajímavým z hlediska léčby osteoporózy. Oproti přirozenému vitaminu je alfakalcidol účinný u pacientů s normální i sníženou hladinou vitaminu D. Zvýšením hladiny D hormonu potlačuje produkci parathormonu, snižuje osteoresorpci a zvyšuje kostní formaci. Deficit D hormonu ovlivňuje přímo, jelikož nevyžaduje hydroxylaci v ledvinách a má rovněž schopnost příznivě ovlivnit poruchu receptorů pro vitamin D indukcí jejich exprese v cílových tkáních. Přirozený vitamin D slouží k nutriční suplementaci, zatímco alfakalcidol představuje farmakologickou intervenci. Místo alfakalcidolu v léčbě osteoporózy lze spatřovat zejména v léčbě starších nemocných se sarkopenií, se zvýšeným rizikem pádu a s přítomností renální nedostatečnosti ať už vyjádřené klinicky či pouze poklesem glomerulární filtrace pod 65 ml/min. Lze ho použít rovněž v léčbě glukokortikoidy indukované osteoporózy. Od léčby alfakalcidolem se dle výsledků klinických studií a jejich metaanalýz očekává snížení rizika pádu, zlepšení svalové síly, udržení a nárůst BMD v oblasti bederní páteře, snížení rizika vertebrálních a non-vertebrálních fraktur. Další přínos představuje pleiotropní efekt D hormonu na cílových tkáních při normalizaci jeho hladin
Seznam použité literatury
- [1] Holick MF. Vitamin D, photobiology, metabolism, mechanism of action, and clinical appliactions. In: Primer on the metabolic bone disases and disorders of mineral metabolism. 5th Edition. Lippincott, Philadelphia 1999; 92–98.
- [2] Mellanby E. An experimental investigation of rickets. Lancet 1919; 1: 407–411.
- [3] McCollum EV, Simmonds N, Becker JE, Shipley PG. Studies on experimental rickets. XXI: an experimental demonstration of the existence of a vitamin which promotes calcium deposition. J Biol Chem 1922; 53: 293–296.
- [4] De Luca H. The vitamin D story: a collaborative effort of basic science and clinical medicine. Fed Proc Am Soc Exp Biol 1988; 2: 1083–1086.
- [5] Tsai KS, Heath H, Kumar R, et al. Impaired vitamin D metabolism with aging in women: possible role in pathogenesis of senile osteoporosis. J Clin Invest 1984; 73: 1668–1672.
- [6] Slatoplosky E, Weerts C, Thielan J, et al. Marked suppression of secondary hyperparathyroidism by intravenous administration of 1,25-dihydroxycholecalciferol in uremic patients. J Clin Invest 1984; 74: 2136–2143.
- [7] Hamdy NAT, Kanis JA, Beneton MNC, et al. Effect of alfacalcidol on natural course of renal bone disease in mild to moderate renal failure. Br Med J 1995; 310: 358–363.
- [8] Ogata E. Hypoparathyroidism: practice and theoretical background for 1a-OH-D treatment. Bone Miner 1990; 9: 229–232.
- [9] Cundy T. Hypoparathyroidism. In: Hosking D, Ringe JD (eds). Treatment of metabolic bone disease. Dunitz, London 2000; 187–194.
- [10] Pettifor JM. Recent advances in pediatric metabolic bone disease: the consequences of altered phosphate homeostasis in renal insufficiency and hypophosphatemic vitamin D resistant rickets. Bone Miner 1990; 9: 199–214.
- [11] Davies M. Treatment of osteomalacia. In: Hosking D, Ringe JD (eds). Treatment of metabolic bone disease. Dunitz, London 2000; 232–239.
- [12] Heaney RP, Barger-Lux MJ, Dowel MS, Chen TC, Holick MF. Calcium absorptive effect of vitamin D and its major metabolites. J Clin Endocrinol Metab 1997; 82, 4111–4116.
- [13] Hart GR. Overview of vitamin D measurement and methodologies. Immunodiagnostic systems 2005; 2: 1–9.
- [14] McKenna MJ. Differences in vitamin D status between countries in young adults and the elderly. Am J Med 1992; 93: 69–77.
- [15] Krexner E, Resch H, Pietschmann P, et al. Vitamin D status in residents of a long-term-care geriatric hospital in Vienna. Osteologie 1996; 5: 13–18.
- [16] Chapuy MC, Durr F, Chapuy P. Age-related changes in parathyroid hormone and 25 hydroxycholecalciferol levels. J Gerontol 1996; 38: 19–22.
- [17] Chapuy MC, Chapuy C, Meunier PJ. Calcium and vitamin D supplements: effects on calcium metabolism in elderly people. Am J Clin Nutr 1987; 46: 324–328.
- [18] Chapuy MC, Arlot ME, DuBoef F, et al. Vitamin D3 and calcium to prevent hip fractures in elderly women. N Engl J Med 1992; 327: 1637–1642.
- [19] Chapuy MC, Schott AM, Garnero P, et al. Healthy elderly French women living at home have secondary hyperparathyroidism and high bone turn-over in winter. J Clin Endocrinol Metab 1996; 81: 1129–1133.
- [20] Vieth R, Cole DE, Hawker GA, et al. Wintertime vitamin D insufficiency is common in young Canadian women, and their vitamin D intake does not prevent it. Eur J Clin Nutr 2001; 55: 1091–1097.
- [21] Välimäki VV, Alfthan H, Lehmusklallio E, et al. Vitamin D status as a determinant of peak bone mass in young finnish men. J Clin Endocrinol Metabol 2004; 89: 76–80.
- [22] Holick MF, Chen TC. Vitamin D deficiency: A world wide problem with health consequences. A J Clin Nutr 2008; 87: 1080–1086.
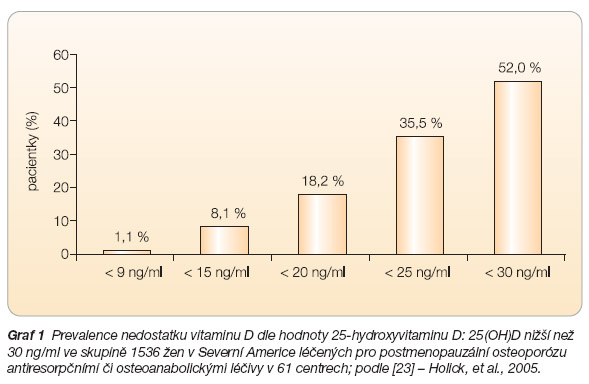
- [23] Holick MF, Siris ES, Binkley N, et al. Prevalence of vitamin D inadequacy among postmenopausal North American women receiving osteoporosis therapy. J Clin Endocrinol Metab 2005; 90: 3215–3224.
- [24] Cantorna MT, Mahon BD. D hormone and immune system. J Rheumatol 2005; 32 (Suppl. 1): 11–20.
- [25] Verhaar HJJ, Samson MM, Jansen PAF, et al. Muscle strength, functional mobility and vitamin D in older women. Aging Clin Exp Res 2000; 12, 455–460.
- [26] Avioli LV. Vitamin D and the D hormones, alfacalcidol and calcitriol, as therapeutic agents for osteoporotic populations. Calcif Tissue Int 1999; 65: 292–294.
- [27] Ichikawa F, Sato K, Nanjo M, et al. Mouse primary osteoblasts express vitamin D 25-hydroxylase mRNA and convert 1a,25-dihydroxyvitamin D3. Bone 1995; 16: 129–135.
- [28] Shiraishi A, Takeda S, Masaki T, et al. Alfacalcidol inhibits bone resorption and stimulates formation in an ovariectomized rat model of osteoporosis: distinct actions from estrogen. J Bone Miner Res 2000; 15: 770–779.
- [29] Ringe J, Schacht E. Prevention and therapy of osteoporosis: the roles of plain vitamin D and alfacalcidol. Rheumatol Int 2004; 24: 189–197.
- [30] Bischoff HA, Borchers M, Gudat F, et al. In situ detection of 1,25-dihydroxyvitamin D receptor in human skeletal muscle tissue. Histochem 2001; 33: 434–448.
- [31] Seino I, Tanaka H, Yamaoka K, Yabucchi H. Circulating 1a,25-dihydroxyvitamin D3 levels after a single dose of 1a,25-dihydroxyvitamin D3 or 1a-hydroxyvitamin D3 in normal men. Bone Miner 1987; 2: 479–485.
- [32] Scharla SH, Schacht E, Bawey S, et al. Pleiotropic effects of 1-alfa-hydroxyvitamin D (alfacalcidol) in patients with rheumatoid arthritis. Arthritis Rheum 2003; 23: 268–274.
- [33] Amin S, LaValley MP, Simms RW, et al. The role of vitamin D in corticosteroid-induced osteoporosis: a metaanalytic approach. Arthritis Rheum 1999; 42: 1740–1751.
- [34] Papadimitropoulos E, Wells G, Shea B. Metaanalysis of the efficacy of vitamin D treatment in preventing osteoporosis in postmenopausal women. Endocrine Reviews 2002; 23: 560–569.
- [35] Ringe JD. Active vitamin D metabolites in glucocorticoid-induced osteoporosis. Calcif Tissue Int 1997; 60: 124–127.
- [36] Ringe JD, Coster A, Meng T, et al. Treatment of glucocorticoid-induced osteoporosis with alfacalcidol/calcium versus vitamin D/calcium. Calcif Tissue Int 1999; 63: 337–340.
- [37] Ringe JD, Faber H. Calcium and vitamin D in the prevention and treatment of glucocorticoid-induced osteoporosis. Clin Exp Rheumatol 2000; 5 (Suppl. 21): 44–48.
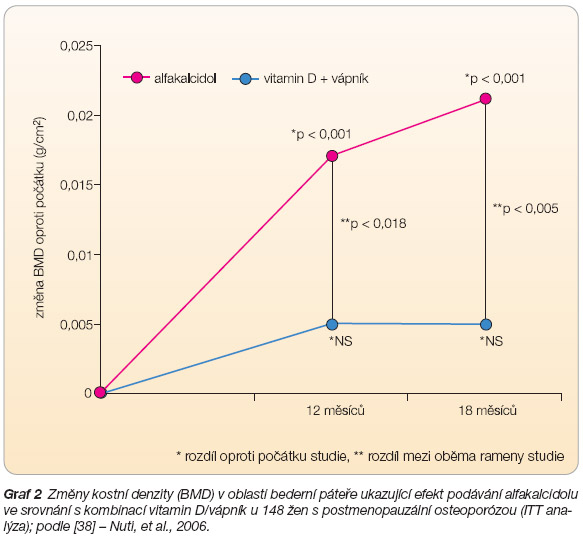
- [38] Nuti R, Bianchi G, Brandi ML, et al. Superiority of alfacalcidol compared to vitamin D plus calcium in lumbar bone mineral density in postmenopausal osteoporosis. Rheumatol Int 2006; 26: 445–453.
- [39] Richy F, Ethgen O, Bruyere O, Reginster JY. Efficacy of alphacalcidol and calcitriol in primary and corticosteroid-induced osteoporosis: a metaanalysis of their effects on bone mineral density and fracture rate. Osteoporosis Int 2004; 15: 301–310.
- [40] Richy JD, Schacht E, Bruyere O, et al. Vitamin D analogs versus native vitamin D preventing bone loss and osteoporosis related fractures: A comparative metaanalysis. Calcif Tissue Int 2005; 76: 176–186.
- [41] Ringe JD, Faber H, Fahramand, Schacht E. Alphacalcidol versus plain vitamin D in the treatment of glucocorticoid/inflammation-induced osteoporosis. J Rheumatol 2005; 32 (Suppl. 76): 33–40.
- [42] Sambrook PN, Kotowitz M, Nash P, et al. Prevention and treatment of glucocorticoid induced osteoporosis: a comparison calcitriol, vitamin D plus calcium and alendronate plus calcium. J Bone Min Res 2003; 18: 919–924.
- [43] Richy F, Dukas L, Schacht E. Differential effects of D-hormone analogs and native vitamin D on the risk of falls. A comparative metaanalysis. Calcif Tissue Int 2008; 82: 102–107.
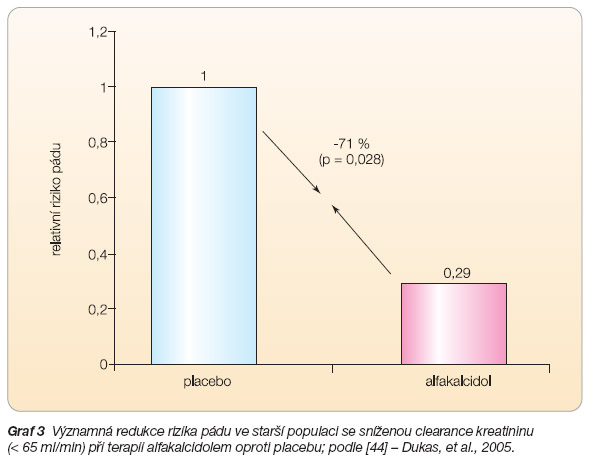
- [44] Dukas L, Schacht E, Mazor Z, Stähelin HB. Treatment with alfacalcidol in elderly people significantly decreases the high risk of falls associated with a low creatinine clearance of <65 ml/min. Osteoporosis Int 2005; 16: 198–203.
- [45] Ringe JD. Osteoporosis in dialogue. 100 questions and 100 answers. Thieme Verlag, Stuttgart 2001.
- [46] Ringe JD, Schacht E. Improving the outcomes of established therapies of osteoporosis by adding the active vitamin D analog alphacalcidol. Rheumatology Int 2007; 28: 103–111.
- [47] Ushiroyma T, Ieda A, Sakai M, et al. Effects of combined use of calcitonin and 1alfa-hydroxycholecalciferol on vertebral bone loss and bone turnover in women with postmenopausal osteopenia and osteoporosis: a prospective study of long term and continuous administration with low dose calcitonin. Maturitas 2001; 40: 229–238.
- [48] Fujita T, Fukase M, Shimada T, Yamamoto H. Treatment of established osteoporosis with 1 alfa(OH) vitamin D3 and low dose of intermitent calcitonin. VBBM 1992; 10: 37–40.
- [49] Gallagher JC, Fowler SE, Detter JR, Sherman SS. Combination treatment with estrogen an calcitriol in the prevention of age-related bone loss. J Clin Endocrinol Metab 2001; 86: 3618–3628.
- [50] Gorai I, Tanaka Y, Iwacki Y. Raloxifen when combined with 1alfa(OH) vitamin D more greatly suppresses bone turnover and increases bone density than when used alone in postmenopausal Japanese women with osteoporosis or osteopenia. J Bone Miner Res 2006; 21 (Suppl. 1): 186.
- [51] Frediani B, Allegri A, Bisohno S, Marcolongo R. Effects of combined treatment with calcitriol plus alendronate on bone mass and bone turnover in postmenopusal osteoporosis. Two years of continuous treatment. Clin Drug Invest 1998; 14: 235–244.
- [52] Ones K, Schacht E. Superiority of a combined treatment of alfacalcidol and alendronate compared to the monotherapies in postmenopausal osteoporosis. Osteoporosis Int 2006; 17 (Suppl. 1): 20.
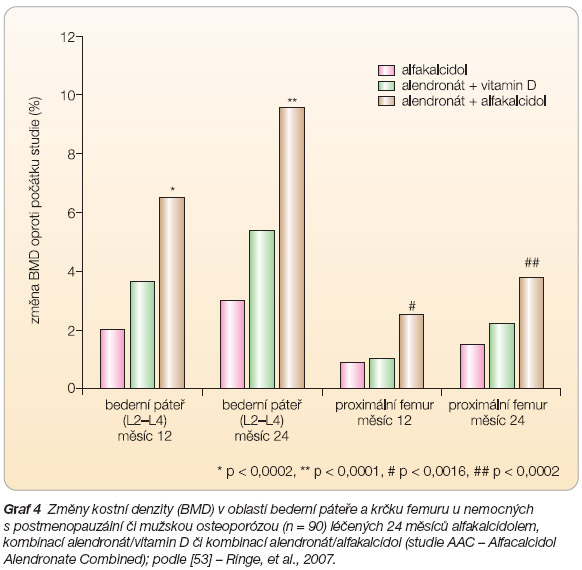
- [53] Ringe JD, Farahmand P, Schacht E, Rozehnal A. Superiority of a combined treatment of Alendronate and Alfacalcidol compared to the combination of Alendronate and plain vitamin D or Alfacalcidol alone in established postmenopausal or male osteoporosis (AAC-Trial). Rheumatol Int 2007; 27: 425–434.
- [54] Štěpán J, Payer J, Abrahámová J. Stratifikace léčby postmenopauzální osteoporózy. Prakt Lék 2004; 84: 500–506.
- [55] Štěpán J. Acidum ibandronicum – léčba postmenopauzální osteoporózy. Remedia 2006; 16: 4–13.