Ambrisentan v léčbě plicní arteriální hypertenze
Plicní hypertenze je definována zvýšením středního tlaku v plicnici a zvýšením plicní cévní rezistence. Nejvíce zkušeností s farmakoterapií je u plicní arteriální hypertenze, která vzniká jako důsledek primárního postižení plicních arteriol. Při specifické léčbě plicní arteriální hypertenze se používají léky ze skupiny prostanoidů, inhibitorů fosfodiesterázy typu 5 a antagonistů endotelinových receptorů.
Ambrisentan je vysoce selektivní antagonista endotelinového receptoru ETA s dlouhým biologickým poločasem, který umožňuje podání 1krát denně. Jeho účinek v léčbě plicní arteriální hypertenze byl studován v řadě střednědobých klinických studií, existují také data o efektu dlouhodobé léčby. Ambrisentan v dávkách 1 mg, 2,5 mg, 5 mg a 10 mg 1krát denně prokazatelně prodlužuje vzdálenost při testu šestiminutovou chůzí, zlepšuje hemodynamiku a prodlužuje dobu do klinického zhoršení. Elevace transamináz nad trojnásobek normy nepřesahuje u léčených nemocných 3 % případů. Ambrisentan neovlivňuje významněji metabolismus warfarinu. Ambrisentan je indikován u nemocných s plicní arteriální hypertenzí ve funkční třídě NYHA II a III ke zlepšení zátěžové kapacity.
Pozn. Klasifikace NYHA I–IV (New York Heart Association) popisuje dle subjektivního stavu pacienta stadium srdečního selhání.
Úvod
Plicní arteriální hypertenze (PAH) je primární onemocnění plicních arteriol hemodynamicky charakterizované vzestupem středního tlaku v plicnici nad 25 mm Hg v klidu a nad 30 mm Hg při zátěži, normálním tlakem v zaklínění a plicní cévní rezistencí vyšší než 3 WU (Woodovy jednotky). PAH bez léčby rychle progreduje a postupně vede k pravostrannému srdečnímu selhání a ke smrti. Do skupiny PAH je řazena především idiopatická a familiární PAH (popsána již v roce 1891 jako skleróza plicní arterie a později známá především jako primární plicní hypertenze) a dále řada stavů, které se idiopatické PAH podobají klinickým obrazem a léčbou a jejichž vznik je asociován s vrozenými zkratovými srdečními vadami, se systémovými onemocněními pojiva, s některými jaterními a infekčními chorobami nebo s abúzem některých anorektik [1]. Minimální prevalence PAH v dospělé populaci se odhaduje na 15 nemocných na milion obyvatel, zhruba 43 % představují nemocní s idiopatickou a familiární PAH. Nejvyšší výskyt PAH je zaznamenáván u pacientů ve věku 41–60 let. Medián přežití neléčeného pacienta s PAH je 2–3 roky, u PAH asociované se systémovými onemocněními pojiva je dokonce ještě kratší. Hlavní změny v oblasti plicní mikrocirkulace u pacientů s PAH zahrnují vazokonstrikci, cévní remodelaci a trombózu v důsledku relativní nadprodukce faktorů s účinky vazokonstrikčními, růstovými a trombogenními (endotelin, serotonin, tromboxan) ve srovnání s tvorbou faktorů s účinky vazodilatačními, antiproliferačními a antitrombotickými (NO, prostacyklin, vazoaktivní intestinální peptid) při endoteliální dysfunkci. Cílem farmakoterapie PAH je ovlivnit vazokonstrikci, remodelaci i prokoagulační stav. Vedle konvenční léčby se zejména v posledním desetiletí významně uplatňuje tzv. specifická farmakoterapie (prostanoidy, antagonisté receptorů pro endotelin, inhibitory fosfodiesterázy typu 5).
Mechanismus účinku
Endotelin-1 (ET-1) je nejsilnější endogenní vazokonstriktor vznikající působením endotelin konvertujícího enzymu na biologicky prakticky neaktivní tzv. big endotelin. Hraje zásadní roli v regulaci kardiovaskulárního systému, respiračního systému a v regulaci metabolismu vody a iontů. Vedle vazokonstrikce indukuje hypertrofii a hyperplazii různých buněk, proliferaci fibroblastů, produkci extracelulární matrix a rovněž aktivuje mechanismy zánětlivé reakce. Hladina cirkulujícího ET-1 je zvýšena za řady patologických okolností, např. u arteriální hypertenze, PAH, aterosklerózy nebo srdečního selhání [2]. Působení ET-1 je zprostředkováno vazbou na receptory ETA a ETB. Receptor ETA je exprimován zejména na buňkách hladkého svalstva a na fibroblastech. Endotelinový receptor ETB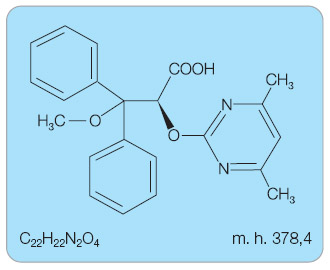 je exprimován na buňkách endotelu a rovněž na buňkách hladkého svalstva, na fibroblastech a makrofázích. Aktivace receptoru ETA je odpovědná za hlavní účinky ET-1, za vazokonstrikci a proliferaci. Naopak izoforma endotelinového receptoru ETB odpovídá za clearance ET-1 a za jeho zpětné vychytávání endoteliálními buňkami, zejména v plicích a v ledvinách. U zdravých jedinců vede aktivace receptoru ETB k vazodilataci díky stimulaci produkce NO a prostacyklinu, dále brání apoptóze a inhibuje expresi endotelin konvertujícího enzymu. Aktivace receptoru ETB však v důsledku jeho exprese na buňkách hladkého svalstva a na fibroblastech může vést také k vazokonstrikci, proliferaci a fibróze. U nemocných s PAH dochází k up-regulaci vazebných míst pro ET v oblasti plicních arteriol. Aktivovaný endotelinový systém u PAH lze ovlivnit duální nebo selektivní blokádou endotelinových receptorů. Ambrisentan je vysoce selektivní nesulfonamidový antagonista receptoru ETA (obr. 1). Poměr afinity k receptoru ETA ve srovnání s receptorem ETB je větší než 4000 : 1 [3]. Po dosažení účinné plazmatické koncentrace je ambrisentanem obsazeno více než 90 % endotelinových receptorů ETA.
je exprimován na buňkách endotelu a rovněž na buňkách hladkého svalstva, na fibroblastech a makrofázích. Aktivace receptoru ETA je odpovědná za hlavní účinky ET-1, za vazokonstrikci a proliferaci. Naopak izoforma endotelinového receptoru ETB odpovídá za clearance ET-1 a za jeho zpětné vychytávání endoteliálními buňkami, zejména v plicích a v ledvinách. U zdravých jedinců vede aktivace receptoru ETB k vazodilataci díky stimulaci produkce NO a prostacyklinu, dále brání apoptóze a inhibuje expresi endotelin konvertujícího enzymu. Aktivace receptoru ETB však v důsledku jeho exprese na buňkách hladkého svalstva a na fibroblastech může vést také k vazokonstrikci, proliferaci a fibróze. U nemocných s PAH dochází k up-regulaci vazebných míst pro ET v oblasti plicních arteriol. Aktivovaný endotelinový systém u PAH lze ovlivnit duální nebo selektivní blokádou endotelinových receptorů. Ambrisentan je vysoce selektivní nesulfonamidový antagonista receptoru ETA (obr. 1). Poměr afinity k receptoru ETA ve srovnání s receptorem ETB je větší než 4000 : 1 [3]. Po dosažení účinné plazmatické koncentrace je ambrisentanem obsazeno více než 90 % endotelinových receptorů ETA.
Farmakologie
Po podání per os se ambrisentan rychle vstřebává a z 99 % se váže na plazmatické proteiny. Plazmatická koncentrace lineárně závisí na dávce a není ovlivněna příjmem potravy. Maximální plazmatické koncentrace je dosaženo během 3–4 hodin po podání 1 dávky. Ambrisentan je metabolizován v játrech glukuronidací. Průměrný eliminační poločas u nemocných s PAH po podání 5–10 mg ambrisentanu je 13,6–16,5 hodiny. To vysvětluje možnost dávkovat přípravek 1krát denně. Na rozdíl od sulfonamidových antagonistů receptorů pro endotelin (bosentan, sitaxsentan) nebyla u ambrisentanu popsána významnější léková interakce při současném podání warfarinu nebo sildenafilu [4, 5]. U nemocných s PAH a s lehkou nebo středně těžkou renální insuficiencí se farmakokinetika ambrisentanu neliší od nemocných bez renální insuficience. Úprava dávek tedy není nutná. Není však dostatek údajů o farmakokinetice ambrisentanu u pacientů s těžkou renální insuficiencí (clearance kreatininu < 20 ml/min). Vliv jaterní insuficience na metabolismus ambrisentanu není znám. Dá se však předpokládat. Proto se nedoporučuje jeho podání u nemocných se závažnější jaterní lézí (Childova-Pughova klasifikace kategorie B nebo C). Teratogenita se považuje za vlastnost všech léčiv ze skupiny antagonistů receptorů pro endotelin. Vylučování ambrisentanu do mateřského mléka není prokázáno. Jeho podání kojícím ženám však není vhodné.
Klinické zkušenosti
Ambrisentan byl studován v řadě klinických studií. 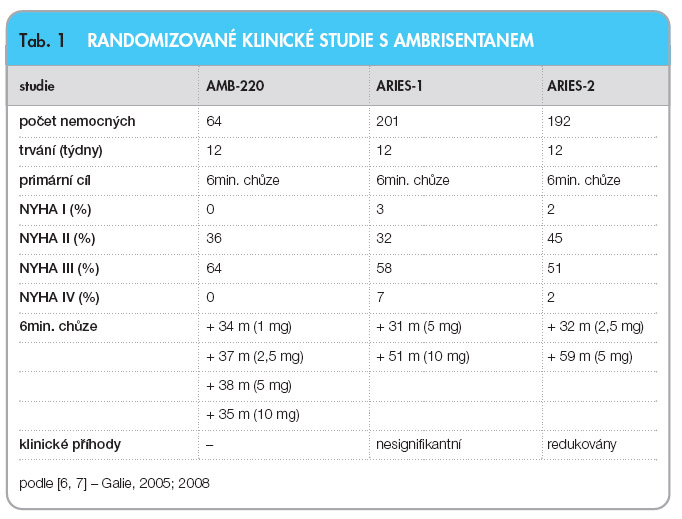 Účinek rozdílných dávek ambrisentanu (1 mg, 2,5 mg, 5 mg a 10 mg 1krát denně) byl zkoušen u 64 nemocných s PAH (idiopatická, při systémových onemocněních pojiva, v důsledku abúzu anorektik a při infekci virem HIV). Studie je označována jako AMB-220 (tab. 1) [6]. Po 12 týdnech se prodloužila vzdálenost při testu šestiminutovou chůzí ve všech 4 skupinách léčených ambrisentanem průměrně o 36 m. Během dalších dvanácti týdnů otevřené fáze studie se vzdálenost prodlužovala a nejlepšího výsledku bylo dosaženo po 24 týdnech léčby (prodloužení o 54 m). Ambrisentan vedl rovněž ke zlepšení symptomů hodnocených funkční klasifikací NYHA. U 36 % nemocných se třída NYHA snížila alespoň o 1 stupeň, zatímco zhoršení bylo pozorováno jen u 3,4 % nemocných. Při léčbě ambrisentanem se rovněž zlepšily hemodynamické parametry, dušnost hodnocená Borgovou škálou a kvalita života.
Účinek rozdílných dávek ambrisentanu (1 mg, 2,5 mg, 5 mg a 10 mg 1krát denně) byl zkoušen u 64 nemocných s PAH (idiopatická, při systémových onemocněních pojiva, v důsledku abúzu anorektik a při infekci virem HIV). Studie je označována jako AMB-220 (tab. 1) [6]. Po 12 týdnech se prodloužila vzdálenost při testu šestiminutovou chůzí ve všech 4 skupinách léčených ambrisentanem průměrně o 36 m. Během dalších dvanácti týdnů otevřené fáze studie se vzdálenost prodlužovala a nejlepšího výsledku bylo dosaženo po 24 týdnech léčby (prodloužení o 54 m). Ambrisentan vedl rovněž ke zlepšení symptomů hodnocených funkční klasifikací NYHA. U 36 % nemocných se třída NYHA snížila alespoň o 1 stupeň, zatímco zhoršení bylo pozorováno jen u 3,4 % nemocných. Při léčbě ambrisentanem se rovněž zlepšily hemodynamické parametry, dušnost hodnocená Borgovou škálou a kvalita života.
Nemocní, kteří ukončili 24 týdnů léčby, byli zařazeni do dlouhodobé otevřené studie. Podle symptomů mohla být dávka ambrisentanu zvyšována. Celkem 50 pacientů dostávalo ambrisentan v monoterapii po dobu 1 roku, 50 % z nich dávku 10 mg denně. Po celou dobu sledování zůstal účinek léčby zachován. Vzdálenost při testu šestiminutovou chůzí byla prodloužena průměrně o 55 m u všech dávkovacích schémat. Zlepšena zůstala rovněž třída NYHA a stupeň dušnosti podle Borga. Jednoroční přežití představovalo 92 % ve srovnání s očekávanými 77 % u srovnatelné neléčené populace. K hlavním referovaným nežádoucím účinkům během prvních 12 týdnů studie patřily otoky dolních končetin, kongesce nosní sliznice, respirační infekce, bolesti hlavy, flush a nauzea. Výskyt jednotlivých nežádoucích účinků nezávisel na dávce ambrisentanu. Elevace transamináz nad trojnásobek normy se vyskytla u 2 nemocných během prvních 24 týdnů léčby. Během otevřené dlouhodobé studie nebylo další zvýšení hladin jaterních transamináz nad trojnásobek normy zaznamenáno.
Účinek ambrisentanu byl dále testován ve 2 randomizovaných klinických studiích fáze 3: ARIES-1 v USA a ARIES-2 v Evropě (Ambrisentan in PAH-A Phase 3, Randomized, Double Blind, Placebo Controlled, Multicenter, Efficacy Study), viz tab. 1 [7].
Ve studii ARIES-1 dostávalo 201 nemocných s PAH ambrisentan v dávce 5 mg nebo 10 mg 1krát denně nebo placebo po 12 týdnů. Vzdálenost při testu šestiminutovou chůzí se prodloužila o 31 m ve skupině léčené dávkou 5 mg denně a o 51 m ve skupině léčené dávkou 10 mg denně. U léčených nemocných se rovněž snižovala třída NYHA a dušnost hodnocená Borgovou škálou. Klesla také plazmatická koncentrace BNP (brain natriuretic peptide). Počet klinických zhoršení definovaných jako úmrtí, transplantace plic, hospitalizace pro zhoršení PAH, atriální septostomie nebo nutnost zahájení alternativní specifické léčby PAH byl ve skupině léčené ambrisentanem 3, ve skupině užívající placebo 6. Rozdíl nebyl statisticky signifikantní. U žádného z pacientů léčených ambrisentanem nedošlo během studie k elevaci transamináz nad trojnásobek normy.
Studie ARIES-2 zahrnula 192 nemocných s PAH. Testována byla dávka 2,5 mg nebo 5 mg ambrisentanu podávaná jednou denně. Kontrolní skupina dostávala placebo. U pacientů léčených 2,5 mg ambrisentanu se vzdálenost při testu šestiminutovou chůzí prodloužila po 12 týdnech o 22 m a u pacientů exponovaných dávce 5 mg o 59 m. Klinické zhoršení se vyskytlo u 6 % léčených pacientů a u 22 % pacientů dostávajících placebo. V léčené skupině se snížila plazmatická koncentrace BNP. Kvalita života hodnocená dotazníkem SF-36 se v léčené populaci zlepšila. Více než trojnásobné zvýšení hladiny jaterních transamináz nebylo pozorováno u žádného z léčených pacientů. V populaci 261 nemocných, kteří dostávali ambrisentan v programu ARIES, byly nejčastějším nežádoucím účinkem periferní otoky, kongesce nosní sliznice, palpitace a flush. Jejich výskyt narůstal s dávkou. Celkem 383 pacientů, kteří ukončili studie ARIES 1 a 2, bylo zařazeno do dlouhodobého sledování [8]. Nemocní, kteří dostávali aktivní léčbu, v léčbě pokračovali. U pacientů z placebové větve byla aktivní léčba zahájena. Průměrná doba léčby činila 1,4 roku. Jednoleté přežití se zásadně nelišilo v jednotlivých skupinách exponovaných různým dávkám ambrisentanu a pohybovalo se mezi 94,7 % a 96,8 %. Výskyt nežádoucích účinků při dlouhodobé léčbě byl srovnatelný s fází kontrolovanou placebem.
Díky nižšímu výskytu hepatopatie při léčbě ambrisentanem ve srovnání s bosentanem a sitaxsentanem se zájem soustředil na jeho využití u nemocných, u nichž léčba ostatními antagonisty receptorů pro endotelin vedla k indukci elevace jaterních testů. V otevřené nekontrolované studii s 36 pacienty, kteří přerušili léčbu sitaxsentanem nebo bosentanem pro zvýšení hladiny transamináz na více než trojnásobek normy, byl podáván po normalizaci výsledku jaterních testů ambrisentan [9]. Z celkového počtu 36 studovaných nemocných jich 25 dostávalo současně prostanoidy nebo inhibitory fosfodiesterázy typu 5. U jednoho nemocného se při dávce 5 mg ambrisentanu denně vyskytla elevace transamináz do pětinásobku normy. K normalizaci došlo po redukci dávky na 2,5 mg denně. Během sledování, kdy medián doby expozice ambrisentanu byl 13 měsíců, nebyla léčba ambrisentanem u žádného nemocného přerušena pro elevaci jaterních testů.
Indikace a kontraindikace
Ambrisentan je indikován u nemocných s PAH ve funkční třídě NYHA II a III ke zlepšení zátěžové kapacity. Jde o první specifický lék u PAH, který je v Evropě registrován i pro funkční třídu NYHA II. Ambrisentan se podává v podobě tablet. Léčba je zahajována dávkou 5 mg podávanou 1krát denně, v případě snášenlivosti lze dávku zvýšit na 10 mg 1krát denně.
Před započetím léčby ambrisentanem je nutno vyloučit graviditu. Během terapie je nezbytná důsledná antikoncepce kombinací 2 metod. Těhotenský test u menoaktivních žen prováděný každý měsíc je samozřejmostí. Ambrisentan nemá být indikován u nemocných s elevací jaterních transamináz nad trojnásobek normy. Jejich pravidelná kontrola má být provedena každý měsíc. Při elevaci na trojnásobek až pětinásobek normy má být proveden kontrolní odběr. Pokud je zvýšená hodnota potvrzena, dávka ambrisentanu má být redukována nebo má být léčba zcela přerušena. Jaterní testy pak mají být kontrolovány každé 2 týdny až do poklesu hodnot pod trojnásobek normy. V případě elevace jaterních transamináz na pětinásobek až osminásobek normy je třeba léčbu ambrisentanem přerušit a vyčkat poklesu hodnot. Pokud hodnoty klesnou pod trojnásobek normy, je možné léčbu ambrisentanem znovu zahájit za pečlivé monitorace jaterních testů. Pokud bylo při léčbě zaznamenáno více než osminásobné zvýšení hladiny jaterních transamináz, musí být terapie ihned přerušena a nemá být znovu zahajována. Terapie ambrisentanem musí být rovněž přerušena, pokud je vzestup hladin transamináz provázen více než dvojnásobným zvýšením hodnot celkového bilirubinu. Při podávání ambrisentanu je také nezbytné měsíčně monitorovat hemoglobin. Pokud dojde ke klinicky významnému poklesu jeho hladiny a není zřetelná jiná příčina, léčbu je třeba přerušit.
Závěr
Ambrisentan je selektivní antagonista endotelinového receptoru ETA podávaný 1krát denně, který u nemocných s PAH vede k významnému zlepšení funkční zdatnosti, hemodynamiky, kvality života a prognózy. Přípravek je dobře tolerován a má lepší bezpečnostní profil než sulfonamidoví antagonisté receptorů pro endotelin. Ač je výskyt hepatotoxicity a lékových interakcí při léčbě ambrisentanem relativně vzácný, obezřetnosti je třeba zejména při současném podání léků metabolizovaných přes systém cytochromu P-450 (sildenafil, warfarin). Ambrisentan je v ČR registrován pod názvem Volibris. Ambrisentan se nepochybně stane významnou součástí terapie PAH u nemocných v klinickém stadiu NYHA II a III.
Seznam použité literatury
- [1] Simonneau G, Galie N, Rubin LJ, et al. Clinical classification of pulmonary hypertension. J Am Coll Cardiol 2004; 43 (12 Suppl S): 5S–12S.
- [2] Schiffrin EL, Touyz RM. Vascular biology of endothelin. J Cardiovasc Pharmacol 1998; 32 (Suppl. 3): S2–S13.
- [3] Vatter H, Zimmermann M, Jung C, et al. Effect of the novel endothelin(A) receptor antagonist LU 208075 on contraction and relaxation of isolated rat basilar artery. Clin Sci 2002; 103 (Suppl. 48): 408S–413S.
- [4] Gerber MJ, Dufton C, Pentikis H, et al. Ambrisentan has no clinically relevant effect on the pharmacokinetics or pharmacodynamics of warfarin. Chest 2006; 130 (Suppl. 4): 256S.
- [5] Dufton C, Gerber M, Yin O, et al. No clinically relevant pharmacokinetic interaction between ambrisentan and sildenafil. Chest 2006; 130 (Suppl. 4): 254S.
- [6] Galie N, Badesch D, Oudiz R, et al. Ambrisentan therapy for pulmonary arterial hypertension. J Am Coll Cardiol 2005; 46: 529–535.
- [7] Galie N, Olschewski H, Oudiz RJ, et al. Ambrisentan for the treatment of pulmonary arterial hypertension: Results of the ambrisentan in pulmonary arterial hypertension, randomized, double-blind, placebo-controlled, multicenter, efficacy (ARIES) study 1 and 2. Circulation 2008; 117: 3010–3019.
- [8] Oudiz RJ, for the ARIES study group. Long-term ambrisentan therapy provides sustained benefit in patients with pulmonary arterial hypertension. Chest 2007; 132: 474a.
- [9] McGoon M, Frost A, Oudiz R, et al. Ambrisentan rescue therapy in patients with pulmonary arterial hypertension who discontinued bosentan or sitaxsentan due to liver function abnormalities. Chest 2006; 130: 254S.