Andexanet alfa – specifické antidotum při závažném krvácení po léčbě apixabanem nebo rivaroxabanem
Souhrn:
Kvasnička J. Andexanet alfa – specifické antidotum při závažném krvácení po léčbě apixabanem nebo rivaroxabanem. Remedia 2020; 30: 284–286.
Článek podává přehled o novém antidotu přímých perorálních inhibitorů FXa apixabanu a rivaroxabanu, kterým je andexanet alfa (přípravek Ondexxya®). Uvedeny jsou také výsledky uskutečněných klinických studií fáze I–III/VI a dávkování andexanetu alfa při život ohrožujícím krvácení.
Summary:
Kvasnicka J. Andexanet alfa – specific antidote to severe bleeding after a treatment with apixaban or rivaroxaban. Remedia 2020; 30: 284–286.
A review of a new antidote for direct oral inhibitors of FXa, apixaban and rivaroxaban, andexanet alfa (Ondexxya®), has been reviewed. The results of ongoing phase I–III/VI clinical trials are presented with its dosage for the life‑threatening bleeding.
Key words: antidote, Fxa inhibitor, andexanet alfa, bleeding
Nová perorální antikoagulancia
(NOAC) nebo také přímá perorální antikoagulancia (DOAC), mezi
něž řadíme přímý inhibitor trombinu dabigatran etexilát
(přípravek Pradaxa)
a přímé inhibitory aktivovaného faktoru X (FXa) apixaban
(přípravek Eliquis), edoxaban (přípravek Lixiana) a rivaroxaban
(přípravek Xarelto), se v České republice postupně
používají již od roku 2002. V indikaci prevence
ischemické cévní mozkové příhody při nevalvulární fibrilaci
síní nebo léčba žilního tromboembolismu nyní již pomalu
vytěsňují perorální nepřímé antikoagulancium warfarin, které
je používáno k antikoagulační léčbě již od padesátých
let minulého století. Výhody uvedených NOAC/DOAC spočívají
především v tom, že na rozdíl od warfarinu nemusí
být antikoagulační účinek při používání jednotné dávky
během léčby laboratorně kontrolován, léčbu DOAC/NOAC také
provází nižší výskyt intrakraniálních krvácení.
Antidota v klinické praxi
Bezpečnost antikoagulační léčby se nicméně zvyšuje s možností použití specifických antidot v případě krvácení nebo k eliminaci antikoagulačního účinku v případě neodkladné operace apod. Antidotem warfarinu je běžně dostupný vitamin K1 a při nutnosti rychlé obnovy koagulace lze použít koncentráty protrombinového komplexu se třemi koagulačními faktory – II, IX, X (PCC) – nebo koncentráty se čtyřmi koagulačními faktory – II, IX, X a VII – protrombinového komplexu (4 F PCC) a s jejich dávkováním dle výše zjištěné hodnoty mezinárodního normalizovaného poměru (INR).
Od roku 2015 je již také k dispozici antidotum prvního přímého perorálního antikoagulancia dabigatran etexilátu (přípravek Praxbind), které je u dospělých pacientů indikováno v situacích, kdy je třeba urychleně zvrátit antikoagulační účinky při naléhavých chirurgických nebo jiných urgentních výkonech či při život ohrožujícím nebo nekontrolovaném krvácení [1]. Pro přímé perorální inhibitory FXa však dosud žádné specificky reagující antidotum k dispozici nebylo, k zástavě krvácení je používána nespecifická substituce s PCC, respektive s přípravky 4 F PCC [2]. V případě život ohrožujícího krvácení je možné použít i eptakog alfa, rekombinantní aktivovaný FVIIa (přípravek NovoSeven) [3], který je jinak určen výhradně k substituci při krvácení nemocných s hemofilií A nebo B a získaným inhibitorem FVIII nebo FIX anebo u jiných vzácných krvácivých stavů.
V roce 2018 však již bylo ve Spojených státech amerických schváleno použití antidota přímých perorálních inhibitorů FXa apixabanu a rivaroxabanu [4], které bylo v roce 2019 podmíněně registrováno i v Evropě [5], a nyní je již možné jej získat i v České republice. Tímto antidotem je andexanet alfa (přípravek 2. generace Ondexxya).
Farmakologický efekt andexanetu alfa
Andexanet alfa je rekombinantní formou aktivovaného proteinu lidského FX, která specificky reverzibilně váže v poměru 1 : 1 inhibitory FXa a odstraňuje je z cirkulace, včetně přímých perorálních inhibitorů FXa. Přípravek je rekombinantní DNA technikou syntetizován v ovariálních buňkách čínského křečka. V jeho molekule je přitom uměle potlačena prokoagulační aktivita při záměně aminokyseliny serinu za alanin. To způsobí, že molekula andexanetu alfa není po odstranění domény kyseliny gama karboxyglutamové (Gla) schopna vazby s protrombinázovým komplexem, a tedy zde nemůže štěpit a aktivovat FII protrombin na trombin (aktivovaný FII). Andexanet alfa tak mimo vyvazování cirkulujících přímých, ale i nepřímých inhibitorů FXa ztrácí schopnost aktivovat koagulaci.
Původní molekula rekombinantního proteinu andexanetu alfa byla nazvána r Antidote (PRT 064445). Vyrobila ji kalifornská společnost Portola a účinek této molekuly byl nejprve s úspěchem ověřen při inhibici antikoagulačního efektu inhibitorů FXa (apixaban, rivaroxaban, betrixaban, enoxaparin, fondaparinux) na zvířecích modelech [6]. Nejasná však zatím zůstává role zjištěné vazby andexanetu alfa na inhibitor dráhy tkáňového faktoru (tissue factor pathway inhibitor, TFPI). To by mohlo po podání andexanetu alfa vést k omezení účinku tohoto přirozeného inhibitoru koagulace, který je in vivo uvolňován při zátěži z endotelií [7].
Klinické hodnocení
Farmakokinetická studie u zdravých dobrovolníků
Po úvodních testech s molekulou
andexanetu alfa a přímými inhibitory FXa s pokusnými
zvířaty bylo přistoupeno ke klinickému testování fáze
I v randomizovaném, dvojitě zaslepeném, placebem
kontrolovaném pokusu se 32 zdravými dobrovolníky. Získané
farmakokinetické parametry andexanetu alfa v dávkách 30, 90,
300 a 600 mg jsou v přehledu [8] uvedeny v tabulce 1. Biologický poločas andexanetu alfa byl velikostí
dávky ovlivněn poměrně málo, i když jeho koncentrace
v krvi narůstala.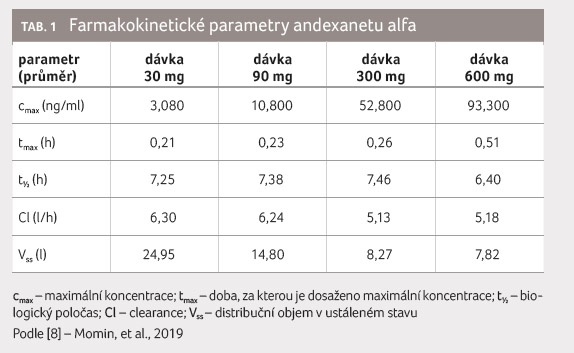
Farmakodynamická studie u zdravých dobrovolníků
Poté již následovaly dvě randomizované a placebem kontrolované studie fáze II, které měly za úkol zjistit efekt i.v. bolusu a poté kontinuální 120minutové infuze andexanetu alfa na inhibici účinku apixabanu (studie ANNEXA A, 14 503) podávaného v dávce 2× 5 mg denně po dobu 3,5 dne a na inhibici rivaroxabanu (studie ANNEXA R, 14 504) podávaného v dávce 20 mg čtyři dny zdravým dobrovolníkům vyššího věku (50–75 let). V obou studiích bylo zjištěno, že andexanet alfa potlačil inhibici FXa (z více než 90 %) s rychlým dosažením maxima již za dvě minuty po podání bolusové dávky. Nízká koncentrace nevázaného inhibitoru FXa se pak udržela po celou dobu infuze a pokračovala dále i po skončení infuze. Jasný efekt antidota proti placebu se u osob léčených apixabanem nebo rivaroxabanem projevil ještě vzestupem generace trombinu [9]. Vedle klinicky nezávažných komplikací (zvýšení teploty, nával horka, pocit horkosti, bolest hlavy, kašel nebo dušnost) bylo při laboratorním vyšetření pozorováno přechodné zvýšení koncentrace D dimeru nebo fragmentů protrombinu F1+2 v krevní plazmě. Tromboembolické příhody však u testovaných zdravých jedinců pozorovány nebyly.
Na závěr pak následovala další klinická multicentrická prospektivní studie ANNEXA 4 (14 505), nyní již testující účinek andexanetu alfa u krvácejících pacientů léčených inhibitory FXa. Tuto kohortu (n = 352) tvořili především staří nemocní (průměrný věk byl 77 let) s různými chorobami kardiovaskulárního systému, z nichž většina (80 %) užívala perorální přímá antikoagulancia pro prevenci ischemického iktu při fibrilaci síní.
Studie ANNEXA 4
Studie ANNEXA 4, nyní již
s andexanetem alfa 2. generace Annexa
(v Evropě Ondexxya),
měla za cíl zjistit jeho efekt při život ohrožujícím nebo
závažném krvácení (z toho 64 % intrakraniální a 26 %
gastrointestinální krvácení) u pacientů užívajících
apixaban, rivaroxaban, nebo v menší míře edoxaban či
enoxaparin. V rivaroxabanové skupině byla dávka andexanetu
alfa odstupňována podle doby, kdy krvácející naposledy požili
rivaroxaban. Pokud nastalo krvácení po více než sedmi
hodinách po požití, byla zvolena nižší dávka andexanetu
alfa – 400 mg i.v. bolus a poté 480 mg v infuzi
aplikované déle než dvě hodiny. Stejné nižší dávkování
bylo zvoleno u všech osob, které krvácely při léčbě
apixabanem. Pokud však v rivaroxabanové skupině došlo
ke krvácení v době kratší než sedm hodin po požití
rivaroxabanu či doba požití nebyla známa, byla zvolena vyšší
dávka andexanetu alfa – bolus 800 mg i.v. a poté 960 mg
andexanetu alfa v infuzi. Tato vyšší dávka byla podána
i několika krvácejícím pacientům léčeným edoxabanem či
po injekci enoxaparinu. Účinek antidota byl hodnocen podle
dvou primárních cílových ukazatelů: a) procentuální změna
nálezů anti FXa (respektive koncentrace zvoleného přímého
inhibitoru FXa v ng/ml) v krvi z výchozího stavu
k nejnižší hodnotě dosažené po bolusové dávce
do konce infuze a b) míra hemostázy (dobrá nebo
vynikající hemostatická účinnost v porovnání se slabou
nebo nulovou) dosažené během 12 hodin po infuzi. Kritéria
dosažené hemostázy [8] jsou uvedena v tabulce 2,
hodnocení pak prováděla nezávislá komise.
Před podáním andexanetu alfa byl u pacientů užívajících apixaban zjištěn medián anti FXa 149,7 ng/ml a u pacientů užívajících rivaroxaban medián 211,8 ng/ml. Po podání antidota došlo k poklesu anti FXa z výchozí hodnoty o –93,4 % (skupina s apixabanem) a o –92,5 % (skupina s rivaroxabanem). Hemostatická účinnost andexanetu alfa pak byla komisí vyhodnocena jako dobrá až vynikající u léčených 81,9 % pacientů. Při hodnocení bezpečnosti bylo zjištěno, že během 30denního sledování zemřelo 54 pacientů (15,4 %). Příčiny úmrtí byly jednak kardiovaskulární (n = 27) – hemoragický nebo ischemický iktus, náhlá srdeční smrt, selhání srdeční pumpy, infarkt myokardu aj., jednak nekardiovaskulární (n = 27) – respirační selhání, sepse, trauma, nádor aj. To dokazuje, že krváceli pacienti, kteří již měli řadu závažných onemocnění před zařazením do studie.
Ve studii ANNEXA 4 se však u 36 (10,3 %) pacientů vyskytla i tromboembolická komplikace, a to s těmito projevy: cerebrovaskulární příhoda (35,7 %), hluboká žilní trombóza (33,1 %), akutní infarkt myokardu (19,0 %), plicní embolie (11,9 %) a tranzitorní ischemická ataka (2,4 %). V diskusi k publikovaným výsledkům autoři uvádějí, že výskyt tromboembolických příhod nelze přičítat „prokoagulačnímu“ efektu andexanetu alfa, ale výchozímu stavu krvácejících pacientů a „hyperkoagulační“ reakci organismu na krvácení, která se projevila při poklesu účinku antikoagulancií. V klinické studii fáze II prováděné u zdravých osob k nim po podání andexanetu alfa nedocházelo [10].
Zvláštní populace pacientů
Důležité jsou také uváděné údaje o farmakokinetice u zvláštních skupin pacientů dle SPC Ondexxya [5].
Věk a pohlaví
Ve studii porovnávající farmakokinetiku andexanetu alfa u starších (62–69 let) a mladších (26–42 let) zdravých pacientů nebyl mezi oběma skupinami zjištěn statisticky významný rozdíl. Dávkování není tedy třeba upravovat dle výše věku. Na základě farmakokinetické analýzy populace bylo zjištěno, že různost pohlaví nemá klinicky významný účinek na farmakokinetiku andexanetu alfa.
Pacienti s poruchou funkce ledvin nebo jater
Žádná klinická hodnocení farmakokinetiky andexanetu alfa u pacientů s poruchou funkce ledvin nebo jater nebyla provedena. Upravovat dávku u pacientů s poruchou funkce ledvin nebo jater však není třeba, protože andexanet alfa má nízkou až nulovou renální clearance, a protože proteinová terapeutika nejsou vylučována žlučí a/nebo stolicí.
Dávkování andexanetu alfa
Dávkování andexanetu alfa při život
ohrožujícím nebo jiném závažném krvácení, které je uvedeno
v SPC přípravku Ondexxya
[5], přibližují tabulky 3
a 4. Záleží
na době, kdy po požití léku došlo ke krvácení,
a na dávce léku.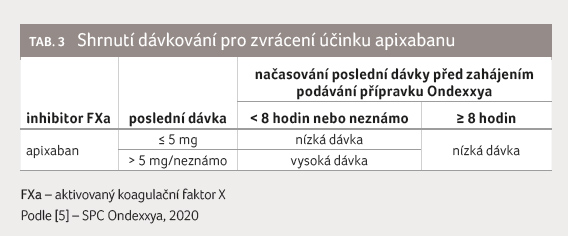
Diskuse
Závěrem je také třeba vysvětlit,
proč zatím byla přípravku Ondexxya
v Evropě udělena jen podmíněná registrace. Hlavním
problémem je, že ve studii ANNEXA 4 nebyla kontrolní
skupina léčena dosud doporučovaným způsobem (např. s 4 F
PCC). Dále zde byl testován poněkud jiný přípravek, andexanet
alfa 2. generace, než tomu bylo v klinickém hodnocení
fáze II nebo I. Výrobce má proto ještě předložit
vyjasnění, proč došlo k trombotickým příhodám, dodat
výsledky srovnávací studie mezi přípravky 1. a 2. generace
ve vztahu k výši dávky antidota (studie 19 514),
dále výsledky použití andexanetu alfa u pacientů
s intrakraniálním krvácením užívajících vedle
rivaroxabanu, apixabanu i edoxaban (studie 18 513) a měl
by také předložit aktualizovaný farmakokinetický
a farmakodynamický model s použitím již dřívějších
dat minulých studií, včetně aplikace u osob japonského
etnika. Konečné datum, do kdy je třeba vše doložit, bylo
stanoveno na rok 2023, viz SPC Ondexxya
[5].
Další překážkou pro použití andexanetu alfa v běžné praxi bude vysoká cena přípravku. Ve vyšší koncentraci stojí nyní dávka Ondexxya asi 500 000 Kč (písemné sdělení lékárny Všeobecné fakultní nemocnice v Praze na dotaz autora). To je tedy asi desetkrát více, než je cena antidota dabigatran etexilátu (přípravek Praxbind). Převyšuje také mnohonásobně cenu alternativní léčby při krvácení s 4 F PCC [11]. Ondexxya je také dle SPC indikována jen při krvácení při léčbě apixabanem nebo rivaroxabanem. Neměla by se tedy zatím používat při krvácení během léčby dalším přímým perorálním inhibitorem FXa edoxabanem.
Nadějné je však to, že přes uvedení andexanetu alfa na trh není zatím ještě ukončen další výzkum v oblasti jiných možných antidot inhibitorů FXa, a uvidíme také, co přinese další vývoj při hledání a klinickém testování univerzálního antidota přímých i nepřímých inhibitorů FXa [12].
Podpořeno MZ ČR – RVO VFN64165.
Seznam použité literatury
- [1] Kvasnička J, Marková M. Farmakoterapie v hematologii. In: Marek J, Vrablík M, eds. Markova farmakoterapie vnitřních nemocí; 5., zcela přepracované a doplněné vydání. Praha: Grada, 2019: 269–344.
- [2] Čihák R, Haman L, Táborský M. The 2018 European Heart Rhythm Association Practical Guide on the use of non‑vitamin K antagonist oral anticoagulants in patients with atrial fibrillation. Summary of the document prepared by the Czech Society of Cardiology. Cor et Vasa 2018; 60: e421–e447.
- [3] Kvasnička J, Penka M, Kvasnička T, et al. Doporučení České společnosti pro trombózu a hemostázu České lékařské společnosti J. E. Purkyně pro bezpečnou léčbu novými perorálními antikoagulancii (NOAC) – dabigatran etexilatem, apixabanem a rivaroxabanem. Vnitřní lékařství 2015; 61: 537–546.
- [4] Heo YA. Andexanet Alfa: First Global Approval. Drugs 2018; 78: 1049–1055.
- [5] Souhrn údajů o přípravku Ondexxya, SÚKL [online]. Dostupné na: http://www.sukl.cz [cit. 2020‑03‑12].
- [6] Le G, De Guzman FR, Hollenbach SJ, et al. A specific antidote for reversal of anticogulation by direct and indirect inhibitors of coagulation factor Xa. Nat Med 2013; 19: 446–451.
- [7] Lu G, Lin J, Coffey G, et al. Interaction of andexanet alfa, a universal antidote to fXA inhibitors, with tissue factor pathway inhibitor enhances reversal of fXA inhibitor‑induced anticoagulation [abstract]. J Thromb Haemost 2015; 13(Suppl 2): 634–635.
- [8] Momin JH, Hughes GJ. Andexanet alfa (Andexxa) for the reversal of direct oral anticoagulants. Pharm Ther 2019; 44: 530–532.
- [9] Siegal DM, Curnutte,JT, Connolly SJ, et al. Andexanet Alfa for the Reversal of Factor Xa Inhibitor Activity. N Engl J Med 2015; 373: 2413–2424.
- [10] Connolly SJ, Crowther M, Eikelboom JW, et al. Full study report of andexanet alfa for bleeding associated with factors Xa inhibitors. N Engl J Med 2019; 380: 1326–1335.
- [11] Frontera JA, Bhatt P, Lalchan R, et al. Cost comparison of andexanet versus prothrombin complex concentrates for direct factor Xa inhibitor reversal after hemorrhage. J Thromb Thrombolysis 2020; 49: 121–131.
- [12] Kalathottukaren MT, Creagh AL, Abbina S, et al. Comparison of reversal activity and mechanism of action of UHRA, andexanet, and PER977 on heparin and oral FXa inhibitors. Blood Adv 2018; 2: 2104–2114.