Atezolizumab v první linii léčby neskvamózního metastatického nemalobuněčného karcinomu plic
Souhrn:
Koubková L. Atezolizumab v první linii léčby neskvamózního metastatického nemalobuněčného karcinomu plic. Remedia 2019; 29: 319–322.
Imunoterapie je již nedílnou součástí léčby metastatického nemalobuněčného karcinomu plic (non‑small cell lung cancer, NSCLC). Výsledky řady studií prokázaly prodloužení celkové doby přežití nejprve ve vyšších liniích léčby, nyní již máme k dispozici závěry klinických hodnocení, v nichž byl prokázán prospěch z imunoterapie podávané v kombinaci s chemoterapií v první linii léčby, a to bez ohledu na expresi PD‑L1 (ligandu receptoru programované buněčné smrti 1). Ve studii fáze III IMpower150 byl hodnocen přínos kombinace atezolizumabu, bevacizumabu a chemoterapie u pacientů s dříve neléčeným neskvamózním metastatickým NSCLC. Na základě výsledků hodnocení byla kombinace atezolizumab, bevacizumab, paklitaxel a karboplatina schválena americkým Úřadem pro kontrolu potravin a léčiv (FDA) v prosinci 2018 a Evropskou lékovou agenturou (EMA) v březnu 2019 v první linii léčby metastatického neskvamózního NSCLC včetně pacientů s mutací genu EGFR či s přestavbou genu ALK po selhání cílené terapie.
Summary:
Koubkova L. Atezolizumab in the first line of treatment for non-squamous metastatic non-small cell lung cancer. Remedia 2019; 29: 319–322.
Immunotherapy is already an integral part of the treatment of metastatic non‑small cell lung cancer (NSCLC). The results of a number of studies have shown an increase in overall survival time in higher treatment lines, and we now have the results of clinical trials that have demonstrated the benefit of immunotherapy in combination with chemotherapy in the first line, regardless of PD‑L1 expression (programmed cell death receptor ligand 1). In Phase III IMpower150 trial, the benefit of the combination of atezolizumab, bevacizumab and chemotherapy was evaluated in patients with previously untreated non‑squamous metastatic NSCLC. Based on the results of the evaluation, the combination of atezolizumab, bevacizumab, paclitaxel and carboplatin was approved by the US Food and Drug Administration (FDA) in December 2018 and the European Medicines Agency (EMA) in March 2019 in the first‑line treatment of metastatic non‑squamous NSCLC including patients with EGFR mutation or alteration of the ALK gene after failure of targeted therapy.
Key words: non‑small cell lung cancer, immunotherapy, atezolizumab
Úvod
Imunoterapie není zaměřena na samotný nádor, ale na imunitní systém pacienta. Cílem léčby jsou povrchové antigeny přítomné na nádorových a imunitních buňkách. Strategie založená na protilátkách inhibujících kontrolní body imunitní reakce může výrazně zlepšit protinádorovou imunitní odpověď. Ligand receptoru programované buněčné smrti 1 (PD L1) může být exprimován na nádorových buňkách a/nebo na nádor infiltrujících imunitních buňkách a může přispívat k inhibici protinádorové imunitní odpovědi v nádorovém mikroprostředí. Vazba PD L1 na PD 1 a B7.1 receptory nacházející se na T lymfocytech a na antigen prezentujících buňkách potlačuje cytotoxickou T buněčnou aktivitu, proliferaci T lymfocytů a tvorbu cytokinů.
Atezolizumab (Tecentriq®) je modifikovaná humanizovaná monoklonální protilátka typu imunoglobulinu G1 (IgG1) proti PD L1 s odstraněnou funkcí Fc domény, která se přímo váže na PD L1 a poskytuje duální blokádu PD 1 a B7.1 receptorů. Tím uvolňuje inhibici imunitní odpovědi zprostředkované vazbou PD L1/PD 1, čímž dochází k reaktivaci protinádorové imunitní odpovědi bez navození buněčné cytotoxicity závislé na protilátkách. Atezolizumab neovlivňuje interakci PD L2/PD 1, což umožňuje zachování inhibičních signálů zprostředkovaných PD L2/PD 1.
Již ve studii OAK fáze III [1] prokázal atezolizumab přínos v celkovém přežití (overall survival, OS) oproti docetaxelu u pacientů s dříve léčeným NSCLC bez ohledu na histologii nebo expresi PD L1. Medián OS byl 13,8 měsíce (95% CI [interval spolehlivosti] 11,8–15,7) vs. 9,6 měsíce (95% CI 8,6–11,2); HR (poměr rizik) 0,73 (95% CI 0,62–0,87; p = 0,0003). V říjnu 2016 byl americkým Úřadem pro kontrolu potravin a léčiv (FDA) a v září 2017 Evropskou lékovou agenturou (EMA) schválen pro léčbu metastatického NSCLC progredujícího po předchozí léčbě platinovým dubletem.
Přidání atezolizumabu k bevacizumabu a chemoterapii ve studii IMpower150 předpokládalo, že jak bevacizumab, tak chemoterapie mohou mít imunomodulační efekt a zvýšit tak účinnost atezolizumabu.
Studie IMpower150
IMpower150 byla mezinárodní multicentrická, otevřená randomizovaná studie fáze III, v níž byl hodnocen přínos kombinace atezolizumabu, bevacizumabu a chemoterapie u pacientů s dříve neléčeným metastazujícím neskvamózním NSCLC [2,3]. Studie byla uspořádána do tří léčebných ramen: atezolizumab, karboplatina a paklitaxel (ACP), bevacizumab, karboplatina a paklitaxel (BCP) nebo atezolizumab, bevacizumab, karboplatina a paklitaxel (ABCP). Od března 2015 do prosince 2016 bylo zařazeno 1 202 pacientů, kteří byli randomizováni v poměru 1 : 1 : 1. Indukční léčba (atezolizumab 1 200 mg, bevacizumab 15 mg/kg, paklitaxel 200 mg/m2, karboplatina AUC [plocha pod křivkou plazmatické koncentrace] 6) aplikovaná ve 4–6 cyklech byla podávána každé tři týdny, následovala udržovací léčba atezolizumabem, bevacizumabem nebo oběma přípravky do progrese hodnocené dle kritérií RECIST (Response Evaluation Criteria in Solid Tumors) či do neakceptovatelné toxicity. Povoleno bylo pokračování v léčbě atezolizumabem i po progresi, jestliže byl patrný klinický prospěch z terapie. Přechod k léčbě (crossover) atezolizumabem nebyl ve studii povolen.
Demografická charakteristika a výchozí
onemocnění pro studijní populaci byly mezi léčebnými rameny
dobře vyváženy. Medián věku činil 63 let (rozmezí 31‒90
let) a 60 % pacientů představovali muži. Většinu
pacientů tvořili běloši (82 %). Přibližně 10 %
nemocných mělo známou mutaci EGFR (receptor pro epidermální
růstový faktor), 4 % měla známé přestavby ALK
(anaplastická lymfomová kináza), u 14 % byly přítomny
výchozí jaterní metastázy a většina pacientů byli kuřáci
nebo bývalí kuřáci (80 %). Výchozí výkonnostní stav
podle škály ECOG (Eastern Cooperative Oncology Group) byl 0 (43 %)
nebo 1 (57 %). Celkem 51 % osob trpělo nádorem s expresí
PD L1 ≥ 1 % TC (na nádorových buňkách)
nebo ≥ 1 % IC (na tumor infiltrujících
imunitních buňkách) a 49 % nádorem s expresí
PD L1 < 1 % TC a < 1 % IC. Randomizace
byla stratifikována podle pohlaví, přítomnosti jaterních
metastáz a exprese PD L1 na TC a IC.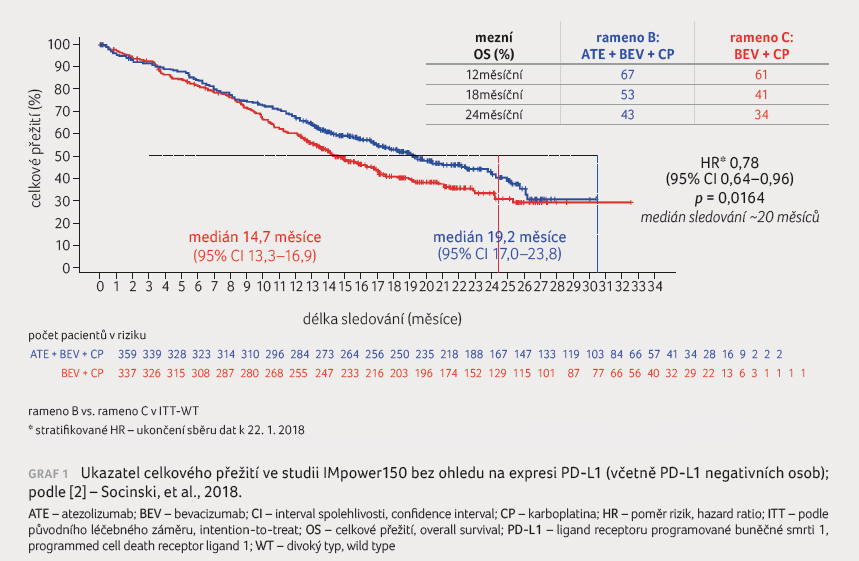
Dva primární cílové ukazatele
představovaly hodnocení přežití bez progrese (progression free
survival, PFS) řešitelem v ITT (intention to treat)
populaci bez známé genetické alterace v genu EGFR/ALK ‒
ITT WT (wild type) populace ‒ a ve WT populaci
s vysokou expresí genového podpisu pro efektorové T lymfocyty
(exprese PD L1, CXCL9 a IFNγ messenger RNA; tzv. Teff high
WT populace) a OS v ITT WT populaci. Medián PFS ve WT
byl delší ve skupině léčené ABCP než ve skupině
s léčbou BCP (8,3 měsíce oproti 6,8 měsíce; HR 0,62;
95% CI 0,52–0,74; p < 0,001).
V Teff high WT populaci dosahovalo při léčbě ABCP PFS
11,3 měsíce vs. 6,8 měsíce při léčbě BCP (HR 0,51; 95% CI
0,38–0,68; p < 0,001).
Medián OS byl rovněž delší ve skupině ABCP než při
léčbě BCP (19,2 měsíce vs. 14,7 měsíce; HR 0,78; 95%
CI 0,64‒0,96; p = 0,02),
graf 1. Ukazatele PFS
a OS byly také delší ve skupině s léčbou ABCP
než s léčbou BCP u pacientů s mutacemi genu EGFR
nebo s translokacemi genu ALK (PFS 9,7 měsíce vs. 4,1 měsíce;
HR 0,59; 95% CI 0,37‒0,94; OS nedosaženo vs. 17,5 měsíce; HR
0,54; 95% CI 0,29‒1,03) a u pacientů s jaterními
metastázami (PFS 7,4 měsíce vs. 4,9 měsíce; HR 0,42; 95% CI
0,26‒0,66; OS 13,2 měsíce vs. 9,1 měsíce; HR 0,54; 95% CI
0,33‒0,88), graf 2A, B.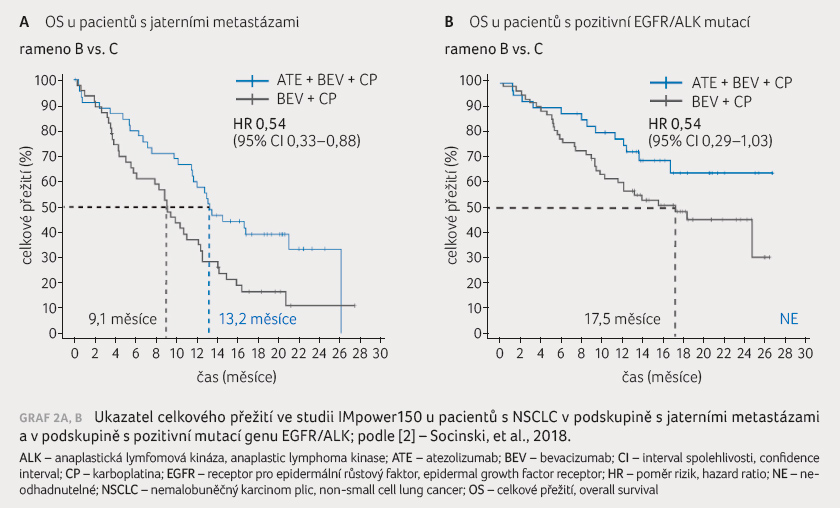
Studie prokázala, že přidání atezolizumabu k bevacizumabu s chemoterapií významně prodlužuje PFS a OS u dříve neléčených pacientů s neskvamózním NSCLC. Ukazatel PFS po 12 měsících byl dvojnásobně vyšší v rameni s léčbou ABCP oproti rameni s BCP (36,5 % vs. 18,0 %) a celková léčebná odpověď (ORR) byla rovněž vyšší v rameni s ABCP (63,5 % vs. 48 %). Přežití bez progrese v rameni ABCP bylo delší ve všech podskupinách podle exprese PD L1 a tzv. Teff gene signature expression (exprese genového podpisu pro efektorové T lymfocyty), včetně pacientů s nízkou nebo negativní expresí PD L1 a nízkou Teff gene signature expression. Vyšší exprese PD L1 byla spojena s lepším výsledkem PFS, prospěch byl podobný jako u vysoké Teff gene signature expression, což ukazuje na jejich podobnou prediktivní hodnotu.
Bezpečnostní profil kombinované léčby atezolizumabem s bevacizumabem a chemoterapií byl v souladu s bezpečnostním profilem jednotlivých přípravků, a to včetně případů krvácení v souvislosti s podáním bevacizumabu. Imunitně podmíněné nežádoucí účinky byly podobné jako při monoterapii atezolizumabem. Většina nežádoucích účinků byla přechodná a limitovaná na indukční fázi s chemoterapií.
Závěr
Schválení kombinace atezolizumabu, bevacizumabu, paklitaxelu a karboplatiny v první linii léčby rozšířilo možnosti terapie pacientů s metastatickým neskvamózním NSCLC. Za pozornost jistě stojí to, že do studie byli zařazeni i pacienti s prokázanou mutací EGFR a s přestavbou genu ALK, kteří progredovali po léčbě inhibitory tyrozinkinázy. Monoterapie checkpoint inhibitory v minulosti neprokázala u těchto pacientů větší efekt než standardní chemoterapie, a proto do studií s imunoterapií nebývají zařazováni. Tito nemocní jsou však často po ukončení cílené léčby v klinicky velmi dobrém stavu, a jsou proto vhodní k další účinné terapii. Přítomnost jaterních metastáz je negativním prognostickým faktorem a rovněž u těchto pacientů prokázala kombinace příznivý účinek léčby. Studie doložila efektivnost kombinované terapie bez ohledu na míru exprese PD L1, tedy i pro nemocné s nízkou, negativní nebo neznámou expresí PD L1, kteří tvoří většinu osob s metastatickým NSCLC.
Podpořeno projektem Ministerstva zdravotnictví koncepčního rozvoje výzkumné organizace 00064203 FN Motol.
Seznam použité literatury
- [1] Rittmeyer A, Barlesi F, Waterkamp D, et al. Atezolizumab versus docetaxel in patients with previously treated non‑small‑cell lung cancer (OAK): a phase 3, open‑label, multicentre randomised controlled trial. Lancet 2017; 389: 255‒265.
- [2] Socinski MA, Jotte RM, Cappuzzo F, et al. Atezolizumab for First‑Line Treatment of Metastatic Nonsquamous NSCLC. N Engl J Med 2018; 378: 2288‒2301.
- [3] Reck M, Mok TSK, Nishio M, et al. Atezolizumab plus bevacizumab and chemotherapy in non‑small‑cell lung cancer (IMpower150): key subgroup analyses of patients with EGFR mutations or baseline liver metastases in a randomised, open‑label phase 3 trial. Lancet Resp Med 2019; doi: 10.1016/s2213‑2600(19)30084‑0.