Augmentační terapie alfa‑1 antitrypsinem – současný přístup v Evropě
Profesor Marc Miravitlles z Univerzitní nemocnice Vall d’Hebron v Barceloně byl hostem XXIII. hradeckých pneumologických dnů, které se konaly 26.–27. dubna 2019 v prostorách Univerzity Hradec Králové. Profesor Miravitlles se v bloku sdělení věnovaných aktuální léčbě chronické obstrukční plicní nemoci ujal přednášky shrnující problematiku deficitu alfa‑1 antitrypsinu (AATD) a vývoje dostupné léčby.
Poznání zákonitostí tvorby
a působení alfa 1 antitrypsinu (AAT) přispívá
k pochopení problematiky chronické obstrukční plicní nemoci
(CHOPN) a jejích rozmanitých forem. Deficit AAT představuje
dědičnou poruchu, která byla poprvé popsána v roce 1963
(Laurell a Eriksson). Alfa 1 antitrypsin je enzym,
proteázový inhibitor, který inaktivuje řadu enzymů, z nichž
významným pro toto onemocnění je elastáza neutrofilů v plicní
tkáni. V důsledku jeho nedostatku/nefunkčnosti neprobíhá
dostatečná neutralizace proteáz, dochází k poškození
plicního parenchymu a u velkého podílu nemocných
k rozvoji emfyzému. Jedná se o typickou manifestaci
onemocnění, i když ne jedinou.
Na podkladě mutace genu pro AAT dochází ke změnám prostorové konformace enzymu, který se fyziologicky tvoří v játrech. Vedle změny jeho funkce dochází k jeho kumulaci v játrech namísto jeho sekrece do oběhu, k poškození hepatocytů a k jejich apoptóze. Jaterní cirhóza je druhou nejčastější komplikací AATD.
Léčebné možnosti
Logicky prvním přístupem k léčbě byla snaha doplnit pacientovi to, co mu chybí. Substituční léčba AAT izolovaného od dárců krve byla testována na konci osmdesátých let ve Spojených státech amerických. Ukázalo se, že po podání infuze (60 mg/kg i.v. jednou týdně) je dosahováno vrcholových sérových koncentrací s jejich následným rychlým poklesem v průběhu několika dní (dle biologického poločasu 5–6 dní). Snahou je při sledování průběhu plazmatických koncentrací udržet hodnoty AAT na protektivní úrovni. Cílem ovšem nejsou dostatečné koncentrace v plazmě, ale dostatečná účinnost v cílovém orgánu (plicích). Tu potvrdila provedená sledování. Jako obraz účinnosti léčby byla dokumentována rostoucí aktivita anti elastázy v návaznosti na stoupající sérové koncentrace AAT a pokles zánětlivé aktivity v bronchiálním parenchymu [1,2]. Efektivitu léčby doložil i sledovaný pokles koncentrací desmosinu a isodesmosinu, biomarkerů degradace elastinu. Tyto látky jsou přítomny pouze v elastinu. Augmentační léčba AAT prokázala statisticky signifikantní redukci hodnot desmosinu a isodesmosinu v plazmě a zejména v bronchoalveolární laváži [3].
Průkaz postižení
Podávání AAT prokázalo v různých studiích pozitivní vliv na zpomalení rychlosti poklesu plicních funkcí (měřeno jako FEV1, forced expiratory volume in 1 second) [4,5]. Je velmi obtížné vzhledem k malému počtu pacientů provádět randomizovaná, zaslepená a placebem kontrolovaná klinická hodnocení. Průkaz účinnosti léčby byl v minulosti založen hlavně na observačních studiích, které mají jistá omezení v metodice a srovnávání populací. Testy plicních funkcí (FEV1) užívané obvykle jako cílové ukazatele (endpointy) k hodnocení účinnosti nejsou ideální, k analýzám vyžadují poměrně velké množství pacientů a dlouhodobé sledování. AATD je vzácné a pomalu progredující onemocnění. Sledování rovněž ukázala, že se v průběhu onemocnění mění vývoj hodnot sledovaných parametrů. Dawkins a kol. [6] dokumentovali výrazný roční pokles FEV1 u středně závažné formy nemoci v porovnání s nevýrazným poklesem FEV1 u velmi závažného stupně postižení navzdory probíhající progresi onemocnění.
Profesor Miravitlles přirovnal AATD a emfyzém na podkladě AAT k osteoporóze. Emfyzém můžeme charakterizovat obdobně ztrátou denzity tkáně, v tomto případě plicní. Podobně jako osteologové používají k hodnocení průběhu onemocnění denzitometrická měření kostní tkáně, můžeme emfyzematické postižení plic sledovat prostřednictvím ztráty plicní denzity a její distribuce. Tato měření již dnes máme díky novým technologiím k dispozici. Výpočetní tomografie (CT) se etablovala jako velmi citlivá metoda pro použití v diagnostice, k hodnocení závažnosti onemocnění a ke kvantifikaci postižení. CT denzitometrické skenování prokázalo dobrou korelaci s měřením plicních funkcí [7] a ukázalo vyšší citlivost [8]. I navzdory nízkému počtu pacientů například v porovnání s obvyklým počtem nemocných s CHOPN je možné dosáhnout statisticky signifikantních výsledků dle statistických analýz. Studie EXACTLE (Exacerbations and Computed Tomography scan as Lung End points) [9] opět potvrdila přínos této metodiky i augmentační léčby AAT.
Plicní denzita, nově sledovaný parametr měřený v gramech na litr, je ovlivněna věkem, pohlavím, BMI, aktuálním stavem a historií kuřáctví [10]. Denzitometrická CT měření byla použita již v četných studiích a analýzách sledujících účinnost intravenózního podávání AAT a opakovaně dokládají redukci poklesu plicní denzity při augmentační léčbě oproti placebové skupině. Integrovaná analýza dvou studií [11] prezentovala průměrný pokles plicní denzity od počáteční hodnoty –4,082 g/l při podávání léčby a –6,379 g/l v placebové větvi, tj. s rozdílem pro léčbu 2,297 (95% interval spolehlivosti [CI] 0,669–3,926; p = 0,006). To odpovídá ročnímu poklesu o 1,73 a 2,74 g/l.
Závěry klinického hodnocení
Studie RAPID, představující dosud
nejrozsáhlejší klinické hodnocení terapie AATD, definitivně
potvrdila účinnost augmentační léčby AAT z předešlých
hodnocení. Tato multicentrická, randomizovaná, dvojitě zaslepená
studie kontrolovaná placebem používala ke kvantifikaci
postižení výpočetní tomografii. Sledování pacientů přineslo
dvě zjištění – potvrdilo efektivitu intravenózního
podávání AAT (60 mg/kg jednou týdně) na redukci poklesu
denzity plicní tkáně (roční ztráta 1,45 g/l ve skupině
s aktivní léčbou vs. 2,19 g/l v placebové větvi)
a také dokumentovalo význam časného zahájení léčby.
Po skončení dvouletého zaslepeného období mohli pacienti
vstoupit do otevřené fáze studie, kdy byli nemocní
z placebové skupiny převedeni na aktivní léčbu
a sledováni další dva roky. Data ukazují, že u pacientů
původně zařazených v placebové větvi bylo dosaženo
po převedení na aktivní léčbu obdobné rychlosti
ztráty plicní denzity (1,08 g/l/rok vs. 1,31 g/l/rok). Tedy
zpomalení progrese onemocnění i při opožděném zahájení
léčby, nicméně křivky poklesu denzity plicní tkáně obou
sledovaných skupin běží vedle sebe a již se nikdy neprotnou
(graf 1) [12].
Profesor Miravitlles vysvětlil tyto výsledky – „co již
bylo ztraceno, už nelze obnovit“, léčba tedy není schopna
plicní tkáň regenerovat, ale dokáže zpomalit poškození
plicního parenchymu – a vyzdvihl význam časného zahájení
léčby.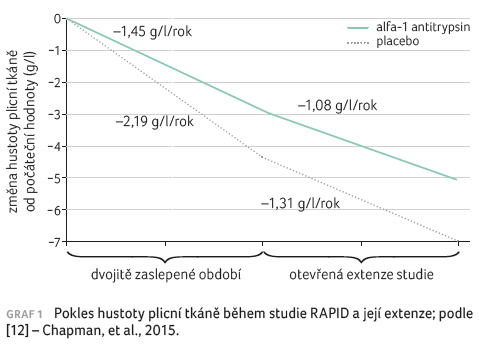
Rahaghi a Miravitlles ve své publikaci [13] dokládají zvýšenou mortalitu u neléčených pacientů. Intravenózní podávání AAT představuje možnost, jak zpomalit rozvoj onemocnění a zachránit nemocným 5–6 let života.
Analýza studie RAPID ukázala, že u pacientů s vyššími sérovými koncentracemi AAT měřenými před další aplikací léku (tzv. trough) byl zaznamenán nižší pokles hustoty plicní tkáně. Tedy čím více AAT pacient má, tím lépe.
Jak bylo uvedeno výše, desmosin
a isodesmosin se užívají k měření degradace elastinu.
Analýza studie RAPID a její extenze [14] prokázala, že
snížená degradace elastinu byla spojena
s pomalejším poklesem hustoty plicní tkáně. Augmentační
terapie AAT snížila u pacientů s AATD degradaci
elastinu. U pacientů z placebové větve došlo
po převedení na podávání AAT v extenzi studie
ke změnám sérových koncentrací desmosinu a isodesmosinu,
které byly podobné jako u pacientů s aktivní léčbou
(graf 2).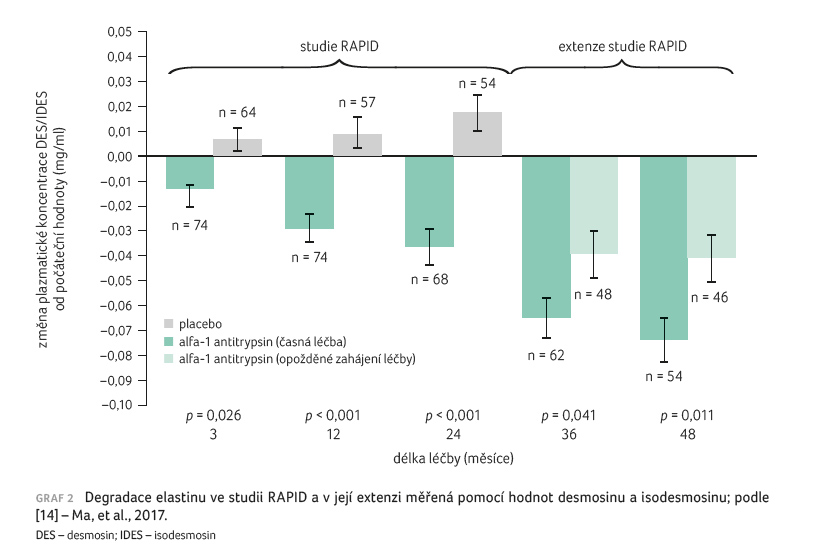
Tyto výsledky podporují použití hodnot desmosinu a isodesmosinu jako biomarkerů pro monitorování progrese emfyzému a léčebné odpovědi, nicméně onemocnění je ve svém obraze i rozvoji velmi heterogenní a závažnost postižení se může v návaznosti na řadu faktorů lišit. Mezi rizikové faktory, které ovlivňují pokles plicních funkcí, patří pohlaví, kouření, astma, chronická bronchitida a pneumonie [15,16]. Vzácnost onemocnění neumožňuje klinikům četná srovnání a odhalení nuancí v diagnóze, to vše činí rozhodovací proces v léčbě obtížným.
Management léčby
Přes nedávné pokroky ve znalostech o AATD je toto onemocnění vzácně diagnostikováno a léčeno. S cílem optimalizovat management léčby proběhl nedávno internetový průzkum [17], který ukázal, že diagnóza i vedení léčby jsou v Evropě velmi heterogenní, evropská spolupráce je nezbytná ve snaze generovat co největší objem dat pro optimální nastavení léčby.
Dokument Evropské společnosti pro respirační onemocnění (European Respiratory Society, ERS) týkající se diagnostiky a léčby AATD [18] uvádí, že management léčby pacientů s AATD by měl být organizován specializovanými centry na národní či regionální úrovni. Klinické charakteristiky a anamnéza nemocných s AATD by měly být systematicky shromažďovány prostřednictvím národních a mezinárodních registrů s cílem zlepšit znalosti o vývoji nemoci a její optimální léčbě. Zhodnocení pacienta by mělo probíhat v jednotlivých krocích se stanovením individuálních rizik a s definováním fenotypu. Propojení s multidisciplinárním týmem by mělo zajistit nejlepší možnou péči.
Zásadní je identifikovat pacienta s AATD; velmi důležité je ujistit se, že pacient nekouří, pokud byl kuřákem; identifikovat a snažit se ovlivnit další případné rizikové faktory; nastavit optimálně stávající terapii CHOPN a odeslat pacienta do specializovaného centra péče; zhodnotit indikaci augmentační léčby, definovat léčebný plán a pokračovat nadále v monitoraci nemocného. Jednotlivé kroky ucelené jako léčebný algoritmus považuje dokument ERS za optimální péči, nemocným s AATD je třeba poskytnout komplexní přístup. Bohužel víme, že takto to v Evropě neprobíhá, diagnóza onemocnění je opožděna, u zhruba 60 % pacientů o více než pět let.
V internetovém průzkumu [17] se jako hlavní překážka stanovení diagnózy ukázalo nízké povědomí o nemoci v oboru praktického lékařství. Názory na způsob sledování nemocných se také poměrně odlišovaly. Pro monitorování pacientů s AATD v klinické praxi byla za praktičtější považována spirometrie než kvantitativní CT, na tu je nahlíženo jako na užitečnější spíše v klinických studiích. Mezi evropskými státy se rovněž významně liší dostupnost léčby – úhrada a podíl pacientů, kterým je léčba indikována. Profesor Miravitlles vyzdvihl španělský přístup aktivního screeningu onemocnění a upozornil na existující specifika jednotlivých států a důsledky pro pacienty.
Registry a mezinárodní
iniciativy
Znalosti o rozvoji nemoci a o její léčbě by nám měl pomoci rozšířit systematický sběr dat do národních a mezinárodních registrů. Smyslem registrů u vzácných onemocnění je zvýšení znalostí a podnícení klinického výzkumu, podpora spolupráce mezi zeměmi a vědeckými skupinami. Profesor Miravitlles stručně prezentoval španělský registr AATD (REDAAT), který byl vytvořen v roce 1993. Je zde aktuálně zařazeno více než 700 nemocných. Průměrný věk pacientů je 56,2 roku, 62 % tvoří muži. Shromažďování kvalitních dlouhodobých dat z reálného života, fenotypizace a genotypizace by měly pomoci pochopit podstatu onemocnění a vedení léčby. Distribuce diagnostikovaných pacientů na území Španělska odráží umístění specializovaných center a zájem lékařů, nejvíce nemocných je sledováno v oblastech center.
V roce 1998 byl založen mezinárodní registr AIR (The Alpha 1 International Registry), který měl napomoci spolupráci odborníků z 21 zemí, zařazovat nemocné do klinických studií, nicméně nesbíral prospektivní data.
Nově realizovaný program ERS Clinical Research Collaborations (CRCs) poskytuje podporu projektům v různých oblastech léčby respiračních onemocnění. Pro AATD vznikla celoevropská síť European Alpha 1 Research Collaboration (EARCO) s cílem podporovat výzkum a vzdělání v problematice AAT a vytvořit registr EARCO se sběrem prospektivních dat. Ve výboru EARCO v současnosti působí zástupci 24 zemí včetně České republiky. Hlavní vizí je napomoci časné diagnóze AATD, pochopit podstatu onemocnění a zajistit dostupnost účinné léčby. Důraz jen kladen na specializovaná centra. Mezi hlavní výzkumné záměry EARCO patří vytvoření standardů pro laboratorní stanovení diagnózy AATD, průzkum postojů týkajících se indikace augmentační léčby, průzkum neuspokojených potřeb zdravotnických odborníků i pacientů a vytvoření mezinárodního prospektivního registru. Registr EARCO by měl být propojen s národními registry a integrovat již posbíraná data. Měl by zahrnout data o AATD z různých geografických končin, porovnat demografické i klinické charakteristiky a sdílet postoje a myšlenky mezi kliniky a vědci. Přístup k webovým stránkám registru by měl být přímý a otevřený všem lékařům (pravděpodobně v druhé polovině roku 2019). Recentní publikace [19], na kterou odkázal profesor Miravitlles, shrnuje záměry a strukturu EARCO. Jako důležité vyzdvihl přednášející napojení EARCO na národní registry, na virtuální sítě poskytovatelů zdravotní péče u vzácných onemocnění v Evropě (European Reference Networks) a zapojení pacientů prostřednictvím European Lung Foundation. Závěrem profesor Miravitlles pozval všechny odborníky k aktivní účasti na této iniciativě.
Redakčně zpracovala PharmDr. Kateřina Viktorová
Seznam použité literatury
- [1] Hubbard RC, Sellers S, Czerski D, et al. Biochemical efficacy and safety of monthly augmentation therapy for alpha 1‑antitrypsin deficiency. JAMA 1988; 260: 1259–1264.
- [2] Stockley RA, Bayley DL, Unsal I, Dowson LJ. The effect of augmentation therapy on bronchial inflammation in alpha1‑antitrypsin deficiency. Am J Respir Crit Care Med 2002; 165: 1494–1498.
- [3] Ma S, Lin YY, He J, et al. Alpha‑1 Antitrypsin Augmentation Therapy and Biomarkers of Elastin Degradation. COPD 2013; 10: 473–481.
- [4] Survival and FEV1 decline in individuals with severe deficiency of alpha1‑antitrypsin. The Alpha‑1‑Antitrypsin Deficiency Registry Study Group. Am J Respir Crit Care Med 1998; 158: 49–59.
- [5] Tonelli AR, Brantly ML. Augmentation therapy in alpha‑1 antitrypsin deficiency: advances and controversies. Ther Adv Respir Dis 2010; 4: 289–312.
- [6] Dawkins PA, Dawkins CL, Wood AM, et al. Rate of progression of lung function impairment in alpha1‑antitrypsin deficiency. Eur Respir J 2009; 33: 1338–1344.
- [7] Shaker S, Stavngaard T, Stolk J, et al. α1‑Antitrypsin deficiency: Computed tomographic imaging in α1‑antitrypsin deficiency. Thorax 2004; 59: 986–991.
- [8] Dirksen A, Dijkman JH, Madsen F, et al. A randomized clinical trial of alpha(1)‑antitrypsin augmentation therapy. Am J Respir Crit Care Med 1999; 160: 1468–1472.
- [9] Dirksen A, Piitulainen E, Parr DG, et al. Exploring the role of CT densitometry: a randomised study of augmentation therapy in alpha1‑antitrypsin deficiency. Eur Respir J 2009; 33: 1345–1353.
- [10] Coxson HO, Dirksen A, Edwards L, et al. The presence and progression of emphysema in COPD as determined by CT scanning and biomarker expression: a prospective analysis from the ECLIPSE study. Lancet Respir Med 2013; 1: 129–136.
- [11] Stockley RA, Parr DG, Piitulainen E, et al. Therapeutic efficacy of alpha‑1 antitrypsin augmentation therapy on the loss of lung tissue: an integrated analysis of 2 randomised clinical trials using computed tomography densitometry. Respiratory Research 2010; 11: 136.
- [12] Chapman KR, Buron JGW, Piitulainen E, et al. Intravenous augmentation treatment and lung density in severe α1 antitrypsin deficiency (RAPID): a randomised, double‑blind, placebo‑controlled trial. Lancet 2015; 386: 360–368.
- [13] Rahaghi FF, Miravitlles M. Long‑term clinical outcomes following treatment with alpha 1‑proteinase inhibitor for COPD associated with alpha‑1 antitrypsin deficiency: a look at the evidence. Respir Res 2017; 18: 105.
- [14] Ma S, Lin YY, Cantor JO, et al. The Effect of Alpha‑1 Proteinase Inhibitor on Biomarkers of Elastin Degradation in Alpha‑1 Antitrypsin Deficiency: An Analysis of the RAPID/RAPID Extension Trials. Chronic Obstr Pulm Dis 2017; 4: 34–44.
- [15] Demeo DL, Sandhaus RA, Barker AF, et al. Determinants of airflow obstruction in severe alpha‑1‑antitrypsin deficiency. Thorax 2007; 62: 806–813.
- [16] Esquinas C, Serreri S, Barrecheguren M, et al. Long‑term evolution of lung function in individuals with alpha‑1 antitrypsin deficiency from the Spanish registry (REDAAT). Int J Chron Obstruct Pulmon Dis 2018; 13: 1001–1007.
- [17] Horváth I, Canotilho M, Chlumský J, et al. Diagnosis and management of α1‑antitrypsin deficiency in Europe: an expert survey. ERJ Open Res 2019; 5: 00171–2018.
- [18] Miravitlles M, Dirksen A, Ferrarotti I, et al. European Respiratory Society statement: diagnosis and treatment of pulmonary disease in α1‑antitrypsin deficiency. Eur Respir J 2017; 50: 1700610.
- [19] Miravitlles M, Chorostowska‑Wynimko J, Ferrarotti I, et al. The European Alpha‑1 Research Collaboration (EARCO): a new ERS Clinical Research Collaboration to promote research in alpha‑1 antitrypsin deficiency. Eur Respir J 2019; 53: doi: 10.1183/13993003.00138‑2019.