Avelumab v terapii uroteliálního karcinomu
Souhrn:
Rozsypalová A, Büchler T. Avelumab v terapii uroteliálního karcinomu. Remedia 2021; 31: 403–405.
Uroteliální karcinom představuje více než 90 % nádorů močového měchýře (a dalších vývodných cest močových). U lokálně pokročilých a metastatických nádorů byla po dlouhou dobu jedinou možností systémové léčby chemoterapie, kdy nejlepších odpovědí bylo dosaženo s režimy na bázi cisplatiny. Dnes se nám začínají objevovat možnosti využití nových léků z oblasti imunoterapie a cílené léčby. Mezi tyto nadějné přípravky patří i anti‑PD‑L1 monoklonální protilátka avelumab (Bavencio©), která prokázala svoji účinnost ve studii JAVELIN v rámci udržovací terapie první linie u pacientů bez progrese po léčbě cisplatinou. V této indikaci však zatím není v České republice stanovena úhrada z veřejného zdravotního pojištění.
Summary:
Rozsypalova A, Buchler T. Avelumab in the therapy of urothelial carcinoma. Remedia 2021; 31: 403–405.
Urothelial carcinoma accounts for more than 90% of bladder tumors. In locally advanced and metastatic tumors, chemotherapy has been the only option for systemic treatment for a long time, with the best responses achieved with cisplatin‑based regimens. Nowadays we have the possibility to use new drugs like immunotherapy and targeted therapy. These promising drugs include the anti‑PD‑L1 monoclonal antibody avelumab (Bavencio©), which has been shown to be effective in the first‑line maintenance in patients without progression after cisplatin therapy (JAVELIN study). However, there is no payment from public health insurance for avelumab in this indication in the Czech Republic.
Key words: urothelial carcinoma, immunotherapy, avelumab.
Úvod
Uroteliální karcinom představuje více než 90 % nádorů močového měchýře a močových cest (ledvinné kalichy a pánvička, močovody, část močové trubice), jejichž sliznici tvoří specifický epitel – urotel (někdy také označovaný jako přechodný epitel). Vznik uroteliálního karcinomu často souvisí s expozicí rizikovým faktorům, jako jsou kouření tabáku, polycyklické aromatické uhlovodíky, chronická iritace močového měchýře.
Terapie uroteliálního karcinomu se odvíjí od pokročilosti onemocnění. Počáteční lokalizovaná stadia jsou řešitelná chirurgicky (transuretrální resekce/radikální cystektomie s disekcí lymfatických uzlin). V případě pokročilejšího onemocnění je indikována léčba medikamentózní, která může být aplikována lokálně nebo systémově. Dnes máme na výběr mezi chemoterapií, imunoterapií a cílenou léčbou.
Základem systémové léčby pokročilých uroteliálních karcinomů zůstává chemoterapie, v ideálním případě na bázi cisplatiny. Čím dál více se však do popředí i v této oblasti dostávají nové léčebné modality z oblasti imunoterapie a cílené léčby.
Uroteliální karcinom je charakterizován genomovou nestabilitou, vysokou expresí ligandu programované buněčné smrti 1 (PD L1), mutacemi poškozujícími DNA a vysokou mutační náloží nádoru. To všechno jsou rysy, které jsou předpokladem zvýšené odpovědi na imunoterapii pomocí inhibitorů kontrolních bodů [1].
Mezi uvedené přípravky patří i avelumab, na který se zaměříme v tomto článku.
Mechanismus účinku avelumabu
Avelumab je humánní monoklonální protilátka (IgG1) namířená proti PD L1. Avelumab se váže na PD L1 a blokuje tak interakci mezi PD L1, receptory programované buněčné smrti 1 (PD 1) a receptory B7.1. Tak je odstraněn supresivní účinek PD L1 na cytotoxické CD8+ T lymfocyty, což vede k obnově protinádorové odpovědi T lymfocytů. Kromě toho avelumab indukuje tzv. přímou lýzu nádorových buněk zprostředkovanou NK buňkami (tzv. přirození zabíječi, natural killer cells), a to prostřednictvím buněčné cytotoxicity závislé na protilátkách (antibody dependent cell mediated cytotoxicity, ADCC) [2].
Studie JAVELIN Bladder 100
Randomizovaná, multicentrická studie fáze III JAVELIN Bladder 100 hodnotila avelumab jako udržovací terapii u pacientů s metastatickým nebo lokálně pokročilým inoperabilním uroteliálním karcinomem, kteří dosáhli regrese, nebo alespoň stabilizace onemocnění při chemoterapii první linie na bázi platiny.
Zařazeno bylo celkem 700 pacientů s neresekovatelným, lokálně pokročilým nebo metastazujícím uroteliálním karcinomem, jejichž onemocnění neprogredovalo při 4–6 cyklech indukční chemoterapie první linie na bázi platiny. Vyloučeni byli pacienti s autoimunitním onemocněním nebo jiným stavem vyžadujícím užívání imunosupresiv. Pacienti byli randomizováni v poměru 1 : 1 do ramene s avelumabem (n = 350) podávaným v dávce 10 mg/kg každé dva týdny jako udržovací léčba po chemoterapii založené na platině, nebo do ramene bez aktivní léčby (n = 350). Stratifikace nemocných byla provedena na základě nejlepší odpovědi na chemoterapii první linie (stabilizace onemocnění/částečná odpověď/úplná odpověď), dále podle přítomnosti viscerálních metastáz v době zahájení chemoterapie [1]. V obou ramenech dosáhlo celkové nebo částečné odpovědi na chemoterapii 72 % pacientů a jen 28 % pacientů dosáhlo při předchozí chemoterapii stabilizace.
Primární cílový ukazatel
představovalo celkové přežití (overall survival, OS), a to
od doby randomizace (po 4-6
indukčních cyklech chemoterapie na bázi platiny). Hodnocení
proběhlo u všech randomizovaných pacientů a zvlášť
pak u skupiny osob s expresí PD L1 (hodnoceno testem
Ventana SP 263). Pozitivita PD L1 byla definována jako ≥ 25 %
nádorových buněk barvených na PD L1; nebo ≥ 25 %
imunitních buněk barvených na PD L1, pokud více než
1 % oblasti nádoru obsahovalo imunitní buňky; nebo 100 %
imunitních buněk barvených na PD L1, pokud 1 % oblasti
nádoru obsahovalo imunitní buňky [2]. Dalším hodnoceným
parametrem byly přežití bez progrese (progression free
survival, PFS) a bezpečnost přípravku.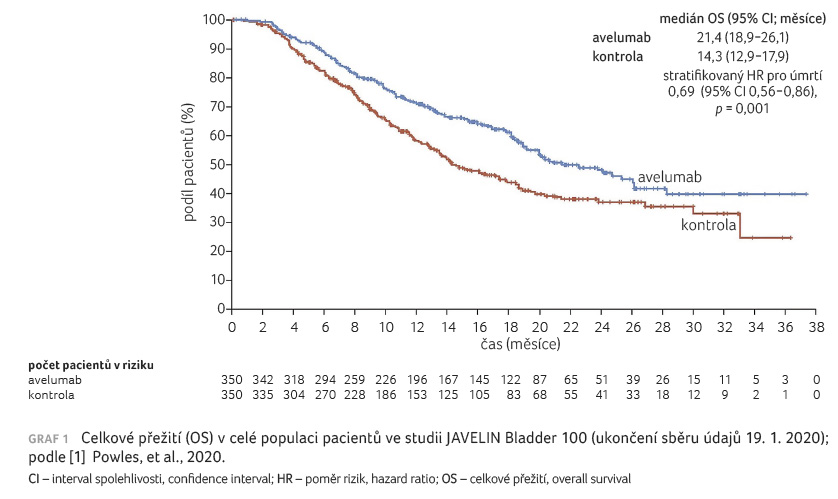
Celkové přežití bylo signifikantně delší u pacientů v rameni s avelumabem ve srovnání s pacienty pouze s podpůrnou léčbou − 71,3 % (95% interval spolehlivosti [CI] 66,0−76,0) vs. 58,4 % (95% CI 52,7−63,7); medián OS činil 21,4 měsíce (95% CI 18,9−26,1) a 14,3 měsíce (95% CI 12,9−17,9), graf 1 [1]. Obdobně i v případě sekundárních cílových ukazatelů bylo dosaženo lepších výsledků v rameni s avelumabem − medián PFS činil 3,7 měsíce (95% CI 3,5−5,5) ve skupině s avelumabem a 2,0 měsíce (95% CI 1,9−2,7) v kontrolní skupině.
Zvlášť byly parametry vyhodnoceny
pro pacienty s PD L1 pozitivními tumory. I u těchto
nemocných bylo OS výrazně delší než v kontrolním
rameni - OS po jednom roce
činilo 79,1 % (95% CI 72,1-84,5)
ve skupině s avelumabem ve srovnání s 60,4 %
(95% CI 52,0-67,7) v kontrolní
skupině (graf 2) [1]. Medián PFS představoval
ve skupině s avelumabem 5,7 měsíce (95% CI 3,7-7,4)
oproti 2,1 měsíce (95% CI 1,9-3,5)
v kontrolní skupině (stratifikovaný poměr rizik 0,56; 95% CI
0,43-0,73) [1].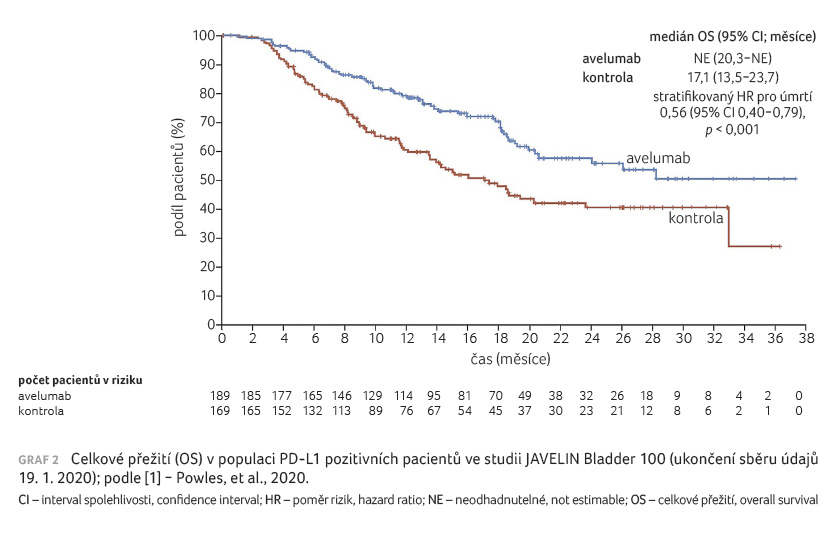
Využití v klinické praxi
Avelumab je indikován v monoterapii k udržovací léčbě první linie dospělých pacientů s lokálně pokročilým nebo metastazujícím uroteliálním karcinomem bez ohledu na expresi PD L1, kteří jsou bez progrese po chemoterapii na bázi platiny [2]. Stanovení exprese PD L1 je vyžadováno v případě využití imunoterapie v monoterapii (atezolizumab, pembrolizumab) v první linii u pacientů, kteří nejsou schopni podstoupit terapii na bázi cisplatiny. V rámci udržovací terapie avelumabem se exprese PD L1 jako prediktivní marker odpovědi na léčbu neprokázala [3].
Léčba avelumabem má být zahájena do 10 týdnů od ukončení chemoterapie a podávána až do progrese onemocnění.
Mezi další indikace avelumabu patří jeho využití v monoterapii k léčbě dospělých pacientů s metastatickým karcinomem z Merkelových buněk (stadium IV), v kombinaci s axitinibem v první linii u dospělých pacientů s pokročilým renálním karcinomem a příznivou prognózou (podrobněji viz SPC) [2].
Dávkování
Doporučená dávka avelumabu
v monoterapii je 800 mg podávaných intravenózně v průběhu
60 minut každé dva týdny [2]. Před prvními čtyřmi infuzemi
s avelumabem je doporučena premedikace antihistaminikem
a paracetamolem. Pokud čtvrtá infuze proběhne bez komplikací,
pak u následujících dávek se premedikace podává podle
rozhodnutí lékaře [2]. Podle závažnosti nežádoucích účinků
je doporučeno terapii odložit nebo přerušit. Snížení dávky
není doporučeno.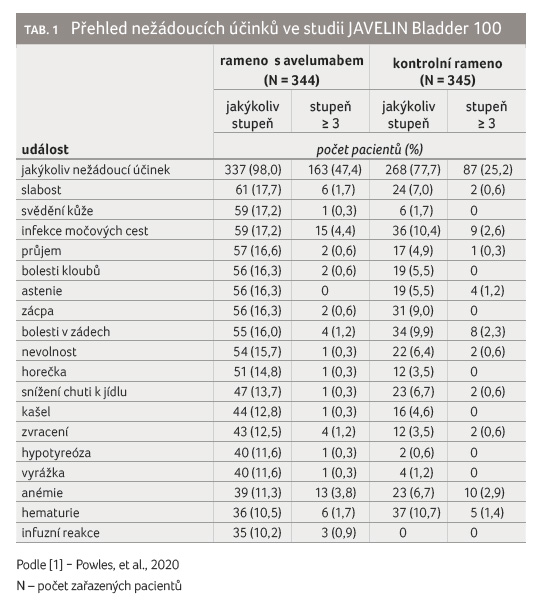
Nežádoucí účinky
Stran nežádoucích účinků je zapotřebí počítat s imunitně podmíněnou toxicitou charakteristickou pro inhibitory kontrolních bodů. Výskyt nežádoucích účinků byl vyšší v rameni s avelumabem v porovnání s kontrolním ramenem (98,0 % vs. 77,7 %), tabulka 1. Byl zde i vyšší výskyt toxicity stupně 3 (47,4 % vs. 25,2 %). Autoimunitní nežádoucí účinky byly dobře zvládnutelné a reverzibilní. Většina nežádoucích účinků odezněla po přerušení terapie avelumabem a po podání kortikosteroidů spolu s podpůrnou léčbou, nebo po trvalém ukončení léčby avelumabem [1,2].
Závěr
U pacientů s pokročilým nebo metastatickým uroteliálním karcinomem byla dosud standardní léčbou chemoterapie na bázi platiny (ideálně cisplatiny, popřípadě karboplatiny u pacientů s nevyhovující glomerulární filtrací), většinou v kombinaci s gemcitabinem (4-6 cyklů). Na základě výsledků studie JAVELIN Bladder 100 se pacientům, u nichž při předešlé terapii na bázi platiny nedošlo k progresi onemocnění, nabízí možnost udržovací terapie avelumabem.
Avelumab prokázal svoji účinnost napříč podskupinami, a to bez ohledu na expresi PD L1 i na předchozí režim chemoterapie.
Na základě těchto statisticky signifikantních výsledků je udržovací terapie avelumabem doporučena jako nový léčebný standard. V České republice v této indikaci však zatím není stanovena úhrada z veřejného zdravotního pojištění.
Seznam použité literatury
- [1] Powles T, Park SH, Voog E, et al. Avelumab Maintenance Therapy for Advanced or Metastatic Urothelial Carcinoma. N Engl J Med 2020; 383: 1218–1230.
- [2] SPC Bavencio. Dostupné na: https://www.ema.europa.eu/en/do-
- [3] Apolo AB, Ellerton JA, Infante JR, et al. Avelumab as second‑line therapy for metastatic, platinum‑treated urothelial carcinoma in the phase Ib JAVELIN Solid Tumor study: 2‑year updated efficacy and safety analysis. J Immunother Cancer 2020; 8: e001246.